CYP3A4 基因位点多态性对托法替布治疗类风湿关节炎临床疗效及药品不良反应的影响*
王 钦,金智华,蔡亮亮
(南通大学附属医院,江苏南通 226001)
类风湿关节炎(RA)以慢性进行性关节病变为主要临床表现,若不能及时、有效治疗,会引起关节破坏、强直、畸形与功能障碍,使疾病进入不可逆阶段,甚至导致患者残疾[1-2]。我国患病人数达400 万例,且致残率高[3-4]。RA的常用治疗药物主要有三大类,即皮质醇类药物、非甾体抗炎药及缓解病情的抗风湿药[5]。托法替布是新开发的口服蛋白酪氨酸激酶抑制剂,能有效抑制Janus 激酶(JAK)通路,从而阻断多种炎性因子的信号转导[6]。临床试验表明,托法替布能有效治疗RA,尤其适用于甲氨蝶呤疗效不佳或无法耐受较大剂量甲氨蝶呤的中重度RA 患者[7-8]。托法替布可与甲氨蝶呤或其他缓解病情的抗风湿药联用,达到协同治疗的作用。但并不是所有患者都适用于枸橼酸托法替布,目前尚无明确的评价体系,盲目、非个体化的用药势必会带来经济与时间上的损失。托法替布的绝对口服生物利用度约为74%,在体内约70%经肝脏代谢,在肝脏内的代谢主要由细胞色素P450 酶3A4(CYP3A4)介导,也有少量经CYP2C19介导[9]。托法替布在体内的代谢物共8种,其药理活性主要由母体分子引发。CYP3A4 基因多态性可引起该代谢酶的活性改变,从而可能影响托法替布的疗效和药品不良反应(ADR)[10]。已知的CYP3A4 单核苷酸多态性(SNP)位点有20 余种,其中与中国汉族人相关的SNP 位点主要有CYP3A4*4 A13871G(rs55951658)、CYP3A4*18 T20070C(rs28371759)、CYP3A4*1G G20239A(rs2242480)等,以上3 个SNP 位点均有一定的突变率[11]。本研究中基于某院数据探讨了3个SNP 位点CYP3A4*4,CYP3A4*18,CYP3A4*1G基因多态性对托法替布治疗RA临床疗效和ADR的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合2009 年美国风湿病协会制订的RA临床诊断标准[12];民族为汉族;国籍为中国。本研究方案经医院医学伦理委员会批准,患者签署知情同意书,在尊重个体自主权、如实告知、保护隐私、不造成伤害的原则下开展研究工作。
排除标准:3 个月内接受免疫抑制剂治疗;同时使用强效CYP3A4 诱导剂及中强效CYP3A4 抑制剂;合并其他风湿免疫疾病;妊娠期或哺乳期;合并恶性肿瘤、高血压、糖尿病、高脂血症、感染性疾病等;肝肾功能或心功能不全。
病例选择与分组:选取我院风湿免疫科2020 年2 月至2022 年8 月收治的RA 患者309 例作为RA 组,另选取同期的健康人群165 例作为对照组。RA 组中,男126例,女183例;年龄31~69岁,平均(52.40±10.17)岁。对照组中,男68 例,女97 例;年龄30~68 岁,平均(51.8 ± 9.7)岁。两组研究对象一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 仪器与试药
仪器:NP968 - C 型核酸提取仪,全血DNA 基因组提取试剂盒,均购自西安天隆科技有限公司;3730 XL型荧光定量聚合酶链反应(PCR)仪(美国ABI 公司);Biospectrometer 型紫外可见分光光度计,D30 型核酸蛋白检测仪,均购自德国Eppendorf 公司;HSP92Ⅱ型限制性内切酶(美国Fermentas 公司);PreMix Taq DNA 聚合酶(美国Thermo Fisher公司)。
试药:无核酸酶水(美国Thermo Fisher 公司);枸橼酸托法替布片(正大天晴药业集团南京顺欣制药有限公司,批号分别为191008112,200623126,210224124,210927126,220114113,规格为每片5 mg)。
1.3 方法
1.3.1 治疗方法
RA 组患者予枸橼酸托法替布片联合相同剂量的甲氨蝶呤、来氟米特、碳酸钙、维生素D3、叶酸治疗。其中,枸橼酸托法替布片每日2次,每次5 mg;甲氨蝶呤每周1 次,每次7.5 mg;来氟米特每日1 次,每次10 mg;碳酸钙日1次,每次1.5 g;维生素D3每日1次,每次125 IU;叶酸每周1次,每次5 mg,服用甲氨蝶呤的次日顿服。共治疗6个月。
1.3.2 试验方法
标本采集:采集RA组和对照组患者的静脉血各2 mL,无需空腹,加入EDTA - K2抗凝真空采血管内,置4 ℃冰箱保存,待测。
DNA提取:采用磁珠法自动提取全血DNA基因组,严格按试剂盒说明书操作。自动提取后,采用电泳法检测DNA 是否提取完整,采用紫外可见分光光度计检测DNA 浓度和纯度。若符合试剂盒规定的标准,立即进行后续基因检测步骤或置-20 ℃冰箱保存。
CYP3A4 基因位点多态性分析:1)引物设计。采用Primer Premier 6.0引物设计软件设计,基因引物序列见表1。2)PCR 反应体系。反应体系共25.0 μL,包括脱氧核糖核苷三磷酸(dNTP)2.0 μL,10 × PCR 扩增缓冲液2.5 μL,10 μmol/L 浓度上下游引物各0.75 μL,PreMix Taq DNA 聚合酶3.0 μL,基因组DNA 2.0 μL,无核酸酶水定容至25.0 μL。3)PCR 扩增条件。95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循环40次;72 ℃延伸2 min。4)电泳及测序分型。将2.0 μL限制性内切酶加入5.0 μL PCR 扩增产物内,37 ℃恒温孵育7 h,加2%琼脂糖凝胶进行Goldview染色,250 V电压下电泳。阳性产物由济南广音医疗科技有限公司测序,采用Chromas 2.6.5软件对基因序列进行比对分析,并确定基因型。

表1 基因引物序列Tab.1 Gene primer sequence
1.4 观察指标与疗效判定标准
观察指标:1)临床指标改善情况。包括肿胀关节数、压痛关节数、晨僵时间、医师评估视觉模拟评分法(VAS)评分、患者评估VAS 评分、健康状况问卷(HAQ)评分。2)实验室指标。包括血常规、尿常规、C反应蛋白、红细胞沉降率、肝肾功能等[12]。3)安全性。统计治疗期间RA组患者服用托法替布后的相关ADR发生情况。将ADR 的严重程度分为轻度、中度、重度3 个等级[13],采用Karch和Lasagna评定法将ADR的因果关系判定为肯定、很可能、可能、条件、可疑5 级[14]。其中,肯定、很可能和可能3 级可作为ADR 的主要判定依据,以区分ADR 是由托法替布引起,而非由同服药物引起。出现托法替布相关ADR 的RA 患者纳入ADR 组,未出现托法替布相关ADR的RA患者纳入无ADR组。
疗效判定:采用美国风湿病学学会(ACR)制订的ACR20 标准[12]评估。符合ACR20 标准即为改善;反之,为未改善。
1.5 统计学处理
采用SPSS 26.0 统计学软件分析。计量资料以±s表示,行t检验;基因分型的频率分布满足Hardy -Weinberg 平衡采用χ2检验;组间的基因型与等位基因频率的比较采用χ2检验;基因型为3组数据的分析采用Kruskal - Wallis 检验,基因型为2 组数据的分析采用Mann-Whitney检验。P<0.05为差异有统计学意义。
2 结果
2.1 基因检测结果
RA 组和对照组患者的CYP3A4*4,CYP3A4*18,CYP3A4*1G基因位点多态性均无显著差异(P>0.05)。CYP3A4基因型分布与等位基因频率比较见表2。

表2 RA组和对照组患者CYP3A4基因型分布与等位基因频率比较[例(%)]Tab.2 Comparison of CYP3A4 genotype distribution and allele frequency between the RA group and the control group[case(%)]
2.2 CYP3A4 基因多态性与临床疗效的关系
根据疗效评价结果,181 例RA 患者纳入改善组,128 例纳入未改善组。改善组和未改善组RA 患者的疾病活动度差异显著(P<0.05),而CYP3A4*4,CYP3A4*18,CYP3A4*1G基因位点多态性均无显著差异(P>0.05)。详见表3。

表3 改善组和未改善组患者一般资料与CYP3A4基因型分布比较Tab.3 Comparison of the patient′s general data and CYP3A4 genotype distribution between the improved group and the non -improved group
2.3 ADR 发生情况
ADR组中,因果关系判定为肯定9例,很可能37例,可能12例;ADR严重程度为轻度51例,中度7例。详见表4。

表4 ADR累及系统与临床表现(n=58)Tab.4 ADR - involved systems and their clinical manifestations(n = 58)
2.4 CYP3A4 基因多态性与ADR 的关系
ADR 组和无ADR 组患者的CYP3A4*1G基因位点多态性差异显著(P<0.05),而CYP3A4*4和CYP3A4*18基因位点多态性均无显著差异(P>0.05)。详见表5。
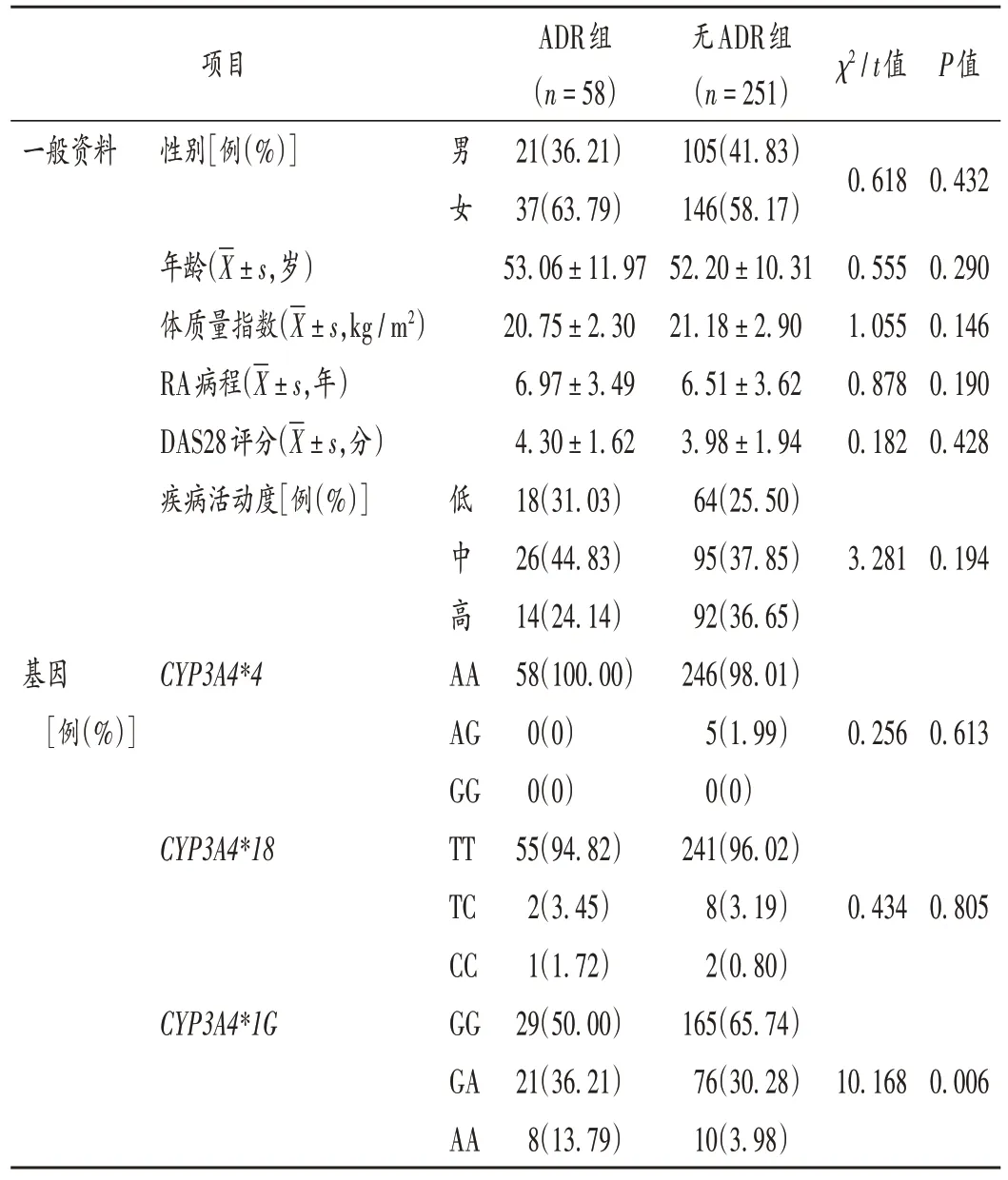
表5 ADR组和无ADR组患者一般资料与CYP3A4基因型分布比较Tab.5 Comparison of the patient′s general data and CYP3A4 genotype distribution between the ADR group and the non -ADR group
3 讨论
3.1 CYP3A4 基因位点选择
CYP3A4 基因序列突变率低,已发现能明显影响酶功能活性的基因多态性位点亦较少[15]。国内外的研究显示,在中国汉族人群中存在多态性并可能影响酶活性的CYP3A4 基因位点有CYP3A4*4 A13871G,CYP3A4*5 C15702G,CYP3A4*6 17661del,CYP3A4*18T20070C,CYP3A4*1G G20239A,CYP3A4*22 C15389T等。在中国人群CYP3A4 基因位点中,CYP3A4∗1G是目前已知的突变率最高的位点,也是中国研究者研究最多的CYP3A4 基因位点。CYP3A4*4,CYP3A4*5,CYP3A4*6在中国汉族人群中有较低的突变率,突变后可显著升高辛伐他汀的调血脂作用[16]。但CYP3A4*5和CYP3A4*6突变率均低于1%,本研究中受限于病例数量,并未将上述2 个位点纳入研究。研究表明,CYP3A4*18在中国汉族人群中的突变率低于10%,并能引起氯吡硫磷与睾酮的代谢速率加快[17]。CYP3A4*22是近期发现的影响酶活性的多态性位点,在欧美人群中的突变率约为8%,而在非洲人群与亚裔人群中的突变率较低[18]。有研究显示,CYP3A4*22基因位点的突变并不能引起辛伐他汀调血脂作用的改变,对酶活性无影响[19],故本研究中未将CYP3A4*22基因位点纳入研究。目前,尚无文献明确报道CYP3A4 基因多态性是否对托法替布的体内代谢有影响。本研究中选取CYP3A4*4,CYP3A4*18,CYP3A4*1G基因位点,调查了江苏南通地区汉族RA患者和健康人群的CYP3A4基因多态性,又考察了基因多态性对托法替布临床疗效及ADR的影响。
3.2 CYP 基因位点与临床疗效
RA 患者和健康人群的CYP3A4*4基因均未检出突变纯合型,G 等位基因突变率均低于1%;RA 患者和健康人群CYP3A4*18的C 等位基因突变率均低于4%。可见,CYP3A4*4和CYP3A4*18都是江苏南通汉族人群突变率很低的位点。RA 患者和健康人群CYP3A4*1G的A等位基因突变率约为20%,呈现出较明显的基因多态性,与文献[20]报道的结果相似。RA 患者和健康人群间的CYP3A4*4,CYP3A4*18,CYP3A4*1G基因位点多态性均无显著差异,提示RA 的发病与上述位点多态性无关。改善组和未改善组患者的疾病活动度差异显著,而CYP3A4*4,CYP3A4*18,CYP3A4*1G基因位点多态性的差异均无显著差异。可见,疾病活动度与托法替布的临床疗效有相关性,疾病活动度较低患者的药物疗效更好,托法替布更适用于中低疾病活动度的RA 患者。在CYP3A4∗1G基因的相关研究中发现,与野生纯合型比较,突变杂合型与突变纯合型人群外周血单核细胞内CYP3A4 mRNA 的相对表达量显著减少,CYP3A4∗1G基因突变后可下调CYP3A4 mRNA 的表达,从而降低CYP3A4酶的活性[20]。YE等[21]研究了CYP3A4酶活性改变对托法替布代谢的影响,发现CYP3A4.1酶变体可导致托法替布的体内清除率显著降低。本研究中所有RA患者的托法替布剂量均为药品说明书推荐的每日2次,每次5 mg,剂量较大。由于CYP3A4∗1G基因突变会引起CYP3A4酶活性降低,在CYP3A4酶活性正常或降低时,托法替布的血药浓度处于正常或升高水平,疗效较好。
3.3 CYP3A4 基因位点与ADR
本研究结果显示,ADR组和无ADR组的CYP3A4*1G位点多态性差异显著,而CYP3A4*4和CYP3A4*18基因位点多态性无显著差异,提示CYP3A4*1G基因位点突变与托法替布所致ADR 有相关性。CYP3A4∗1G是具有功能意义的突变,CYP3A4酶活性在CYP3A4∗1G基因位点突变后下降,该酶的代谢能力减弱,引起托法替布血药浓度升高,发生ADR。由于CYP3A4*4和CYP3A4*18基因位点的突变率较低,并未观察到二者对托法替布ADR的影响。
3.4 临床应用与本研究局限性
CYP3A4*1G基因多态性和托法替布治疗RA 的ADR 有相关性,建议临床应用托法替布时监测CYP3A4*1G基因多态性。对于CYP3A4∗1G突变杂合型和突变纯合型的RA 患者,必要时适当降低剂量,以保证用药安全。此外,临床用药应考虑患者是否同时应用影响CYP3A4 酶活性的药物和饮食。酮康唑等强效CYP3A4 酶抑制剂会抑制托法替布的体内代谢,导致托法替布暴露量增加,可小剂量给药,每日1次,每次5 mg;利福平等强效CYP3A4 酶诱导剂会加快托法替布的体内代谢,导致托法替布暴露量减少,甚至可能导致药理作用丧失,可较大剂量给药,每日2 次,每次5 mg,或避免与强效CYP3A4酶诱导剂同时使用。
本研究存在以下局限性:1)由于部分医师对药物基因检测的认知度不足,以及检测费用较高,导致纳入本研究的病例数较少;2)本研究为单中心临床研究,且部分位点的突变率低,可能影响研究结论的可靠性;3)CYP3A4 基因多态性与托法替布临床疗效的相关性研究的样本量较小,研究数据不充分,所有位点均未得出有显著差异的结果,这与真实世界可能存在偏差。后续研究中,要扩大病例数量,联合多中心研究探讨中国人群CYP3A4基因多态性对托法替布临床疗效的影响;结合相关基因检测和托法替布血药浓度监测结果,全面地评价药物的有效性和安全性。

