PPARγ基因沉默的人骨髓基质细胞对骨髓抑制小鼠造血功能的影响*
王雪梅, 黄纯兰,△, 周铁军, 李玉娇, 魏梦宇, 陈 燕, 陈晓敏, 王万玥
西南医科大学附属医院 1血液内科 2干细胞实验室 3病理科,泸州 646099
骨髓抑制是恶性肿瘤患者放化疗后常见的副反应之一,也是恶性肿瘤治疗过程中最大的不利因素[1]。从某种意义上讲,良好控制骨髓抑制是放化疗成功的关键。为了快速恢复骨髓抑制患者的造血功能,临床上开始应用骨髓基质细胞移植技术,不仅能减轻骨髓抑制,还不会影响放化疗对肿瘤细胞的杀伤作用[2-3]。
过氧化物酶体增殖激活受体γ(peroxisome proliferator activated receptor-gamma,PPARγ)是一类被配体激活的转录因子,具有调控糖脂代谢、调控脂肪细胞分化等多种生物学功能[4]。人骨髓基质细胞又称骨髓间充质干细胞,是骨髓的重要组成部分,成骨细胞和脂肪细胞都起源于骨髓间充质干细胞。既往研究发现骨髓间充质干细胞的成骨作用可促进造血功能,脂肪细胞可抑制造血功能。因此,成骨和脂肪形成之间的平衡对造血至关重要[5]。造血干细胞(hemopoietic stem cell,HSC)移植是一种治疗各种血液系统疾病的根治性治疗方法,而HSC的维持和谱系分化需要由支持性的基质龛来支持。国外Abbuehl等[6]通过小鼠模型发现基质不足限制了供体来源的HSC数量,在体内共移植原代骨髓间充质干细胞可定量地恢复基质功能,使供体来源的HSC数量加倍,改善HSC移植的潜力,更有利于血液系统疾病的治疗。国内Zhen等[7]采用骨髓间充质干细胞尾静脉注射干预,结果发现骨髓间充质干细胞能改善骨髓抑制小鼠的造血功能。但目前尚无关于将骨髓间充质干细胞PPARγ基因沉默后再输注于小鼠体内的相关研究。鉴于此,本研究采用骨髓间充质干细胞移植技术及慢病毒干扰技术,将PPARγ基因沉默的人骨髓基质细胞系HS-5植入骨髓抑制小鼠,观察骨髓抑制小鼠造血功能变化,并进一步通过HS-5成脂/成骨诱导分化等体外实验初步探讨其可能的作用机制,为临床治疗骨髓抑制奠定基础。
1 材料与方法
1.1 主要试剂与仪器
人骨髓基质细胞系HS-5(ATCC,美国);高糖DMEM(上海麦克林);成人骨髓间充质干细胞成骨诱导分化完全培养液(货号HUXMA-90021,Cyagen,美国);成人骨髓间充质干细胞成脂诱导分化完全培养液(货号HUXMA-90031,Cyagen,美国);10%胎牛血清(fetal bovine serum,FBS,New Zealand Sourced,康宁公司,美国);α-MEM培养液(货号32561102,北京百奥创新科技有限公司);青霉素-链霉素双抗溶液(Penicillin-Streptomycin,PS,货号60162ES76,上海翌圣);OriCell®油红O染色液(Cyagen,美国);OriCell®茜素红染色液(Cyagen,美国);IMDM培养液(上海麦克林);双酚A二缩水甘油醚(BADGE,MERCK公司,德国);RNA提取试剂盒(北京天根生化);CCK-8试剂盒(重庆葆光生物);Transwell小室(Biosharp);RNAi慢病毒于吉凯基因定制;引物于生工生物工程(上海)股份有限公司合成;倒置荧光显微镜(CKX53,日本奥林巴斯);全自动血液细胞分析仪器(BC-6800,深圳迈瑞生物医疗电子股份有限公司)。
1.2 HS-5细胞的复苏与培养
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养液混合均匀。在1000 r/min条件下离心3 min,弃去上清液,加1~2 mL培养液后吹匀。然后将所有细胞悬液加入含适量培养液的培养瓶中培养过夜。第3天换液并检查细胞密度,当细胞密度达80%~90%时进行传代培养。HS-5细胞培养条件:采用20%FBS+α-MEM+1%PS培养液,于37℃ CO2温箱中培养。
1.3 PPARγ基因慢病毒干扰及PPARγ基因的检测
处于对数生长期的HS-5细胞以胰酶消化,采用完全培养液制成5×104个/mL细胞悬液,接种于培养板中,继续培养保证感染时铺板量达到15%~30%左右。按照预实验结果,选择MOI80+P液更换感染培养液,加入病毒进行感染。感染24 h后更换为常规培养液继续培养,转染后72 h,用0.6 μg/mL的嘌呤霉素筛选3 d后得到PPARγ RNAi的稳定转染细胞,在RNA水平检测PPARγ基因的敲减效果。引物为PPARγ-FP:5′-AGATCATTTACACAATGCTGGC-3′;PPARγ-RP:5′-TAAAGTCACCAAAAGGCTTTCG-3′。实验组加入含有PPARγ目的基因和GFP绿色荧光报告基因的慢病毒载体感染细胞,对照组加入仅含GFP绿色荧光报告基因的慢病毒载体感染细胞。
1.4 骨髓抑制小鼠造模及分组检测
对15只6~8周龄SPF级Balb/c雄性小鼠(重庆腾鑫生物技术有限公司)进行X射线全身照射,总剂量为4 Gy,照射距离为80 cm,照射时间为8 min,诱导小鼠产生骨髓抑制。造模后2 h,将小鼠随机分为3组,分别为实验组、对照组、空白组,每组5只。实验组小鼠尾静脉注射PPARγ RNAi干扰的HS-5细胞;对照组小鼠尾静脉注射未行PPARγ RNAi干扰的HS-5细胞;空白对照组小鼠尾静脉注射等量的生理盐水。各组于放疗前、放疗后24 h、放疗后1周、放疗后2周进行外周血常规检测。于放疗后2周,采集小鼠血清,采用酶联免疫吸附法检测PPARγ表达水平;然后予以颈椎脱臼法处死小鼠后分离股骨,立即放入中性甲醛溶液中固定,常规脱钙、石蜡包埋切片,显微镜下观察拍照,并采用病理图像分析系统(PAS-8000)分析脂肪细胞空泡面积。
1.5 HS-5细胞的成脂诱导分化
进行成脂诱导分化的细胞分为2组,实验组:PPARγ RNAi干扰的HS-5细胞;对照组:未行PPARγ RNAi干扰的HS-5细胞。而未行成脂诱导分化的HS-5细胞作为空白组。
成脂诱导分化步骤如下:向6孔板中加入0.1%明胶1 mL,放置在CO2培养箱预处理30 min,然后吸去明胶,接种待诱导的HS-5细胞,接种密度为2×104细胞/cm2。每孔加入2 mL普通完全培养液,于37℃、5%CO2培养箱中培养。当细胞融合度达到100%时,去除完全培养液,向6孔板中加入2 mL成脂诱导分化培养液A液。诱导3 d后,吸去6孔板中的A液,加入2 mL成脂诱导分化培养液B液。维持1 d后,吸去B液,换回A液进行诱导。A液和B液交替使用,直到出现足量、大小适宜的脂滴。吸去6孔板中的成脂诱导分化完全培养液,用PBS洗涤2~3次,加入2 mL 4%多聚甲醛溶液固定30 min。PBS洗涤2~3次后,每孔加入油红O染色液,室温染色30 min,PBS洗涤2~3次,于显微镜下观察成脂染色效果。
1.6 HS-5细胞的成骨诱导分化
进行成骨诱导分化的细胞分为2组,实验组:PPARγ RNAi干扰的HS-5细胞;对照组:未行PPARγ RNAi干扰的HS-5细胞。而未行成骨诱导分化的HS-5细胞作为空白组。
成骨诱导分化步骤如下:向6孔板中加入0.1%明胶1 mL,放置在CO2培养箱预处理30 min,然后吸去明胶,接种待诱导的HS-5细胞,接种密度为2×104个细胞/cm2。每孔加入2 mL普通完全培养液,于37℃、5%CO2培养箱中培养。当细胞融合度达到70%时,去除完全培养液,向6孔板中加入2 mL成骨诱导分化培养液,每隔3天更换一次成骨诱导分化培养液,诱导3周后,去除成骨诱导分化培养液,PBS洗涤2~3次后加入2 mL 4%多聚甲醛溶液固定30 min。PBS洗涤2~3次后,每孔加入茜素红室温染色5~10 min后PBS洗涤2~3次,于显微镜下观察成骨染色效果。
1.7 CCK-8增殖实验
进行CCK-8增殖实验的细胞分为4组,实验组:PPARγ RNAi干扰的HS-5细胞经成骨诱导分化3 d后,与小鼠骨髓HSC共培养;阳性对照组:50 μmol/L BADGE(PPARγ抑制剂)处理的HS-5细胞经成骨诱导分化3 d后,与小鼠HSC共培养;阴性对照组: 未干扰PPARγ的HS-5细胞经成骨诱导分化3 d后,与小鼠HSC共培养;空白组:小鼠HSC单独培养,不与HS-5细胞共培养。
共培养及CCK-8增殖实验步骤如下:将小鼠HSC按每孔1×105细胞接种于24孔板Transwell上室中,下室为前期成骨分化诱导后的HS-5细胞,上室加入200 μL IMDM培养液,下室弃去原先培养液,加入500 μL IMDM培养液,每个24孔板Transwell中每个组接种4个孔,共重复接种3个板。放入37℃,5% CO2培养箱中培养,于24、48、72 h分别取出一个Transwell培养板的细胞做CCK-8增殖实验。每个孔取100 μL细胞悬液加入96孔板,各加入10 μL CCK-8混匀,37℃ CO2培养箱中孵育4 h,采用酶标仪于450 nm处进行吸光度(A)值检测。
1.8 统计学方法

2 结果
2.1 PPARγ RNAi转染效率分析
实验组、对照组均在200倍视野下观察绿色荧光蛋白表达量,计算绿色荧光蛋白表达阳性细胞所占比例。实验组与对照组绿色荧光蛋白阳性细胞所占比例无明显差异。见图1。

图1 慢病毒感染后荧光图片Fig.1 Fluorescent images of the lentiviral infection
2.2 PPARγ RNAi转染后HS-5细胞PPARγ基因的表达
实验组PPARγ基因在HS-5细胞中的表达水平明显低于对照组[(0.53±0.04)vs.(1.00±0.02),P<0.05],说明PPARγ基因在实验组HS-5细胞中被成功干扰。
2.3 PPARγ基因沉默的HS-5细胞对骨髓抑制小鼠血常规的影响
2.3.1 PPARγ基因沉默的HS-5细胞对小鼠血小板的影响 放疗后,各组小鼠血小板水平均呈先降低后升高趋势,放疗后1周,三组小鼠血小板水平差异显著,且实验组>对照组>空白组(P<0.05)。放疗前、放疗后24 h、放疗后2周,三组间差异不明显(均P>0.05)。详见表1。

表1 PPARγ基因沉默的HS-5细胞对小鼠血小板的影响Table 1 Effects of PPARγ gene-silenced HS-5 cells on mouse
2.3.2 PPARγ基因沉默的HS-5细胞对小鼠白细胞的影响 放疗后,各组小鼠白细胞水平均呈先降低后升高趋势,放疗后1周,三组小鼠白细胞水平差异显著,且实验组>对照组>空白组(P<0.01)。放疗前、放疗后24 h、放疗后2周,三组间差异不明显(均P>0.05)。详见表2。

表2 PPARγ基因沉默的HS-5细胞对小鼠白细胞的影响Table 2 Effects of PPARγ gene-silenced HS-5 cells on mouse white blood
2.3.3 PPARγ基因沉默的HS-5细胞对小鼠红细胞的影响 放疗后,各组小鼠红细胞水平均呈先降低后升高趋势,但放疗前、放疗后24 h、放疗后1周、放疗后2周,三组间差异无统计学意义(均P>0.05)。见表3。

表3 PPARγ基因沉默的HS-5细胞对小鼠红细胞的影响Table 3 Effects of PPARγ gene-silenced HS-5 cells on mouse red blood
2.3.4 PPARγ基因沉默的HS-5细胞对小鼠血红蛋白的影响 放疗后,各组小鼠血红蛋白水平均呈先降低后升高趋势,但放疗前、放疗后24 h、放疗后1周、放疗后2周,三组间差异无统计学意义(均P>0.05)。详见表4。

表4 PPARγ基因沉默的HS-5细胞对小鼠血红蛋白的影响Table 4 Effects of PPARγ gene-silenced HS-5 cells on mouse
2.4 PPARγ基因沉默的HS-5细胞对小鼠脂肪空泡面积百分比的影响
放疗后2周,实验组、对照组、空白组小鼠脂肪空泡面积百分比分别为:(5.34±0.82)%、(14.19±1.31)%、(18.27±2.32)%,三组小鼠脂肪空泡面积百分比差异显著,且实验组<对照组<空白组(P<0.05)。
2.5 小鼠血常规与血清PPARγ表达水平及脂肪空泡面积百分比的关系分析
放疗后2周,经Pearson相关分析显示,小鼠血常规各指标与其血清PPARγ表达水平呈负相关(均P<0.05),与脂肪空泡面积百分比呈负相关(均P<0.05),见表5。

表5 小鼠血常规与PPARγ表达水平及脂肪空泡面积百分比的关系分析(r)Table 5 Analysis of the relationship between blood routine and PPARγ expression level and percentage of fat vacuolar area(r)
2.6 PPARγ基因沉默对HS-5细胞成脂分化的影响
经成脂分化诱导后,对细胞进行油红O染色,被染为橙红色的细胞即为脂肪细胞,细胞核呈蓝色,被细胞质中大小不等的脂滴挤向一侧。实验组与对照组相比,橙红色的细胞比例明显较低,见图2。

图2 三组成脂分化结果(油红O染色,×100)Fig.2 The adipogenic differentiation results of three groups(oil red O staining,×100)
2.7 PPARγ基因沉默对HS-5细胞成骨分化的影响
经成骨分化诱导后,采用茜素红对细胞进行染色,出现红色钙结节处即为成骨细胞。实验组与对照组相比,红色钙结节比例明显较高,见图3。

图3 三组成骨分化结果(茜素红染色,×100)Fig.3 The osteogenic differentiation results of three groups(alizarin red staining,×100)
2.8 PPARγ基因沉默的HS-5细胞对小鼠HSC增殖的影响
成骨分化诱导3 d后,实验组、阳性对照组、阴性对照组HS-5均与小鼠HSC细胞进行共培养,空白组则单独培养HSC细胞,CCK-8法检测结果显示共培养24、48、72 h后,实验组、阳性对照组小鼠HSC细胞增殖水平均高于阴性对照组和空白组(均P<0.01),详见表6。
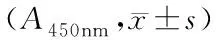
表6 PPARγ基因沉默的HS-5细胞对小鼠HSC增殖的影响Table 6 Effect of HS-5 cells with PPARγ gene silencing on proliferation of HSC in mouse
3 讨论
放化疗是一种常见的癌症治疗方法,它通过使用高能量的辐射和化学药物来杀死癌细胞。然而,放化疗也会对正常细胞造成损伤,特别是对骨髓造血干细胞的影响最为明显,导致骨髓抑制。骨髓造血干细胞数量减少或功能受损,会影响机体的正常造血功能,严重时甚至可能危及生命[8]。构建骨髓抑制动物模型可模拟临床治疗对病情的影响,具有现实意义。骨髓抑制模型一般采用化疗或放疗诱导,但考虑化疗药物造模时间较长,且机体存在报复性反弹趋势[9-10],所以本研究采用X射线进行全身照射构建骨髓抑制小鼠模型。研究中经X射线进行全身照射的小鼠在放疗后24 h血常规均存在异常,说明骨髓抑制小鼠造模成功。
PPAR是核激素受体家族中的配体激活受体,包括PPARα、PPAR β/δ和PPARγ三个亚型,其中对PPARγ的研究最为深入[11]。PPARγ由6个蛋白结构域组成,具有多种生物学功能,例如调控糖脂代谢、免疫炎症、动脉粥样硬化、肿瘤细胞分化、脂肪细胞分化等[12]。有研究显示,前脂肪细胞的增殖、分化,脂肪细胞内脂质积累是由PPARγ表达所调控[13];骨骼肌特异性过表达PPARγ可以促进氧化纤维的形成和肌内脂肪沉积[14]。而脂肪组织大量沉积是放化疗所致骨髓抑制的病理变化之一,有研究发现,在用PPARγ抑制剂治疗的小鼠中,辐射后骨髓植入相对于野生型或未治疗的小鼠加速,该研究认为拮抗骨髓脂肪生成可增强临床骨髓移植中的造血恢复[15]。Li等[16]研究发现高脂饮食可加重5-氟尿嘧啶诱导的骨髓抑制和细胞减少,用PPARγ拮抗剂预处理高脂饮食小鼠,逆转了5-氟尿嘧啶的骨髓抑制,加速了HSC和血小板的恢复,因此认为PPARγ拮抗剂治疗提供了一种潜在的策略来缓解高脂饮食下恶化的造血功能。本研究采用骨髓间充质干细胞移植及慢病毒干扰技术,将PPARγ基因沉默的HS-5细胞植入骨髓抑制小鼠,结果发现放疗后1周,实验组小鼠血小板、白细胞水平明显高于对照组和空白组,说明PPARγ基因沉默的HS-5细胞可有效抑制血小板、白细胞水平降低,缓解放疗所致的骨髓抑制及造血功能恶化。放疗后2周,实验组小鼠脂肪空泡面积百分比显著低于对照组、空白组,且经Pearson相关分析显示,血常规各指标与血清PPARγ表达水平呈负相关,与脂肪空泡面积百分比呈负相关。该结果说明PPARγ基因沉默的HS-5细胞可有效减少骨髓抑制小鼠骨髓内的脂肪组织沉积,且骨髓抑制与PPARγ基因表达水平、脂肪组织沉积密切相关。
为了进一步探讨PPARγ基因沉默对骨髓抑制小鼠造血功能保护的可能机制,本研究在体外诱导HS-5细胞成脂/成骨分化,结果发现实验组与对照组相比,橙红色的细胞比例明显较低,红色钙结节比例明显较高,提示PPARγ基因沉默的HS-5细胞成脂分化能力减弱,成骨分化能力增强,这与Li等[17]的另一篇报道相似,该报道认为骨髓基质细胞在多种因子和细胞内信号的转录调控下,可分化为多种细胞类型,包括脂肪细胞和成骨细胞。骨髓基质细胞的PPARγ被干扰表达后,其分化脂肪细胞数量减少,而分化为成骨细胞的数量增多。Duan等[18]研究发现,激活PPARγ信号通路可促进骨髓基质细胞的成脂分化,而抑制PPARγ的组蛋白乙酰化水平可有效阻止骨髓基质细胞的成脂分化。以上均证实PPARγ基因在骨髓基质细胞定向分化中起到关键作用。
为了在体外模拟骨髓基质细胞移植治疗骨髓抑制小鼠的过程,本研究将成骨诱导分化的HS-5细胞与小鼠HSC细胞共培养后采用CCK-8法检测小鼠HSC细胞增殖情况,结果发现共培养24、48、72 h后,实验组、阳性对照组小鼠HSC细胞增殖水平均明显高于阴性对照组和空白组,说明PPARγ表达干扰后,同PPARγ拮抗剂BADGE一样均可抑制小鼠HSC细胞增殖。分析原因,PPARγ基因沉默的HS-5细胞,其成骨分化能力强,在成骨分化诱导下能产生更多的成骨细胞,而成骨细胞可进一步合成促进造血细胞生长的因子,诱导造血细胞增殖。
综上所述,PPARγ基因沉默的HS-5细胞植入骨髓抑制小鼠后有利于小鼠造血功能维持,其机制可能是:PPARγ基因沉默的HS-5细胞成骨分化能力增强,从而提高小鼠HSC细胞增殖能力,促进骨髓抑制小鼠造血功能恢复。

