柯里拉京对吗啡耐受大鼠脊髓小胶质细胞活化的作用机制*
关 森, 王慧淼, 汪冬梅, 胡 杰△
河北省承德市中心医院 1麻醉科 2检验科 3内分泌科,承德 067000
作为阿片类药物,吗啡(morphine,Mor)被广泛用于临床急慢性疼痛的治疗[1-2]。然而长期使用吗啡导致药物耐受性,其镇痛效果减弱,加重患者治疗不适感[3]。在慢性吗啡耐受大鼠模型的脊髓组织中,神经小胶质细胞活化,促炎因子水平升高[4]。降低促炎因子水平或抑制胶质细胞活化可减轻吗啡耐受症状[5-6]。柯里拉京(corilagin,Cor),一种提取自中草药的水溶性逆没食子酸鞣质,可抑制辐射诱导的小胶质细胞活化,发挥抗炎作用,减少促炎性介质生成[7-8]。本文旨在探索柯里拉京对慢性吗啡耐受的作用及机制。
1 材料和方法
1.1 实验动物及材料
30只SPF级雄性SD大鼠购自常州卡文斯实验动物有限公司;盐酸吗啡注射液购自沈阳第一制药厂;柯里拉京购自成都仪睿生物科技有限公司;ELISA试剂购自武汉伊莱瑞特生物科技股份有限公司。Iba-1、ERK和JNK抗体购自艾博抗(上海)贸易有限公司,p-ERK、p-JNK、p-p38和p38抗体购自圣克鲁斯生物技术公司。
1.2 动物实验和分组
将SPF级雄性SD大鼠(8~9周,体重200~280 g)置于标准实验室中饲养,室温(22±1)℃,自由进食。将大鼠随机分为对照(Control,n=6)组、柯里拉京(Cor,n=6)组,吗啡(Mor,n=6)组,吗啡+低柯里拉京(Mor+Cor 10 mg/kg,n=6)组和吗啡+高柯里拉京(Mor+Cor 20 mg/kg,n=6)组。对照组大鼠注射等体积生理盐水。柯里拉京组大鼠腹腔注射20 mg/kg的柯里拉京和生理盐水。吗啡组大鼠皮下注射吗啡10 mg/kg和生理盐水,以建立慢性吗啡镇痛大鼠耐受模型。大鼠在注射吗啡14 d后形成较为稳定的机械痛敏,标志慢性吗啡耐受模型建立成功[9]。吗啡+低柯里拉京(10 mg/kg)组和吗啡+高柯里拉京(20 mg/kg)组的大鼠在吗啡给药30 min前分别腹腔注射10 mg/kg和20 mg/kg柯里拉京,连续给药14 d[10]。动物饲养过程符合国际实验动物评估和认证协会的动物福利指南,动物研究方案获得了我院伦理委员会的批准。
1.3 实验方法
1.3.1 水浴甩尾法 将大鼠固定,取其尾部末端1/3放入(50±0.2)℃水浴锅中,记录大鼠尾部从入水到开始甩尾的时间(tail flick latency,TFL)。每只大鼠测3次,测试间隔5 min,取其平均值为基础甩尾潜伏期(baseline latency,BL)。为防止烫伤,若小鼠15 s未甩尾,则TFL记为15 s。大鼠最大镇痛效能计算公式如下:最大效应百分数(maximal possible effect,MPE)=(TFL-BL)/(15-BL)×100%。分别于第1、3、5、7、9 d测定各组大鼠甩尾潜伏期。
1.3.2 免疫荧光法 经过药物处理14 d后,用50 mg/kg戊巴比妥钠麻醉大鼠,在冰上迅速分离出脊髓的腰膨大节段。将组织切片(30 μm)用4%多聚甲醛固定15 min,用Triton X-100透化切片15 min。然后用10%正常山羊血清封闭1 h。经磷酸盐缓冲液(PBS)清洗后,将切片与一抗Iba-1在4℃下孵育过夜,而后与二抗室温孵育1 h。使用4′,6-二脒基-2-苯基吲哚溶液染色5 min。最后,使用共聚焦激光扫描荧光显微镜对切片进行观察,软件FV10-AW测量免疫活性染色的吸光度,计算阳性细胞率。
1.3.3 蛋白免疫印迹实验 使用RIPA(radio immunoprecipitation assay)缓冲液裂解脊髓组织,BCA(bicinchoninic acid)试剂盒测定蛋白质浓度。15 μg蛋白样品进行电泳分离后,转移至PVDF(polyvinylidene fluoride)膜上,将膜室温封闭2 h,与Iba-1、p-ERK、p-JNK、p-p38、ERK、JNK、p38一抗在4℃下孵育过夜,次日将膜与二抗室温孵育2 h。加入增强型化学发光试剂(ECL)底物发光试剂,用dyssey红外成像系统检查印迹,以GAPDH为内参。
1.3.4 酶联免疫吸附实验(ELISA) 按说明书操作,用ELISA试剂盒检测脊髓组织中炎症因子IL-6,TNF-α和IL-1β的表达。
1.3.5 逆转录-聚合酶链反应 利用Trizol试剂提取总的RNA。按照说明书,用反转录试剂盒将1 μg RNA逆转录为互补DNA。借助SYBR Green进行PCR反应。扩增条件:95℃预变性10 min,95℃变性15 s,60℃退火1 min,72 ℃延伸1 min,共40个循环。引物序列如下:IL-6,正向:5′-AGAGACTTCCAGCCAGTTGC-3′,反向:5′-AGTCTCCT-CTCCGGACTTGT-3′;TNF-α,正向:5′-AACACACGAGACGCTGAAGT-3′,反向:5′-TCCAGTGAGTTCCGAAAGCC-3′;IL-1β,正向:5′-GAG-TCTGCACAGTTCCCCAA-3′,反向:5′-ATGTCCCGACCATTGCTGTT-3′;GAPDH,正向:5′-TGTGAACGGATTTGGCCGTA-3′,反向:5′-GA-TGGTGATGGGTTTCCCGT-3′。基因的相对表达量由2-ΔΔCt法计算。
1.4 统计学方法
2 结果
2.1 柯里拉京增加对吗啡耐受大鼠的镇痛作用
如图1所示,与对照组相比,吗啡组的镇痛作用随时间推移逐渐降低(均P<0.01)。与吗啡组相比,柯里拉京给药后延缓了吗啡镇痛作用的消失(均P<0.05)。
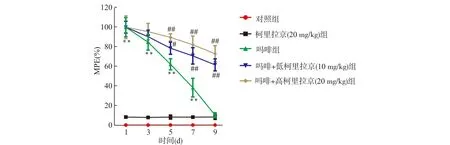
与对照组比较,**P<0.01;与吗啡组比较,#P<0.05 ##P<0.01
2.2 柯里拉京降低吗啡耐受大鼠的小胶质细胞活化
如图2所示,与对照组比较,吗啡组Iba-1的阳性细胞率显著增加,柯里拉京预处理后,阳性细胞率显著降低。与对照组相比,吗啡组Iba-1蛋白表达显著增加,柯里拉京预处理后,Iba-1蛋白表达逐步降低。
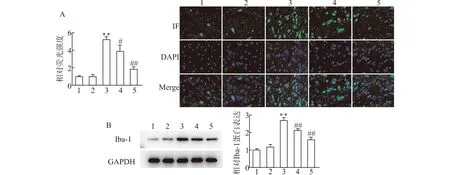
1:对照组;2:柯里拉京(20 mg/kg)组;3:吗啡组;4:吗啡+低柯里拉京(10 mg/kg)组;5:吗啡+高柯里拉京(20 mg/kg)组;A:免疫荧光检测Iba-1阳性细胞率;B:蛋白免疫印迹法检测Iba-1表达;与对照组比较,**P<0.01;与吗啡组比较,#P<0.05 ##P<0.01
2.3 柯里拉京降低吗啡耐受大鼠脊髓炎性细胞因子的释放
如图3所示,与对照组比较,吗啡组炎性因子表达显著增加,柯里拉京预处理后,炎性因子表达显著降低。与对照组比较,吗啡组炎性因子mRNA表达水平显著上升,柯里拉京预处理后,炎性因子mRNA表达显著下调。

1:对照组;2:柯里拉京(20 mg/kg)组;3:吗啡组;4:吗啡+低柯里拉京(10 mg/kg)组;5:吗啡+高柯里拉京(20 mg/kg)组;A~C:ELISA试剂盒检测炎性因子IL-6、TNF-α、IL-1β表达;D:qRT-PCR检测炎性因子IL-6、TNF-α、IL-1β的mRNA表达;与对照组比较,**P<0.01;与吗啡组比较,#P<0.05 ##P<0.01
2.4 柯里拉京抑制吗啡耐受大鼠脊髓中MAPK信号通路的激活
如图4所示,与对照组比较,吗啡组p-ERK、p-JNK和p-p38表达显著增加,柯里拉京预处理后,p-ERK、p-JNK和p-p38表达显著降低(均P<0.01)。

1:对照组;2:柯里拉京(20 mg/kg)组;3:吗啡组;4:吗啡+低柯里拉京(10 mg/kg)组;5:吗啡+高柯里拉京(20 mg/kg)组;免疫蛋白印迹法检测MAPK信号通路相关蛋白表达;与对照组比较,**P<0.01;与吗啡组比较,##P<0.01
3 讨论
吗啡是临床上常用的镇痛药,提高其镇痛效果对治疗临床急慢性疼痛性疾病有重大意义。本研究建立大鼠吗啡耐受模型以探讨柯里拉京在吗啡耐受中的作用及可能机制。
胶质细胞活化和促炎因子是吗啡耐受的主要参与者[11-12]。研究发现,柯里拉京具有抗炎和抗氧化特性[13]。腹腔注射柯里拉京可产生显著的抗痛觉特性[14]。本研究发现柯里拉京可降低吗啡耐受性,且高剂量组效果显著。
小胶质细胞活化参与吗啡耐受是因为其衍生的溶酶体半胱氨酸蛋白酶Cathepsin S是放大痛觉信号的重要介质[15]。研究表明,柯里拉京可抑制小胶质细胞活性,降低Iba-1表达[16-17]。本研究发现,吗啡显著提高大鼠脊髓中阳性细胞率和Iba-1蛋白表达,柯里拉京预处理后,阳性细胞率和Iba-1蛋白表达降低,表明柯里拉京抑制吗啡耐受引起的小胶质细胞活化。
在吗啡耐受模型中,TNF-α和IL-1β表达明显升高[18]。此前已报道,柯里拉京抑制炎性因子的表达[8]。本研究发现,吗啡组中IL-6、TNF-α和IL-1β表达显著增加,柯里拉京预处理后,IL-6、TNF-α和IL-1β表达降低,表明柯里拉京对促炎因子具有抑制作用。
Wang等[19]发现吗啡耐受可激活MAPK信号。众所周知,MAPK与病理性疼痛密切相关[20-21]。此外,MAPKs的激活被证实在阿片类药物诱导中具有潜在作用[22-23]。在吗啡耐受大鼠模型中,大鼠中枢及周围神经系统中ERK和JNK信号通路被激活[24]。抑制ERK和JNK信号通路后,吗啡镇痛耐受效果明显降低[25]。米诺环素通过抑制p38拮抗吗啡抗痛性耐受[23]。柯里拉京通过抑制ERK/JNK MAPK阻断NF-κB介导的炎症途径,以改善对肝脏的毒性[26]。本研究发现,柯里拉京预处理降低了吗啡组中p-ERK、p-JNK和p-p38高表达,表明柯里拉京通过抑制MAPK信号通路改善吗啡耐受。
综上,柯里拉京抑制吗啡耐受诱导的小胶质细胞活化,炎性因子释放和MAPK信号通路的激活,提示柯里拉京可能通过抑制MAPK信号通路延缓吗啡耐受的进展,为其在吗啡耐受的临床应用中提供新的理论依据。但是,本研究也存在一些不足,比如,柯里拉京在临床上对吗啡耐受进展的影响并未研究,这也将是我们之后研究的重点所在。

