骨髓脂肪细胞因子与骨髓增生异常综合征的相关性研究*
李遇春 王军亮 王靖宇 李扬威 辛雅萍 吕晓东
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是起源于造血干细胞的一组高度异质性髓系肿瘤,有较高的转化为急性髓系白血病(acute myeloid leukemia,AML)的风险,可作为白血病前期进展为临床白血病的连续过程,因此是研究白血病发生和进展病理机制较好的研究模型。MDS 一直被认为是一种基因病,是由调控细胞增殖、凋亡和代谢的关键基因突变累积引起的疾病。本课题组前期研究发现,约80%的MDS 患者可检测出突变基因,突变的发生存在高度异质性和多样性[1-2]。而相同的MDS 表型伴随不同的突变基因,提示突变基因可能是更深层次原因的结果,而非MDS 发生进展的主要原因。
越来越多的研究提示,肿瘤细胞的代谢异常不仅是肿瘤的一个特征,也可能是肿瘤的潜在原因[3],多数癌基因或抑癌基因的功能是维持肿瘤异常的代谢状态。骨髓微环境是MDS 细胞发生的始动因素和赖以生存的环境,脂肪细胞是其重要组成部分,可通过分泌脂肪细胞因子如脂联素(adiponectin,ADP)、瘦素(leptin,LEP)、内脏脂肪素(nicotinamide phosphoribosyltransferase,NAMPT)、降脂素(complement factor D,CFD)和人补体C1q 肿瘤坏死因子相关蛋白1(C1q/TNF-related protein 1,CTRP1)等,参与正常造血,其与血液肿瘤的发生及治疗关系密切[4]。本研究根据88 例MDS患者骨髓脂肪细胞因子水平及伴随突变基因,结合临床特征和生存信息,进一步评估骨髓微环境中脂肪细胞因子水平与MDS 发生、进展及预后的关系。
1 材料与方法
1.1 临床资料
回顾性分析2020 年2 月至2022 年2 月郑州大学附属肿瘤医院治疗的72 例初诊MDS(81.8%)患者和16 例MDS 继发急性髓系白血病(secondary acute myeloid leukemia,sAML)(18.2%)患者的临床资料。88 例患者中,男性51 例,女性37 例,中位年龄52(38~63)岁。纳入标准:1)初发未治疗的MDS 患者;采用MDS 中国诊断与治疗指南(2019 年版)进行诊断和分型,根据MDS 修订国际预后积分系统(IPSSR)进行评分与分组;2)性别、发病年龄、血常规计数资料、骨髓原始细胞比例、染色体结果等重要资料完整者。排除标准:1)妊娠或哺乳期患者;2)合并自身免疫性疾病患者;3)合并其他血液系统疾病及恶性肿瘤患者。该研究经过本院伦理委员会批准(批号:2020-KY-0090-001),并且全部患者及家属均已签署知情同意书。
1.2 方法
1.2.1 样本采集和处理 于髂后或髂前上棘局部麻醉后抽吸骨髓液5 mL,EDTA 抗凝,2 000 转/分离心后,分离骨髓上清液。剩余样本,采用天根血液基因组DNA 提取试剂盒提取DNA,经微量分光光度计NanoDrop 2000 定量,样本保存于-20℃冰箱待测。
1.2.2 采用酶联免疫吸附法检测脂肪细胞因子 采用酶联免疫吸附法(ELISA)检测骨髓上清液中的脂肪细胞因子,如ADP、LEP、NAMPT、CFD 和CTRP1。使用“Curve Expert”软件制作标准曲线,根据样本OD 值,计算脂肪细胞因子浓度。使用X-tile 软件对患者进行脂肪因子表达水平分组。
1.2.3 高通量测序靶向检测基因突变 使用探针捕获78 种髓系肿瘤的热点基因,采用Illumina Next Seq500测序平台进行测序。测序后数据利用人基因组数据库(HG19),COSMIC、1 000 genomes 和dbSNP等数据库进行分析。平均基因覆盖率>99%,平均测序深度为1 500×,目标区域测序深度超过1 000×,检测灵敏度1%。
1.2.4 染色体核型分析 骨髓细胞经过24 h 培养,收集细胞制片,采用常规R 显带技术进行核型分析,根据《人类细胞遗传学国际命名体制(ISCN2013)》进行描述。
1.2.5 治疗 依据患者年龄、IPSS-R 预后分层、依从性等进行评价,选择治疗方案。88 例患者中,20 例(22.7%)接受单纯支持治疗,12 例(13.6%)接受免疫抑制剂或免疫调节剂治疗,36 例(40.9%)接受去甲基化药物治疗,8 例(9.1%)接受化疗,8 例(9.1%)接受异基因造血干细胞移植,4 例(4.5%)接受中药制剂治疗。
1.2.6 随访 上述病例通过电话沟通及查阅门诊及住院电子病例的方式对患者进行随访,并记录患者疾病进展情况及生存结局,随访时间截至2023 年4 月,并计算患者的无进展生存期(progression-free survival,PFS)及总生存期(overall survival,OS)。随访患者中,失访2 例(2.3%),中位随访时间19(1~37)个月。PFS 定义为MDS 诊断之日至进展、复发或死亡的日期。OS 定义MDS 为诊断之日至死亡或随访截止日期。
1.3 统计学分析
采用SPSS 26.0 软件进行统计学分析。计量资料采用t检验或非参数秩和检验进行比较,计数资料采用χ2检验或Fisher 精确检验进行比较。Spearman或Pearson 相关分析检验变量相关性。采用Kaplan-Meier 法进行生存分析,Cox 比例风险回归模型进行单因素和多因素分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 患者临床资料
88 例患者外周血结果显示,血红蛋白(HGB)中位数为83.0(69.0~103.3)g/L,中性粒细胞计数(ANC)中位数为1.3(0.7~3.1)×109/L,血小板(PLT)中位数为51.0(26.0~150.8)×109/L,身体质量指数(BMI)中位数为23.2(21.5~26.0)kg/m2。其他项目,见表1。

表1 患者临床特征
2.2 骨髓脂肪细胞因子表达水平分析
骨髓脂肪细胞因子与临床特征分组结果分析,性别相关结果显示,男性ADP 和LEP 水平[ADP:6.67(2.73~18.32)μg/mL;LEP:0.30(0.16~0.69)ng/mL]分别较女性[ADP:13.12(7.53~24.18)μg/mL;LEP:0.57(0.19~1.45)ng/mL]显著降低(P=0.027,P=0.019),见图1A,1B。

图1 骨髓脂肪细胞因子表达水平分析
年龄相关结果显示,年龄<65 岁患者的ADP、CFD和NAMPT 水平[ADP:7.88(3.41~17.62)μg/mL;CFD:1.30(0.78~2.20)μg/mL;NAMPT:0.78(0.56~1.59)ng/mL]较年龄≥65 岁患者[ADP:17.60(5.77~29.86)μg/mL;CFD:2.43(1.73~4.83)μg/mL;NAMPT:1.37(1.02~4.37)ng/mL]显著降低(P=0.020,P<0.001,P=0.021)。而年龄<65 岁患者的LEP 水平0.45(0.20~1.11)ng/mL,较年龄≥65 岁患者0.27(0.12~0.49)ng/mL 显著升高(P=0.043),见图1C~1F。
BMI 相关结果显示,BMI<24 kg/m2患者的ADP水平[12.07(4.75~24.71)μg/mL]较BMI≥24 kg/m2患者的[6.55(2.73~15.06)μg/mL]显著升高(P=0.025),然而BMI<24 kg/m2患者的LEP 水平[0.32(0.16~0.67)ng/mL]较年龄≥24 岁患者的0.56(0.24~1.21)ng/mL 显著降低(P=0.020),见图1G,1H。
原始细胞比例相关结果显示,升高组(原始细胞≥5%)的NAMPT 水平1.36(0.68~3.16)ng/mL 较无原始细胞升高组0.78(0.50~1.48)ng/mL 显著升高(P=0.037),见图1I。疾病类型分组结果显示,MDS组的CTRP1 水平0.09(0.02~0.21)ng/mL 较sAML组0.04(0.01~0.05)ng/mL 显著升高(P=0.010),见图1J。其余脂肪细胞因子各组间差异均无统计学意义。
2.3 骨髓脂肪细胞因子与MDS 基因突变分析
70 例患者髓系血液肿瘤热点基因突变结果显示,共检测到35 种突变基因,其中45 例64.3%(45/70)患者检出至少1 个基因突变,突变基因频率最高的为RUNX1 12 例(13.0%),其余突变检出率依次为U2AF 19 例(9.8%),TET 25 例(5.4%),TP5 35 例(5.4%),NPM 15 例(5.4%),EVT 64 例(4.4%),NRAS 4 例(4.4%),SETBP 14 例(4.4%),SRSF 24 例(4.4%),ASXL 14 例(4.4%)。突变基因依据其功能进行分类,按突变频率高低依次排列,转录调节相关基因31 例(33.7%),表观遗传相关基因24 例(26.1%)、剪接子相关基因13 例(14.1%)、信号传导相关基因12 例(13.0%)、细胞周期与凋亡相关基因12 例(13.0%)。
45 例基因突变阳性患者中,发生1 个基因突变16 例(35.6%),2 个基因突变15 例(33.3%),3 个基因突变10 例(22.2%),4 个及以上基因突变4 例(8.9%)。
脂肪细胞因子与突变基因功能分类的相关分析显示,CTRP1 水平的升高与表观遗传相关异常基因的发生呈正相关(CTRP1:γ=0.252,P=0.001),CTRP1 水平与TET2 和U2AF1 的发生呈正相关(TET2:γ=0.416,P<0.001;U2AF1:γ=0.251,P=0.036),ADP 和CFD 水平分别与NPM1 的发生呈正相关(ADP:γ=0.237,P=0.048;CFD:γ=0.265,P=0.026),见图2。
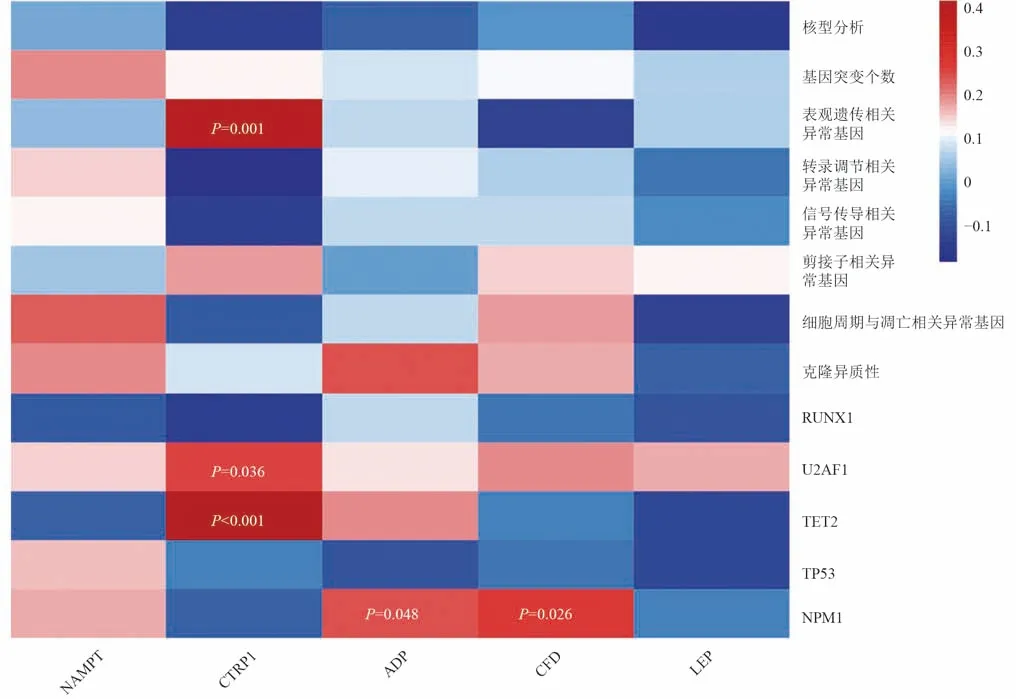
图2 骨髓脂肪细胞因子与MDS 基因突变等因素相关性分析
2.4 骨髓脂肪细胞因子与患者预后的关系
86 例随访患者,中位PFS 时间15.4(95%CI:13.1~17.6)个月,中位OS 时间22.3(95%CI:15.4~29.2)个月。根据患者一般情况(年龄、性别和BMI),疾病特征[ANC、HGB、PLT、血细胞减少系数、染色体核型、原始细胞比例分组和修订的国际预后积分系统(IPSS-R)预后评分]、高频突变基因(RUNX1、U2AF1、TET2、TP53、NPM1)、脂肪细胞因子(CTRP1、LEP、ADP、CFD 和NAMPT)进行单因素生存分析。结果显示,较高危(IPSS-R>3.5 分)(P=0.001)、RUNX1+(P=0.002)、TP53+(P=0.001)、LEP<0.2 ng/mL(P=0.001)、NAMPT ≥2.1 ng/mL(P=0.027)、原始细胞5%~20%(P<0.001)、TET2-(P=0.02)、CTRP1<0.1 ng/mL(P=0.041)与较差的PFS 相关。而较高危(IPSSR>3.5 分)(P=0.01 )、RUNX1+(P=0.001 )、TP53+(P=0.001)、LEP<0.2 ng/mL(P<0.001)、NAMPT≥2.1 ng/mL(P=0.024)、原始细胞≥20%(P<0.001)、NPM1+(P=0.045)和CFD ≥2.9 μg/mL(P=0.032)与较差的OS 相关。
将单因素分析中P<0.05 的独立因素纳入多因素Cox 回归模型。对于PFS,将P<0.05、相互独立且相互之间不存在多重共线性(VIF<5)的变量,原始细胞比例、RUNX1、TET2、TP53、LEP、NAMPT、CTRP1纳入多因素Cox 回归分析。结果显示RUNX1 阳性(HR=2.323,95%CI:1.076~5.017,P=0.032)、原始细胞5%~20%(HR=6.829,95%CI:2.700~17.272,P<0.001)、LEP<0.2 ng/mL(HR=3.238,95%CI:1.529~6.853,P=0.002)是MDS 患 者PFS 的危险因素。NAMPT<2.1 ng/mL(HR=0.459,95%CI:0.216~0.977,P=0.043)是MDS 患者PFS 的保护因素,见图3A。

图3 影响OS 和PFS 的多因素分析
对于OS,同上将原始细胞比例、RUNX1、TP53、NPM1、LEP、NAMPT、纳入多因素Cox 回归分析。结果显示RUNX1 阳性(HR=2.778,95%CI:1.266~6.097,P=0.011 )、TP53 阳 性(HR=6.182,95%CI:1.583~24.138,P=0.009)、LEP<0.2 ng/mL(HR=4.145,95%CI:1.872~9.179,P<0.001)、原始细胞≥20%(HR=4.183,95%CI:1.808~9.678,P=0.001)是MDS患者OS 的独立危险因素,见图3B。
3 讨论
肿瘤的发生依赖于细胞代谢重编程,而细胞内外代谢产物的改变与肿瘤微环境、基因异常和肿瘤细胞分化关系密切[3]。骨髓脂肪细胞因子是骨髓造血微环境中的脂肪细胞衍生的代谢物和生物活性肽。本研究发现,骨髓脂肪细胞因子水平与MDS 患者性别、年龄以及BMI 关系密切。既往研究结果提示,不同性别间存在脂肪细胞因子水平差异,女性LEP 水平高于男性[4-5]。在年龄相关研究中发现,ADP 水平随着年龄的增长而增加,而LEP 水平随着年龄的增长而下降[6]。且脂肪细胞因子水平与BMI 指数关系密切,其中ADP与总脂肪量呈反比[7],而LEP 呈正比[8]。上述研究结果与本研究结果相近,但既往研究多数分析外周血或组织中脂肪因子水平,而骨髓微环境中脂肪细胞因子水平更适于分析其与血液肿瘤发生及进展间的关系。
在与MDS 基因异常分析中发现,CTRP1 表达与表观遗传类相关基因突变(TET2)和U2AF1 突变(RNA 剪切相关基因)的发生呈正相关。CTRP1 是CTRP 家族成员之一,主要在脂肪组织中表达,是代谢的关键调节因子[9]。研究发现,CTRP1 的表达有助于NF-κB 信号转导,促进肺癌和结肠癌进展,且CTRP1高表达与肺癌、胃癌和肾癌的预后不良相关[10-11]。此外,CTRP1 高表达可通过调节p53 基因促进人类肿瘤细胞(大肠癌细胞、乳腺癌细胞、肺癌细胞、肺癌细胞和胚胎肾细胞)生长[12]。上述结果提示,CTRP1 可促进实体肿瘤进展且与预后不良有关,但鲜见CTRP1在血液肿瘤中的相关研究。TET2 编码一种甲基胞嘧啶双加氧酶,可促进DNA 去甲基化,有助于骨髓生成的表观遗传调节,其突变可影响造血干细胞/祖细胞的分化及增殖过程[13-14]。而动物实验也证实,TET2 突变小鼠可发展为与人MDS 相似的髓系恶性肿瘤[15]。U2AF1 突变可导致RNA 剪接发生错误,从而导致肿瘤的发生。目前鲜见CTRP1 与TET2、U2AF1 间的相关研究,但有研究发现造血细胞因子可磷酸化TET2,导致其在红系祖细胞中的激活[16]。本研究提示TET2 等基因突变的出现,可能是骨髓微环境中脂肪细胞因子变化(如CTRP1)的适应性改变,与MDS的发生及进展关系密切,但相关机制仍需要在未来的研究中进一步阐明。
本研究发现,NAMPT 在≥65 岁患者和原始细胞≥5%患者的骨髓微环境中明显升高,且预后相关多因素分析提示骨髓NAMPT 低表达是MDS 患者预后生存的保护因素。NAMPT 是一种已知可调节恶性肿瘤细胞生长、凋亡和血管生成的分泌性脂肪因子[17]。已被发现在肝癌[18]、大肠癌[19]等多种实体肿瘤中高表达且与不良预后相关。在血液肿瘤中,已被证实在多发性骨髓瘤患者的血清或者组织中高表达[20]。Cagnetta 等[21]发现,硼替佐米耐药的多发性骨髓瘤患者中,NAMPT 高表达与不良预后相关。此外,NAMPT 抑制剂FK866 和硼替佐米联用可增强NAD+消耗,激活caspase 3、caspase 8、caspase 9 和ADP 核糖聚合酶,从而产生诱导细胞凋亡的协同效应,增加骨髓瘤细胞对硼替佐米的敏感性。Bong 等[22]也证实,在多发性骨髓瘤细胞中通过特异性siRNA 敲除NAMPT 可抑制增殖并诱导细胞凋亡。但NAMPT 在MDS 中的作用鲜见报道。综上提示,NAMPT 高表达可能参与到MDS 的发生和进展,其表达水平可提示患者预后。
本研究MDS 患者预后分析中,LEP<0.2 ng/mL是MDS 患者PFS 和OS 的独立危险因素。LEP 是脂肪细胞产生的多能细胞因子[23]。有研究发现其具有促肿瘤作用,当骨髓瘤细胞与脂肪细胞共培养时,LEP可激活AKT/STAT3 通路,增加Bcl-2 水平,抑制caspase 3 酶活性,抑制肿瘤细胞凋亡,进而导致骨髓瘤化疗耐药,并增强骨髓瘤细胞的增殖和迁移能力[24]。LEP 也可通过MAPK/ERK1/ERK2 和PI3K 等信号通路,激活髓系和淋系肿瘤细胞的相关受体,刺激细胞增殖和细胞因子分泌,并抑制细胞凋亡[25]。但也有部分研究发现LEP 在肿瘤中的发挥抑制作用。血清LEP 水平与乳腺癌发病风险呈负相关[26],并可通过p38-MAPK 依赖性信号通路抑制体外肝癌细胞生长[27]。此外,低LEP 水平也与胰腺内分泌肿瘤相关[28]。脂肪细胞中LEP 的合成及分泌受能量代谢平衡、胰岛素水平、微环境炎症状态等多因素影响[29]。结合以往研究提示,在MDS 发生过程中,LEP 可能发挥肿瘤抑制作用,低LEP 水平可能参与MDS 的疾病进展。
综上所述,骨髓微环境中的脂肪细胞因子,与MDS 患者一般特征、基因突变以及患者预后均密切相关,提示其在MDS 发生和进展中发挥重要作用,为进一步研究骨髓微环境脂代谢重编程在血液肿瘤发病中的作用提供借鉴。
本文无影响其科学性与可信度的经济利益冲突。

