儿童肝脏未分化胚胎性肉瘤的影像表现及病理分析
吴朔春 孙雪峰 杨梅 仪晓立 陶然 邹继珍
肝脏未分化胚胎性肉瘤(undifferentiated embryonal sarcoma of the liver,UESL)于1978 年首次由Stocker 等[1]报道。UESL 是继肝母细胞瘤和肝细胞癌之后,居第3 位常见的儿童肝脏恶性肿瘤[2],占儿童肝脏恶性肿瘤的9%~15%[3]。既往报道UESL 恶性程度高,可转移至肺、胸膜及腹膜,预后较差,5 年生存率低于10.0%,近年来研究显示UESL 经新辅助化疗、手术及放疗综合治疗,可以显著改善临床预后[4-7]。UESL 临床表现及辅助检查缺乏特异性,确诊依赖组织病理学和免疫组织化学检查[8-9],因此临床术前诊断困难,误诊率高,难以早期诊断。本研究回顾性分析总结11例经手术病理证实的UESL 患儿的超声、CT 和MRI影像学表现,并与临床及病理表现对照,探讨儿童UESL 的影像特点及鉴别诊断要点,以期提高对UESL 的认识和诊断水平,从而早期诊断、积极治疗。
1 材料与方法
1.1 临床资料
收集首都儿科研究所附属儿童医院2009 年12月至2021 年12 月11 例经手术病理证实的UESL,其中男性5 例,女性6 例,年龄3~12 岁,中位年龄8 岁,8 例患儿年龄位于6~10 岁。该研究经本院医学伦理委员会批准(批号:SHERLLM2023002)。
1.2 方法
1.2.1 影像学检查 11 例患儿均行CT 平扫检查,其中联合采用CT 增强检查9 例,超声6 例,MRI 平扫3 例,其中1 例并增强MRI 扫描。
CT 检查采用美国GE Lightspeed 16 层或Discovery HD750 扫描机,常规取仰卧位扫描;哭闹不合作者检查前给予10%水合氯醛0.25~0.50 mL/kg 镇静。扫描参数:管电压100~120 kV,管电流100~150 mA;扫描层厚5.00 mm,螺距1.000~1.375,重建层厚0.625 mm 或1.250 mm;增强扫描采用非离子对比剂碘海醇(含碘300 mg/mL,购自北京北陆药业股份有限公司),经前臂静脉以1.2~2.5 mL/s 流率团注,剂量1.5~2.0 mL/kg,注射后15~20 s、50~60 s、120 s分别获得动脉期、门静脉期及延迟期图像。
MRI 扫描使用美国GE HDx 1.5 T MRI 扫描仪,仰卧位,选用8 通道体线圈对腹部进行扫描,扫描序列及参数:轴位脂肪抑制FSE 序列T2WI,TR 4 600 ms,TE 103 ms;轴位SE 序列T1WI,TR 340 ms,TE 4.2 ms;轴位DWI,TE 70 ms,b=800 s/mm2;冠状面脂肪抑制稳态进动平衡序列(fast imaging employing steadystate acquisition,FIESTA),TE 1.6 ms,反转角为65°。增强扫描采用脂肪抑制SE 序列T1WI,TR 340 ms,TE 9 ms;静脉注射Gd-DTPA,剂量0.2 mL/kg。FOV为400 mm×400 mm,矩阵为288×160。层厚为5.0 mm,层间距均为0.5 mm。
超声扫描采用荷兰Philips iU22 型彩色多普勒超声诊断仪,C5-1 和C8-5 凸阵探头,频率分别为1~5 MHz和5~8 MHz。患儿取仰卧位,常规扫查腹部实性脏器。
1.2.2 图像分析 重建图像传输至美国GE ADW 4.4 数字影像诊断工作站,由2 名专业放射影像诊断医师采用盲法分析UESL 影像表现。观察内容包括位置、数量、大小、形态、边缘、是否均质、有无钙化、实性成分形态、强化程度、肿瘤与血管及周围组织的关系、病灶内外有无增粗迂曲的血管、有无淋巴结肿大及远处转移、肿瘤分期。选取病灶最大横截面的最长径作为病灶大小的测量标准。病灶形态为类圆形或不规则形。肿瘤实质的密度(或信号)以周围正常肝实质为参照区分为低密度(信号)及等密度(信号)、高密度(信号)。肿瘤强化程度以周围正常肝实质为参照区分为轻度、中等及明显。肿瘤分期参照美国肿瘤协作组2017 年修订版的治疗前(pre-treatment extent of tumor,PRETEXT)分期[10]。
1.2.3 手术及病理 11 例UESL 均行手术切除,其中4 例术前行化疗。切除标本先行大体观察,后石蜡包埋切片行常规H&E 染色和免疫组织化学分析。
2 结果
11 例患儿中9 例以中上腹不适、疼痛就诊;2 例无明显临床症状,家长扪及右腹部肿块就诊。实验室检查甲胎蛋白(AFP)与癌胚抗原(CEA)均为阴性,乳酸脱氨酶(LDH)均有不同程度升高(范围295.0~835.6 U/L)。
2.1 位置及大小
本研究11 例UESL 均为单灶性病变,其中7 个病灶位于肝右叶,2 个位于左叶,2 个累及左右两叶。按照PRETEXT分期系统:PRETEXT Ⅱ期9 例,PRETEXT Ⅲ期2 例。病灶最长径11.5~19.8 cm,中位最长径14.6 cm。
2.2 CT 表现
11 例UESL 病灶平扫均表现为相对于肝实质的边界清晰的低密度灶,病灶局限在肝内、膨胀性生长,瘤体位于肝脏轮廓内,病灶内密度欠均匀,表现为病灶内大部为囊性低密度(图1A),CT 值10~25 HU,呈单房或多房表现,5 例病变为单发囊腔结构,6 例为多房囊腔,囊腔内壁周缘可见不规则的条索或片絮状软组织密度影,病灶中可见厚薄不均的分隔影,局部可呈结节状表现。
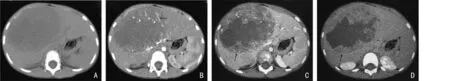
图1 1 例5 岁女性UESL 患儿的CT 影像表现
增强扫描病灶边缘较平扫更为清晰,与周围正常肝实质边界清晰,动脉期9 例肿瘤病灶边缘及分隔可见斑片及结节状轻度或中等强化,密度稍低于或等于周围正常肝组织(图1B)CT 值为21~56 HU;门静脉期(图1C)及延迟期(图1D)渐进性、向心性强化,7例呈轻度或中等强化,强化程度稍低于周围正常肝组织或程度相当,CT 值为42~92 HU;2 例病灶呈明显强化,强化程度稍高于周围正常肝组织,CT 值为97~110 HU;囊性部分始终未见强化;另增强扫描动脉期8 例病灶边缘见明显强化迂曲走行血管影(图1B)。腹腔内发现肿大淋巴结总计8 枚,术后病理均为反应性增生;在所有病灶观察中均未发现静脉瘤栓。
2.3 MRI 表现
3 例患儿病灶在T1WI 上均呈边界清楚的囊状高低混杂信号影,囊内信号不均匀,可见范围大小不等的T1 高信号区(图2A)。T2WⅠ中3 个病灶以程度不同的高信号为主(图2B),其内可见条索状低信号分隔影。DWI 呈高信号(图2C),表观弥散系数(ADC)值减低。增强扫描动脉期病灶边缘强化(图2D),门脉期及延迟期(图2E)继续强化,呈现渐进性、向心性强化趋势。

图2 1 例9 岁男性UESL 患儿的MRI 影像表现
2.4 超声表现
6 例UESL 病灶行超声检查,显示回声均呈囊实混合回声,其中以囊性为主2 例,实性为主4 例。其中2 例囊性区呈多房分隔样,囊腔形态不规则,大小不一;4 例实性区呈高低混杂不均匀回声;5 例病灶内见出血。
2.5 病理表现
大体检查:肿瘤质软,切面呈鱼肉状,灰黄、灰白或灰褐色,囊实性,多数有囊性退行性变、出血和坏死(图3),肿瘤与肝组织间见纤维性包膜分隔,其中3例无明显包膜、1 例包膜完整、6 例包膜不完整;周边肝脏无硬化。
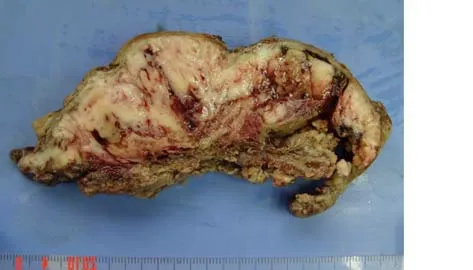
图3 UESL 的大体病理表现
显微镜检查:瘤细胞呈梭形、多边形或不规则形,弥漫片状分布,排列松散,8 例可见多核瘤巨细胞,6 例见核分裂象(图4);间质疏松,多为黏液状或透明状,纤维组织有局灶性玻璃样变,6 例在细胞内和间质中弥散分布有小圆形嗜酸性小体;瘤周肝组织无硬化。

图4 UESL 的显微镜下检查(H&E×200)
免疫组织化学示:11 例病例波形蛋白(Vimentin)及α1-抗胰蛋白酶(α1-antitrypsin,α1-AT)均表达阳性(图5);AFP、HBsAg 和CEA 阴性;NSE、S-100、SMA、CK 阴性。

图5 UESL 的免疫组织化学检查
3 讨论
3.1 儿童UESL 概述
儿童原发性肝脏肿瘤约2/3 为恶性[11]。UESL 为高度恶性肿瘤,目前多认为其起源于间叶组织[12]。约50%的UESL 患儿在6~10 岁确诊[3],发病无性别差异[13]。本研究中有8 例患儿年龄位于6~10 岁,男女比例相当,与报道基本一致;本组最小诊断年龄3 岁,既往报道UESL 患儿年龄最小为4 个月[5]。UESL 初期症状通常无特异性,临床多表现为上腹部疼痛或触及肿块,通常不伴有黄疸,不合并肝炎、肝硬化;肿瘤标记物常阴性,AFP 多正常,肝功能正常或仅轻度受损。本研究11 例患儿AFP 均为阴性,LDH 均有不同程度升高,提示肝功能轻度受损,未见肝硬化。
3.2 儿童UESL 病理学特点
UESL 多为孤立的体积巨大实性或囊实性肿块,无包膜,可见假包膜;肿瘤组织质软,通常伴有明显的坏死、出血及大小不等囊变,内可见厚薄不等分隔,囊内含棕色凝胶样物。镜下可见卵圆形、梭形或星形肿瘤细胞,胞质少,缺乏核仁,瘤细胞排列疏密不一,核分裂象多见,异型性明显,其间有多核巨细胞或多形细胞。肿瘤细胞胞质内外可见大小不等PAS 染色阳性的嗜酸性透明小体,嗜酸性小体被认为是UESL 组织学最具特征性的改变[14];可见增生的胆管。本文11 例中6例(54.5%)存在嗜酸性小体,8 例(72.7%)可见多核瘤巨细胞。有研究报道[15-16]大多数UESL 病例免疫组织化学表达Vimentin 和α1-AT 阳性,提示瘤细胞为原始间叶组织细胞来源。本研究11 例病灶均表达Vimentin 和α1-AT 阳性,而AFP、SMA、CK、NSE、S-100 均为阴性。共计发现8 枚肿大淋巴结,均为反应性增生,未见转移。全部患儿均未发现远处转移。
3.3 儿童UESL 的影像表现分析
UESL 通常单发,大多位于肝右叶,边缘较清楚,多局限于肝内表现为膨胀性生长。本研究11 例均为单发,其中7 例(63.6%)发生于肝右叶,均与既往报道相符。由于UESL 富含亲水的酸性黏多糖基质造成其水分不断吸收,因此超声所见UESL 多为实性为主的混合性回声,而CT 及MRI 多表现以囊性成分为主,两种检查不一致性表现被认为是UESL 较为特征的影像学表现[17]。
既往报道UESL 在超声上表现为不均匀回声的囊实性肿瘤[3,18];本研究亦显示病灶多呈囊实性改变,多表现为孤立的混杂回声肿块,边界清晰,常伴多囊性变,既可表现为囊性为主,亦可为实性为主,较少表现为纯实性;UESL 病灶实性区回声不均匀,常以高低混杂形式出现,UESL 病灶囊性区多有厚薄不均匀的分隔。
在CT 平扫影像上,UESL 病变表现为边界清楚的不均匀低密度肿块,其中囊性密度比例较大,造成囊性外观的假象[17,19];实性成分不均匀分布于边缘,病灶内钙化极少见;大多数病灶存在实性结节和厚薄不均的分隔。MRI 检查T1WI 上多呈混杂低信号,内可见大小不等条片状高信号灶,为瘤内出血表现;T2WI 多以囊性或囊实性为主不同程度混杂高信号,分隔可清晰显示。
CT、MRI 增强扫描时,病灶边缘或内部斑片状轻度不均匀强化,随时间延迟强化范围逐渐增大,并由周边强化向中心蔓延,囊内软组织影或分隔影表现为持续渐进式轻中度强化,强化范围增大。延迟期肿瘤边缘常可见假包膜。本研究增强扫描所有病灶动脉期均有不同范围轻、中度强化,且以不规则斑片状轻中度强化为主,静脉期及延迟期病灶均呈持续不均匀强化,强化范围持续增大,8 例(72.7%)见假包膜征。
本研究注意到增强扫描动脉期大多数病灶(8/9)边缘存在迂曲动脉血管,因此当在CT/MRI 上遇到肝脏囊性肿瘤时,这些异常血管的存在可作为诊断UESL 的一个提示。有研究指出[3],UESL 病灶内易自发破裂出血,若观察到病灶内发生出血征象将有助于UESL 的诊断。本研究中UESL 病灶内出血发生率高达72.7%(8/11),出血在CT 表现为低密度,在T1 加权MR 图像上呈高信号区,在T2 加权MR 图像上呈低信号区,或者在CT 和MR 图像上均表现为液体-液体平面[17,19]。
3.4 鉴别诊断
儿童UESL 主要与囊性肝脏间叶性错构瘤(hepatic mesenchymal hamartoma,HMH)鉴别,HMH 常见于2 岁前,而UESL 在5 岁以下儿童中少见;HMH 患儿血清AFP 可表现为轻度增高,而UESL 患儿血清AFP 多正常;UESL 病灶囊性区多有厚薄不均匀的分隔及内壁结节,并且由于其黏液样基质可吸附水分,故在CT 上表现为液性密度,而在超声图像中为实性回声,不一致性亦为其重要特点;UESL 肿瘤边缘存在迂曲动脉血管,病灶内易自发破裂出血,若观察到上述征象将有助于UESL 的诊断。肝母细胞瘤通常发生在3 岁前,囊性肝母细胞瘤囊变坏死区广泛,内壁不规整,钙化和出血多见,90% 病例AFP 升高。肝包虫多见于流行区,囊内壁及囊壁环形或弧形钙化是其特征表现。肝脓肿一般伴有明显发热、病灶边界模糊,增强扫描呈环形“晕征”强化。
儿童肝脏UESL 临床罕见,术前容易误诊,影像学表现有一定特征性,多表现为边界清楚的单囊或多囊性病灶,内有不同程度的实性部分,边缘可见迂曲动脉影;而超声图像则多提示为实性为主病灶,其不一致性亦为本病的重要特点,了解其影像特点,结合临床特征,对与其他肿瘤的鉴别诊断有一定价值,但确诊仍需要依靠病理检查。
本文无影响其科学性与可信度的经济利益冲突。

