化学合成原料药国际注册中起始物料选择探讨
赵 燕
(浙江海正药业股份有限公司,浙江台州 318000)
在化学合成类原料药工艺研发中,起始物料如何进行合理的选择和论证是合成工艺研发人员首先需要考虑的问题。既然如此,研发人员对哪类物料才是起始物料,即起始物料的基本定义和选择要有一定的了解和认知。起始物料 (SM: starting material) 是指一种原料、中间体或原料药,用来生产另一种原料药,以重要结构片段结合进原料药化学结构中;此类物料可能在市场上有销售、能够通过商业合同或供货协议从一个或多个供应商处购得,或由原料药生产厂家自行生产;具有明确的物理化学性质、立体化学结构、杂质控制策略。以上是根据ICH Q7、Q11[1]以及国际主要药政市场指南梳理的合成类原料药起始物料的基本定义。起始物料如何合理地定义和选择,ICH Q11指南中给出了一套基础的选择原则,并提供了一定的科学指导,但具体到某一个原料药的起始物料如何合理地选择,因产品工艺路线和背景信息的差异,不可能从指南中找到一个固定答案,故起始物料如何选择依然成了一个仁者见仁、智者见智的热门争议话题。基于此,本文将以ICH Q11指南为基础,并结合多年原料药国际注册的实际工作经验展开对合成类原料药起始物料如何合理定义和选择的科学探讨。
1 起始物料合理选择重要意义
在合成类药品从研发开始到成功上市的整个生命周期中,起始物料合理定义和正确选择一直占有举足轻重的地位,如下所述。
1)工艺研发阶段:研发工作从起始物料的正确选择开始。
2)大生产阶段:GMP管理要求从起始物料的引入开始。
3)原料药注册阶段:注册文件工艺描述从起始物料的引入开始。
4)制剂注册阶段:起始物料定义不准确,制剂文件将被拒收[2]。
5)注册批准后阶段:变更控制从起始物料的引入开始。
因原料药合成路线过短或原起始物料化学结构复杂,被国外药政官方提了缺陷信要求原料药合成路线前移,重新定义起始物料,则将对原料药GMP生产起点和国外注册文件内容产生重大影响,同时也可能对关联制剂产品的注册审评进度产生负面的影响。
因原起始物料需要按照中间体管理,原料药厂家势必面临以下问题。
(1)GMP资质:原起始物料厂家是否具备中间体GMP资质要求?如不具备,需要寻找其他有GMP资质的中间体厂家,并进行中间体新供应商的变更上报。
(2)资料保密:原起始物料厂家是否愿意按照中间体的要求提供详细的工艺资料和质量文件支持原料药的国外注册工作?如中间体厂家不愿意直接提供详细资料给原料药厂家,是否愿意配合原料药厂家申报中间体国外市场注册文号或是否愿意配合直接送交中间体的英文资料到国外官方?如以上方式都不可行,则需要寻找其他有资质并愿意配合原料药国外注册的中间体厂家,同样需进行中间体新供应商的变更上报。
(3)杂质研究:新定义起始物料引入的各类杂质,尤其是基因毒性杂质、亚硝铵杂质、元素杂质、有机杂质、残留溶剂等,需进行评估、研究、并制定合理的控制策略。
如以上信息补充工作无法按照官方缺陷信要求的回复时限要求按期完成,原料药厂家需要向国外药政官方申请延期回复缺陷信函或者主动申请退审注册文件。原料药注册文件的审评如出现以上这种情况,势必会对制剂注册项目的审评周期造成重大影响:制剂文件审评周期延长或直接被官方拒收。
2 基于ICH Q11探讨起始物料选择问题
2.1 国际药政市场认可度介绍
ICH Q11指南主要用于指导原料药的研发和生产,于2012年05月01日批准实施。该文件是目前关于合成类原料药起始物料如何进行选择和论证方面最全面、最权威的指南,对如何选择起始物料和原料药国际注册申报时应提交哪些起始物料信息提供了积极指导,目前已被世界主要药政监管机构认可采纳。
2.2 起始物料合理选择决策树
起始物料选择决策树分为两个部分。第一部分主要关注起始物料化学结构,如图1所示;第二部分主要关注起始物料杂质控制策略,如图2所示。

图1 起始物料选择决策树第一部分
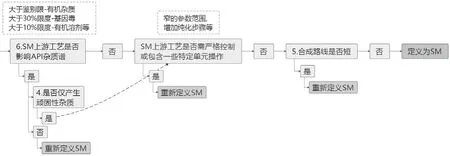
图2 起始物料选择决策树第二部分
2.2.1 决策树第一部分重点内容解析[3]
是否有确定理化性质和结构?主要是针对有文献报道、能够进行化学结构确证实验和解析的化合物、非溶液状态的化合物 (如分离中间体一般处于溶液状态,是一个混合物,不能开展化学结构确认的实验和解析,故不适合作为起始物料)。
是否构成原料药重要结构片段?ICH Q11初衷主要是指导业界用于区分起始物料和其他简单的物料,所以用来成盐、成酯的简单酸或简单碱、或其他简单有机物,则应为试剂,不是起始物料。起始物料是指分子结构对原料药分子的药理活性有贡献或是有重要意义的部分,但有时候也被研发人员或注册申报人员错误地理解为原料药结构相近的片段,这时候可能就会因为起始物料化学结构复杂而被官方要求原料药合成路线前移。综上所述,企业研发人员或注册申报人员要理解重要结构片段的实质要求和实际含义,知悉这是一个相对的概念,才能把起始物料和其他试剂、催化剂、溶剂、中间体进行准确区分。
是否广泛用于非药物市场[4]?对这一条做出正确判断的前提,首先要理解什么是非药物市场。非药物性市场是指用于药品生产的数量只占该化合物总市场份额的一小部分,如某化合物已作为商品在食品、化妆品等市场使用多年,则可认为是来自非药物性市场,此类化合物可认为质量安全,故来自非药物市场的起始物料不需要进行杂质控制策略的详细论证。
2.2.2 决策树第二部分重点内容解析
什么情况下是影响原料药杂质谱?根据ICH Q11的解释:大于ICH Q3A鉴别限的有机杂质;大于30% ICH M7限度的基因毒性杂质;大于10% ICH Q3C限度的2类有机溶剂等。
(1)起始物料上游工艺是否需严格控制或包含一些特定单元操作?指的是比较窄的工艺操作参数范围、增加特定的纯化步骤等,这些步骤往往包含关键工艺参数,故起始物料合成路线需前移。
(2)是否仅产生顽固性杂质?顽固性杂质的限定条件:在既定起始物料至少前一步化学合成产生,且这些步骤没有其他影响原料药的杂质产生。
(3)合成路线是否短?到底几步合成反应路线才合适,没有固定的答案。需要具体产品具体分析,但需注意对于未分离中间体步骤,因没有杂质去除机会,严格来说不能算是一步化学合成反应。最后一步成简单盐的步骤,因没有共价键的产生,也不能算是一步化学合成反应。
2.3 起始物料选择的基本原则
起始物料选择基本原则解读如下。这六个基本原则相辅相成,缺一不可。在起始物料合理性论证时,不能仅针对某一个原则展开详细论述,而忽略其他原则,
(1)化学反应的每一个分支都要进行评估,确认是否有一个或多个起始物料。
(2)起始物料应有确定的物理化学性质和立体化学结构。未分离的中间体处于溶液的状态或混合物的状态,无法进行化学结构的确证,从这个方面来说不能作为起始物料。
(3)起始物料化学结构是构成原料药化学结构的显著片段。
(4)工艺前端物料属性和操作条件的变更对最终原料药成品质量影响较小。工艺前端的杂质更易去除。因此起始物料离原料药的工艺步骤距离越长,起始物料所带来的杂质残留到成品的风险越低,但同时也要综合考虑企业的GMP生产成本,并不是生产工艺越长越好。
(5)应有足够的工艺描述(通常包括多个化学转化步骤),以了解工艺变化对杂质形成和去除的影响。
(6)影响杂质谱的生产步骤一般应包含在工艺描述中。如原定起始物料合成路线影响原料药成品杂质谱,且这些杂质不全是顽固性杂质,则合成路线需前移,重新按照以上六个基本原则选择新的起始物料。原料药生产厂家应对起始物料带来的杂质有全面准确的了解,并采用适当的分析方法进行残留研究,并根据各杂质对后续化学反应及原料药质量的影响制订合理的控制策略。
起始原料的选择除了应符合以上基本指导原则的要求外,企业实际生产运行中还需考虑以下因素:起始原料是否有稳定的、能满足原料药大规模生产的商业化来源;起始物料供应商是否有较完善的生产与质量控制体系;是否能与原料药生产厂家建立良好的沟通与协作,例如,起始原料工艺或质量控制有变更,应及时告知原料药生产厂家,以便原料药或制剂厂家及时进行变更评估和注册申报。
3 起始物料合理选择的实战应用
在原料药国际注册主文件 (DMF:Drug Master File) 3.2.S.2.3物料章节需要对起始物料选择的合理性进行论证。根据原料药国际市场注册指南要求并结合多年实际注册工作经验,建议从以下方面进行起始物料选择是否合理的评估和论证。
3.1 起始物料基本信息
(1)化学名称:IUPAC命名。
(2)立体化学结构式:需体现手性中心。
(3)CAS NO.:按需书写。
(4)厂家信息:体现实际的生产场地,不能是办公地点。
3.2 合成路线信息展示
起始物料合理选择论证时,工艺路线书写请参考图3 (来自ICH Q11 Q&A),书写注意事项:
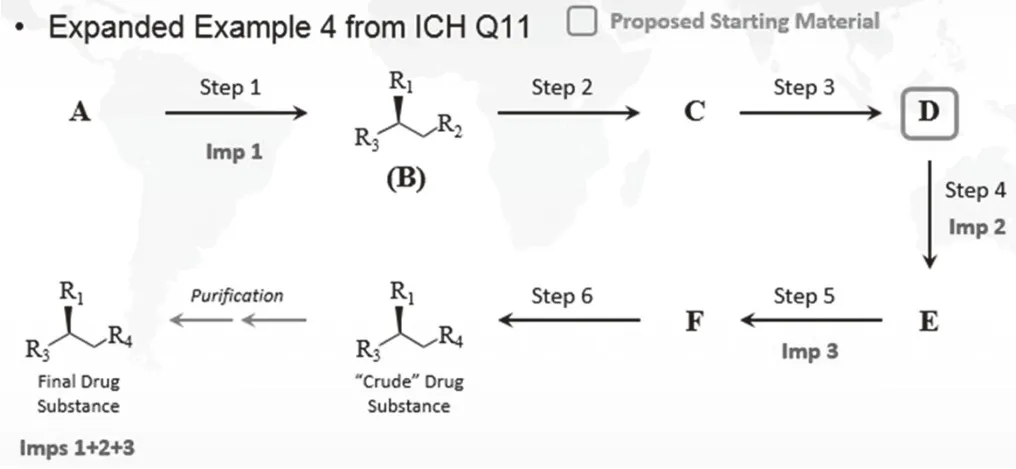
图3 ICH Q11起始物料论证合成路线书写格式
(1)标识出每个化合物的立体化学结构式
(2)标识出每个工艺步骤中可能产生的杂质
(3)标识出原料药的杂质谱
3.3 起始物料选择论证
依据ICH Q11指南对起始物料如何合理选择展开论证。基于起始物料选择六大基本原则和决策树展开合理性论证,六条原则相辅相成,缺一不可。
原料药厂家在起始物料选择论证的过程中可能遇到以下几种情况,如有问题按需整改后才能安排注册申报:
(1)既定起始物料同时满足六大基本原则,则推荐定义为起始物料,可开展后续的研究和注册工作。
(2)既定起始物料已在非药用市场广泛使用,则推荐定义为起始物料,可开展后续的研究和注册工作。
(3)既定起始物料如不能同时满足以上六大基本原则,需根据起始物料其他情况论证,支持既定起始物料定义是否合理。例如,既定起始物料有有效的DMF或CEP,可以考虑作为原料药起始物料,可开展后续的研究和注册工作。
(4)需要重新定义起始物料,工艺路线前移,既定起始物料升级为中间体。原起始物料供应商资质如无法满足GMP要求,需寻找其他有资质的合格中间体供应商。以上工作完善后再开展后续的研究和注册工作,否则等被官方要求路线前移而企业还没有做好应对措施,将面临非常被动的局面。
4 结束语
国际药政市场对合成类原料药起始物料选择合理性的审评越来越严格,ICH Q11指南的符合性是合成类原料药进军国际市场的敲门砖。原料药厂家一定要清楚国外药政官方在起始物料合理性审评时想看到什么?综上所述归纳两点:原料药合成路线长短合适,杂质控制策略恰当充分。合成路线长短和杂质控制策略相辅相成,相得益彰。如起始物料的选择同时满足以上这两点,原料药国际注册过程中基本不会收到官方针对起始物料提出重大缺陷信函,例如起始物料前移。在起始物料合理选择的前提下,才能使得原料药和制剂的国外市场注册审评顺利获批,产品早日出口上市。

