双水相萃取-连续光源石墨炉原子吸收光谱法测定水样中的痕量锑
李 月,杨光冠,张占恩,2*
(1.苏州科技大学 环境科学与工程学院,苏州 215009;2.苏州科技大学,江苏省环境科学与工程重点实验室,苏州 215009)
锑是一种类金属元素,普遍存在于自然界且具有毒性,在生物体内容易蓄积,是工业中常用的重金属之一[1]。它的价态一般分为零价锑、三价锑和五价锑。水环境中的锑主要由地表土壤径流、岩石风化和人类活动产生[2]。人类在发展重工业时会开发利用到越来越多的锑,产生的许多含锑或其化合物的废气、废水等会污染环境,这些物质会通过呼吸道、消化道或皮肤等接触途径进入人体,进而导致多脏器受损[3]。尽管锑元素很早就为人所知,但因其是公认的非生命必需元素,而且在环境中含量低(特别是在水环境中),因而长期以来未得到足够的关注,所以研究金属锑的测定方法还是比较有意义的,有利于后续环境的治理和保护。
目前,国内外金属锑的样品预处理方法有分散液相微萃取[4]、固相萃取[5]和磁性固相萃取[6]等。上述萃取方法存在着一定局限性,比如分散液相微萃取体积小,无法自动进样,只能手动进样,误差较大,对石墨管有损坏。双水相萃取具有条件温和、成本低、样品体积满足自动进样要求、可以获得较高的回收率的优点,已经成功应用于生物工程、药物提取、金属离子分离等方面[7]。其原理是萃取液由两种互不相溶的水溶液组成,在萃取过程中,分子氢键、盐析作用和范德华力等作用力导致待萃取物在两相之间产生含量差异,从而实现了富集分离[8]。双水相萃取与连续光源石墨炉原子吸收光谱仪相结合,为痕量金属的测定提供了参考,在一定程度上提高了灵敏度,相比其他检测方法,在性能上相对较好,有效减少了基体干扰,可以在复杂环境样品中进行检测。
为了进一步提高灵敏度和萃取率,本工作将双水相萃取与连续光源石墨炉原子吸收光谱法联用,提出了测定水样中痕量锑(以Sb3+计)的方法,此方法具有检出限低、精密度好、节省时间的优点,并将其应用于自来水、湖水、河水的分析,取得了令人满意的结果。
1 试验部分
1.1 仪器与试剂
ControAA700型连续光源原子吸收光谱仪,石墨炉系统;PHS-3S型台式酸度计;PL203型电子天平;UPWS-l-20T型超纯水器。
Sb3+标准储备溶液:1 mg·L-1,使用时用水稀释至所需质量浓度。
吡咯烷基二硫代氨基甲酸铵(APDC)储备溶液:2 g·L-1,称取0.2 g APDC,用水溶解,并定容至100 mL。
APDC、乙腈、氯化铵、硫酸铵、氯化钠、氢氧化钠、盐酸、邻苯二甲酸氢钾、二苯碳酰二肼(DPCI)、二乙基二硫代氨基甲酸钠(DDTC)、硫脲、抗坏血酸均为分析纯以上级别;试验用水为超纯水。
1.2 仪器工作条件
氘灯连续光源;波长 217.6 nm;干燥温度110 ℃,干燥时间10 s;灰化温度700 ℃,灰化时间10 s;原子化温度1 950 ℃,原子化时间4 s;清除温度2 450 ℃,清除时间4 s;氘灯背景校正。
1.3 试验方法
采集自来水、河水、湖水3种样品,用0.45 μm滤膜过滤后存储于4 ℃冰箱中,每种水样取25 mL置于50 mL比色管中,加入50 g·L-1硫脲-50 g·L-1抗坏血酸的混合液10 mL,再加入2.5 mL的2 mol·L-1盐酸溶液[9],混匀,放置1 h,将样品中的五价锑还原成三价锑。
取5 mL上述处理后的样品于10 mL具塞比色管中,用0.05 mol·L-1的邻苯二甲酸氢钾-盐酸缓冲溶液调节pH为4,再加入0.5 mL的2 g·L-1APDC储备溶液,摇匀,盖上玻璃塞,静置20 min,使螯合反应充分进行。用移液枪迅速将1.6 mL乙腈注入样品溶液中,摇匀,加入1.2 g氯化钠,摇晃具塞比色管,使氯化钠充分溶解,最终双水相形成。收集上层有机相于1 mL石墨炉自动取样杯中,按照仪器工作条件测定。
2 结果与讨论
2.1 螯合剂及其用量的选择
Sb3+经过螯合反应生成疏水性的化合物,然后被萃取到有机相中,使其得到分离富集[10]。将DPCI、DDTC、APDC等3种螯合剂分别用于双水相萃取试验,结果表明APDC的萃取效果最好。APDC作为Sb3+的螯合剂,它的用量对萃取过程作用很大。试验考察了2 g·L-1APDC储备溶液的用量为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8 mL时对Sb3+萃取效率的影响,结果见图1。
结果表明:当2 g·L-1APDC储备溶液的用量从0.1 mL增加到0.5 mL时,生成的APDC-Sb(Ⅲ)金属螯合物逐渐增加,吸光度迅速上升,直至0.5 mL时生成的APDC-Sb(Ⅲ)金属螯合物最多,吸光度达到最大值;继续增加APDC储备溶液的用量,APDC-Sb(Ⅲ)螯合物被萃取到的量减少,可能是由于反应过剩的APDC也会被萃取,与螯合物竞争萃取溶剂,导致了吸光度下降[11]。因此,试验选择2 g·L-1APDC储备溶液作为最佳螯合剂,APDC储备溶液用量为0.5 mL。
2.2 反应体系酸度的选择
酸度会影响螯合物的存在形式,进而影响Sb3+的萃取效率[12]。因此,试验考察了反应体系的pH为1~7时对Sb3+萃取效率的影响。结果表明:pH从1增大至4时,Sb3+萃取效率较高,吸光度上升;在pH为4时,吸光度达到最大值;pH从4增大至7时,吸光度却下降。因此,试验选择的反应体系酸度为pH 4。
2.3 乙腈用量的选择
采用乙腈作为萃取剂,固定其他试验条件不变,考察了乙腈的用量为1.4,1.5,1.6,1.7,1.8,1.9,2.0 mL时对Sb3+萃取效率的影响,由于乙腈用量低于1.4 mL时沉积相难以被仪器自动吸取,所以选用乙腈1.4 mL作为优化用量起点。结果表明:乙腈用量在1.4~1.6 mL时,随着溶剂体积的增大,沉积相的体积增大,吸光度也随之增加;在乙腈用量为1.6 mL时吸光度达到最大;进一步增大乙腈的用量,吸光度却在下降,沉积相体积增加幅度不大,这可能是由于金属螯合物在被充分萃取的情况下,溶剂体积越大,吸光度越小。在满足痕量金属测定要求的情况下,为了得到最好的萃取效率,试验选择乙腈用量为1.6 mL。
2.4 氯化钠用量的选择
在不加入无机盐的情况下,双水相无分层现象出现。因此,对目标物进行萃取分离时,还需考虑无机盐的种类和用量。采用氯化铵、硫酸铵、氯化钠等3种无机盐进行双水相萃取试验,结果表明氯化钠的萃取效果最好。试验进一步考察了氯化钠用量(1.2,1.3,1.4,1.5,1.6 g)对Sb3+萃取效率的影响。由于氯化钠用量为1.1 g时分相不清晰,萃取不完全,所以选用1.2 g作为优化起点;而当氯化钠用量不小于1.7 g时,无机盐又不能完全溶解,所以选用1.6 g作为优化终点。
结果表明,随着氯化钠用量的增加,吸光度不断下降。并且在试验过程中观察到当氯化钠的用量从1.2 g增加到1.6 g时,乙腈的相体积也在不断增加,得到的相体积分别是0.38,0.46,0.53,0.60,0.64 mL。这可能是由于盐效应,当相体积不断增大,盐含量就会降低,从而导致螯合物稳定性降低,使得吸光度下降。因此,试验选择氯化钠用量为1.2 g。
2.5 反应时间的选择
反应时间是指样品溶液定容后到加入萃取剂之前的时间间隔。双水相萃取形成的水-乙腈-氯化钠体系接近均质体系,操作条件温和,增大了萃取效率,缩短了萃取时间。试验考察了反应时间为5,10,15,20,25,30 min时对后续Sb3+萃取效率的影响。结果表明:随着反应时间的延长,吸光度逐渐增大,萃取效率也逐渐增大;直至20 min时吸光度达到最大,萃取基本平衡,萃取效果最好;继续延长反应时间,吸光度变化不大。这可能是由于螯合反应在20 min时已基本完成。因此,试验选择的反应时间为20 min。
2.6 共存干扰离子的影响
在试验过程中,样品溶液中的有些共存金属离子和溶解性有机物经历了螯合反应也会被萃取到有机溶剂中[13],从而影响Sb3+的萃取效率。试验考察了常见共存离子对萃取Sb3+的影响,向5.00 μg·L-1Sb3+标准溶液中加入不同的离子:10 000倍的K+、Na+、Ca+,1 000倍的Fe3+、Li+、Ba2+,100倍的Al3+、Ni2+,10倍的Cu2+、Cd2+、Pb2+。结果表明,测定结果相对误差的绝对值均在10%以内,上述共存离子不干扰测定,说明该方法具有较强的选择性和抗干扰能力。
2.7 标准曲线和检出限
取适量的Sb3+标准储备溶液,用水逐级稀释,配制成质量浓度为0,1.00,5.00,10.00,15.00,20.00 μg·L-1的Sb3+标准溶液系列。按照试验方法测定,以Sb3+的质量浓度为横坐标,对应的吸光度为纵坐标进行线性拟合。得到标准曲线的线性范围为1.00~20.00 μg·L-1,线性回归方程为y=7.400×10-3x+7.000×10-4,相关系数为0.999 1。
按照空白溶液中Sb3+测定值的标准偏差s的3倍除以标准曲线的斜率k的方法计算检出限(3s/k),结果为0.048 μg·L-1。
2.8 精密度试验
按照试验方法分别对质量浓度5.00,10.00 μg·L-1的Sb3+标准溶液平行萃取、测定10次,计算测定值的相对标准偏差(RSD),结果分别为4.6%和3.3%,说明方法精密度较高。
2.9 样品分析和回收试验
按照试验方法测定自来水、河水、湖水中锑的含量,并进行加标回收试验[14],计算回收率,结果见表1。
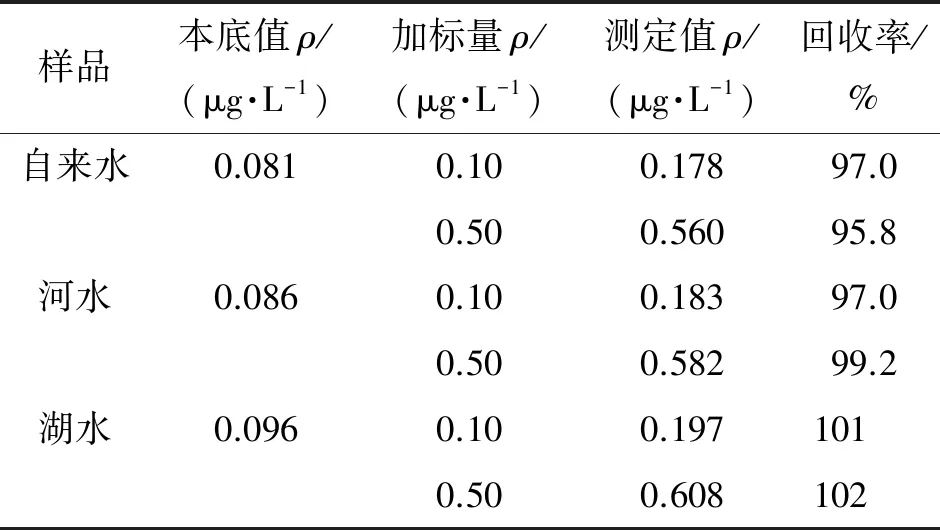
表1 回收试验结果
由表1可知,样品中锑的回收率为95.8%~102%,说明方法准确度较高。
本工作提出了双水相萃取-连续光源石墨炉原子吸收光谱法测定水样中痕量锑的方法,利用单一变量法确定了最佳试验条件,并应用于自来水、河水、湖水中锑的检测,该方法简单、快速、经济、准确,测定结果也令人满意[15-16],可为双水相萃取金属离子提供一定的参考价值。

