猪流行性腹泻病毒Nsp7 基因真核表达载体的构建及表达
魏佳琪,高振秋,郑亮,牛欣雨,武峰峰,吴春宇,王志昊,张华,曹宏伟,,
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.黑龙江八一农垦大学动物科技学院;3.盐城师范学院)
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的病毒性疾病,该病极具传染性。PEDV 主要是引发肠道炎症,对肠道造成损害,包括绒毛萎缩和脱落[1-2]。PEDV 为有囊膜的5’端加帽、3’端ploy(A)尾的单股正链RNA 病毒,是α 冠状病毒家族中的一员,基因组核苷酸大约28 000 nt[3-4]。在PEDV 的基因组中,有三分之二的基因编码非结构蛋白,即复制酶蛋白1a 和1b。它们在自身编码的剪切酶的作用下被剪切成16 个非结构蛋白(Nsp1-Nsp16),这些非结构蛋白在PEDV 复制、装配和逃避宿主天然免疫中发挥重要的作用[5]。PEDV 编码的23个病毒蛋白中,已被证实有11 个蛋白能够拮抗干扰素的产生,从而逃避宿主天然免疫[6]。
PEDV Nsp7 蛋白分子量约为10 kDa,编码83 个氨基酸,属于疏水性蛋白质。PEDV Nsp7 蛋白与病毒的复制以及病毒粒子的组装有关[7-9]。研究发现,冠状病毒Nsp7 可以抑制宿主天然免疫,拮抗IFN 免疫应答[10]。冠状病毒编码的非结构蛋白在病毒RNA 的合成、加工以及病毒-宿主相互作用中发挥多种功能,其中Nsp7 至Nsp10 蛋白可以作为这些酶的关键辅助因子[11]。
到目前为止,关于冠状病毒Nsp7 作用机制方面的研究报道较少,对于PEDV Nsp7 蛋白也是如此。为进一步研究PEDV Nsp7 蛋白的生物学功能,研究构建了PEDV Nsp7 基因的真核表达质粒,并通过Western Blot 及间接免疫荧光技术确定PEDV Nsp7蛋白在细胞中成功表达。研究为后续制备抗PEDV Nsp7 蛋白的多克隆抗体以及PEDV Nsp7 蛋白的生物学功能研究奠定了一定基础。
1 材料与方法
1.1 细胞与质粒
猪小肠上皮细胞(IPEC-J2)、人肾上皮细胞(HEK-293T)均保存于实验室;胎牛血清(FBS)和DMEM 培养基购自Gibco 生物公司;质粒pCMVMyc 由实验室保存;感受态细胞DH5α 购自北京天根生物技术有限公司;患有PED 的仔猪病料采集于黑龙江省大庆市某猪场,并保存在实验室-80 ℃冰箱。
1.2 主要试剂与抗体
MLV 逆转录酶、PCR 试剂盒、限制性内切酶、无缝克隆酶2×Seamless、M-MLV 反转录酶、ExTaq 热启动DNA 聚合酶购自Takara 公司;LipofectamineTM2000购自Invitrogen 公司;DNA 胶回收试剂盒和质粒提取试剂盒购于Omega 公司;基因特异性引物的合成及重组质粒的序列测定均由擎科(北京)公司完成;小鼠抗Myc 标签单体克隆抗体(TA-01)购自碧云天生物技术有限公司;兔抗β-actin 单克隆抗体(ZM-0001)、HRP 标记的山羊抗小鼠IgG(ZB-2305)、HRP 标记的山羊抗兔IgG(ZB-2301)、FITC 标记的山羊抗小鼠IgG(ZB-0312)购自中杉金桥生物技术有限公司。
1.3 引物的设计
以已经发表在GenBank 网站中的PEDV 毒株基因序列为根据,利用软件Primer 5.0 进行PEDV Nsp7基因上、下游引物设计。特异性上游引物序列:5′-GCCATGGAGGCCCGAATTCGGATGTCTAAACTGA -CTGATATTAAGTGTA-3′(包含EcoRⅠ酶切位点),特异性下游引物序列:5′-CGCGGCCGCGGTACCTCGAGAACTCTGCAACATA C TATTGTC ATTAA-3′(包含XhoⅠ酶切位点)。
1.4 PEDV Nsp7 基因的RT-PCR 扩增
将保存的病变猪小肠用液氮研磨,将其放于1.5 mL EP 管中,进行剧烈摇晃1 min 后静止15 min,将EP 管放入冰盒中,加入200 μL 三氯甲烷,快速摇晃20 s 后静置15 min。将低温静置后的EP 管置于转速为12 000 r·min-1的4 ℃离心机中离心15 min。离心后取出EP 管,再将EP 管中的上清液转移至空的EP 管中,向新的管中加入600 μL 异丙醇,轻轻摇晃,摇晃后静置12 min。静置结束,将EP管离心15 min,转速为12 000 r·min-1。离心后取出EP 管,将管中的上清液舍弃,向管中加入由DEPC 水配制的75%乙醇溶液600 μL,静置5 min。静置后将EP 管4 ℃离心5 min,转速为7 500 r·min-1。离心结束,取出EP 管,将上清液舍弃,继续12 000 r·min-1离心1 min。弃取上清液,将其余液体吹干,去除酒精,加入20 μL DPEC 水进行溶解,溶解后静置15 min,放入-80 ℃冰箱中保存。
RNA 提取完毕后,加入DEPC 水2 μL、Specific Primer(特异性下游引物)2 μL、Random Primer 1 μL、提取好的RNA 模板1 μL。PCR 条件为70 ℃10 min,共1 个循环。再向上述PCR 管中加入混合液:5×MMLV Buffer 2 μL、dNTP mix(10 mM)0.5 μL、RNase inhibitor 0.5 μL、M-MLV 1 μL、DEPC 水1 μL,PCR反应过程为30 ℃保温10 min,42 ℃保温60 min,70 ℃保温15 min,共1 个循环。得到含PEDV 全基因组的cDNA 溶液。
以得到的cDNA 为模板,加入模板1 μL、上游引物0.2 μL、下游引物0.2 μL、Buffer 3 μL、dNTP 2 μL、酶0.13 μL、ddH2O 13.47 μL,总反应体系为20 μL。Nsp7 基因扩增反应条件:94 ℃预变性2 min;94 ℃变性30 s,57.1 ℃退火30 s,72 ℃延伸30 s,共25 个循环;72 ℃保温7 min。将所得到的PCR 产物进行琼脂糖凝胶电泳,切下目的条带,利用胶回收试剂盒对目的产物胶回收,在-20 ℃冰箱中保存。
1.5 Nsp7 基因真核表达载体的构建及鉴定
将pCMV-Myc 载体使用EcoRⅠ与XhoⅠ进行双酶切,酶切条件为37 ℃、2 h,然后将酶切产物进行琼脂糖凝胶电泳,随后利用Omega 胶回收试剂盒将目的条带进行胶回收。将切下的DNA 胶用700 μL Binding Buffer 溶解,条件为60 ℃、10 min。将溶解后的混合液倒入吸附柱中,转速12 000 r·min-1离心1 min,重复该步骤一遍。离心结束后弃掉下管液体,向上管中加入300 μL Binding Buffer,继续12 000 r·min-1离心1 min。弃下管液体,加入700 μL Wash Buffer于上管中,转速12 000 r·min-1离心1 min,此过程重复1 次。丢弃下管液体,13 700 r·min-1离空2 min。离心后向上管加入30 μL 已经加热到60 ℃左右的去离子水,静止溶解5 min,13 700 r·min-1离心2 min,得到纯化后的基因片段和载体片段。
准备PCR 管,放入两种纯化后的产物,同时加入无缝克隆酶2×Seamless、Buffer 和去离子水,总体系为10 μL,放入水浴锅中,连接温度为50 ℃,连接时间为15 min。产物转化DH5α,平板涂布,培养箱培养10 h。挑取单菌落,在液体LB 培养基中37 ℃摇床培养10~12 h 后,将菌液进行PCR 鉴定。PCR 结果显示,扩增出的条带与目的基因大小相符,随后用质粒提取试剂盒提取质粒,并将提取后的质粒进行双酶切鉴定。将鉴定成功的样品送至公司进行测序,将测序结果与理论序列进行比对,结果证明重组质粒正确构建,可做后续实验,将正确质粒命名为pCMVMyc-Nsp7。
1.6 Western Blot 检测
待IPEC-J2 细胞、HEK-293T 细胞密度为80%时,开始转染。首先将质粒在13 000 r·min-1转速下离心10 min,达到除菌的目的。将细胞板中原有的培养基换成DMEM 培养基,放在细胞培养箱备用。将质粒取出,根据质粒的浓度计算加到24 孔细胞培养板中的体积。转染空载体pCMV-Myc 质粒和pCMVMyc-Nsp7 质粒各800 ng,并设置空白对照。准备两个EP 管,管1 中加入50 μL DMEM 和800 ng 质粒溶液。管2 中加入50 μL DMEM 和1 μL 脂质体。静置5 min 后,将两管液体混合,再静置20 min。静置结束后,将混合液分别加入到24 孔板的细胞培养液中,放入37 ℃培养箱中,转染4~6 h,换成500 μL 10%胎牛血清的DMEM 培养基。置于5% CO2培养箱中,37 ℃培养24 h,收取样品。样品收集:将转染后的细胞培养板放置于冰盒上,弃掉培养液,用500 μL的PBS 洗涤2 次,在细胞板每孔中加入40 μL 的RIPA 裂解液,将细胞板放置于4 ℃裂解30 min,裂解工作完成后,将每孔中被裂解的细胞从细胞板上刮下,分别加入到1.5 mL 离心管中,在4 ℃离心机中12 000 r·min-1离心10 min,吸取上清,弃沉淀。加入10 μL 的5×Loading Buffer,最后把蛋白质和染料煮沸10 min,使得蛋白完全发生变性,可直接进行电泳。跑胶:配置聚丙烯酰胺凝胶,等待胶凝固以后,组装胶和电泳槽,在确定不漏的情况下倒入1×SDS电泳液,插上电极,分离蛋白样品,将蛋白样品煮沸10 min,12 000 r·min-1离心10 min。吸取10 μL 上层样品点样,设置电压80 V,跑完上层胶,再把电压改为120 V,当目标蛋白完全分离后,关闭电源。转膜:将胶板撬开,按照条带大小切下对应胶条,切下的凝胶和滤纸放到转膜液中,打开转膜仪,底层铺入浸泡过转膜液的垫网,然后铺上浸泡过的三层滤纸,在滤纸上淋加转移液,驱赶滤纸下层气泡。用镊子将PVDF 膜平铺在滤纸上,采用先中间再两边的铺放办法,避免气泡的产生(膜要提前进行切角做标记,以记住反正面),然后将胶轻轻的铺放在PVDF 膜上,用手调整,使胶各边缘与膜平齐,用玻璃棒赶出多余气泡。再铺一层滤纸及垫网,将转膜夹合紧,放在转膜槽中,将转膜槽放入冰浴的转膜盒中电压200 V、电流100 mA,2 h 后将胶体取出(可以看到转移到膜上的Marker)。封闭:将PVDF 膜放入0.5%的脱脂奶粉中,在摇床上封闭孵育2 h。封闭结束后,需要用1×TBST 溶液洗膜4 次,每次洗膜5 min。孵育抗体:按照说明书配置一抗和二抗,将PVDF 膜先后置于配置好的一抗和二抗中孵育,一抗孵育时间为2 h,1×TBST溶液洗膜2 h,洗膜时间为每次15 min;二抗孵育2 h,1×TBST 溶液洗膜2 h,洗膜时间为每次15 min。曝光:用AI600 仪器曝光,保存结果图片。
1.7 间接免疫荧光
在细胞板中放入爬片,接种细胞,待细胞密度达到60%左右时,开始转染,用Lipofectin2000 将pCMV-Myc 和pCMV-Myc-Nsp7 质粒转染至IPECJ2、HEK-293T 细胞中,4~6 h 后更换含有10%胎牛血清的DMEM 500 μL。在37 ℃、5% CO2培养24 h,取出细胞培养板,弃掉培养液,PBS 洗2 次;向24 孔细胞培养板中每孔加入500 μL 的4%多聚甲醛溶液,10 min 后弃掉溶液,加入PBS 清洗3 次,每次15 min,均放置于水平摇床上;弃掉PBS,加入500 μL的0.1%曲拉通溶液,静置20 min,增加细胞膜的通透性;将曲拉通吸弃,用PBS 洗3 次,每次15 min。每孔加入500 μL 的5% BSA 溶液,静置2 h 后加入PBS,摇床清洗细胞板,每次15 min,清洗3 次;然后用1%BSA 溶液稀释特异性抗体,每孔加入500 μL,静置孵育2 h,加入PBS 清洗细胞板;再加FITC 荧光标记的二抗,室温避光孵育2 h。回收二抗稀释液,加入PBS,将细胞板放在摇床上清洗3 次,每次15 min,最后制片。制片操作如下:首先用镊子取出干净的载玻片,向载玻片上滴加少量DAPI 封片剂,然后挑出细胞爬片,放在封片剂中央,用干净的纸巾轻轻压在细胞爬片上,吸干多余的封片剂,避光放置30 min。待晾干后,黑暗条件下用激光显微镜观察细胞的情况,最后拍照并保存。
2 结果与分析
2.1 RT-PCR 扩增Nsp7 基因全长序列
从病变猪小肠提取总RNA,反转录出cDNA,利用设计的特异性Nsp7 的上、下游引物,并以cDNA为模板对目的基因进行PCR 扩增,所得目的条带为252 bp 的PEDV Nsp7 基因片段,结果如图1 所示。

图1 Nsp7 基因片段的PCR 扩增Fig.1 PCR amplification of Nsp7 gene fragment
2.2 真核表达载体pCMV-Myc 双酶切
为构建PEDV Nsp7 基因的真核表达载体,试验将利用EcoR Ⅰ和Xho Ⅰ两种限制性内切酶对pCMV-Myc 载体进双酶切,将酶切产物进行琼脂糖凝胶电泳,显示真核表达载体双酶切成功,结果如图2 所示。
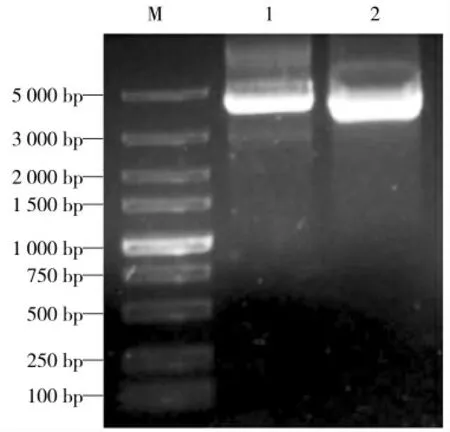
图2 pCMV-Myc 载体的双酶切Fig.2 Digestion of pCMV-Myc vector
2.3 重组质粒pCMV-Myc-Nsp7 的鉴定
利用无缝克隆酶2×Seamless 将目的基因和载体的酶切产物进行连接,连接产物用感受态DH5α 转化,过夜培养,挑取单菌落扩大培养,37 ℃摇床10~12 h,对其进行菌液PCR 鉴定,琼脂糖凝胶电泳后在250 bp 附近出现明亮单一的条带,结果如图3 所示。菌液鉴定成功后,提取质粒,进行双酶切鉴定。酶切体系:EcoRⅠ1 μL、XhoⅠ1 μL、10×H Buffer 1 μL、质粒2 μL、去离子水5 μL,总体系10 μL,置于37 ℃水浴锅中2 h。双酶切产物电泳后在3 000 bp 和250 bp附近出现两条条带,得到试验条带与预期理论设计结果相符,结果如图4 所示。结果均显示重组质粒构建成功,将其命名为pCMV-Myc-Nsp7。

图3 重组质粒pCMV-Myc-Nsp7 的菌液PCR 鉴定Fig.3 Identification of recombinant plasmid pCMV-Myc-Nsp7 by PCR

图4 重组质粒pCMV-Myc-Nsp7 的双酶切鉴定Fig.4 Double enzyme digestion identification of recombinant plasmid pCMV-Myc-Nsp7
2.4 重组质粒pCMV-Myc-Nsp7 的测序及其序列分析
为比较构建的重组质粒与原始Nsp7 基因序列的同源性,将筛选的阳性重组质粒pCMV-Myc-Nsp7取10 μL 送至生物公司进行测序。将NCBI 网站上的PEDV Nsp7 基因序列与所得到的测序结果进行序列比对,最终结果显示,其同源性高达99%,重组质粒构建成功。序列比对结果如图5 所示。
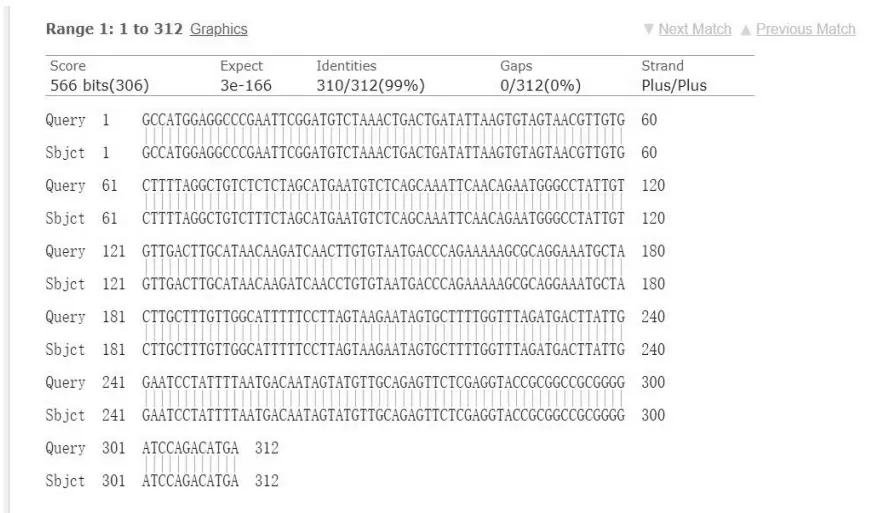
图5 pCMV-Myc-Nsp7 与CV777 毒株Nsp7 基因序列比对Fig.5 Sequence alignment between pCMV-Myc-Nsp7 and CV777 strain Nsp7
2.5 重组质粒的Western Blot 鉴定
为检测重组质粒pCMV-Myc-Nsp7 在细胞中的表达情况,将重组质粒分别转染至HEK-293T 细胞、IPEC-J2 细胞中,先后利用鼠抗Myc 单抗及山羊抗小鼠荧光二抗标记,检测空载体pCMV-Myc 及重组表达载体pCMV-Myc-Nsp7 的表达情况。Western Blot 结果显示,重组质粒pCMV-Myc-Nsp7 在IPEC-J2 细胞、HEK-293T 细胞均能够成功表达,结果如图6 表示。

图6 Western Blot 鉴定蛋白融合表达Fig.6 Identification of fusion protein expression by Western Blot
2.6 重组蛋白Nsp7 的免疫荧光鉴定
研究以间接免疫荧光技术探究了pCMV-Myc-Nsp7 在IPEC-J2 细胞和HEK-293T 细胞中的分布情况。免疫荧光结果显示,重组表达载体pCMVMyc-Nsp7 质粒在IPEC-J2 细胞和HEK-293T 细胞中成功表达,结果如图7 所示。

图7 重组蛋白Nsp7 在细胞中表达的免疫荧光鉴定Fig.7 Immunofluorescence identification of recombinant protein Nsp7 expression in cells
3 讨论
猪肠道冠状病毒(SECoV)包括猪流行性腹泻病毒(PEDV),传染性胃肠炎病毒(TGEV)和猪δ 型冠状病毒(PDCoV),占新生猪致命性水样腹泻的大部分,并给世界带来重大的经济和公共卫生负担。冠状病毒感染的共同特征是逆转宿主细胞周期,以促进病毒复制,但具体机制在很大程度上仍未知。虽然这三种SECoV 主要感染体内肠上皮,并引起相似的临床体征,但其细胞向性和致病性存在明显差异[12]。PEDV 最初在20 世纪70 年代报道,导致新生仔猪死亡率最高。主要表现为呕吐、腹泻、厌食、消瘦,年龄越小,症状则越为明显,对养殖业以及畜牧业造成巨大的威胁。该病在英国被首次发现,与猪胃肠炎病症状极为相似,给猪进行诊断和治疗带来了极大的困难[13-14]。而两者主要区别是猪流行性腹泻主要针对于幼猪,对幼猪威胁较大,对成年猪而言,症状较轻,不致死[15-16]。自猪流行性腹泻在欧洲多个国家爆发以来,使得农场中猪的产量直线下降,造成了非常大的影响[17]。在PEDV 流行期间,不同的出版物引用了与PEDV 快速传播相关的几个风险因素(动物运动,卡车污染,屠宰场污染,受污染的饲料和饲料厂,以及农场员工等),控制PEDV 感染最有效的途径之一是接种疫苗[18]。
猪流行性腹泻病毒核酸型为RNA,编码的5 种结构蛋白为S 蛋白、E 蛋白、M 蛋白、N 蛋白、ORF3蛋白,其中ORF3 蛋白是其唯一编码的辅助性蛋白。该病毒还编码非结构蛋白,即Nsp1-Nsp16。这些非结构蛋白在病毒复制、装配、拮抗天然宿主免疫中发挥重要的作用。现在关于PEDV 编码的各种蛋白的表达及生物学功能研究的文献相对较少。有研究表明,CoV 的Nsp7 蛋白是相对保守的,由于蛋白构象的缘故,发挥功能时可能受到Nsp8 的影响,或是与Nsp8相互作用[17]。但在PEDV 中,Nsp7 抑制干扰素的产生,与Nsp8 无关[19]。猪传染性胃肠炎病毒(TGEV)的Nsp7 在病毒组装过程中发挥重要作用,其定位在细胞质,下调猪小肠上皮细胞中IL-8 的表达[20]。猪繁殖与呼吸综合征病毒(PRRSV)的Nsp7 在诱导宿主体液免疫应答中起重要作用[21]。在SARS-CoV-2 中,Nsp7、Nsp8 和Nsp12 为RNA 转录复合物(RTC)的三个组分,负责识别和处理RNA,用于新病毒的繁殖和病毒蛋白的核糖体转录[22]。
Nsp7 在病毒生命周期中发挥重要作用,由于与已知结构的同源性非常低,导致对Nsp7 的功能和结构机制知之甚少。为探讨Nsp7 蛋白功能,研究利用基因克隆技术构建了pCMV-Myc-Nsp7 真核表达载体,并验证Nsp7 蛋白在细胞中能正常表达,为猪流行性腹泻病毒Nsp7 蛋白的功能研究奠定了良好的基础。

