新型冠状病毒Nsp1 基因真核表达载体的构建及对宿主蛋白质翻译的影响
王宏宇,田志飘,刘红线,郑亮,3,于雯,吴志军,Matthew Kay,高振秋,曹宏伟,耿荣庆,张华,,3,4
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.盐城师范学院药学院;3.黑龙江八一农垦大学动物科技学院;4.盐城师范学院江苏省肿瘤靶向纳米诊疗材料工程研究中心)
2019 年暴发了由严重急性呼吸综合征冠状病毒2(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)感染引起的新型冠状病毒肺炎(Coronavirus disease 2019,COVID-19),于2020 年流行至全球,给多个国家和地区人民的生命财产安全带来巨大威胁[1-2]。截至2022 年9 月,全球报告的COVID-19病例数超过6 亿,死亡人数超过650 万,但疫苗接种率只有68%。而且SARS-CoV-2 基因组仍在不断地变异,形成多种传播力强的变异株,对研究高效的疫苗造成了严重的困难[3]。
SARS-CoV-2 属于β 冠状病毒,是一种有包膜的单股正链RNA 病毒[4]。SARS-CoV-2 基因组大约30 kb,包含一个5′-非翻译区(5′-UTR)、3′-非翻译区(3′-UTR)和十个单独的蛋白质编码开放阅读框(ORF)。病毒基因组可翻译出非结构蛋白(Nonstructural protein)、结构蛋白(Structural protein)和辅助蛋白(Accessory protein)3 大类[5-6]。其中,非结构蛋白的ORF 序列位于基因组上游,形成两个开放阅读框(ORF1a 和ORF1b),并在蛋白酶作用下水解形成16 个非结构蛋白(Nsp1-Nsp16)[7-8];结构蛋白由核衣壳(N)蛋白、膜(M)蛋白、包膜(E)蛋白和刺突(S)蛋白组成,结构蛋白和辅助蛋白的ORF 位于基因组下游[9-10]。SARS-CoV-2 的基因组比对其他β 冠状病毒基因组发现,与SARS-CoV 具有79.5%的序列同一性,但显然SARS-CoV-2 与SARS-CoV 是不同的,它被认为是一种感染人类的新型β 冠状病毒[11-12]。
Nsp1 是冠状病毒编码的第一个病毒蛋白,基因位于ORF1a 的5′端[13]。Nsp1 基因组长540 bp,蛋白由180 个氨基酸组成,大小为19.78 kDa,等电点5.36[14]。Nsp1 是冠状病毒的毒力决定因子,是病毒用来确保自身在宿主中复制和传播的核心武器之一;在病毒生命周期中发挥关键作用;对宿主细胞具有破坏性的作用,即对宿主基因表达的抑制和逃避细胞免疫反应[15]。而SARS-CoV Nsp1 通过抑制宿主蛋白翻译的机制,主要是结合小核糖体亚基,并在起始过程的各个阶段停止mRNA 翻译,后与核糖体结合导致内切核酸切割和随后的宿主mRNA 降解[16]。但Nsp1 与病毒mRNA 的5’-UTR 中的保守区域之间相互作用,阻止病毒蛋白表达的关闭机制尚未研究清楚[17]。总之,Nsp1 抑制依赖于宿主表达的所有细胞抗病毒防御机制,包括干扰素抗病毒反应。先天免疫系统关键部分的关闭可能有助于有效的病毒复制和免疫逃避,它在削弱抗病毒免疫反应方面的核心作用,使Nsp1 蛋白成为潜在的治疗靶点[18]。但目前,国内外有关SARS-CoV-2 Nsp1 蛋白结构与功能方面的研究报道仍然较少。
研究从NCBI 网站上获取SARS-CoV-2 Wuhan-Hu-1 毒株Nsp1 基因序列,通过设计引物及密码子优化后,合成该基因。利用PCR 技术扩增得到Nsp1基因,将基因连接到真核表达载体pEGFP-N1 后,转染至HEK-293T 和HeLa 细胞,利用Western Blot 技术检测重组载体pEGFP-N1-SARS-CoV-2-Nsp1 的表达情况;重组质粒转染细胞后,经嘌呤霉素标记细胞中正在合成的蛋白,利用Western Blot 技术检测嘌呤霉素信号及考马斯亮蓝染色检测总蛋白。Western Blot 结果显示,SARS-CoV-2 Nsp1 蛋白成功在HEK-293T 和HeLa 细胞中表达,并且发现重组质粒的表达能够抑制细胞中正在合成的蛋白质数量。这些结果说明,pEGFP-N1-SARS-CoV-2-Nsp1 重组表达载体构建成功,验证了SARS-CoV-2 Nsp1 蛋白具有抑制宿主蛋白质翻译的功能,为以后更深入研究SARS-CoV-2 Nsp1 蛋白的功能及特性奠定了基础。
1 材料与方法
1.1 试剂
DMEM 培养基购自Gibco 生物公司,含10%的胎牛血清(FBS)、100 μg·mL-1青霉素和链霉素;人胚胎肾上皮细胞(HEK-293T)、人宫颈癌细胞(HeLa)和pEGFP-N1 载体由实验室保存;重组质粒pET-28a-SARS-CoV-2-Nsp1 由国家蛋白质科学研究(上海)设施购买(对全球开放);感受态细胞DH5α(DE3)购自上海昂羽生物有限公司;EcoRⅠ和XhoⅠ核酸内切酶购自TaKaRa 公司;DNA 胶回收试剂盒、质粒提取试剂盒购自Omega 公司;2×Hieff PCR Master Mix购自翌圣生物科技(上海)股份有限公司;ExFect Transfection Reagent、PCR 试剂盒、一步克隆同源重组试剂盒购于诺唯赞公司;考马斯亮蓝(R250)、鼠抗GFP 单克隆抗体和小鼠抗β-Actin 单克隆抗体购自碧云天生物技术公司;小鼠puromycin 抗体购自Merck 公司;DNA Marker 购自南京普诺恩生物技术有限公司;辣根酶标记山羊抗小鼠IgG 购自中杉金桥生物技术有限公司。
1.2 引物设计
根据已发表在NCBI 网站上的SARS-CoV-2 Wuhan-Hu-1(NC_045512)毒株基因序列合成Nsp1基因。并利用Nsp1 基因序列和实验室保存的pEGFP-N1 载体通过Primer5.0 软件序列设计具有特异性的上游引物和下游引物,通过无缝克隆技术设计引物序列,经擎科生物技术公司进行密码子优化后,合成得到基因的上游引物和下游引物,其中上游引物:5′-GCGCTACCGGACTCAGATCTCGAGATGGAGAGCCTTGTCCCTGGTTTCA-3′(EcoRⅠ),下游引物:5′-TGGATCCCGGGCCCGCGGTACCGTCCCTCCGTTAAGCTCACGCATGAGT-3′(XhoⅠ),引物合成由擎科生物(南京)公司完成。
1.3 扩增目的基因
将国家蛋白质科学研究(上海)设施提供的重组质粒pET-28a-SARS-CoV-2-Nsp1 作为模板与引物混合,并通过PCR 扩增反应获取目的基因:模板1 μL,2×Hieff PCR Master Mix 25 μL,上游引物0.2 μL,下游引物0.2 μL,ddH2O 13.6 μL 组合体系20 μL。PCR 程序设定:94 ℃预变性5 min;94 ℃变性30 s;58 ℃退火30 s;72 ℃延伸45 s(35 次循环);72 ℃终延伸10 min;反应结束后,将产物经1.5%琼脂糖凝胶电泳得到目的条带,通过胶回收试剂盒纯化后,保存于-20 ℃备用。
1.4 pEGFP-N1-SARS-CoV-2-Nsp1 真核表达载体的构建及鉴定
用EcoRⅠ和XhoⅠ对pEGFP-N1 载体进行双酶切,37 ℃水浴过夜,回收、纯化双酶切后的载体片段。将扩增好的目的基因产物和双酶切好的载体片段按物质的量6∶1 加入体系,并添加ExnaseⅡ和5×CEⅡBuffer 进行连接,37 ℃水浴30 min 后得到连接产物。将连接产物通过感受态细胞DH5α 进行转化,摇菌后离心,并加入液体LB 混匀涂布平板,置于37 ℃培养箱中培养8 h,在平板中挑取单菌落,加液体LB 培养基和氨苄霉素后,37 ℃摇床培养过夜,用质粒试剂盒提取质粒。将质粒双酶切鉴定,经验证后取20 μL送由擎科生物(南京)公司进行测序,对比序列正确后命名为pEGFP-N1-SARS-CoV-2-Nsp1,保存于-20 ℃备用。
1.5 Western Blot 检测
将HEK-293T 细胞接种于24 孔板中,在细胞的汇合度达到80%时,用ExFect Transfection Reagent进行转染试验,将板中500 μL10% FBS 的DMEM 培养液更换为400 μL 无血清DMEM 培养液,再将质粒和转染试剂混合加到对应的孔中,转染后4~6 h,将无血清DMEM 培养液更换为500 μL10% FBS 的DMEM 培养液,放置恒温二氧化碳细胞培养箱中。取出细胞板置于冰盒上,吸弃孔中旧培养液,并用已灭菌的PBS 冲洗2 次,在孔中加入40 μL 的RIPA 裂解液裂解30 min。用枪头刮下细胞,并收集在EP 管中,4 ℃、12 000 g 离心10 min 后收集上清,再按比例加入5×Loading Buffer,100 ℃煮沸10 min,恢复室温后12 000 g 离心10 min,将所得的混合物经15% SDSPAGE 胶分离。电泳结束后通过湿转,将蛋白转印PVDF 膜上,置于5%脱脂奶粉孵育2 h,用TBST 缓冲液洗膜,再用一抗小鼠抗GFP 标签单克隆抗体摇床孵育2 h,TBST 缓冲液洗膜2 h,用二抗山羊抗小鼠辣根酶标记IgG,稀释倍数1∶3 000,摇床孵育2 h,再次用TBST 缓冲液洗膜2 h,配制曝光液,上机曝光拍照,观察其表达情况。
1.6 考马斯亮蓝染色
将HEK-293T 细胞接种于24 孔板中,同上述操作经转染、换液、培养后取出细胞板,PBS 冲洗后加RIPA 裂解液裂解30 min。收集细胞后于4 ℃离心10 min,吸取上清,再加入5×Loading Buffer,100 ℃煮沸10 min 后12 000 g 离心10 min,将所得的蛋白样品经15% SDS-PAGE 胶分离,将胶块放在考马斯亮蓝染色液中,置于摇床10~16 min,100 ℃煮沸至胶块脱去浮色,将其置于曝光机器后拍照。
2 结果与分析
2.1 Nsp1 基因的扩增
研究以国家蛋白质科学研究(上海)设施提供的pET-28a-SARS-CoV-2-Nsp1 重组质粒作为模板,经PCR 扩增得到目的基因,大小为540 bp 的Nsp1 基因片段,结果如图1 所示。
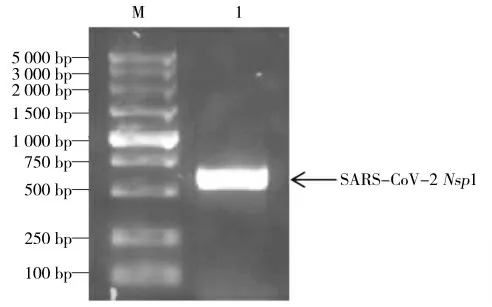
图1 SARS-CoV-2 Nsp1 基因的获取Fig.1 Acquisition of SARS-CoV-2 Nsp1 Gene
2.2 重组质粒pEGFP-N1-SARS-CoV-2-Nsp1 的构建
利用EcoRⅠ和XhoⅠ两种酶,经过双酶切鉴定重组质粒是否构建成功。在37 ℃水浴锅中反应2 h,将真核载体pEGFP-N1 及重组真核质粒pEGFPN1-SARS-CoV-2-Nsp1 双酶切产物经1.5%琼脂糖凝胶电泳分离,结果对比重组质粒双酶切得到大小约为4 700 bp 和540 bp 的载体和目的条带,符合预期,结果如图2 所示。重组质粒经公司测序结果显,SARS-CoV-2 Nsp1 成功连接到真核载体pEGFP-N1上,表明重组真核质粒pEGFP-N1-SARS-CoV-2-Nsp1 构建成功。

图2 重组载体pEGFP-N1-SARS-CoV-2-Nsp1的双酶切鉴定Fig.2 Identification of pEGFP-N1-SARS-CoV-2-Nsp1 vector by double enzyme digestion analysis
2.3 SARS-CoV-2 Nsp1 蛋白在HEK-293T 细胞中表达
在铺有HEK-293T 细胞的24 孔板中转染大约800 ng 的重组质粒pEGFP-N1-SARS-CoV-2-Nsp1,培养24 h,经RIPA 裂解及收集细胞。通过SDSPAGE 凝胶分离,使用小鼠抗GFP 单抗、山羊抗小鼠二抗检测载体pEGFP -N1 及重组表达载体pEGFP-N1-SARS-CoV-2-Nsp1 的表达情况,且利用小鼠抗β-Actin 单克隆抗体检测其细胞内参表达情况。结果如图3 所示,转染重组质粒的样品中出现与预期大小一致的条带,对照组未观察到相关条带,说明SARS-CoV-2 Nsp1 蛋白在HEK-293T 细胞中成功表达。
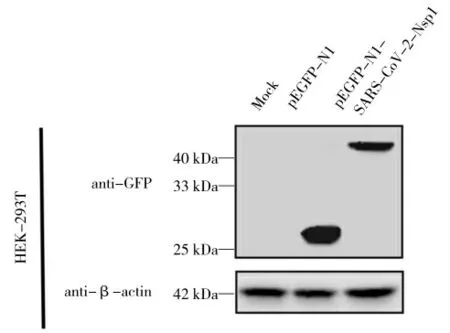
图3 Western Blot 技术检测重组质粒在HEK-293T 细胞中的表达Fig.3 Detection of the expression of recombinant plasmids in HEK-293T cells by Western Blot
2.4 SARS-CoV-2 Nsp1 蛋白在HeLa 细胞中表达
在铺有HeLa 细胞的24 孔板中转染重组质粒pEGFP-N1-SARS-CoV-2-Nsp1,同2.3 中操作方法,收集细胞后,经SDS-PAGE 凝胶电泳分离,使用小鼠抗GFP 单抗和山羊抗小鼠二抗孵育,检测其细胞表达情况。结果如图4 所示,得到同样结果,说明SARS-CoV-2 Nsp1 蛋白在HeLa 细胞中成功表达。

图4 Western Blot 技术检测重组质粒在HeLa 细胞中的表达Fig.4 Detection of the expression of recombinant plasmids in HeLa cells by Western Blot
2.5 SARS-CoV-2 Nsp1 蛋白抑制HEK-293T 细胞蛋白合成
将pEGFP-N1 质粒及重组质粒pEGFP-N1-SARS-CoV-2-Nsp1 转染至铺有HEK-293T 细胞的24 孔板中,培养一段时间,加入嘌呤霉素处理1 h,对细胞中正在合成的蛋白质进行标记。同2.3 中操作方法,收集细胞后,通过Western blot 技术和考马斯亮蓝染色检测。如图5、6 显示,考马斯亮蓝染色显示在总蛋白量不变的情况下,重组质粒转染后细胞中正在合成的蛋白质数量明显减少。结果说明,SARSCoV-2 Nsp1 蛋白具有抑制宿主蛋白质翻译的功能。
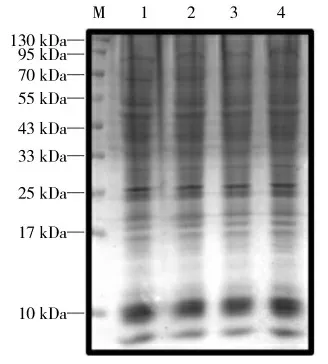
图5 SARS-CoV-2 Nsp1 蛋白抑制HEK-293T细胞总蛋白合成Fig.5 Inhibition of SARS-CoV-2 Nsp1 protein on protein synthesis in HEK-293T cells

图6 SARS-CoV-2 Nsp1 蛋白抑制HEK-293T 细胞蛋白合成Fig.6 Inhibition of SARS-CoV-2 Nsp1 protein on protein synthesis in HEK-293T cells
2.6 SARS-CoV-2 Nsp1 蛋白抑制HeLa 细胞蛋白合成
将pEGFP-N1 质粒及重组质粒pEGFP-N1-SARS-CoV-2-Nsp1 转染至铺有HeLa 细胞的24 孔板中,培养一段时间,加入嘌呤霉素处理1 h,使细胞中正在合成的蛋白质进行标记。同2.3 中操作方法,收集细胞后,通过Western blot 技术检测。结果如图7所示,随着重组质粒转染进入细胞,细胞中正在合成的蛋白质数量减少。结果说明,SARS-CoV-2 Nsp1 蛋白具有抑制宿主蛋白质翻译的功能。

图7 SARS-CoV-2 Nsp1 蛋白抑制HeLa 细胞蛋白合成Fig.7 Inhibition of SARS-CoV-2 Nsp1 protein on protein synthesis in HeLa cells
2.7 SARS-CoV-2 Nsp1 蛋白抑制外源蛋白的合成
在铺有HeLa 细胞的24 孔板中,转入pDsRed2-C1 质粒,再将重组质粒pEGFP-N1-SARS-CoV-2-Nsp1 及pEGFP-N1 载体转染至细胞中共同培养24 h。同2.3 中操作方法,收集细胞后,通过Western blot 技术检测。结果如图8 所示,随着重组质粒转染进入细胞,细胞中外源转入质粒合成的蛋白质表达减少。结果说明,SARS-CoV-2 Nsp1 蛋白具有抑制外源蛋白质翻译的功能。

图8 SARS-CoV-2 Nsp1 蛋白抑制外源蛋白的合成Fig.8 Inhibition of SARS-CoV-2 Nsp1 protein on the synthesis of foreign proteins
3 讨论
SARS-CoV-2 引起的高发病率和高死亡率的急性呼吸道疾病(COVID-19)迅速蔓延至全球,已成为全世界人类健康最严重的威胁之一,引起了公众的极大关注。世界卫生组织(WHO)宣布COVID-19 为全球突发公共卫生事件[19]。从疾病表现来看,SARSCoV-2 感染可以是无症状的,而COVID-19 的范围从轻微的流感样疾病到危及生命的并发症。SARSCoV-2 不仅会影响呼吸道,导致肺炎,还会影响胃肠道、神经系统或心血管系统[20-21]。目前,COVID-19 的研究仍处于初步阶段,还需要进一步系统性的研究。而且迄今为止,世界上还没有出现较为有效地针对SARS-CoV-2 变异毒株的特定药物或疫苗,仅能进行对症治疗,但科学家们正在积极研制几种抗病毒药物。尽管正在探索更多的治疗选择,但依旧没有统一的治疗方法可用。只能不断推进公共卫生防预措施,通过使用个人防护设备和遏制措施来限制病毒传播。尽管这些策略对于减少病毒的传播至关重要,但它们对社会经济发展产生极大的不利影响,坚持这些预防策略很难维持社会发展和进步[22-23]。然而,考虑到广大人群的流动性,预计随后还会出现大流行波[24]。因此,研究SARS-CoV-2 的检测方法仍然是遏制和缓解COVID-19 策略的重要组成部分,从每次疫情中吸取的教训都可能有助于为未来的大流行做好准备。由于SARS-CoV-2 的不断进化,演变出具有单核苷酸多态性变体和许多谱系,这些变化使得对SARS-CoV-2 的研究更加困难[25-26]。所以迫切的需要深入研究病毒,了解其致病性和毒力机制,以制定更有效的预防和治疗策略。
在过去的二十年中,三种高致病性人类冠状病毒(CoV),包括严重急性呼吸综合征(SARS-CoV)、中东呼吸综合征(MERS-CoV)和SARS-CoV-2 编码的非结构蛋白1(Nsp1)都表现出共同的生物学功能[27]。Nsp1 作为α 和β 冠状病毒编码一种独特的蛋白质,既能抑制宿主免疫反应,又能降低宿主细胞中的全局基因表达水平。Nsp1 作为冠状病毒的关键致病因子,通过多种机制阻碍宿主蛋白表达的同时,逃避其自身被抑制,允许病毒RNA 的翻译。越来越多的文献研究了抑制冠状病毒Nsp1 诱导的免疫反应和抑制蛋白质合成的数据,旨在深入探究SARS-CoV-2 Nsp1 更多和更具体的生物学功能,有利于加深对病毒的了解,开发更有效的疫苗[28]。
试验利用真核表达载体pEGFP-N1 将Nsp1 基因标记,EGFP 作为突变型绿色荧光蛋白(GFP),即使在高温、极端pH 和变性剂等条件下都能稳定、持续发出荧光[29]。除此之外,pEGFP-N1 载体不影响细胞的形态和生长,所以研究将载体选为pEGFP-N1 载体[30]。试验中,通过引物设计及PCR 扩增出SARSCoV-2 Nsp1 基因,通过同源重组酶将其连接至pEGFP-N1 载体,构建了pEGFP-N1-SARS-CoV-2-Nsp1 真核重组质粒,并成功在HEK-293T 细胞和HeLa 细胞中表达。经转染HEK-293T 细胞、HeLa 细胞及嘌呤霉素标记等试验操作,发现Nsp1 蛋白能抑制宿主蛋白质及外源蛋白的翻译水平。研究通过成功构建pEGFP-N1-SARS-CoV-2-Nsp1 真核重组质粒及抑制宿主蛋白和外源蛋白翻译功能,为下一步深入SARS-CoV-2 Nsp1 蛋白功能的研究奠定基础。

