解淀粉芽孢杆菌OMR1-7 菌株对拟石莲花属多肉植物黑腐病的生防效果*
刘 爽,唐 锐,谭 丹,薛治峰,李梦杰,张廷萍,秦世雯
(云南大学 农学院/资源植物研究院,云南 昆明 650500)
多肉植物是一类营养器官肥厚的观赏植物,品种繁多,易栽培,深受全球消费者喜爱[1]。多肉植物是中国云南省“云花”产业的重要组成部分,截至2021 年,云南多肉植物生产面积超67 hm2,产量超3 000 万盆[2]。景天科(Crassulaceae)拟石莲属(Echeveria)是近年来热门的多肉植物种类,具有莲花状桩型,品种繁多,叶色和花色美丽,被广泛应用于室内盆栽、城市绿化及园林景观中。黑腐病是多肉植物生产和家庭种植过程中的主要病害之一,在全球多肉种植地均有发生,给多肉植物产业造成了一定的损失[3]。该病引起多肉植物的水层组织和维管束组织腐烂和萎蔫,造成叶片出现透明水渍状病斑并脱落,茎部呈黑腐症状,最终导致植株枯萎死亡[4]。研究发现:拟石莲属黑腐病的病原菌为尖孢镰刀菌(Fusarium oxysporum),能够危害血色罗密欧(E.agavoidescv.‘Romeo’)[5]、静夜(E.derenbergiicv.‘Purpus’)[6]、彩虹(Echeveriacv.‘Rainbow’)[7]、东云(E.agavoides)[8]和紫珍珠(Echeveriacv.‘Perle von Nürnberg’)[9]等品种。
尖孢镰刀菌作为全球防控难度最大的土传病原真菌之一,能够在无寄主的情况下长期存活于土壤中,而现有的化学药剂和农业防治手段无法将其根除[3]。多肉植物黑腐病的防治主要采取化学防治手段,由于多肉植物多用于家庭种植,对其化学药剂的毒性有较高要求。生物防治是使用生物拮抗剂(细菌、真菌等),通过“以菌治菌”达到防病和促进寄主生长的目标[10]。生防菌剂具有绿色、环保、对人体安全等特点,是理想的多肉植物黑腐病防治手段。然而,多肉黑腐病的生物防治研究目前还处于空白。本研究从小粒野生稻(Oryza minuta)根部分离鉴定了1 株解淀粉芽孢杆菌(Bacillus amyloliquefaciens) OMR1-7 菌株,通过测定其拮抗效果、产铁载体和生物膜能力、定殖能力和温室防效,以期明确其对拟石莲属多肉品种血色罗密欧和静夜的生防效果,为多肉植物黑腐病的生物防治提供菌种资源。
1 材料与方法
1.1 供试材料
供试植物品种:小粒野生稻,由农业农村部多年生稻生物学与种质创新重点实验室提供;拟石莲属多肉植物血色罗密欧和静夜购于云南昆明一多肉植物商业大棚。
供试病原菌:血色罗密欧黑腐病菌F.oxysporumKMEARM-2[5]和静夜黑腐病菌F.oxysporumKMJY6[6]均由云南大学农学院植物病理学研究室鉴定和提供。
供试载体:GFP 标记解淀粉芽孢杆菌OMR 1-7 菌株所用遗传转化载体pGFP4 412 由中国农业大学王埼教授惠赠。
1.2 生防细菌的分离
采用组织分离法[11],从健康的小粒野生稻上剪取根部组织,无菌水冲洗干净表面污渍后用滤纸吸干表面水分。根部组织经75%酒精浸泡5 min、无菌水漂洗1 次、2.5%次氯酸钠浸泡3 min、无菌水漂洗3 次后,用无菌滤纸吸干表面水分。将根部组织放入无菌研钵中,加入适量无菌水,研磨后对研磨液进行梯度稀释,吸取组织液100 μL涂布于LB 固体培养基[12]上;同时吸取第3 次漂洗液100 μL 涂布于LB 固体培养基,若无细菌生长表明根部表面已彻底消毒。将以上平板置于37 ℃黑暗培养1~3 d 直至有菌落长出,挑取形态不同的细菌菌落进行纯化和保藏。
1.3 生防菌株的鉴定
1.3.1 形态学鉴定
将OMR1-7 菌株划线培养于LB 培养基,37 ℃培养24 h 后观察其单菌落形态,随后进行革兰氏染色并观察其菌体形态特征。
1.3.2 分子序列特征鉴定
利用TIANGEN 细菌基因组DNA 提取试剂盒提取OMR1-7 菌株的DNA;利用16S rDNA 引物27F (5′ -AGAGTTTGATCCTGGCTCAG-3′)和1492-R (5′-GGTTACCTTGTTACGACTT-3′)以及gyrA基因引物gyrAF (5′-CAGTCAGGAAATGCGTACGTCCTT-3′)和gyrAR (5′-CAAGGTAATGCTCCAGGCATTGCT-3′)进行PCR 扩增;扩增片段经电泳和测序检测后,在NCBI 数据库进行Blastn 比对分析,并提交至国家生物信息中心Genbase 数据库(https://ngdc.cncb.ac.cn/genbase);利用MEGA11.0软件以邻接法构建16S rDNA 和gyrA系统发育树,Bootstrap 值设为1 000。
1.4 拮抗效果的测定
1.4.1 菌丝抑制率的测定
采用平板对峙法,将5 mm2黑腐病菌KMJY6 和KMEARM-2 菌块分别接种于PDA 平板[13]中央,将OMR1-7 菌株划线培养于LB 固体培养基,37 ℃培养24 h 后,挑取单菌落接种至LB液体培养基,28 ℃、180 r/min 振荡培养12 h,制成1×108CFU/mL 的菌悬液。将OMR1-7 菌悬液划线接种于病原菌菌块两侧2.5 cm 处,设3 次重复试验。以仅接种病原菌菌块的PDA 平板为对照。将PDA 平板置于28 ℃恒温培养箱中培养6 d,待对照组菌丝长满平板后,按公式计算OMR1-7 菌株对黑腐病菌的菌丝抑制率:抑制率=[(对照菌落直径-处理菌落直径)/对照菌落直径 ]×100%。
1.4.2 菌体抑制率的测定
将OMR1-7 菌悬液与融化、冷却至约40 ℃的PDA 培养基按体积比1∶10 混合,制成OMR1-7毒板,将5 mm2黑腐病菌KMJY6 和KMEARM-2 菌块接入毒板中心,设3 次重复试验。以PDA平板为对照。将毒板和PDA 平板置于28 ℃恒温培养5~7 d,然后计算OMR1-7 菌株对黑腐病菌的菌体生长抑制率,计算公式同1.4.1 节。
1.5 生防菌株产铁载体能力测定
1.5.1 产铁载体定性分析
采用滤纸片法,将生防菌株接种于CAS 培养基[14]上,28 ℃倒置培养2~3 d 后观察是否有透明圈,以LB 培养基为对照。透明圈和菌落圈直径的比值即为菌株产铁载体能力。
1.5.2 产铁载体定量分析
取OMR1-7 菌悬液100 μL 接种于1 mL CAS培养液,28 °C、180 r/min 振荡培养48 h,离心后取上清液300 μL 置于96 孔板中,每个处理3 个重复,用酶标仪(Molecular Devices SpectraMax®i3,中国)检测630 nm 处的吸光度值(As);另取LB培养基与CAS 培养液等体积混匀,以其630 nm处的吸光度值(Ar)作为参比值,根据公式SU=1-As/Ar 计算菌株产铁载体的相对含量(SU)。
1.6 生防菌株产微生物膜能力的测定
1.6.1 产微生物膜定性分析
将OMR1-7 菌株接种于LB 培养基培养24 h,离心后弃上清,用MSgg 培养基[15]重悬菌体。在24孔细胞培养板的培养孔中加入 MSgg 培养基2 mL,然后加入 OMR1-7 菌液5 μL,设置3 个重复,于37 ℃静置培养72 h。以MSgg 培养基中加入LB培养基5 μL 为对照,观察OMR1-7 菌株的成膜情况。
1.6.2 产微生物膜定量分析
将OMR1-7 菌株接种于LB 培养基,28 ℃、180 r/min 培养48 h 取出,每组设3 个重复。吸取取出后的菌液4 mL 室温静止培养24 h,弃培养液后用去离子水清洗,用1%结晶紫染色2 min,弃结晶紫溶液,水洗、风干后用1%结晶紫染色。吸出多余结晶紫,用蒸馏水漂洗,待风干后加入洗膜缓冲液[16],振荡10~15 min 后稀释10倍,用紫外分光光度计(岛津 UV2600,日本)测定570 nm 处的吸光度值。
1.7 GFP 标记OMR1-7 菌株的构建
将OMR1-7 菌株接种于30 mL GM 液体培养基[17]中,28 ℃、180 r/min 培养16 h 制成种子液。取种子液1 mL 接种于100 mL GM 液体培养基中,28 ℃、180 r/min 培养至600 nm 处的吸光度值为0.7。取GM 培养液1 mL 加至灭菌的1.5 mL离心管中,冰浴10 min,4 ℃、8 000 r/min 离心10 min,弃上清液。沉淀用200 μL 预冷的ETM[18]漂洗2 次,制成OMR1-7 菌株感受态细胞。取pGFP4 412 质粒1 μg 加至100 μL 感受态细胞中,温和混合后置于电击杯;将电击杯放入Gene-Pulser Xcell 电击仪(Bio-Rad,美国)进行电击(电压1.8 kV,电阻200 Ω),随后加入RM 培养基[19]1 mL,并转移至灭菌的1.5 mL 离心管,28 ℃、200 r/min 培养4 h;取100 μL 涂布于LB 固体培养基(含100 μg/μL 新霉素),28 ℃倒置培养24 h,待长出转化子后,挑取转化子单菌落进行PCR 检测。检测引物为gfp-F (5′-GCCTCTAGAATGAGTAAAGGAGAAGAACTTTTC-3′)和gfp-R (5′-GCCAAGCTTTTATTTGTATAGTTCATCCATGCC-3′)。
1.8 OMR1-7 菌株在多肉植物体内定殖的观察
采用灌根接种法,将GFP 标记的OMR1-7 菌株单菌落接种至LB 液体培养基28 ℃、180 r/min振荡培养,制成1×108CFU/mL 的OMR1-7-GFP菌悬液;取25 mL 分别接种于血色罗密欧和静夜植株,5 d 后接种黑腐病菌孢子悬浮液40 mL。每个处理设置10 株植株,重复3 次。28 d 后取多肉植物的根、茎和叶进行冷冻切片,置于激光共聚焦显微镜(Olympus FV3000,日本)下观察,激发光波长设置为488 nm,发射光波长为510 nm。
1.9 多肉黑腐病温室防效测定
将黑腐病菌接种于Bilai’s 培养基[20]中,28 ℃、180 r/min 振荡培养5 d;用4 层无菌纱布过滤菌丝,制备成密度为1×106mL-1的孢子悬浮液。将OMR1-7 菌液接种于LB 液体培养基中,28 ℃、180 r/min 振荡培养12 h,制备成1×108CFU/mL 的OMR1-7 菌悬液。
分别选取大小一致的健康多肉品种血色罗密欧和静夜,采用灌根接种法,设置以下3 个处理:①清水对照;② 接种黑腐病菌孢子悬浮液40 mL;③先接种OMR1-7 菌液25 mL,5 d 后接种黑腐病菌孢子悬浮液40 mL。每个处理接种植株10 盆,每个处理重复3 次。接种后的植株放置于温度为25 ℃、湿度为50%的温室中,每天观察黑腐病发病症状,28 d 后统计发病率和生防效果。发病率=发病植株数/调查总株数×100%;生防效果=[(处理②发病植株数-处理③发病植株数)/处理②发病植株数 ]×100%。
2 结果与分析
2.1 OMR1-7 菌株的鉴定
OMR1-7 菌株在LB 固体培养基培养1 d 后单菌落呈圆形,淡黄色,半透明,边缘整齐,突起形状平展,表面湿润且有黏稠感(图1a)。革兰氏染色发现该菌为短杆状革兰氏阳性菌(图1b)。分子序列鉴定发现:OMR1-7 菌株16S rDNA 基因(GenBase No.:C_AA009084.1)与从栽培稻品种金刚30 中分离的Bacillus amyloliquefaciensLx-11菌株(GenBank No.:HQ179100.1)相似性最高,为99.93%;OMR1-7 菌株gyrA基因(GenBase No.:C_AA016452.1)与从番茄根际土壤中分离的B.amyloliquefaciensRNB-92 菌株(GenBank No.:LC09-6069.1)相似性最高,为100.00%。通过构建16S rDNA 和gyrA基因系统发育树(图1c 和1d)发现:OMR1-7 菌株与B.amyloliquefaciens聚在同一分支。结合形态学和分子序列鉴定结果可知:OMR1-7 菌株鉴定为解淀粉芽孢杆菌(B.amyloliquefaciens)。

图1 解淀粉芽孢杆菌OMR1-7 菌株的形态特征和分子序列系统发育树Fig.1 Morphological characteristic and molecular sequence phylogenetic tree of Bacillus amyloliquefaciens OMR1-7 strain
2.2 OMR1-7 对多肉黑腐病原菌的抑制效果
OMR1-7 菌株与血色罗密欧黑腐病原菌KMEARM-2 菌株、静夜黑腐病原菌KMJY6 菌株之间均形成了明显的抑菌带(图2a),并且造成了黑腐病菌菌丝末端膨大(图2b)。OMR1-7 菌株对KMEARM-2 和KMJY6 菌株的菌丝生长抑制率分别为57.15%和74.29% (图2c)。KMEARM-2 和KMJY6 菌株在OMR1-7 菌株制成的毒板上生长受到抑制,OMR1-7 菌株对2 个病原菌菌体抑制率分别为84.82%和86.15% (图2d),同时造成2 个病原菌孢子产量减少(图2e)。以上结果说明解淀粉芽孢杆菌OMR1-7 菌株对血色罗密欧和静夜黑腐病菌的菌丝和孢子生长具有显著抑制效果,且造成病原菌侵染结构畸形。
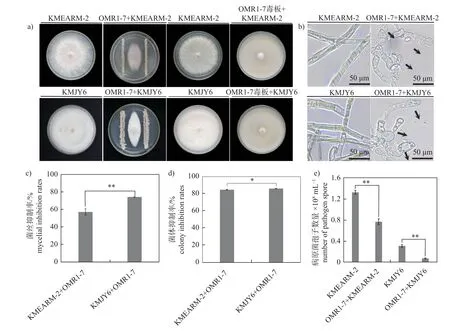
图2 解淀粉芽孢杆菌OMR1-7 菌株对拟石莲属多肉植物黑腐病菌的抑制效果Fig.2 Antagonistic effects of B.amyloliquefaciens OMR1-7 against Fusarium oxysporum causing black rot on Echeveria succulent plants
2.3 OMR1-7 菌株产铁载体能力
OMR1-7 在CAS 培养基上其菌落周围形成了橙黄色透明圈(图3),且OMR1-7 菌株产铁载体的透明圈和菌落圈直径的比值为4.43±0.17。通过定量测定,OMR1-7 菌株产生铁载体的相对含量为80.98%。以上结果说明该菌株具有较强的铁载体分泌能力,能够与植物病原真菌竞争铁元素进而抑制病原菌。
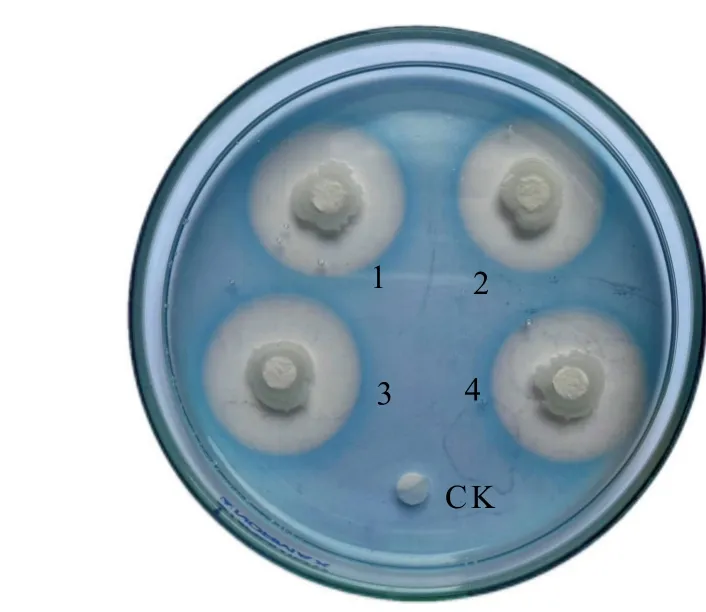
图3 解淀粉芽孢杆菌OMR1-7 菌株在CAS 平板上的产铁载体情况Fig.3 Siderophore produced by B.amyloliquefaciens OMR1-7 on CAS plates
2.4 OMR1-7 菌株产微生物膜能力
OMR1-7 菌株在MSgg 培养基中形成了密集褶皱的生物膜(图4)。OMR1-7 菌株产生的生物膜在570 nm 处的吸光度值为1.60±0.38,说明其具有较强的能力,有利于菌株适应环境以及提高在寄主中定殖和抗菌的活性。

图4 解淀粉芽孢杆菌OMR1-7 菌株在Msgg 液态培养基中形成生物膜Fig.4 Biofilms produced by B.amyloliquefaciens OMR1-7 in Msgg liquid medium
2.5 OMR1-7 菌株在拟石莲花属多肉植物中的定殖
OMR1-7-GFP 菌株能成功定殖于血色罗密欧和静夜的根、茎和叶部(图5)。相较于叶部,OMR1-7-GFP 菌株在寄主根部和茎部数量较多。说明OMR1-7 菌株具有内生特性,占据了拟石莲属多肉植物体根、茎和叶内生态位,有效阻止了黑腐病菌的侵入和扩增。
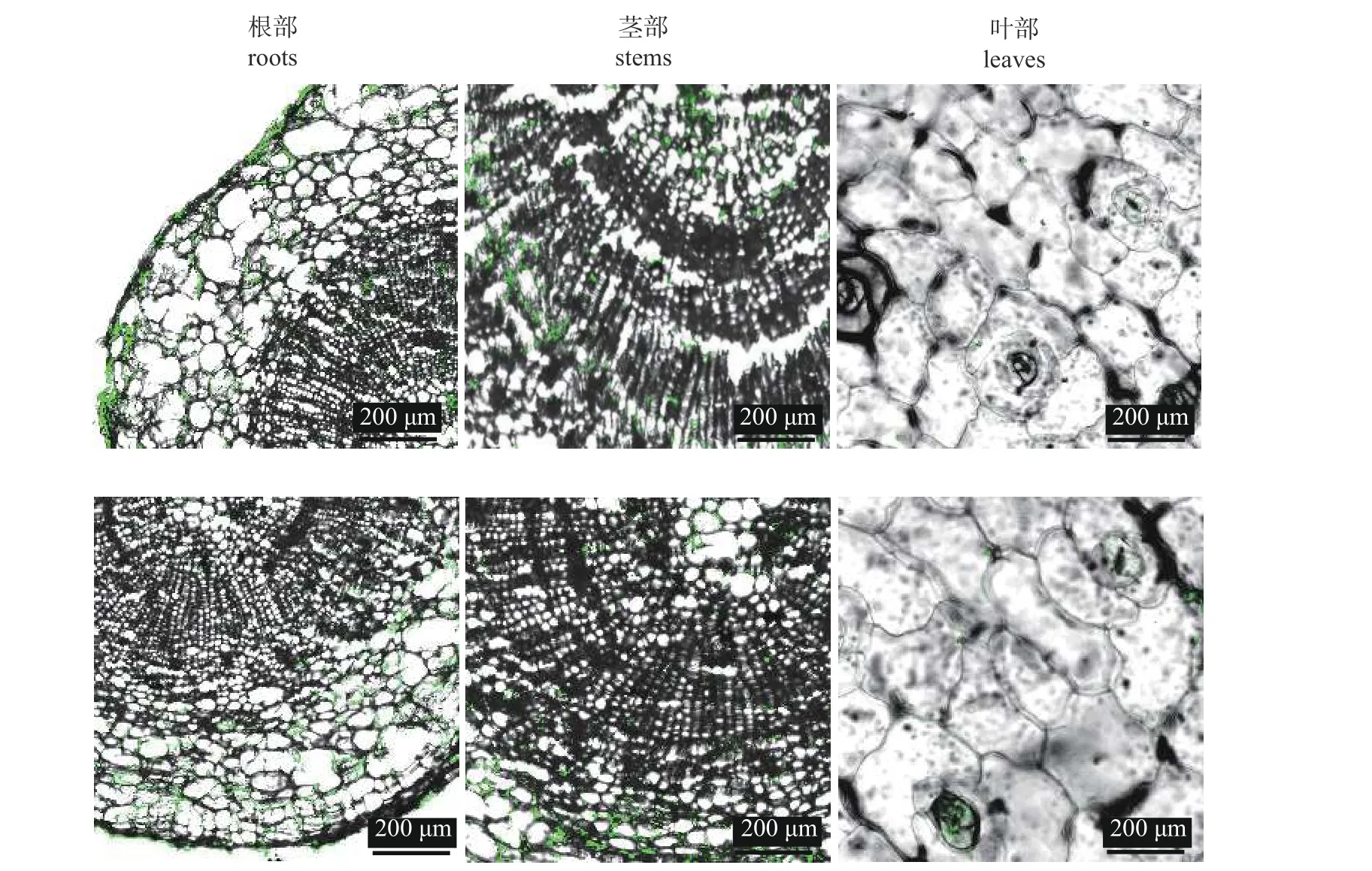
图5 解淀粉芽孢杆菌OMR1-7 菌株在拟石莲属多肉植物血色罗密欧(上)和静夜(下)中的定殖Fig.5 Colonization of B.amyloliquefaciens OMR1-7 in E. agavoides cv.‘Romeo’ (above) and E.derenbergii cv.‘Purpus’ (below)
2.6 OMR1-7 菌株对拟石莲花属黑腐病的生防效果
接种黑腐病菌28 d 后,血色罗密欧和静夜植株叶部和茎部出现了黑腐症状(图6a~b),发病率分别为83.33%和100.00%;而先接种OMR1-7菌株5 d 后再接种病原菌的植株发病率分别为16.67%和33.33% (图6c);OMR1-7 菌株对血色罗密欧和静夜黑腐病的盆栽防效分别达到80.08%和78.89% (图6d)。说明解淀粉芽孢杆菌OMR1-7 菌株对拟石莲属多肉植物黑腐病具有显著的生防效果。

图6 解淀粉芽孢杆菌OMR1-7 菌株对拟石莲属多肉植物血色罗密欧和静夜黑腐病的生防效果Fig.6 Biocontrol efficiency of B.amyloliquefaciens OMR1-7 against black rot diseases of E. agavoides cv.‘Romeo’ (EA) and E.derenbergii cv.‘Purpus’ (ED)
3 讨论
解淀粉芽孢杆菌是目前应用最为广泛的生防细菌之一,具有广谱抗菌活性和较强的抗逆能力,能够促进多种植物生长[21]。解淀粉芽孢杆菌对尖孢镰刀菌(F.oxysporum)、灰葡萄孢(Botrytis cinerea)、稻瘟病菌(Magnaporthe oryzae)、灰绿青霉(Penicillium glaucum)、叶霉病菌(Cladosporium fulvum)等植物病原真菌具有显著的抑菌效果[22-23]。研究表明:解淀粉芽孢杆菌可产生抑菌次生代谢物(表面活性素、大环内酯H、芽孢素、丰原素、地非西丁、杆菌溶素等)以及水解酶类(几丁质酶和蛋白酶),抑制植物病原真菌的生长[24-25]。本研究发现:解淀粉芽孢杆菌OMR1-7菌株与拟石莲属多肉植物黑腐病菌F.oxysporum拮抗互作时,两者之间形成了明显的抑菌带,病原菌菌丝出现畸形且产孢量降低。说明OMR1-7 菌株能够产生抑菌物质影响拟石莲属多肉植物黑腐病菌侵染结构和无性繁殖体的形成,进而影响病原菌的侵入和扩繁。深入挖掘和鉴定OMR1-7 菌株的抗菌物质,有助于开发拟石莲属多肉植物黑腐病的生物农药。
高产铁载体的生防细菌通过竞争土壤中的铁元素从而抑制植物病原菌的生长,促进寄主植物健康[26]。已有研究报道不同种的芽孢杆菌均具有高产铁载体特性[27-29]。黄瓜根际土壤中分离的B.amyloliquefaciensB2 菌株能够产铁载体,抑制黄瓜枯萎病菌(F.oxysporumf.sp.cucumerinum),促进轮作环境下的黄瓜生长[30]。本研究发现:OMR1-7 菌株铁载体产量高达80.98%,说明其与土传性拟石莲花属多肉植物黑腐病菌F.oxysporum拮抗互作时,具有强铁素竞争能力,能够有效抑制病原菌入侵。
解淀粉芽孢杆菌寄主范围广泛,可稳定定殖于寄主植物根际、叶际和体内[31]。B.amyloliquefaciensX5 和BQA2 菌株在番茄根际有较强的定殖能力[32];B.amyloliquefaciensJt84 菌株能够在水稻叶表长期有效定殖[33];B.amyloliquefaciensCC09 菌株在小麦根内、根表和根际均能定殖,且不影响根组织细胞结构[34]。本研究从小粒野生稻中分离到的B.amyloliquefaciensOMR1-7 菌株可在非寄主植物拟石莲属多肉植物的根、茎和叶部有效定殖。OMR1-7 菌株在拟石莲属多肉植物的根和茎部大量定殖,可有效阻止土传性黑腐病菌F.oxysporum从根部侵入,继而向维管束蔓延,说明OMR1-7 菌株具有与黑腐病菌进行空间竞争的能力。此外,B.amyloliquefaciens占据寄主植物根际生态位后,还能招募有益微生物群促进植物生长[35]。
细菌生物膜是细菌群体聚集形成的膜状物,帮助其黏附寄主,提高环境适应性[36]。生物膜被认为是B.amyloliquefaciens在寄主环境定殖并与植物病原菌进行空间竞争的重要物质之一[37-39],它还能在逆境条件下维持B.amyloliquefaciens的营养供给,减少逆境伤害[40]。本研究也发现:OMR1-7 菌株能够产生生物膜,可以帮助其高效定殖于寄主,提高在土壤和寄主中长期存活的能力。
解淀粉芽孢杆菌对多种植物真菌病害具有良好的生防潜力,目前研究报道该菌对F.oxysporum引起病害的生防效果可达60%以上[21]。如:分离自土壤的B.amyloliquefaciensB6 菌株对F.oxysporumf.sp.lycopersicis引起的番茄枯萎病防效为64.35%[41];B.amyloliquefaciensY-4 菌株对F.oxysporumf.sp.cubense引起的香蕉枯萎病防效为67.9%[42];B.amyloliquefaciensHD-5 菌株对F.oxysporum引起的草莓根腐病防效达77.78%[43];喷施解淀粉芽孢杆菌微生物叶面肥悬浮剂对葡萄白粉病的防治效果达65%以上[44]。本研究分离的B.amyloliquefaciensOMR1-7 菌株对拟石莲属多肉植物黑腐病的生防效果为78.89%~80.08%,且该菌株对供试2 种多肉植物黑腐病的生防效果无显著差异,但OMR1-7 菌株在PDA 培养基上对血色罗密欧黑腐病菌的抑菌效果却显著低于对静夜黑腐病菌的抑菌效果。这是由于生防细菌在植物体内的生防效果受自身定殖能力、寄主和环境等多重因素影响,因此体外抑菌防效和田间防效存在一定差异[45-46]。
4 结论
本研究首次对拟石莲花属多肉植物的生物防治进行了生防细菌挖掘,明确了解淀粉芽孢杆菌OMR1-7 菌株对拟石莲属多肉植物黑腐病的生防效果,研究结果将为多肉植物黑腐病的防控和生防药剂开发提供参考。

