不同质量浓度Cu2+和Ag+对大麦成熟胚组培特性的影响*
周洪斌,王卫斌,王梦玥,熊静蕾,陈升位,毛孝强
(云南农业大学 农学与生物技术学院,云南 昆明 650201)
基于愈伤组织的农杆菌浸染技术是大麦遗传转化的主要方法[1]。目前,用于农杆菌浸染的大麦愈伤组织大多来源于幼胚[2],虽然幼胚愈伤诱导率和再分化效率相对较高,但易受大麦基因型和生长季节的限制。以大麦成熟胚为外植体诱导愈伤组织虽不受生长季节限制,但在培养过程中成熟胚易长根、长芽,诱导的愈伤易褐化、质量相对较差,愈伤诱导率和再分化率也较低。为解决上述问题,不同学者探讨了基因型[3]、2,4-D 浓度[4]、成熟胚切割方式[5]等因素对大麦成熟胚愈伤质量和诱导率的影响,发现采用2~6 mg/L 2,4-D,结合成熟胚纵向或横向切割处理可有效抑制培养进程中成熟胚长根和长芽,进而改善大麦成熟胚愈伤组织质量,提高其诱导率。尽管如此,但鲜有大麦成熟胚愈伤组织易褐化、再分化率偏低、绿化愈伤细胞再分化流产(细胞转绿后不能再分化)的报道。
作为植物生长的必要微量元素,适宜浓度Cu2+可有效抑制大麦胚芽鞘生长,进而提高愈伤组织的再分化率[6]。不同学者以CuSO4·5H2O 为Cu2+源,报道了啤酒大麦[6]、水稻[7]、小麦[8]等植物未成熟胚愈伤诱导及其再分化培养中Cu2+的有效浓度,但Cu2+效应及其有效浓度具有基因型依赖性。AgNO3可有效提高精氨酸脱羧酶活性,促进细胞中多胺的合成,进而提高细胞中多胺浓度,减缓植物组织褐化,提高愈伤组织的诱导率和再分化率[9-10]。在大麦幼胚愈伤组织诱导培养中常以AgNO3作为Ag+源,但不同大麦基因型所需AgNO3有效浓度也存在较大差异[11]。
前人虽证实Cu2+和Ag+可有效提高大麦未成熟胚愈伤组织的诱导率或再分化率,但2 种离子协同对大麦成熟胚长根、长芽、愈伤褐化等组培特性的影响仍不清楚。本研究以北青7 号、Bowman 和光头大麦的成熟胚为材料,分析MS 培养基中不同质量浓度Cu2+和Ag+对大麦成熟胚长根、长芽、愈伤组织褐化等7 种组培特性的影响,以期为优化大麦、特别是国内主要大麦品种成熟胚愈伤组织诱导及其再分化技术体系提供理论支持。
1 材料与方法
1.1 试验材料
以Bowman、北青7 号和光头大麦为材料。其中,Bowman 为二棱皮大麦,国外育成品种;北青7 号为六棱裸大麦,育成品种;光头大麦为六棱裸大麦,地方品种。Bowman 和光头大麦由浙江省农业科学院国家大麦改良中心提供,北青7 号由迪庆州农业科学研究所提供。所有材料均由课题组繁育、保存。
1.2 试验方法
1.2.1 材料种植
试验材料均种植于云南农业大学教学试验农场。于2019 年11 月10 日播种,株行距为5 cm×20 cm。其他田间管理措施与大田常规生产基本一致。在完熟期收取不同材料种子置于牛皮袋,自然风干,室温保存,备用。
1.2.2 培养基配制
在MS 培养基中添加蔗糖30.0 g、酪蛋白1.0 g、VB11.0 mg、肌醇350.0 mg、脯氨酸690.0 mg和麦草畏2.5 mg,然后添加适量AgNO3,定容至1 000 mL,构建0、2.00、4.00、6.00 和8.00 mg/L Ag+处理培养基;添加CuSO4·5H2O,定容至1 000 mL,构建0、0.75、1.25、1.75 和2.25 mg/L Cu2+处理培养基。
在MS 培养基中添加蔗糖20.00 g、(NH4)2SO4132.00 mg、谷氨酰胺750.00 mg、VB10.40 mg、肌 醇100.00 mg、2,4-D 2.50 mg、CuSO4·5H2O 1.25 mg 和 BAP 0.10 mg,定容至1 000 mL,构建再分化培养基。
愈伤组织诱导和再分化培养基的琼脂质量浓度均为7 g/L,pH 值均为5.8。除酪蛋白、VB1、肌醇、脯氨酸、头孢霉素、谷氨酰胺和草铵膦采用过滤除菌外,其余成分均采用高温灭菌。
1.2.3 愈伤诱导培养
采用陈升位等[12]报道的大麦成熟胚愈伤组织诱导培养方法,消毒、切割、接种并培养大麦成熟胚。接种14 d 后继代培养愈伤组织,统计出愈胚、长根胚和长芽胚的数量,并从每个处理的愈伤组织中随机取5 个称量,测定愈伤组织湿质量。每个处理接种70 个以上成熟胚,重复3 次。
1.2.4 愈伤再分化培养
暗培养28 d 后再分化培养愈伤组织,分化培养温度25 ℃,光照时间12 h/d。再分化培养7 d后调查褐化和绿化的愈伤组织,21 d 后调查再分化愈伤。
1.2.5 数据统计与分析
按照公式计算7 个指标:愈伤湿质量=愈伤总质量/称量愈伤数;长根率=长根胚数/接种胚数×100%;长芽率=长芽胚数/接种胚数×100%;愈伤诱导率=出愈胚数/接种胚数×100%;褐化率=褐化愈伤数/继代愈伤数×100%;绿化率=变绿愈伤数/分化愈伤数×100%;愈伤再分化率=出苗愈伤数/分化愈伤数×100%。采用SPSS 20.0 的方差和多重比较模块分析数据。
2 结果与分析
2.1 成熟胚的培养特性
通过14 d、25 ℃暗培养,成熟胚平均愈伤诱导率可达94.39%,平均长根率和长芽率分别为2.31%和3.35% (图1)。再分化培养7 d 后未出现新的褐化愈伤组织,14.02%的愈伤组织开始出现绿化细胞。再分化培养14 d 后可见再分化的根和芽(图2),28 d 后愈伤组织基本停止再分化。

图1 不同Cu2+和Ag+处理下不同大麦品种的成熟胚生长差异Fig.1 Differences in the growth of mature embryos of different barley varieties under different Cu2+ and Ag+ treatments

图2 再分化进程中的成熟胚愈伤组织及其再分化幼苗Fig.2 Mature embryos calluses and their seedlings from the process of redifferentiation
3 个大麦材料(基因型)成熟胚的7 种组培特性差异(F值)均达到显著或极显著水平(表1),表型均值也存在不同程度的差异(表2)。光头大麦、北青7 号和Bowman 愈伤诱导率均较高,分别为(94.41±1.15)%、(96.91±0.52)%和(91.85±1.30)%。北青7 号成熟胚愈伤诱导率极显著高于Bowman,但光头大麦与北青7 号、Bowman 间均无显著差异。Bowman 成熟胚愈伤的再分化率极显著高于北青7 号和光头大麦,北青7 号的成熟胚再分化率极显著高于光头大麦,但3 个材料的成熟胚再分化率均较低。Bowman 成熟胚长根率和愈伤褐化率均极显著高于北青7 号和光头大麦;成熟胚长根率和愈伤褐化率在北青7 号与光头大麦间无显著差异。Bowman、北青7 号和光头大麦成熟胚的长芽率无显著差异。Bowman 与北青7 号的绿化率无显著差异,但二者均极显著高于光头大麦。北青7 号的愈伤湿质量极显著高于光头大麦,但其他材料的愈伤湿质量间无显著差异。

表1 3 个大麦材料成熟胚培养特性的方差分析Tab.1 Variance analysis of mature embryo culture characteristics of three barley materials
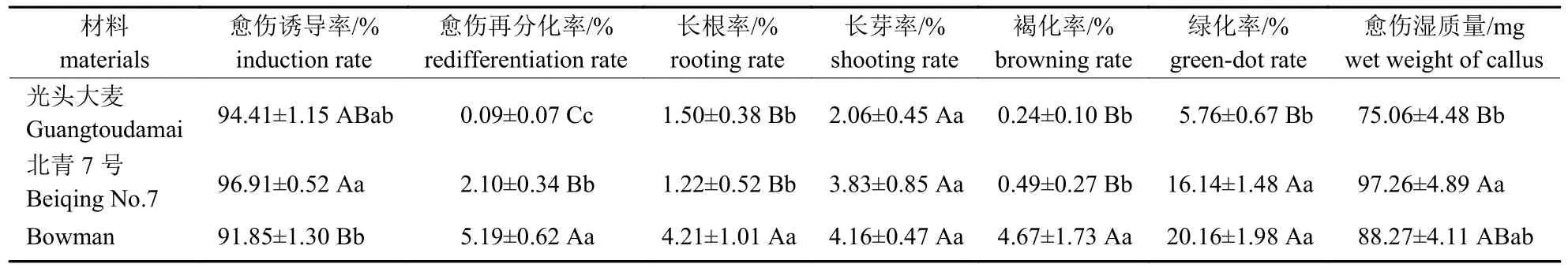
表2 3 个大麦材料成熟胚培养特性的表型均值及其差异Tab.2 Phenotypic mean and difference of mature embryos culture characteristics of three barley materials
2.2 Cu2+对大麦成熟胚培养特性的影响
不同质量浓度Cu2+处理下,愈伤诱导率和再分化率的差异未达到显著水平,但长根率、长芽率、愈伤湿质量等5 种组培特性的差异均达到显著或极显著水平(表3)。多重比较结果(表4)表明:不同Cu2+质量浓度处理间的长根率无显著差异,但均极显著低于对照。0.75 mg/L Cu2+处理的长芽率均极显著低于其他处理,对照的长芽率极显著高于1.25 和1.75 mg/L Cu2+处理,其余处理的长芽率无显著差异。对照的褐化率与1.75 mg/L Cu2+处理的褐化率无显著差异,但极显著高于其他Cu2+处理;4 种Cu2+处理的褐化率也无显著差异。2.25 mg/L Cu2+处理的绿化率极显著低于其他处理,其余处理间的绿化率无显著差异。对照的愈伤湿质量极显著高于2.25 mg/L Cu2+处理,1.25 mg/L Cu2+处理的愈伤湿质量极显著高于0.75 和2.25 mg/L 处理,但其他处理的愈伤湿质量无显著差异。与对照相比,0.75 mg/L Cu2+可减少10.43%的大麦成熟胚长根、7.48%的大麦成熟胚长芽、8.24%的愈伤组织褐化、20.74 mg的愈伤湿质量,且不会有效抑制愈伤组织转绿、增殖和再分化。
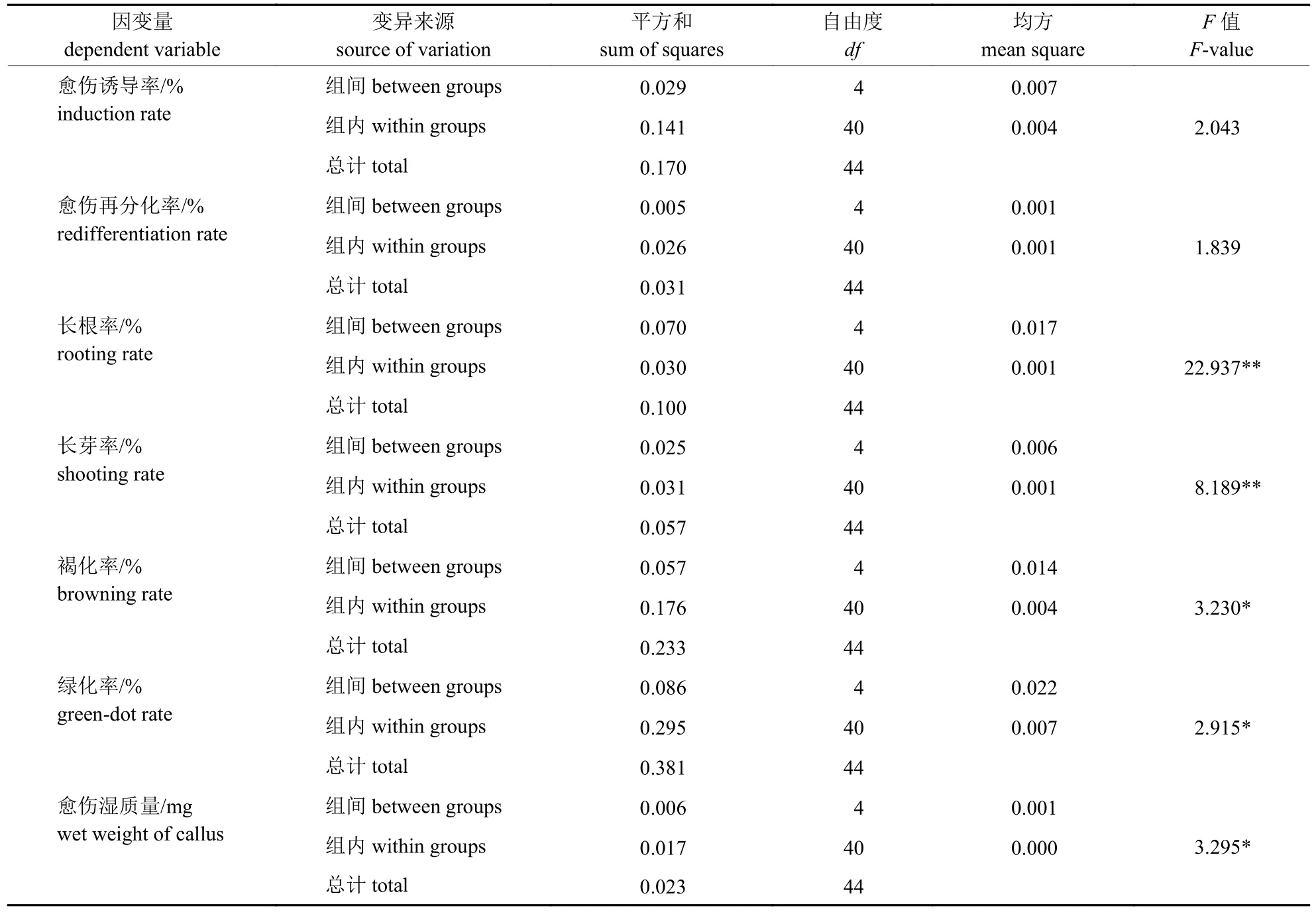
表3 不同质量浓度Cu2+ 处理下大麦成熟胚培养特性的方差分析Tab.3 Variance analysis of the culture characteristics of barley mature embryos under different mass concentrations of Cu2+ treatments
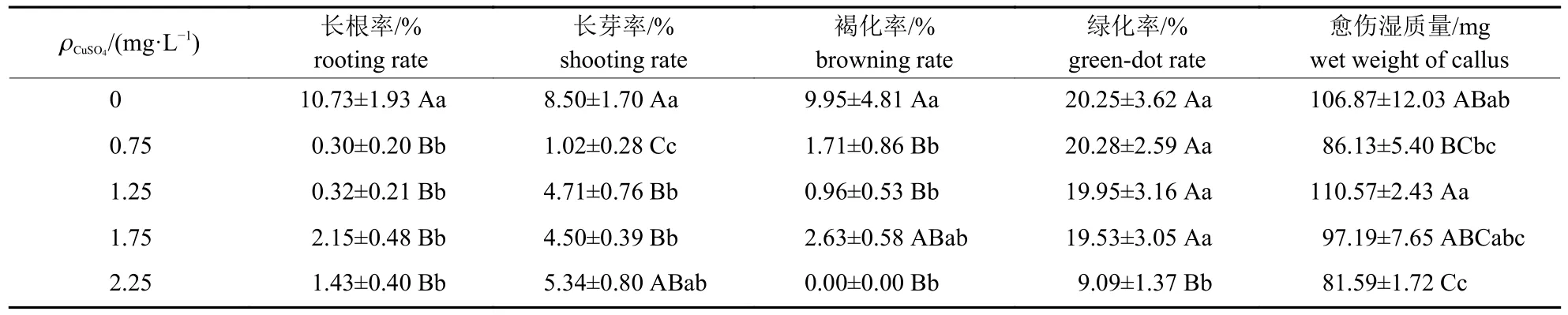
表4 不同Cu2+质量浓度处理下大麦成熟胚培养特性的表型均值及其差异Tab.4 Phenotype mean and difference of the culture characteristics of barley mature embryos under different mass concentrations of Cu2+ treatments
2.3 Ag+对大麦成熟胚培养特性的影响
不同Ag+处理下,再分化率的F值未达到显著水平,其余6 种培养特性的F值均达到极显著水平(表5)。多重比较结果(表6)表明:不同Ag+处理的愈伤诱导率、长根率、长芽率等6 种培养特性存在不同程度差异。4.00 mg/L Ag+处理的愈伤诱导率极显著高于对照、6.00 和8.00 mg/L Ag+处理,但与2.00 mg/L Ag+处理无显著差异。虽然2.00 mg/L Ag+处理的愈伤诱导率与对照也无显著差异,但极显著高于6.00 和 8.00 mg/L Ag+处理。对照的长根率、长芽率和褐化率均极显著高于其他处理,且其他处理间无显著差异。对照的绿化率与4.00 mg/L Ag+处理的绿化率无显著差异,但极显著高于其他处理;4.00 mg/L Ag+处理的绿化率也极显著高于8.00 mg/L Ag+处理;其余处理的绿化率无显著差异。对照、2.00 和4.00 mg/L 处理间的愈伤湿质量无显著差异,但均极显著高于6.00 和8.00 mg/L Ag+处理,6.00 和8.00 mg/L Ag+处理的愈伤湿质量无显著差异。与对照相比,4.00 mg/L Ag+可有效提高6.47%的愈伤诱导率,降低9.08%的成熟胚长根率、7.96%的长芽率和9.67%的愈伤组织褐化,且不会有效抑制愈伤组织转绿、再分化和愈伤湿质量。
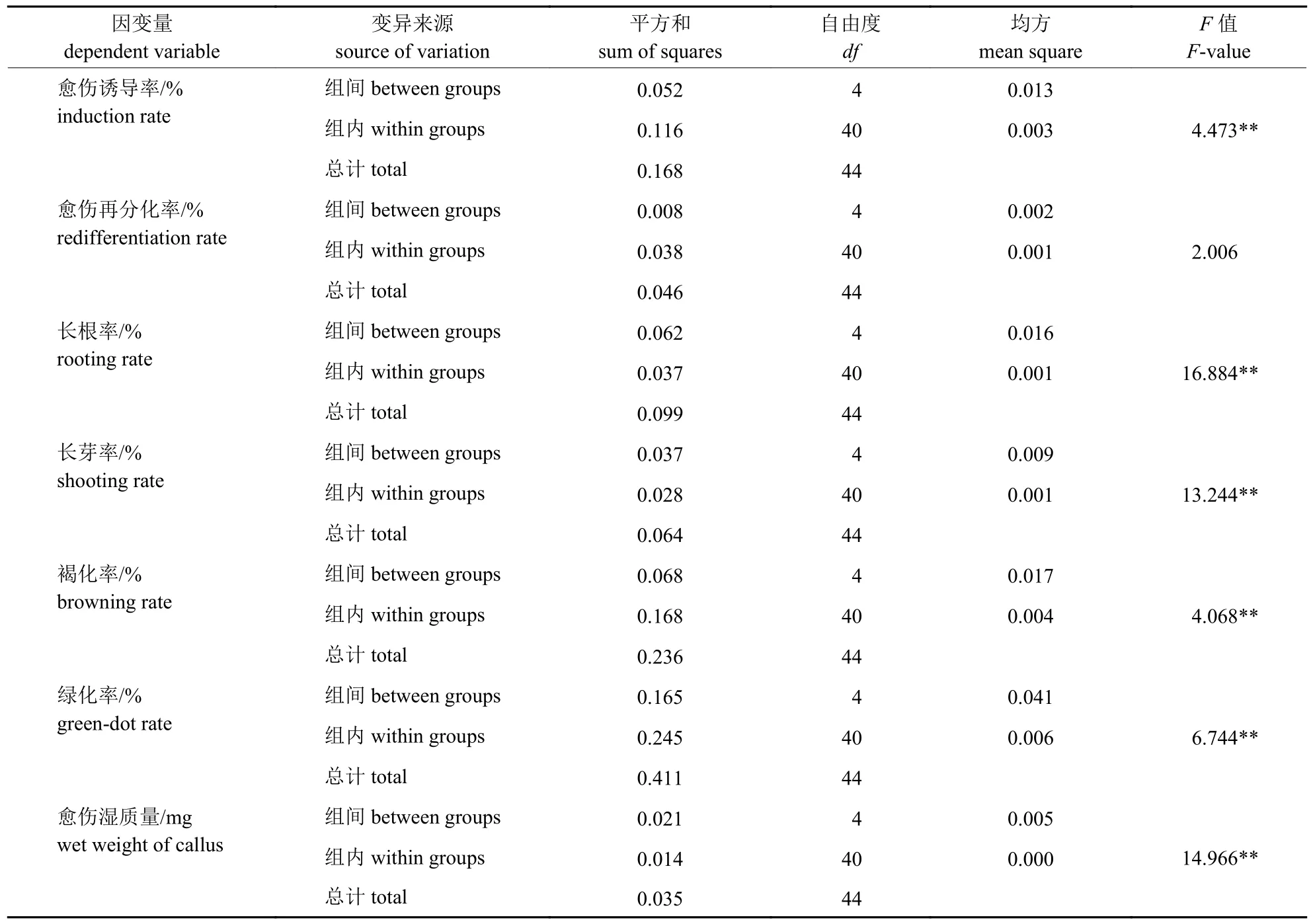
表5 不同Ag+质量浓度处理下大麦成熟胚培养特性的方差分析Tab.5 Variance analysis of the culture characteristics of barley mature embryos under different mass concentrations of Ag+ treatments
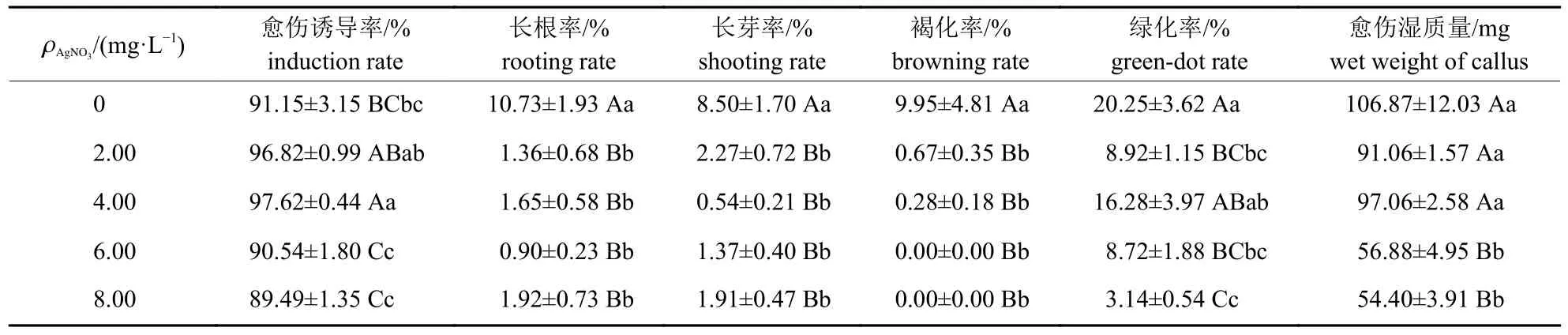
表6 不同Ag+质量浓度处理的大麦成熟胚培养特性的表型均值及其差异Tab.6 Phenotype mean and difference of the culture characteristics of barley mature embryos under different mass concentrations of Ag+ treatments
3 讨论
3.1 3 个大麦品种成熟胚组培特性的基因型差异
虽然3 个大麦品种的棱型、皮裸性、生态型等基本特性存在差异,但在成熟胚培养进程中均出现成熟胚长根、长芽、愈伤组织褐化等共有特性。3 个大麦品种的成熟胚组织培特性存在不同程度差异,其中北青7 号成熟胚的愈伤诱导率极显著高于Bowman;Bowman 成熟胚的长根率和愈伤褐化率均极显著高于北青7 号和光头大麦。由于成熟胚的生理状态、切割方法、培养条件等外部条件基本一致,因此基因型差异可能是导致试验材料成熟胚组培特性存在差异的主要原因。
3.2 Cu2+对组培特性的影响
作为生命活动的必需元素,Cu2+可参与多种代谢反应调控,进而调节植物生长、发育和器官发生。研究发现:0.5~10.0 μmol/L Cu2+可显著提高小麦[13-14]、大麦[15]和高粱[16]愈伤组织的再分化率,促进愈伤组织长根和长芽。在植物细胞中,多酚和络氨酸均可被多酚氧化酶催化,产生醌类物质,而醌类物质积累及其与蛋白和氨基酸的聚合均可导致愈伤组织褐化[17]。已有研究表明:浓度小于3.0 mmol/L 的Cu2+可有效抑制马铃薯、苹果、甘薯和西红柿的多酚氧化酶活性[18-19]。因此,在植物组织培养过程中,大麦成熟胚愈伤的褐化率降低可能是多酚氧化酶活性被Cu2+有效抑制后细胞中醌类物质减少所致。另外,Cu2+是电子传递、蛋白质和碳水化合物生物合成等代谢途径中许多重要酶的组分或激活剂,这些酶(如酯酶和谷氨酸脱氢酶[20-21])可能在愈伤组织再分化过程中起重要作用。
本研究表明:添加0.75~1.25 mg/L Cu2+能显著降低大麦成熟胚愈伤组织诱导和再生过程中褐化率并改善愈伤组织生长状态。在未添加Cu2+的对照中,培养出的愈伤组织长根率、长芽率和褐化率较高,愈伤组织柔软、泛白,愈伤组织的再分化率较低。因此,对大麦成熟胚愈伤组织进行诱导时,宜添加Cu2+进行优化,可以提高遗传转化过程中的再生效率。
3.3 Ag+对组培特性的影响
在植物组织培养中,Ag+具有多种功能,如促进体细胞胚发生以及防止愈伤组织褐化与玻璃化,过量Ag+也会导致细胞机能损坏,破坏蛋白质结构和功能[22-23]。AgNO3作为一种乙烯抑制剂,能有效抑制乙烯合成、缓解植物愈伤组织褐变并促使愈伤组织转化为胚状体[22,24]。有研究证明乙烯会抑制植物器官的发生,而多胺的作用刚好与之相反。培养基中添加Ag+可有效阻止乙烯干扰多胺的合成,从而提高精氨酸脱羧酶的活性,间接促进多胺的合成积累,提高植物愈伤组织的分化率[9-10]。已有研究表明:1.5~4.0 mg/L AgNO3可提高玉米[25]、大麦[11]、甘蓝[26]和大白菜[27-28]愈伤组织的再分化率,但10 μmol/L AgNO3会抑制啤酒花愈伤组织根的分化[29]。低浓度AgNO3能促进白菜[28]、非洲菊[30]和花生[31]愈伤组织形成不定芽,但AgNO3浓度过高时则会发生抑制作用,这可能与Ag+毒性有关。
本研究表明:添加2.00~4.00 mg/L AgNO3后愈伤组织的褐化率较低,色泽偏淡黄、质地紧密,适合作为遗传转化材料;但当Ag+质量浓度大于4.00 mg/L 时,愈伤湿质量显著下降,愈伤生长缓慢,愈伤组织较小。因此,在大麦成熟胚培养中宜采用质量浓度相对较低的AgNO3,以缓解愈伤褐化,提高其再分化率。
4 结论
0.75 mg/L Cu2+虽不能有效促进愈伤增殖、提高愈伤诱导率和愈伤组织转绿,但可有效抑制大麦成熟胚长根、长芽和愈伤褐化;与0.75 mg/L Cu2+处理相比,2.25 mg/L Cu2+可更有效地抑制愈伤褐化,但对成熟胚长根和长芽的抑制效果相对较差,且会有效降低愈伤绿化率;1.25 mg/L Cu2+可有效促进愈伤增殖,但对成熟胚长芽的抑制效果相对较差。2.00 和4.00 mg/L Ag+可有效促进愈伤诱导率,抑制成熟胚长根、长芽和愈伤组织褐化,但2.00 mg/L Ag+会显著降低愈伤组织的绿化率。由于Ag+和Cu2+质量浓度过高对植物具有毒害,因此,在大麦成熟胚的愈伤诱导和再分化培养过程中,添加0.75 mg/L Cu2+和4.00 mg/L Ag+较为适宜。

