羧甲司坦微囊的制备工艺优选
颜元 刘傲 杨成 刘丽娜 王磊 黄静
(贵州医科大学药学院,贵州 贵阳 550025)
羧甲司坦是一种常用的黏液溶解药物,其可通过影响支气管腺体的分泌,促进低黏度的唾液酸黏蛋白分泌,抑制高黏度的岩藻黏蛋白产生,从而降低痰液的黏稠度[1]。此外羧甲司坦可以减少炎症细胞向气道的募集,减轻呼吸道内皮细胞损伤和相关的咳嗽敏感性[2],也可通过降低了Muc5ac和Muc5b的分泌,恢复Muc5b蛋白水平,从而改善患者肺功能,减轻炎症反应[3]。目前羧甲司坦被广泛用于以痰黏液分泌过多为特征的急性和慢性呼吸系统疾病[4],在降低呼吸系统疾病患者咳嗽发作频率、预防疾病进展和改善生活质量方面扮演着重要角色[5]。然而,由于羧甲司坦半衰期较短,当前市售的剂型均需要一天多次给药,极大降低了患者的依从性和顺应性[6]。因此将羧甲司坦制成缓释剂型可减少患者服药次数,提高患者顺应性,同时也能使其在体内缓慢平稳的释放,保持血药浓度平稳,避免出现峰谷现象,降低毒副作用及程度,从而提高患者临床用药的安全性。课题组前期对羧甲司坦缓释片进行了相关研究[7-8],基于此拟将羧甲司坦通过复凝聚法制成微囊,以载药量及包封率为评价指标,以确定羧甲司坦微囊的最佳制备工艺,以期改善当前市售羧甲司坦剂型的一系列临床应用问题。
1 材料与方法
1.1 材料
1.1.1 实验仪器生物显微镜(重庆奥特光学仪器有限公司,型号:B302)、电子分析天平(梅特勒—托利多仪器上海有限公司,型号:EL204,感量:0.01 g)、恒温水浴锅(常州澳华仪器有限公司,型号:HH-2)、紫外可见分光光度计[岛津仪器(苏州)有限公司,型号:UV-2700]、粒径分析仪(北京中慧天诚科技有限公司,型号:Zh5203)。
1.1.2 试验用药羧甲司坦(湖北健文生物医药有限公司,批号:20191130)、明胶(天津市科密欧化学试剂有限公司,批号:20201127)、阿拉伯胶(天津市科密欧化学试剂有限公司,批号:20190507)、5%醋酸(上海申博化工有限公司,批号:1406101)、甲醛(重庆江川化工集团有限公司,批号:20180315)、磷酸氢二钠(北京红星化工厂,批号:20200710)、磷酸二氢钠(北京红星化工厂,批号:20200616)等。
1.2 方法
1.2.1 处方的确定基于参考文献[9-12],采用复凝聚法制备羧甲司坦微囊,确定处方为羧甲司坦1.0 g、明胶1.0 g、阿拉伯胶1.0 g、5%醋酸、蒸馏水、甲醛及Schiff试剂适量。
1.2.2 溶液的配制明胶溶液的配制:称取明胶1.0 g,用适量水浸泡至溶解(必要时加热),加水至30 mL,搅匀,50℃保温备用。阿拉伯胶溶液的配制:于烧杯中加入适量的水,称取阿拉伯胶粉末1.0 g撒于液面,待粉末润湿下沉后,搅拌溶解,加水至30 mL,搅匀,50℃保温备用。
1.2.3 制备工艺操作方法称取羧甲司坦1.0 g于研钵中研磨10 min,再加入配制的阿拉伯胶溶液研磨至显微镜下观察无较大的晶体后,转移至烧杯;于40 ℃水浴恒温持续搅拌并缓慢倒入配制的明胶溶液,醋酸溶液调节pH为4.0,于显微镜下观察成囊后,加入40 ℃蒸馏水80 mL进行稀释凝聚成囊;将上述成囊物置于10 ℃以下的冰浴中,磷酸氢二钠调节溶液pH至9~11,加入甲醛2.0 mL继续搅拌2.0 h进行固化;静置待微囊沉降完全,去除清液,过滤,水洗至无醛味并用Schiff试剂检查至不显色;100 ℃干燥2.5 h,即得。
1.2.4 载药量及包封率(1)微囊含药量:精密称取自制羧甲司坦微囊0.1 g于研钵中研细后,加入到20 mL pH为6.6的磷酸盐缓冲溶液中,于90 ℃水浴加热;充分搅拌20 min使微囊完全破坏(镜检已无微囊存在),过滤,取1.0 mL滤液及2%茚三酮1.0 mL于25 mL容量瓶中,pH 6.6磷酸盐缓冲液定容至刻度,摇匀;水浴加热20 min后迅速置于冰水浴中放至室温;以pH 6.6磷酸盐缓冲溶液为空白,在波长567 nm处测定吸光度A,根据回归方程A=0.0224c-0.5804,R2=0.999计算C(g/mL)。(2)介质总药量:精密量取0.5 mL介质以及1.0 mL 2%茚三酮显色剂于25 mL容量瓶中,用pH 6.6磷酸盐缓冲液,定容至刻度,并充分摇匀;水浴加热20 min后迅速置于冰水浴中放至室温;以pH 6.6磷酸盐缓冲溶液为空白,在波长567 nm处测定吸光度A,根据回归方程A=0.0224c-0.5804,R2=0.999计算C (g/mL)。(3)载药量及包封率计算:包封率(E)=微囊中药物含量/微囊和介质总药量×100%;载药量(L)=微囊中含药量/微囊总重量×100%;载药量及包封率权重系数均为0.5,得到评价指标(H)的计算公式:H=(E×0.5+L×0.5) (H值越大,工艺水平越佳)。
1.2.5 单因素考察实验按1.2.1及1.2.3的处方和制备工艺,控制其他因素不变,以载药量及包封率为考察指标,对影响微囊质量的主要因素包括明胶及阿拉伯胶和羧甲司坦比例、成囊温度、搅拌速度、pH值及固化剂添加量进行考察,筛选较优的工艺处方。
2 结 果
2.1 单因素考察实验结果
2.1.1 囊芯与囊材比例考察结果随着明胶、阿拉伯胶及羧甲司坦比例的增高,羧甲司坦微囊的载药量及包封率逐渐变大。根据H值的大小选择羧甲司坦微囊制备的囊心囊材比例为1∶1∶1.5。见表1。

表1 不同比例囊芯与囊材制备微囊的结果(%)
2.1.2 成囊温度的影响考察结果随着成囊温度的增高,羧甲司坦微囊的载药量及包封率逐渐变小,其中35 ℃及40 ℃结果差异不大,但通过显微镜观察发现35 ℃条件下,羧甲司坦微囊较40 ℃成囊效果好,且其包封率及载药量略高。根据H值的大小故选择羧甲司坦微囊制备的成囊温度为35 ℃。见表2。
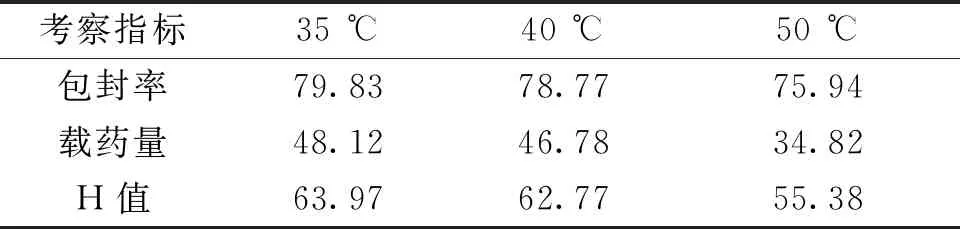
表2 不同成囊温度制备微囊的结果(%)
2.1.3 搅拌速度考察结果搅拌速度为600 r/min时,羧甲司坦微囊的载药量及包封率最高。根据H值的大小故选择羧甲司坦微囊制备的搅拌速度为600 r/min。见表3。

表3 不同搅拌速度制备微囊的结果(%)
2.1.4 pH值考察结果当pH值为5.0时,不能形成微囊,相较于pH值4.0,pH值3.0条件下所制备的羧甲司坦微囊无论其载药量及包封率还是H值均较高,因此选择羧甲司坦微囊制备的pH值为3.0。见表4。

表4 不同pH值制备微囊的结果(%)
2.1.5 固化剂添加考察结果不用固化剂剂量下羧甲司坦微囊的包封率无明显差异,但随着固化剂用量增加其载药量及H值呈下降趋势,以固化剂剂量为2.0 mL时最佳。见表5。
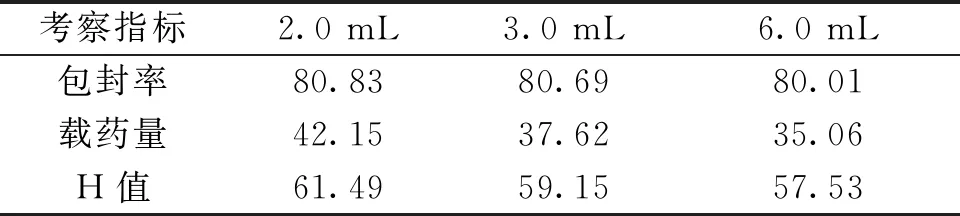
表5 不同固化剂用量制备微囊的结果(%)
2.2 制备工艺的确定根据单因素考察实验所得结果,以包封率及载药量作为评价指标,筛选出羧甲司坦微囊的最优制备工艺,并进行三个批次的验证试验。根据上述单因素实验结果,优选并确定羧甲司坦微囊的制备工艺为:明胶、阿拉伯胶及羧甲司坦比例1∶1∶1.5,成囊温度35 ℃,搅拌速度600 r/min,pH值3.0,固化剂用量2.0 mL。最终确定优化制备工艺为:取羧甲司坦1.0 g于研钵中研磨10 min左右,再加入阿拉伯胶溶液研磨至显微镜下观察无较大的晶体后,转移至烧杯;于35 ℃水浴恒温持续搅拌并缓慢倒入明胶溶液,滴加醋酸溶液至pH约为3.0;于显微镜下观察成囊后,加入35 ℃蒸馏水80 mL进行稀释凝聚成囊;将烧杯取出水浴,并置于10 ℃以下冰浴中,加入甲醛2.0 mL继续搅拌2.0 h进行固化;静置待微囊沉降完全,倾去上清液,将微囊过滤,用水洗至无醛味并用Schiff试剂检查至不显色;通过鼓风干燥机在100 ℃下干燥2.5 h,即得。
2.3 药剂学表征评价
2.3.1 微囊的囊形与粒径根据2.2确定的制备工艺制备羧甲司坦微囊,通过显微镜观察微囊的囊形,并取固化后的含微囊的混悬液0.5 mL加蒸馏水至50 mL。以蒸馏水作为空白试剂,通过粒径分析仪初步测量其粒径大小。自制三批羧甲司坦微囊的显微镜下形态如图1所示,分三个批次制备的微囊外观形状规则,表面光滑,呈类圆形,包封情况良好,均匀度较好。初步测得其粒径为5~25 μm,符合实验要求。
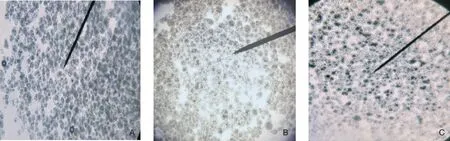
注:A.第一批(批号:20211225);B.第二批(批号:20220108);C.第三批(批号:20220127)。
2.3.2 微囊的载药量及包封率采用2.2项下筛选的最佳处方及制备工艺制备羧甲司坦微囊,按照1.2.4项下的方法测定羧甲司坦微囊的载药量及包封率。自制三批羧甲司坦微囊载药量及包封率见表6。

表6 不同批次微囊的载药量及包封率结果(%)
3 讨 论
复合凝聚法制备微囊最常用的原料是明胶、阿拉伯胶,在制备微囊过程中,囊芯囊材比例、成囊温度、pH值、搅拌速度、固化剂添加量对微囊制备的影响较大[13],进行单因素考察以筛选最佳羧甲司坦微囊的制备工艺。在囊芯囊材比例考察过程中,随着囊芯与囊材比例的升高,其包封率及载药量呈上升趋势。但当明胶、阿拉伯胶及羧甲司坦比例超过1∶1∶1.5时微囊包封率则下降。在实验过程中发现,溶液酸、碱性过强时药物均易于溶解,故当pH值<3.0或>5.0时,均不能制得羧甲司坦微囊,而当pH值为3.0时所制备的羧甲司坦微囊无论其载药量、包封率还是H值均较高。
为使在囊芯周围凝聚的凝胶不再发生溶解,需要固化处理。甲醛是固化处理过程中常用的固化剂,一般进行固化处理时要控制温度为0~5 ℃并加碱调节pH为9~11的弱碱性范围,以防止交联过程中微胶囊之间的互相黏结[14]。本课题使用37%的甲醛作为固化剂,但当使用20% NaOH溶液调节溶液pH进行交联固化时,由于羧甲司坦药物在酸或碱溶液中易溶的性质,观察到原本包封于微囊中的药物溶于NaOH溶液中而形成空囊。故在进行固化过程中使用磷酸氢二钠调节溶液pH为9~11。此外,实验发现,固化剂用量对微囊的载药量会产生显著影响,当不使用甲醛溶液进行固化或甲醛用量过少时,在显微镜下可观察到形成的微囊会产生破囊复溶的现象,而随着固化剂用量的增加,尽管羧甲司坦微囊的包封率无明显差异,但其载药量及H值呈下降趋势,实验结果表明当固化剂剂量为2.0 mL时,其包封率、载药量及H值均最佳。
综上所述,本研究通过初步单因素试验考察的方法,最终确定了羧甲司坦微囊的制备工艺。优选出微囊制备的囊心囊材比例为1∶1∶1.5,成囊温度为35 ℃,搅拌速度为600 r/min,pH值为3.0,固化剂用量为2.0 mL。所制备的羧甲司坦微囊包封情况良好,外观形状规则,表面光滑呈圆形,均匀度较好。初步测得此实验方法制备的羧甲司坦微囊粒径为5~25 μm,一般质量检测符合要求。该制备工艺具有简便、稳定可靠、重现性好等优点,为进一步研究药效、释放度、生物利用度及生物等效性等指标的评价提供了实验依据。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究不涉及伦理及知情同意。

