一种绿豆柱头外露突变体的转录组分析
宋梦媛 郭中校 苏禹霏 邓昆鹏 兰天娇 程钰鑫 包淑英王桂芳 窦金光 姜泽锴 王明海,* 徐 宁,*
一种绿豆柱头外露突变体的转录组分析
宋梦媛1,2郭中校1苏禹霏1,2邓昆鹏1兰天娇1程钰鑫1包淑英1王桂芳1窦金光1姜泽锴1,2王明海1,*徐 宁1,*
1吉林省农业科学院作物资源研究所 / 作物种质资源吉林省实验室, 吉林公主岭 136100;2吉林农业大学农学院, 吉林长春 130118
柱头外露作为提高作物异交率、制种纯度和降低制种成本的优良性状, 在杂交制种中得到了广泛的利用。绿豆是一种闭花授粉的作物, 被报道的柱头外露突变体很少。通过对冀绿7号的化学诱变, 发现了1个柱头外露突变体, 为明确该突变体柱头外露的分子机制, 对该突变体及其野生型冀绿7号即将开放的花蕾进行了转录组测序(RNA-seq)分析。根据差异倍数|log2(Fold Change)|≥1,≤0.05的标准筛选, 在中共得到572个差异表达基因(differentially expressed genes, DEGs), 其中262个DEGs上调, 310个DEGs下调。在基因本体(gene ontology, GO)数据库中, 差异表达基因显著富集到代谢和生物合成等生物过程, 定位在质外体和细胞壁、细胞膜等区域, 与结合、氧化还原等分子功能有关。在京都基因与基因组百科全书(kyoto encyclopedia of genes and genome, KEGG)数据库中, 差异表达基因显著富集在植物激素信号传导、次生代谢物生物合成等通路。功能注释发现许多有关细胞壁合成和代谢、细胞分裂和细胞扩张、植物激素相关的基因, 因此推测突变体中龙骨瓣的细胞分裂、细胞扩张以及植物激素信号传导过程受到影响, 从而导致了柱头外露。本研究为今后探究绿豆柱头外露的分子机制以及该性状在绿豆杂种优势中的利用奠定了基础。
绿豆; 柱头外露; 突变体; 转录组; 高通量测序; 杂种优势
绿豆(L.)属于豆科(Leguminosae)蝶形花亚科(Papilionaceae)豇豆属(), 是我国主要食用豆类之一[1]。受市场价格、主产区种植结构调整、种植效益以及国家相关政策等因素的影响, 我国绿豆产业中出现了种植面积先增后减, 进口量连年增加等问题[2]。中国绿豆单产水平虽然高于印度等主产国, 但仅约为1000 kg hm-2 [3], 单产水平的提高成为发展绿豆产业亟待解决的问题。
杂种优势的利用能够极大提高农作物的产量。但绿豆花是两侧对称的蝶形花, 闭花授粉, 天然异交率极低, 限制了杂种优势的利用。柱头外露可有效提高作物异交率, 并在棉花[4]、水稻[5]、谷子[6]等植物中得到验证。柱头外露是指雌蕊柱头显著伸出花蕾, 难以接受自身花粉的一种性状, 该性状的应用可免去在杂交制种中去雄工作, 提高制种效率, 降低制种成本, 有利于杂种优势的利用。目前绿豆中已被报道的柱头外露突变体仅有[7],于γ射线照射后产生的苏绿1号突变体库中选出, 具有起皱的花瓣和外露的柱头, 但花药仍封闭在龙骨瓣内部, 柱头与花药分离, 阻断了绿豆的自交过程。相对于其他作物而言, 绿豆柱头外露突变体较少, 因此挖掘更多的柱头外露突变体并探究其分子机制至关重要。
柱头外露通常是由于花器官之间的相对长度差异造成的, 该性状可受到温度[8]、植物激素[9]、转录因子[10]等因素的调控。目前, 转录组测序(RNA- seq)[11]已被应用于多种植物中探究柱头外露的遗传基础和分子机制。Riccini等[11]利用RNA-seq技术分析了番茄柱头外露植株中的差异表达基因, 并找到了可能参与控制柱头位置的新候选基因, 其与细胞扩张、植物激素调节等功能有关。Pan等[12]利用转录组测序技术在热胁迫条件下番茄双细胞花粉期的雄蕊和雌蕊中分别鉴定出69个和30个热应答miRNA, 其中一些miRNA及其预测靶标在植物信号传导、花发育和细胞分裂和细胞扩张中起关键作用, 这些miRNA的发现有助于阐明高温诱导柱头外露的分子机制。
本研究中, 吉林省农业科学院在经过化学诱变的绿豆品种冀绿7号中发现了1个柱头外露突变体(), 由于这是绿豆中被报道的第2个柱头外露突变体, 暂命名为。该突变体植株自小花蕾时期开始, 柱头便伸出花外, 柱头与雄蕊分离, 导致自身花粉无法落在柱头上, 从而出现瘪荚、不结实的现象。为探究植株柱头外露的分子机制, 利用该突变体及其野生型材料冀绿7号开花前1 d的花蕾进行转录组测序(RNA-seq), 通过比较分析两者的差异表达基因和代谢通路, 揭示绿豆柱头外露的分子机制, 为该性状在绿豆杂种优势中的利用奠定基础。
1 材料与方法
1.1 试验材料
绿豆柱头外露突变体() (图1-A)及其野生型品种冀绿7号(WT) (图1-B)种植于吉林省农业科学院公主岭实验基地, 均种植10垄, 垄长5.0 m, 垄距0.6 m, 株距14.0 cm, 均进行正常的田间管理。

图1 柱头外露突变体se2和冀绿7号(WT)花蕾的表型比较
A: 柱头外露突变体; B: 冀绿7号(WT)。A: stigma exsertion mutant; B: Jilyu 7 (WT).
1.2 RNA提取、文库构建与测序
在盛花期, 选取冀绿7号开花前1 d的花蕾及开花前1 d且柱头外露花蕾用于转录组测序, 3次重复(分别命名为WT1、WT2、WT3, SE2_1、SE2_2、SE2_3), 每次重复随机选取3株, 每株随机选取花蕾3朵, 用液氮速冻, 并于–80℃保存备用。采用TIANGEN RNAprep Pure Plant Plus Kit (Polysaccharides & Polyphenolics-rich)试剂盒提取叶片总RNA, 利用Agilent 2100 bioanalyzer精确检测RNA完整性, 通过Oligo(dT)磁珠富集带有polyA尾的mRNA, 采用离子打断的方式, 将mRNA打断到250~300 bp的片段, 以此构建mRNA文库。基于Illumina NovaSeq 6000平台进行双末端测序。总RNA提取及质量检测、cDNA文库构建以及测序均委托北京诺禾致源科技股份有限公司完成。
1.3 生物信息学分析
对原始下机数据(raw data)进行过滤, 去除接头及低质量reads后, 使用HISAT2软件(https://www. osc.edu/resources/available_software/software_list/hisat2)将获得的高质量reads比对到绿豆品种冀绿7号的参考基因组(https://doi.org/10.6084/m9.figshare. 19583446)[13]。根据比对结果, 统计每个基因从起始到终止范围内覆盖的reads数, 采用FPKM方法[14]计算每个基因的表达量及WT和重复样品间的Pearson相关系数。采用DESeq2[15]软件, 对WT和间基因表达水平进行差异分析, 筛选差异表达基因(differentially expressed genes, DEGs)的标准为: 表达差异倍数|log2(Fold Change) |≥1,≤0.05。为进一步分析DEGs的生物学功能和代谢途径, 基于超几何分布原理进行GO富集分析和KEGG通路分析。
1.4 差异表达基因的qRT-PCR验证
随机挑选5个差异表达基因并采用qRT-PCR方法验证其表达水平。每个基因进行3次生物学重复,使用Primer Premier 6软件设计合成引物(表1), 并采用作为内参基因。用HiScript 1st Strand cDNA Synthesis Kit对所提取的RNA进行反转录合成mRNA, 并采用SYBR Green法qRT-PCR体系(10 μL): 5 μL 2×SYBR Green Mix, 2 μL cDNA, 正反向引物各0.5 μL (10 μmol L–1), 2 μL ddH2O进行反应。qRT-PCR反应条件为: 95℃预变形5 min, 循环1次; 95℃变性10 s, 60℃退火25 s, 40次循环, 随后进行溶解曲线采集, 并用2–DDCt法定量分析基因的相对表达水平。
2 结果与分析
2.1 转录组测序结果评估和结果统计
Illumina测序结果(表2)显示6个样品质控后共获得270,449,698个clean reads。各样品中clean reads的碱基质量值Q20均高于97%, Q30均高于94%, 表明该样品碱基识别准确性较高, 测序结果质量良好。将clean reads比对到参考基因组上, 比对率均在96.5%以上。同时各个样本间的基因表达量相近(图2-A), 组内和组间3次样本重复的相关性系数均在0.93以上(图2-B), 说明本次测序结果可靠, 样本选择合理, 满足后续分析的要求。
2.2 差异表达基因筛选
利用DESeq2软件以差异倍数|log2(Fold Change)|≥1、≤0.05的标准筛选差异表达基因, 柱头外露突变体和冀绿7号之间有572个差异表达基因(DEGs), 其中262个DEGs上调, 310个DEGs下调, 下调基因数量高于上调基因数量(图3)。
2.3 qRT-PCR验证
为验证转录组数据的可靠性, 随机选取5个差异表达基因进行qRT-PCR验证, 比较这些基因在WT和中的表达水平。结果表明, 这些基因的转录组测序(RNA-seq)与实时荧光定量PCR (qRT-PCR)结果表达趋势一致(图4), 证明本次转录组数据结果可靠。

表1 qRT-PCR所用引物
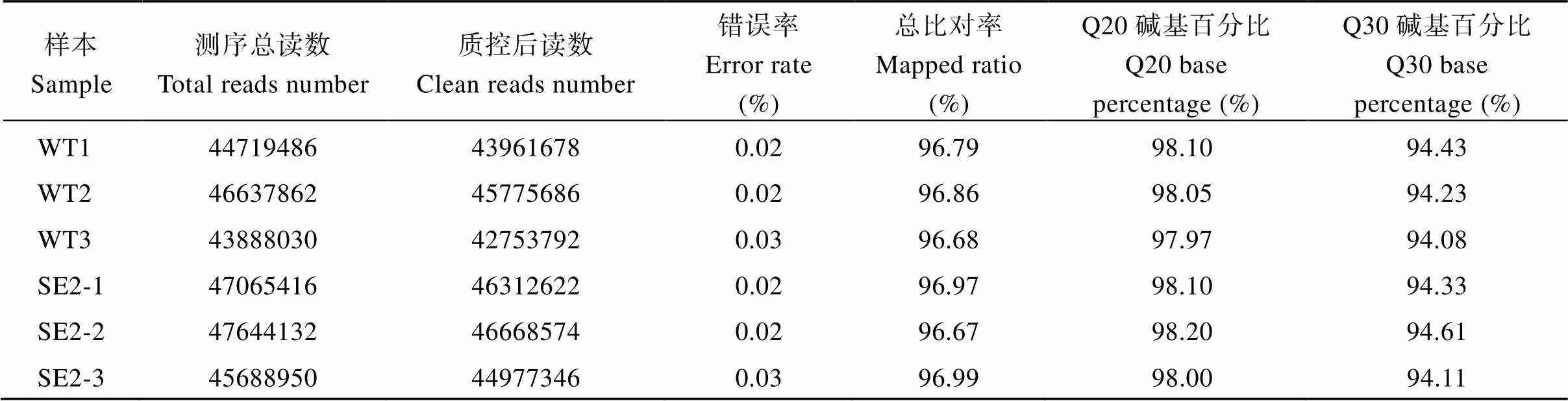
表2 转录组测序相关数据

图2 样本基因表达分布及相关性分析
A: 各样本基因表达分布; B: 样本间相关性。
A: distribution of gene expression in each sample; B: correlation heat map between samples.
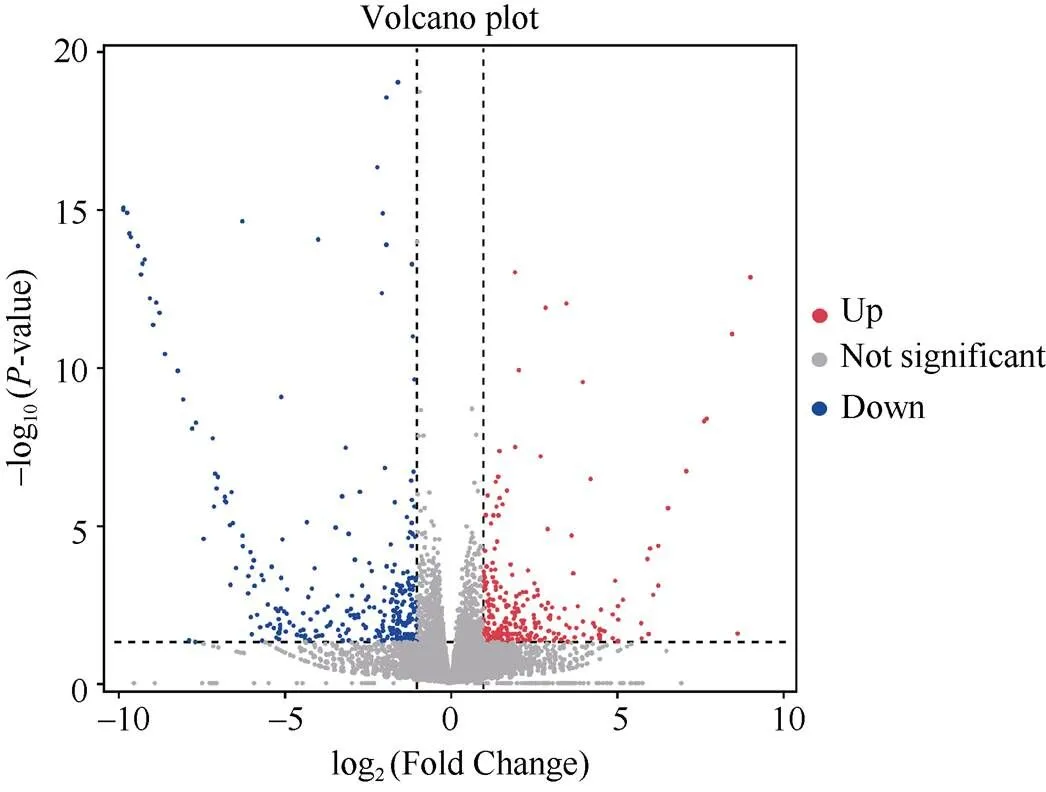
图3 差异基因火山图
Up: 上调基因; Down: 下调基因; Not significant: 无显著差异基因。
Up: up-regulated gene; Down: down-regulated gene; Not significant: not significant difference gene.
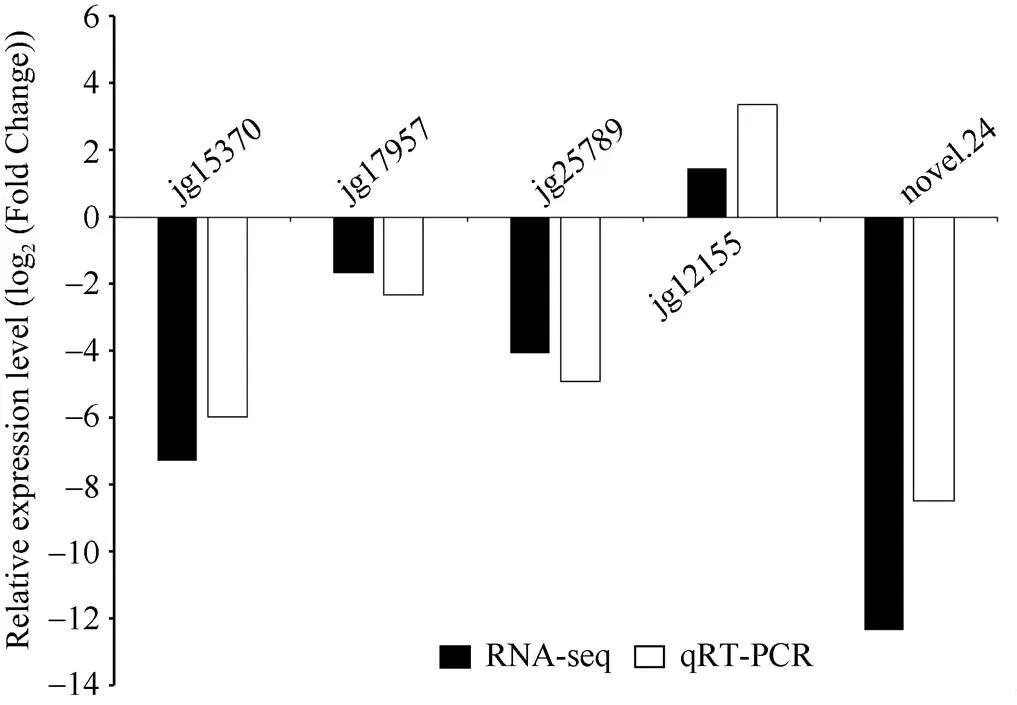
图4 se2和冀绿7号(WT)部分差异表达基因的相对表达水平
2.4 差异表达基因的GO富集分析
利用topGO对冀绿7号和的差异表达基因进行GO富集分析, 按照细胞组分(cellular component, CC)、分子功能(molecular function, MF)和生物过程(Biological process, BP)进行GO分类, 在每个GO分类中选择值最小即富集最显著的前10个条目进行展示(图5)。MF分析发现这些DEGs主要与木葡聚糖: 木葡聚糖转移酶活性、氧化还原酶活性、转录因子活性、水解酶活性等功能有关。CC分析发现DEGs显著富集在细胞外区域(extracellular region)、质外体(apoplast)、细胞壁(cell wall)和外部封装结构(external encapsulating structure)、细胞膜(membrane)中。BP分析发现, 前10个条目主要与糖代谢过程(如GO:0006073, GO:0044042)、转录代谢过程(如GO:0006355, GO:1903506)和生物合成过程(如GO:0009889, GO:0010556)有关。
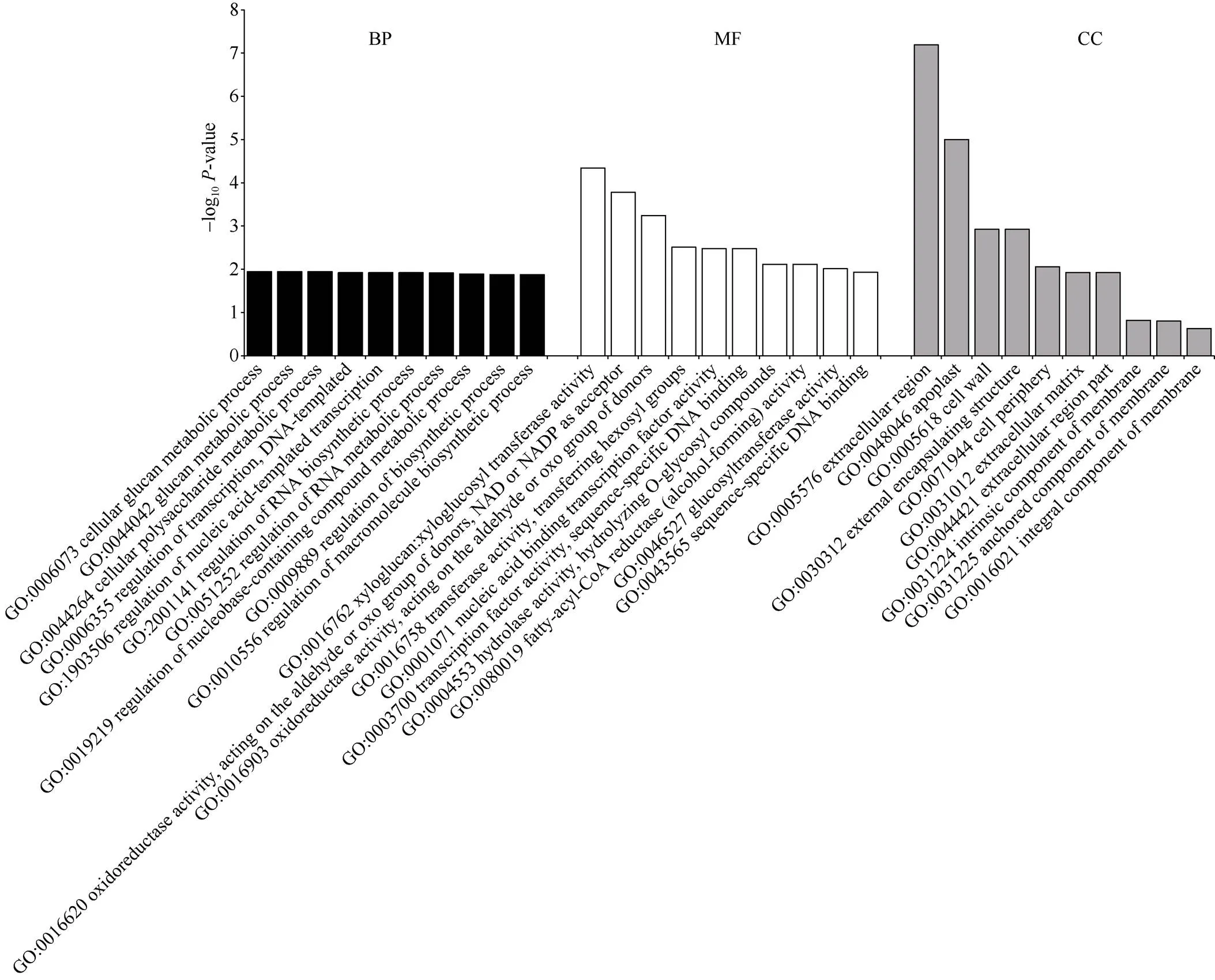
图5 se2和冀绿7号(WT)差异表达基因的GO富集分析
BP: 生物过程; MF: 分子功能; CC: 细胞组分。
BP: biological process; MF: molecular function; CC: cellular component.
2.5 差异表达基因的KEGG分析
KEGG分析结果表明572个DEGs被富集到71个代谢途径, 其中倍半萜和三萜生物合成途径(ko00909)、异喹啉生物碱生物合成途径(ko00950)、角质、木栓质和蜡质生物合成途径(ko00073)、植物激素信号传导途径(ko04075)、次生代谢物生物合成途径(ko01110)这5个KEGG通路被显著富集(图6)。植物激素信号传导途径和次生代谢物生物合成途径富集的差异表达基因数量最多, 分别为10个和35个。除植物激素信号传导通路属于环境信息处理大类外, 其他4个通路均属于代谢大类, 说明的生物代谢和信号传导受到影响。
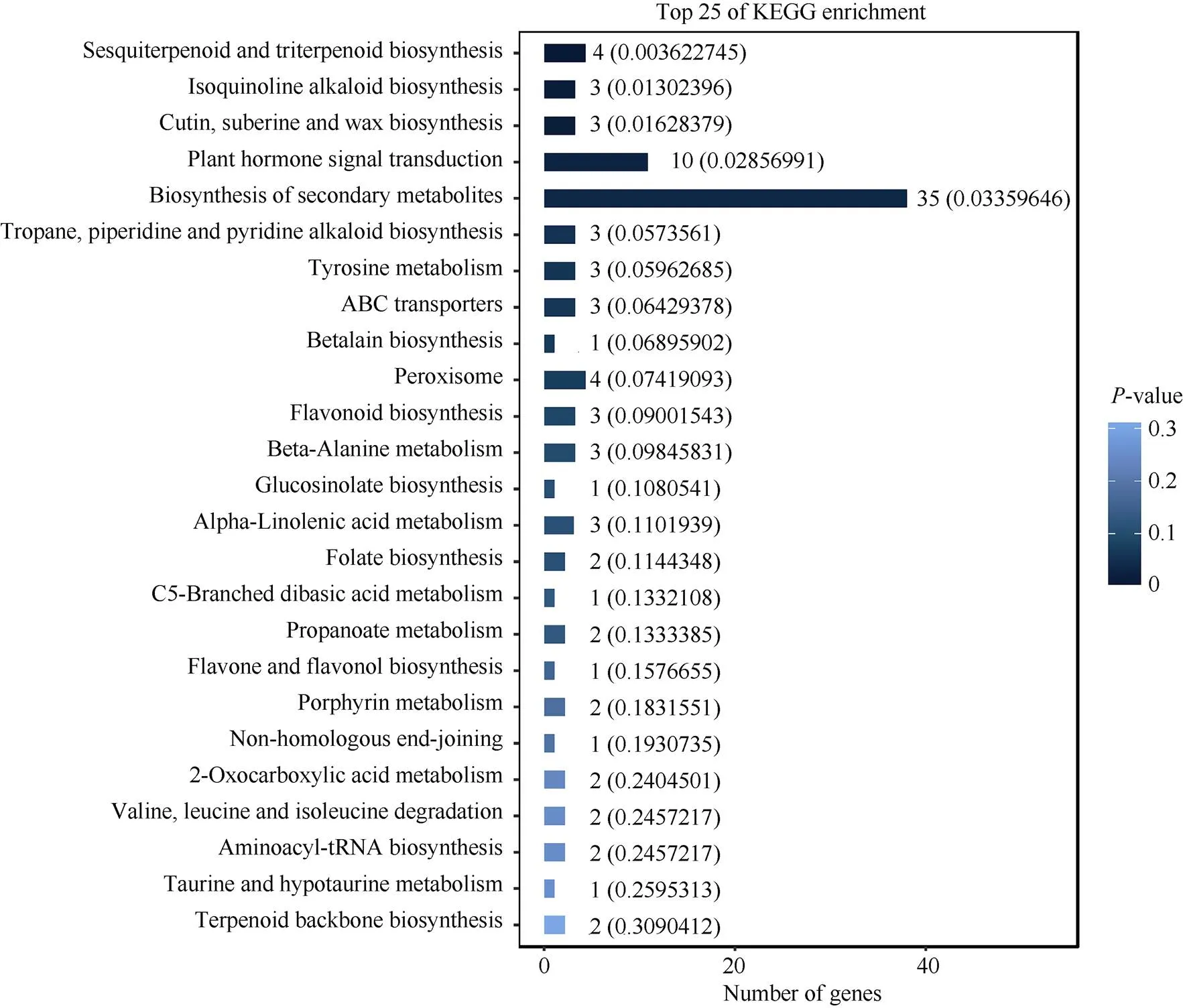
图6 se2和冀绿7号(WT)差异表达基因KEGG富集分析
2.6 柱头外露相关的差异表达基因
2.6.1 细胞分裂和细胞扩张相关的差异表达基因
在本研究中发现了48个与细胞分裂和细胞扩张相关的差异表达基因(表3)。细胞壁在细胞扩张中发挥重要作用[16]。DEGs中共有27个基因参与细胞壁的合成、代谢与修饰, 其中19个基因下调, 下调基因包括5种木葡聚糖内转糖苷酶/水解酶(、、、、)、3种参与次生细胞壁木质素合成的漆酶(、-、-)、纤维素酶、β-1,4-木糖基转移酶、富含亮氨酸重复延伸蛋白样蛋白6 ()等基因,[17]、富含亮氨酸的重复序列()[18]在细胞壁扩张中发挥着重要作用。此外,参与细胞扩张的基因、扩展蛋白()、、以及影响细胞膨压的3个基因(、、)也显著下调。在细胞分裂相关DEGs中有3个基因上调, 7个基因下调, 下调基因包括囊泡转运复合体亚基, 驱动蛋白(、), CHD3型染色质重塑因子, 肽基脯氨酰顺反异构酶(,)、丝氨酸/苏氨酸蛋白激酶样蛋白, 其中, 囊泡转运复合体在拟南芥胞质分裂中参与细胞板起动、成熟和初生细胞壁形成的细胞分泌过程[19]; 玉米中编码同源物的基因突变会导致根毛伸长受损, 发育延迟[20]。说明柱头外露突变体中花器官细胞扩张和细胞分裂这2个生理过程被影响, 这有可能导致柱头外露。
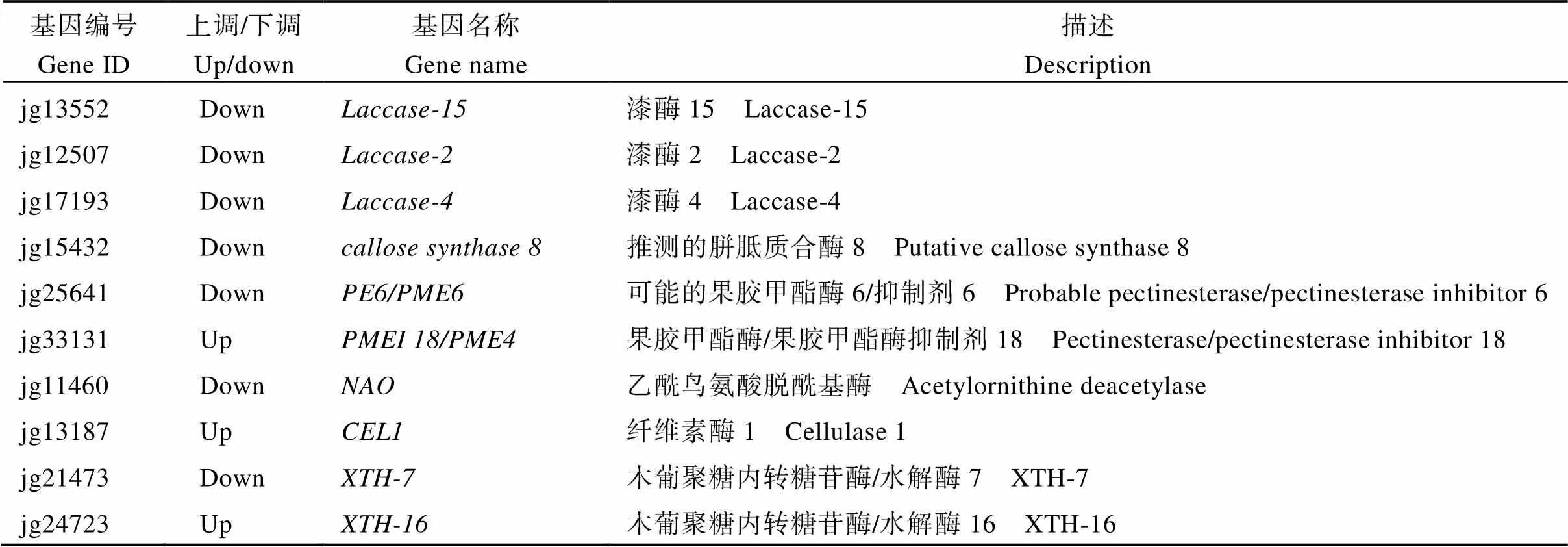
表3 细胞分裂和细胞扩张相关的差异表达基因
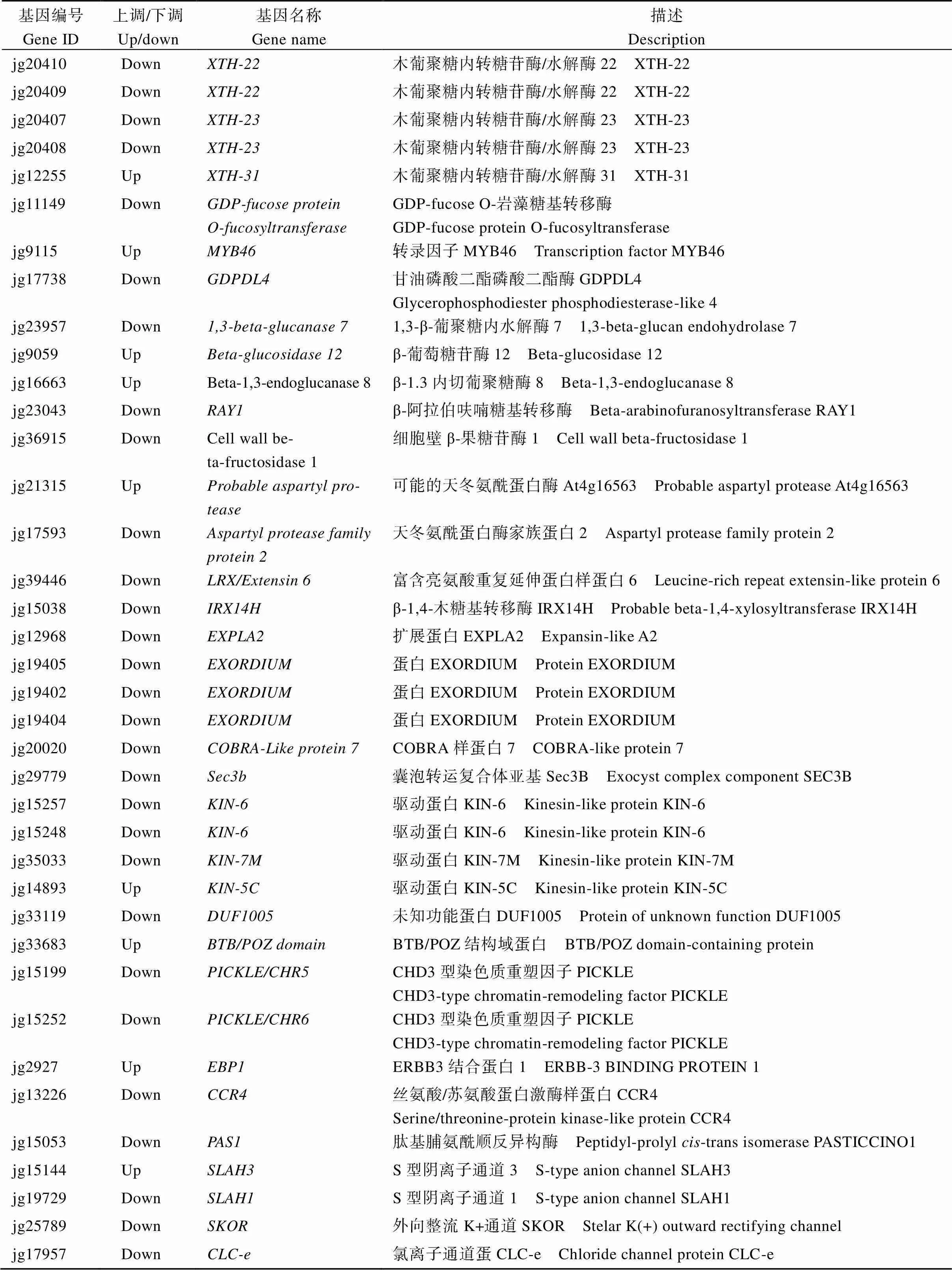
(续表3)
2.6.2 植物激素相关的差异表达基因 在差异表达基因中发现了25个植物激素相关的基因(表4)。生长素相关DEGs中, 2个生长素转运蛋白(、)下调, 1个生长素通道蛋白()和2个生长素响应蛋白(、)上调。在细胞分裂素相关DEGs中, 细胞分裂素脱氢酶6 ()下调; 2个可以激活A型反应调剂因子的双组分响应调节子、上调, 而A型双组份响应调节子下调, A型双组份调节子在细胞分裂素信号传导中起负调控作用[21]。在乙烯相关DEGs中, 1个乙烯受体()和3个乙烯响应因子(、、)上调, 2个锌指结构域应激相关蛋白()下调。此外还有4个赤霉素生物合成相关的氧化酶、HD-ZIP蛋白、-和1个参与茉莉酸生物合成的基因上调。
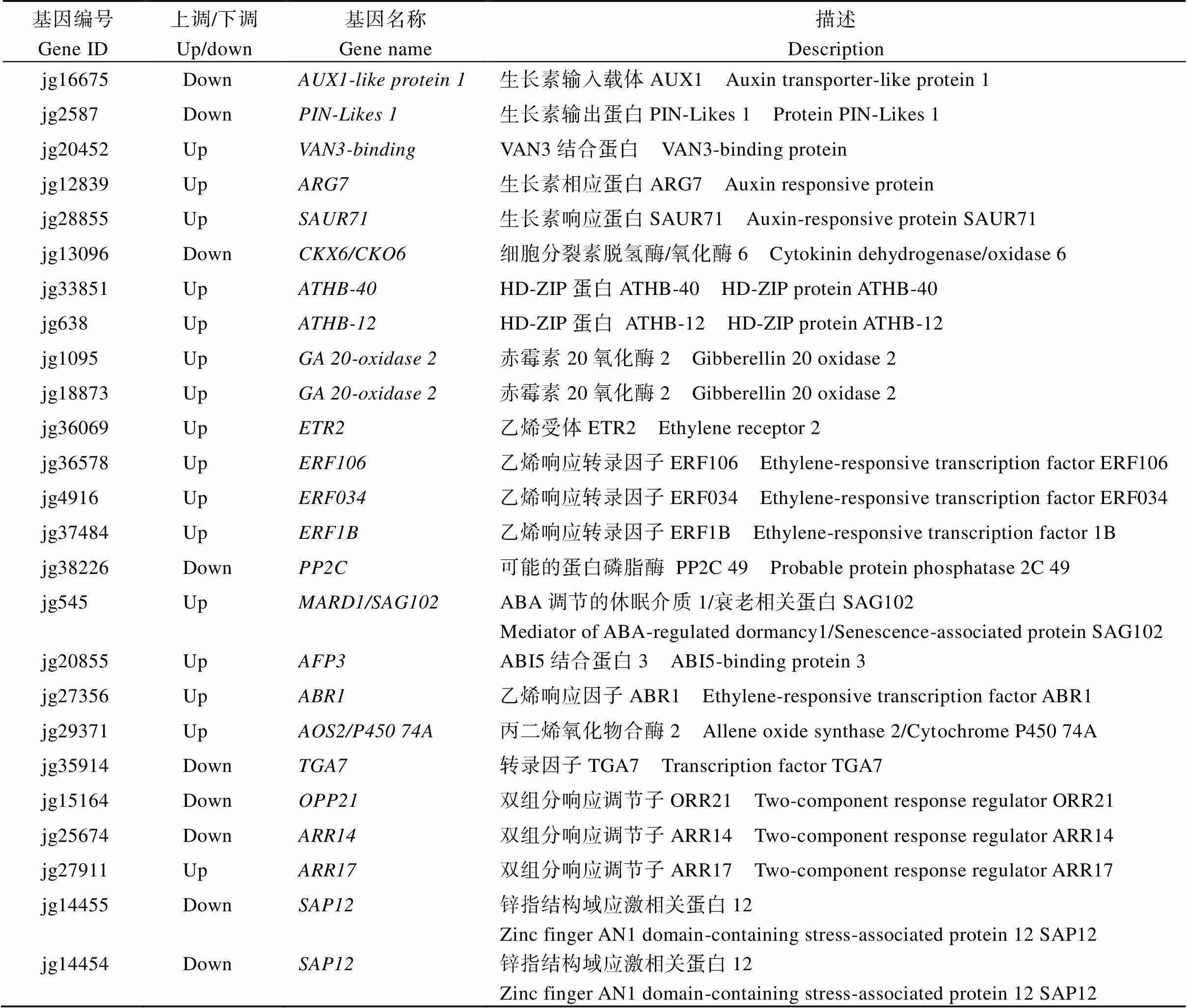
表4 植物激素相关的差异表达基因
3 讨论
绿豆是严格自花授粉作物, 花朵在开放前就已完成授粉, 天然异交率极低, 限制了杂种优势在绿豆中的应用。柱头外露植株的柱头显著高于雄蕊, 并向花器官外延伸, 是提高作物异交率和杂种优势利用率的一个重要性状。本研究中, 稳定遗传的柱头外露突变体是利用0.7% EMS诱变冀绿7号获得的, 与其野生型冀绿7号相比,开花数量增多, 花期延长, 且在小花蕾时期开始出现柱头外露现象, 其龙骨瓣长度显著减小, 雄蕊和雌蕊长度与冀绿7号无显著差异, 说明柱头外露是因为龙骨瓣显著缩短造成的(数据未发表)。为探究柱头外露的分子机制, 本研究对其进行了转录组测序分析, 筛选出572个差异表达基因(DEGs), 其中262个DEGs上调, 310个DEGs下调, 包含许多与细胞分裂、细胞扩张和植物激素相关的差异表达基因。GO分析发现这些基因显著富集在代谢等生物学过程, 质外体、细胞壁、细胞膜等细胞组分, 与结合、氧化还原等分子功能有关。KEGG分析发现这些差异表达基因富集在植物激素信号传导和次生代谢物生物合成等代谢通路, 这与Pan等[12]的研究结果一致。
植物的柱头外露通常是由于花芽发育过程中花器官之间的相对长度差异造成的。花瓣长度、花冠大小等花器官特征都有可能影响柱头外露, 这一点已在水稻[22]、番茄[23]等多个植物中被证明。花器官的生长受到复杂网络的精确调控, 其大小取决于细胞分裂和细胞扩张这2个生理过程[24]。张鋆鋆[25]和胡育玮[26]发现烟草MSK326SE材料的柱头外露与其花器官发育不同步有关, 在其花蕾发育早期细胞分裂旺盛, 导致花柱细胞总数增多、花柱变长,柱头外露; 而在花蕾发育后期花柱长度恢复正常, 但花冠表皮细胞显著变小导致花冠缩短, 柱头外露[27]。本研究中发现了13个细胞分裂相关的DEGs, 其中驱动蛋白(), 肽基脯氨酰顺反异构酶(,)、丝氨酸/苏氨酸蛋白激酶样蛋白()显著下调。参与植物发育过程中的细胞增殖和分化[28], 驱动蛋白则在稳定细胞分裂纺锤体中起重要作用[29]。属于()家族, 该家族首次在玉米中被报道, 它的突变会影响叶表皮分化, 细胞形态大小改变[30], 导致植株矮小和延迟生长[31]; 水稻中,具有促进表皮细胞分化、抑制细胞分裂和维持表皮细胞单层结构的功能[32]。以上差异表达基因可能影响了植株的细胞分裂过程, 导致了柱头外露。细胞扩张伸长发生在花器官发育后期, 细胞壁在器官生长过程中起限制细胞扩张的作用。细胞壁由纤维素、半纤维素、果胶构成, 它的增大始于细胞壁应力松弛, 降低细胞膨胀压力, 进而将水吸入细胞以增加细胞体积并恢复膨胀和细胞壁压力[33]。纤维素和其他细胞壁组分间的复杂相互作用可以通过葡聚糖内切酶、扩展蛋白等几种细胞壁酶修饰, 这几种细胞壁酶能够促进细胞壁应力松弛, 在细胞扩张和植物生长中起着重要作用。GO富集分析和差异表达基因分析发现许多与细胞壁组分和扩张相关的差异表达基因, 其中包括果胶甲酯酶()、纤维素酶1、木葡聚糖内转糖苷酶/水解酶(、)、扩展蛋白)、延伸蛋白(,)、β-1,4-木糖基转移酶、等相关基因, 这些基因均显著下调。绿豆柱头外露突变体中, 编码VrDUF1005的基因由于单个核苷酸突变引起1个氨基酸发生变化, 影响了绿豆发育后期的花瓣细胞分裂和花柱细胞扩张而导致了柱头外露[7]; 而番茄中一个编码非典型转录因子的基因也可以通过调节细胞伸长调控柱头外露[34]。本研究中,的柱头外露是由龙骨瓣缩短引起的,中龙骨瓣的细胞分裂和扩张过程可能受到了影响, 导致柱头外露。
植物激素在各个花器官间的相对表达水平能够影响花器官形态, 并在不同植物的柱头外露中发挥着重要作用。生长素和细胞分裂素均可参与调控细胞的伸长、分裂、分化和花器官发育。植物体内生长素的浓度水平会影响柱头外露率, Cheng等[35]认为生长素含量增加可以促进花柱生长提高柱头外露率, 而水稻4号染色体上柱头外露性状QTL位点的候选基因生长素响应因子的敲除会使水稻内生长素浓度过高, 柱头外露率降低[36]。扩展蛋白是调节植物细胞扩张的关键内源因子, 生长素和脱落酸分别通过提高扩张素活性和浓度介导细胞扩张过程[37], Pan等[38]发现高温条件下, 生长素等植物激素信号传导在雄蕊和雌蕊中的差异表达会影响扩展蛋白的转录水平, 导致番茄柱头外露。赤霉素也参与柱头外露的调节过程, 它通过控制细胞伸长率调节植物的雌蕊、雄蕊、花瓣长度[39], 王燕等[40]发现在亚高温胁迫下喷施赤霉素(gibberellin A3, GA3)可提高番茄花柱的外露率和外露程度, 而赤霉素合成抑制剂PAC处理可以减轻花柱外露程度; Carrera等[41]报道的番茄突变体()中编码赤霉素信号通路阻遏物的基因的区域发生突变, 该突变体表现出柱头外露、花瓣增多和单性结实现象; 在氧化酶家族中,和在雄蕊花丝伸长和育性中起重要作用[42]。茉莉酸(JA)不仅能够调节雄蕊长度, 还能在花瓣发育后期通过限制细胞扩张控制花瓣器官生长[43]。据报道, 高温应激会引起番茄花蕊特别是雄蕊显著缩短, 导致柱头外露, 外源施加JA能显著增加雄蕊和花柱中的细胞数量, 降低柱头外露率[38]; 而在烟草中,外源施加JA可造成花冠缩短, 柱头外露率提升[27]。乙烯也有可能导致柱头外露, 过表达番茄中编码乙烯受体蛋白的基因会导致乙烯含量降低, 植物信号传导减缓, 番茄T431品种的柱头外露表型减轻[35]。本研究中, 发现了许多与植物激素相关的差异表达基因, 其中2个调节生长素稳态的生长素运输蛋白(,)和1个细胞分裂素脱氢酶6 ()下调, 乙烯受体蛋白AT和参与茉莉酸合成的基因上调。是家族的同源转录因子, 它能激活转录因子抑制GA的生物合成和信号传导, 过表达会导致典型的GA缺乏症状, 例如植株矮小、开花延迟、雄性不育等[44];也能负调节GA 20氧化酶基因在花序茎中的表达[45]。以上结果表明, 柱头外露突变体中各种植物激素之间的相互作用可能导致了柱头外露。
4 结论
本研究对一个绿豆柱头外露突变体及其野生型植株冀绿7号开花前1 d的花蕾进行了转录组测序, 通过差异表达基因功能注释以及GO富集分析发现差异表达基因主要与糖代谢、转录代谢和生物合成等过程有关,的细胞壁合成与修饰受到了影响。KEGG富集分析发现, 差异表达基因主要涉及角质、木栓质和蜡质生物合成、植物激素信号传导、次生代谢物生物合成等通路。此外, 还揭示了许多与柱头外露相关的差异表达基因, 包括与细胞分裂和细胞扩张、植物激素相关的差异表达基因。对这些差异表达基因的进一步研究将有助于更全面的了解柱头外露的分子机制, 促进该性状在绿豆杂种优势上的利用。
[1] 郑卓杰. 中国食用豆类学. 北京: 中国农业出版社, 1997. pp 141–166. Zheng Z J. Food Legumes in China. Beijing: China Agriculture Press, 1995. pp 141–166 (in Chinese).
[2] 田静, 程须珍, 范保杰, 王丽侠, 刘建军, 刘长友, 王素华, 曹志敏, 陈红霖, 王彦, 王珅. 我国绿豆品种现状及发展趋势. 作物杂志, 2021, (6): 15–21. Tian J, Cheng X J, Fan B J, Wang L X, Liu J J, Liu C Y, Wang S H, Cao Z M, Chen H L, Wang Y, Wang K. Current situation and development trend of mungbean varieties in China., 2021, (6): 15–21 (in Chinese with English abstract).
[3] 王丽侠, 程须珍, 王素华. 绿豆种质资源、育种及遗传研究进展. 中国农业科学, 2009, 42: 1519–1527. Wang L X, Cheng X Z, Wang S H. Advances in research on genetic resources, breeding and genetics of mungbean (L.)., 2009, 42: 1519–1527 (in Chinese with English abstract).
[4] 黄穗兰, 郭宝德, 冀丽霞, 牛永章, 姜艳丽. 棉花种间杂交长柱头种质系TY35的培育与应用. 山西农业科学, 2015, 43: 777–779. Huang S L, Guo B D, Ji L X, Niu Y Z, Jiang Y L. The selection and application of germplasm line TY35 with long stigma from interspecific crossing in cotton., 2015, 43: 777–779 (in Chinese with English abstract).
[5] 杨保汉. 不育系柱头外露率及其结实率研究. 杂交水稻, 1997, (1): 15–17. Yang B H. Studies on stigma exsertion rate and outcrossing rate of CMS Lines in rice., 1997, (1): 15–17 (in Chinese).
[6] 崔贵梅, 牛天堂, 张福耀, 袁爱萍, 孙毅. 谷子(Beauv.)高异交结实雄性不育系“81-16”的柱头性状观察. 作物学报, 2007, 33: 149–153. Cui G M, Niu T T, Zhang F Y, Yuan A P, Sun Y. The stigma observation on foxtail millet (Beauv.) male-sterile line “81-16” with high outcross seed setting., 2007, 33: 149–153 (in Chinese with English abstract).
[7] Lin Y, Laosatit K, Chen J, Yuan X, Wu R, Amkul K, Chen X, Somta P. Mapping and functional characterization of stigma exposed 1, a DUF1005 gene controlling petal and stigma cells in mungbean ()., 2020, 11: 575922.
[8] Yan H, Zhang B, Zhang Y, Chen X, Xiong H, Matsui T, Tian X. High temperature induced glume closure resulted in lower fertility in hybrid rice seed production., 2017, 7: 1960.
[9] Elshamey E A Z, Hamad H S, Alshallash K S, Alghuthaymi M A , Ghazy M I, Sakran R M, Selim M E, ElSayed M A A, Abdelmegeed T M, Okasha S A, Behiry S I, Boudiar R, Mansour E. Growth regulators improve outcrossing rate of diverse rice cytoplasmic male sterile lines through affecting floral traits.(Basel), 2022, 11: 1291.
[10] Matthias Benoit. From non-self to self: stepwise mutations in transcription factors promote the transition to self-pollination in tomato., 2021, 10: 3183–3184.
[11] Riccini A, Picarella M E, De Angelis F, Mazzucato A. Bulk RNA-Seq analysis to dissect the regulation of stigma position in tomato., 2021, 105: 263–285.
[12] Pan C, Ye L, Zheng Y, Wang Y, Yang D, Liu X, Chen L, Zhang Y, Fei Z, Lu G. Identification and expression profiling of micrornas involved in the stigma exsertion under high-temperature stress in tomato., 2017, 18: 843.
[13] Mortazavi A, Williams B A, McCue K, Schaeffer L, Wold B. Mapping and quantifying mammalian transcriptomes by RNA-Seq., 2008, 5: 621–628.
[14] Trapnell C, Williams B A, Pertea G, Mortazavi A, Kwan G, van Baren M J, Salzberg S L, Wold B J, Pachter L. Transcript assembly and quantification by RNA-Seq reveals unannotated transcripts and isoform switching during cell differentiation., 2010, 28: 511–515.
[15] Love M I, Huber W, Anders S. Moderated estimation of fold change and dispersion for RNA-Seq data with DESeq2., 2014, 15: 550.
[16] Bashline L, Lei L, Li S, Gu Y. Cell wall, cytoskeleton, and cell expansion in higher plants., 2014, 7: 586–600.
[17] Tsabary G, Shani Z, Roiz L, Levy I, Riov J, Shoseyov O. Abnormal ‘wrinkled’ cell walls and retarded development of transgenicplants expressing endo-1,4-β-glucanase (cell) antisense., 2003, 51: 213–224.
[18] Herger A, Dünser K, Kleine-Vehn J, Ringli C. Leucine-rich repeat extensin proteins and their role in cell wall sensing., 2019, 29: 851–858.
[19] Fendrych M, Synek L, Pečenková T, Toupalová H, Cole R, Drdová E, Nebesářová J, Šedinová M, Hála M, Fowler J E, Žárský V. Theexocyst complex is involved in cytokinesis and cell plate maturation., 2010, 22: 3053–3065.
[20] Wen T J, Hochholdinger F, Sauer M, Bruce W, Schnable P S. The roothairless1 gene of maize encodes a homolog of sec3, which is involved in polar exocytosis., 2005, 138: 1637–1643.
[21] To J P C, Haberer G, Ferreira F J, Deruère J, Mason M G, Schaller G E, Alonso J M, Ecker J R, Kieber J J. Type-Aresponse regulators are partially redundant negative regulators of cytokinin signaling., 2004, 16: 658–671.
[22] 吴健, 孙玥, 张融雪, 李军玲, 王晓静, 闫双勇, 马忠友, 孙林静, 苏京平, 王胜军, 刘学军. 水稻柱头外露率相关性状的调查及高柱头外露率不育系的创制. 天津农业科学, 2017, 23(11): 55–60. Wu J, Sun Y, Zhang R X, Li J L, Wang X J, Yan S Y, Ma Z Y, Sun L J, Su J P, Wang S J, Liu X J. Investigation of characters related to stigma exserted rate in rice and establishment of male sterile line with high stigma exposure., 2017, 23(11): 55–60 (in Chinese with English abstract).
[23] Shang L, Song J, Yu H, Wang X, Yu C, Wang Y, Li F, Lu Y, Wang T, Ou-Yang B, Zhang J, Larkin R M, Ye Z, Zhang Y. A mutation in a C2H2-type zinc finger transcription factor contributed to the transition toward self-pollination in cultivated tomato., 2021, 33: 3293–3308.
[24] 张栩佳, 胡灵芝, 陈哲皓, 李颖, 王利琳. 花器官大小调控机制的研究进展. 植物生理学报, 2014, 50: 691–697. Zhang X J, Hu L Z, Chen Z H, Li Y, Wang L L. Research progress in regulation mechanism of floral organ size., 2014, 50: 691–697 (in Chinese with English abstract).
[25] 张鋆鋆. 烟草细胞质遗传柱头外露性状发育特征研究. 河南农业大学硕士学位论文, 河南郑州, 2018. Zhang Y Y. Study on the Developmental Characteristic of Cytoplasmic Inheritance of Tobacco Stigma Exsertion. MS Thesis of Henan Agricultural University, Zhengzhou, Henan, China, 2018 (in Chinese with English abstract).
[26] 胡育玮. 烟草细胞质遗传柱头外露发生机制研究. 河南农业大学硕士学位论文, 河南郑州, 2019. Hu Y W. Study on the Stigma Exsertion Formation Mechanism in Cytoplasmic Inheritance of Stigma Exsertion Tobacco. MS Thesis of Henan Agricultural University, Zhengzhou, Henan, China, 2018 (in Chinese with English abstract).
[27] Li J X, Li M, Wang W M, Wang D, Hu Y W, Zhang Y Y, Zhang X Q. Morphological and physiological mechanism of cytoplasmic inheritance stigma exsertion trait expression in tobacco ()., 2023, 326: 111528.
[28] Smyczynski C, Roudier F, Gissot L, Vaillant E, Grandjean O, Morin H, Masson T, Bellec Y, Geelen D, Faure J D. The C terminus of the immunophilin pasticcino1 is required for plant development and for interaction with a NAC-like transcription factor., 2006, 281: 25475–25484.
[29] Garcia M A, Koonrugsa N, Toda T. Two kinesin-like KIN I family proteins in fission yeast regulate the establishment of metaphase and the onset of anaphase A., 2002, 12: 610–621.
[30] Becraft P W, Stinard P S, McCarty D R. Crinkly4: a tnfr-like receptor kinase involved in maize epidermal differentiation., 1996, 273: 1406–1409.
[31] Kang S G, Lee H J, Suh S G. The maizegene is expressed spatially in vegetative and floral organs, 2002, 45: 219–224.
[32] Pu C X, Ma Y, Wang J, Zhang Y C, Jiao X W, Hu Y H, Wang L L, Zhu Z G, Sun D, Sun Y.receptor-like kinase is required to maintain the interlocking of the palea and lemma, and fertility in rice, by promoting epidermal cell differentiation., 2012, 70: 940–953.
[33] Cosgrove D J. Growth of the plant cell wall., 2005, 6: 850–861.
[34] Chen K Y, Cong B, Wing R, Vrebalov J, Tanksley S D. Changes in regulation of a transcription factor lead to autogamy in cultivated tomatoes., 2007, 318: 643–645.
[35] Cheng M, Gong C, Zhang B, Qu W, Qi H, Chen X, Wang X, Zhang Y, Liu J, Ding X, Qiu Y, Wang A. Morphological and anatomical characteristics of exserted stigma sterility and the location and function of SLLST (long styles) gene in tomato., 2021, 134: 505–518.
[36] Guo N, Wang Y, Chen W, Tang S, An R, Wei X, Hu S, Tang S, Shao G, Jiao G, Xie L, Wang L, Sheng Z, Hu P. Fine mapping and target gene identification of QSE4, a QTL for stigma exsertion rate in rice (L.)., 2022, 13: 959859.
[37] Zhao M, Han Y, Feng Y, Li F, Wang W. Expansins are involved in cell growth mediated by abscisic acid and indole-3-acetic acid under drought stress in wheat., 2012, 31: 671–685.
[38] Pan C, Yang D, Zhao X, Jiao C, Yan Y, Lamin-Samu A T, Wang Q, Xu X, Fei Z, Lu G. Tomato stigma exsertion induced by high temperature is associated with the jasmonate signalling pathway., 2019, 42: 1205–1221.
[39] Cheng H, Qin L, Lee S, Fu X, Richards D E, Cao D, Luo D, Harberd N P, Peng J. Gibberellin regulatesfloral development via suppression of DELLA protein function., 2004, 131: 1055–1064.
[40] 王燕, 潘长田, 王洁, 秦力, 邹滔, 卢钢. 赤霉素对亚高温胁迫下番茄花柱外露及相关基因表达的影响. 浙江大学学报(农业与生命科学版), 2015, 41: 449–457.Wang Y, Pan C T, Wang J, Qin L, Zou T, Lu G. Effects of gibberellin on tomato stigma exsertion and hormone-related gene expression under moderate heat stress.(Agric Life Sci Edn), 2015, 41: 449–457 (in Chinese with English abstract).
[41] Carrera E, Ruiz-Rivero O, Peres L E P, Atares A, Garcia-Martinez J L. Characterization of the procera tomato mutant shows novel functions of the sldella protein in the control of flower morphology, cell division and expansion, and the auxin-signaling pathway during fruit-set and development., 2012, 160: 1581–1596.
[42] Rieu I, Ruiz R O, Fernandez G N, Griffiths J, Powers S J, Gong F, Linhartova T, Eriksson S, Nilsson O, Thomas S G, Phillips A L, Hedden P. The gibberellin biosynthetic genesandact, partially redundantly, to promote growth and development throughout thelife cycle., 2008, 53: 488–504.
[43] Brioudes F, Joly C, Szécsi J, Varaud E, Leroux J, Bellvert F, Bertrand C, Bendahmane M. Jasmonate controls late development stages of petal growth in., 2009, 60: 1070–1080.
[44] Dong S, Tarkowska D, Sedaghatmehr M, Welsch M, Gupta S, Mueller-Roeber B, Balazadeh S. The HB40-JUB1 transcriptional regulatory network controls gibberellin homeostasis in., 2022, 15: 322–339.
[45] Son O, Hur Y S, Kim Y K, Lee H J, Kim S, Kim M R, Nam K H, Lee M S, Kim B Y, Park J, Park J, Lee S C, Hanada A, Yamaguchi S, Lee I J, Kim S K, Yun D J, Söderman E, Cheon C I. ATHB12, an ABA-inducible homeodomain-leucine zipper (HD- Zip) protein of, negatively regulates the growth of the inflorescence stem by decreasing the expression of a gibberellin 20-oxidase gene., 2010, 51: 1537–1547.
Transcriptome analysis of a stigma exsertion mutant in mungbean
SONG Meng-Yuan1,2, GUO Zhong-Xiao1, SU Yu-Fei1,2, DENG Kun-Peng1, LAN Tian-Jiao1, CHENG Yu-Xin1, BAO Shu-Ying1, WANG Gui-Fang1, DOU Jin-Guang1, JIANG Ze-Kai1,2, WANG Ming-Hai1,*, and XU Ning1,*
1Institute of Crop Germplasm Resources, Jilin Academy of Agricultural Sciences / Jilin Provincial Laboratory of Crop Germplasm Resources, Gongzhuling 136100, Jilin, China;2College of Agronomy, Jilin Agricultural University, Changchun 130118, Jilin, China
Stigma exsertion has been widely used in hybrid breeding as an excellent trait to improve crop outcrossing rate, seed purity, and seed production cost. As a closed-pollinated crop, few stigma exsertion mutants have been reported in mungbean. A stigma exsertion mutantwas discovered in mungbean variety Jilyu 7 after chemical mutagination. In order to clarify the molecular mechanism of stigma exsertion, transcription-sequencing (RNA-seq) analysis was conducted on the next day's opening buds ofand its wild type Jilyu 7. A total of 572 differentially expressed genes (DEGs) were obtained in, among which 262 DEGs were up-regulated and 310 DEGs were down-regulated, based on the screening criteria of difference multiplier |log2(Fold Change)| ≥1 and≤ 0.05. In GO database, differentially expressed genes were significantly enriched in biological processes such as metabolism and biosynthesis, and localized in regions such as apoplast, cell walls, and membranes, and mainly associated with molecular functions such as binding and redox. In the kyoto encyclopedia of genes and genome (KEGG) database, differentially expressed genes were significantly enriched in plant hormone signal transduction and biosynthesis of secondary metabolites. Functional annotation revealed many genes related to cell wall synthesis and metabolism, cell division and cell expansion, and plant hormones. Therefore, we hypothesized that cell division, cell expansion, and plant hormone signaling processes of the keel flap inmutants were affected, leading to stigma exsertion. This study laid a foundation for future investigations into the molecular mechanism of stigma exsertion in mungbean and its application in heterosis.
mungbean; stigma exsertion; mutant; transcriptome; high-throughput sequencing; heterosis
10.3724/SP.J.1006.2024.34080
本研究由吉林省农业科技创新工程项目(CXGC2021ZY131, CXGC2021TD111)和财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-08-Z8)资助。
This study was supported by the Agricultural Science and Technology Innovation Program of Jilin Province (CXGC2021ZY131, CXGC2021TD111) and the China Agriculture Research System of MOF and MARA (CARS-08-Z8).
徐宁, E-mail: xunig2008@163.com; 王明海, E-mail: shiyongdou@163.com
E-mail: smyuan2023@163.com
2023-05-09;
2023-09-13;
2023-10-07.
URL: https://link.cnki.net/urlid/11.1809.S.20230928.1446.010
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

