四倍体海稻86的诱导、鉴定及其耐盐碱特性评价分析
李航宇 刘心诚 贺文婷 刘可意 乔振华 吕品苍 张献华 何玉池 蔡得田,2 宋兆建,*
四倍体海稻86的诱导、鉴定及其耐盐碱特性评价分析
李航宇1刘心诚1贺文婷1刘可意1乔振华1吕品苍1张献华1何玉池1蔡得田1,2宋兆建1,*
1湖北大学生命科学学院, 湖北武汉 430062;2武汉多倍体生物科技有限公司, 湖北武汉 430345
多倍体化是植物进化的重要趋势之一。与二倍体植物相比, 多倍体植物往往具有更强的抗耐性。海稻86是具有强耐盐碱能力的水稻种质资源, 在盐碱地开发应用和粮食增产研究中具有重要利用价值。为充分利用多倍体植物抗逆性增强的优势, 选育耐盐碱能力更强的四倍体水稻新品种, 本研究以海稻86为基础, 对其进行离体染色体加倍获得海稻86同源四倍体; 以海稻86-4和海稻86-2发芽期和幼苗期NaCl、Na2CO3和PEG-6000胁迫处理的表型指标及生理生化指标鉴定, 检测两者的耐盐碱特性及差异。结果表明: (1) 通过离体染色体加倍可高效诱导获得四倍体植株, 加倍率达27.63%。 (2) 与海稻86-2相比, 海稻86-4的细胞核DNA含量及根尖染色体数目增加一倍; 形态及农艺性状发生明显变化, 如植株变矮、茎秆变粗、单株有效穗数减少、籽粒及千粒重增大、每穗总粒数及每穗实粒数减少、结实率降低等。(3) 在发芽期, 海稻86-4的发芽势、发芽率、芽长、根长、根数、含水量最高, 海稻86-2次之, 对照黄华占最低; 海稻86-4的盐碱害率最小、盐碱害等级最低, 海稻86-2次之, 对照黄华占的盐碱害率最大、盐碱害等级最高。(4) 在幼苗期, 海稻86-4的脯氨酸和叶绿素含量最高、丙二醛含量和相对电导率最低, 超氧化物歧化酶和过氧化物酶活性最高, 海稻86-2次之, 而对照黄华占的脯氨酸和叶绿素含量最低、丙二醛含量和相对电导率最高、超氧化物歧化酶和过氧化物酶活性最低。综上可知, 与海稻86-2相比, 海稻86-4在表型指标和生理生化指标上均表现出明显的耐盐碱性优势, 具有更强的耐盐碱能力。该研究结果为深入解析海稻86的耐盐碱机制奠定基础, 也为耐盐碱四倍体水稻新品种的选育提供了材料基础和理论依据。
海稻86; 离体染色体加倍; 四倍体; 耐盐碱性; 发芽势; 发芽率; 生理生化指标
土壤盐碱化严重影响作物的生长发育和产量, 是全球粮食安全所面临的巨大挑战之一[1-2]。目前全球约有10亿公顷土地盐碱化, 占世界总耕地面积的20%[3]。我国盐碱地类型复杂, 分布范围广, 总面积高达1亿公顷, 且呈逐年递增的趋势, 严重制约了粮食生产[4]。作为我国最重要的粮食作物, 水稻的种植面积和产量对我国粮食安全起到至关重要的作用。因此, 筛选和培育耐盐碱水稻新品种, 对开发利用盐碱地资源、改善生态环境和保障粮食安全具有重要意义[4-5]。在筛选和培育耐盐碱水稻及相关基础理论研究中, 耐盐碱性的鉴定和评价是重要基础。研究表明, 水稻不同发育时期耐盐碱能力不同, 发芽期和幼苗期对盐碱胁迫更为敏感, 种子吸水膨胀、萌发出芽、根系生长、发育成苗等过程受盐碱胁迫的影响显著[6-8], 因此水稻发芽期和幼苗期的耐盐碱性对其能否在盐碱地中存活起决定作用, 对耐盐碱性的鉴定和评价具有重要参考价值[9-12]。水稻发芽期和幼苗期的耐盐碱能力主要通过表型指标和生理生化指标的检测来进行鉴定和评价。主要表型指标有发芽势、发芽率、发芽指数、苗高、根长、根数、含水量等[13-14], 表型变化是植物受到逆境胁迫后的直观反应, 因而在耐盐碱性鉴定和评价中被广泛使用。盐碱胁迫下植物的多种生理生化指标也会发生显著变化。盐碱胁迫主要破坏植物细胞内离子稳态和平衡, 产生渗透胁迫和离子毒害[15]。当过多的盐离子进入植物体内, 会影响酶的活性以及蛋白的功能, 造成细胞内活性氧水平急剧增加, 如果活性氧不能被及时清除, 将诱导膜脂发生过氧化作用, 产生大量的终产物丙二醛, 同时破坏细胞膜结构, 对植物造成各种次生毒害[16-17]。细胞膜结构被破坏后, 膜的透性增加, 细胞内物质(尤其是电解质)大量外渗, 会导致电导率增加[18]。此外, 盐碱胁迫还会破坏叶绿体结构, 导致叶绿素含量下降[19]。为了应对盐碱胁迫, 植物尤其是耐盐碱植物会激活多种耐受机制, 减少吸收、增加外排或将盐离子区隔化在液泡中以降低其在细胞质中的浓度[20]; 同时还会增加脯氨酸、可溶性糖和甜菜碱等渗透调节物质的合成, 调节细胞渗透平衡[21-22]; 另外, 通过增强超氧化物歧化酶、过氧化物酶、过氧化氢酶等的活性从而激发活性氧清除系统, 清除过量积累的活性氧, 减少次生氧化毒害[23-24]。因此, 基于植物受盐碱胁迫后的生理生化反应, 丙二醛含量、相对电导率、叶绿素含量、渗透调节物含量和活性氧清除酶活性等成为作物耐盐碱性鉴定评价的常用生理生化指标[25-26]。
海稻86由Chen等[27]1986年在广东湛江首次发现, 其具有强耐盐碱能力, 是选育优良耐盐碱水稻新品种的重要种质基础。多倍体化可以增强植物的遗传多样性和环境适应性, 是促进植物进化和物种形成的重要力量之一[28-31]。与二倍体相比, 多倍体植物往往表现出更强的活力, 具有茎秆粗壮、生物量大、营养价值高、抗逆性和适应性强等明显优势, 在育种中具有较大应用价值和潜力, 因此多倍体育种也是目前最有效的植物育种技术之一[32-35]。为充分利用多倍体植物抗逆性增强的优势, 选育耐盐碱能力更强的四倍体水稻新品种, 本研究以海稻86-2为材料, 首先通过离体染色体加倍获得海稻86-4, 进一步检测海稻86-4和海稻86-2的种子发芽期和幼苗期盐碱胁迫处理后表型指标和生理生化指标变化, 评价其耐盐碱能力。研究结果为深入解析海稻86的耐盐碱机制奠定基础, 也为耐盐碱四倍体水稻新品种的选育提供了材料基础和理论依据。
1 材料与方法
1.1 试验材料
海稻86 (Haidao 86, HD86), 由湖北荆楚种业股份有限公司段洪波研究员提供; 耐盐碱特性研究对照材料黄华占(Huanghuazhan, HHZ), 由中国水稻研究所龚俊义研究员提供。
1.2 海稻86的染色体加倍
参照Cai等[36]的离体染色体加倍方法进行。以成熟种胚为外植体诱导愈伤组织, 取旺盛生长的愈伤组织置于含0.05%秋水仙素的液体培养基中进行加倍处理, 处理后的愈伤组织经分化培养、生根培养、炼苗后移栽至室外生长。实验重复3次。每个培养阶段统计相关数据, 按以下公式计算相关指标: 诱导率(%) = 诱导出愈伤组织的种胚数/接种种胚总数×100%; 加倍存活率(%) = 加倍处理后存活愈伤组织数/愈伤组织总数×100%; 分化率(%) = 分化出苗愈伤组织数/存活愈伤组织数×100%; 加倍率(%) = 四倍体苗数/总成苗数×100%。
1.3 四倍体海稻86的鉴定
1.3.1 流式细胞分析 取约0.5 cm2的幼嫩叶片, 放入加有200 μL核酸提取液的塑料培养皿中, 用锋利刀片迅速切碎; 用30 μm孔径滤膜过滤, 加800 μL DAPI染色液, 在倍性检测仪(Sysmex Partec GmbH, Münster, 德国)上检测细胞核DNA含量, 以海稻86-2作对照。
1.3.2 根尖染色体计数 参考李懋学和张赞平[37]去壁低渗火焰干燥法制片, 略改动。取生长旺盛的根尖放入EP管内, 加入2 mmol L–18-羟基喹啉溶液预处理2.5 h, 蒸馏水清洗, 前低渗30 min, 用新鲜卡诺固定液(乙醇∶冰乙酸=3∶1) 4℃固定24 h。取固定好的根尖用蒸馏水清洗后, 转入3%纤维素酶和3%果胶酶混合酶液中, 30℃处理2 h, 用蒸馏水清洗3次, 后低渗10 min。用吸管吸取3~4个根尖置于干净的载玻片上, 加1~2滴卡诺固定液, 用镊子迅速敲碎, 加2~3滴卡诺固定液使细胞分散, 迅速在酒精灯火焰上烤干。用改良苯酚品红染色15 min, 清洗晾干后在Olympus BX51显微镜(Olympus Corporation, 日本)下观察计数。
1.3.3 重要农艺性状考察 成熟期考察材料的重要农艺性状, 包括株高、单株有效穗数、穗长、芒长、籽粒长宽、每穗总粒数、每穗实粒数、结实率、千粒重等, 每个材料考察10株, 具体统计方法参考盖钧镒“水稻主要育种性状的记载方法和标准”[38]。
1.4 发芽期胁迫处理
种子消毒处理后用蒸馏水浸泡至破胸, 取长势良好的种子放入垫有无菌滤纸的培养皿中, 每培养皿30粒。培养皿中分别加入50、100、150、200和250 mmol L–1的NaCl溶液, 10、20、30、40和50 mmol L–1的Na2CO3溶液, 10、20、30、40和50 mmol L–1的PEG-6000溶液, 对种子进行盐、碱及渗透胁迫处理, 同时用蒸馏水处理作对照, 每个处理3次重复。胁迫处理第3天和第7天, 以种子的芽长等于种子长度的一半, 根长等于种子长度为发芽标准[39], 记载发芽种子数; 并在第7天测量芽长、根长、根数、鲜重、干重, 所有发芽种子全部测量, 求平均值。按以下公式进行各表型指标的计算: 发芽势(%) = 3 d内发芽种子数/种子总数×100%; 发芽率(%) = 7 d内发芽种子数/种子总数×100%; 含水量(%) = (鲜重–干重)/鲜重×100%; 相对发芽势(%) = 处理发芽势/对照发芽势×100%; 相对发芽率(%) = 处理发芽率/对照发芽率×100%; 相对芽长(%) = 处理芽长/对照芽长×100%;相对根长(%) = 处理根长/对照根长×100%; 相对根数(%) = 处理根数/对照根数×100%; 相对含水量(%) = 处理含水量/对照含水量×100%; 盐碱害率(%) = (对照发芽率–处理发芽率)/对照发芽率×100%。
盐碱害等级: 1级=盐碱害率0~20.0%, 耐盐碱性极强; 3级=盐碱害率20.1%~40.0%, 耐盐碱性强; 5级=盐碱害率40.1%~60.0%, 耐盐碱性中等; 7级=盐碱害率60.1%~80.0%, 耐盐碱性弱; 9级=盐碱害率80.1%~100.0%, 耐盐碱性极弱。
1.5 幼苗期胁迫处理
种子消毒处理后用蒸馏水浸泡至破胸, 转移至垫有无菌滤纸的培养皿中, 第1~7天用蒸馏水培养, 以后用1/4木村B水稻营养液培养。幼苗生长至第14天, 分别使用含有100 mmol L–1和150 mmol L–1NaCl的木村B水稻营养液、10 mmol L–1和20 mmol L–1Na2CO3的木村B水稻营养液进行盐、碱胁迫处理, 使用不添加NaCl和Na2CO3的木村B水稻营养液作对照, 每个处理3次重复。取胁迫处理2 d的叶片用于超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的测定; 胁迫处理5 d的叶片用于丙二醛(MDA)含量、脯氨酸(Pro)含量、叶绿素含量、相对电导率的测定。叶绿素含量采用丙酮提取法[40]测定; 叶片相对电导率采用抽气法[41]测定; SOD活性、POD活性、MDA含量和Pro含量采用北京盒子生工科技有限公司的相应试剂盒测定。
1.6 数据处理与分析
数据采用SPSS 25.0和Microsoft Excel 2020进行统计分析。2组数据之间的差异显著性采用独立样本检验方法, 多组数据之间的差异显著性采用Duncan’s法进行多组样本间的单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 四倍体海稻86的获得
共接种3批种胚, 由表1可见, 愈伤组织诱导率为81.61%, 经秋水仙素加倍处理后愈伤组织存活率为95.06%; 分化培养中, 愈伤组织分化率为64.06%。移栽后, 共获得加倍植株50株, 通过倍性鉴定确定四倍体植株14株, 加倍率为27.63%。
2.2 四倍体海稻86的鉴定
2.2.1 细胞核DNA含量 流式细胞分析可以快速鉴定植株倍性。本研究利用倍性检测仪, 检测海稻86-4和海稻86-2的细胞核DNA含量, 结果如图1所示。纵坐标表示检测细胞的数量, 横坐标表示细胞核DNA含量, 海稻86-2峰值处的细胞核DNA含量为5963.62, 而海稻86-4峰值处的细胞核DNA含量为11,800.24, 是海稻86-2的2倍, 因此可以确定通过染色体加倍成功获得海稻86-4。
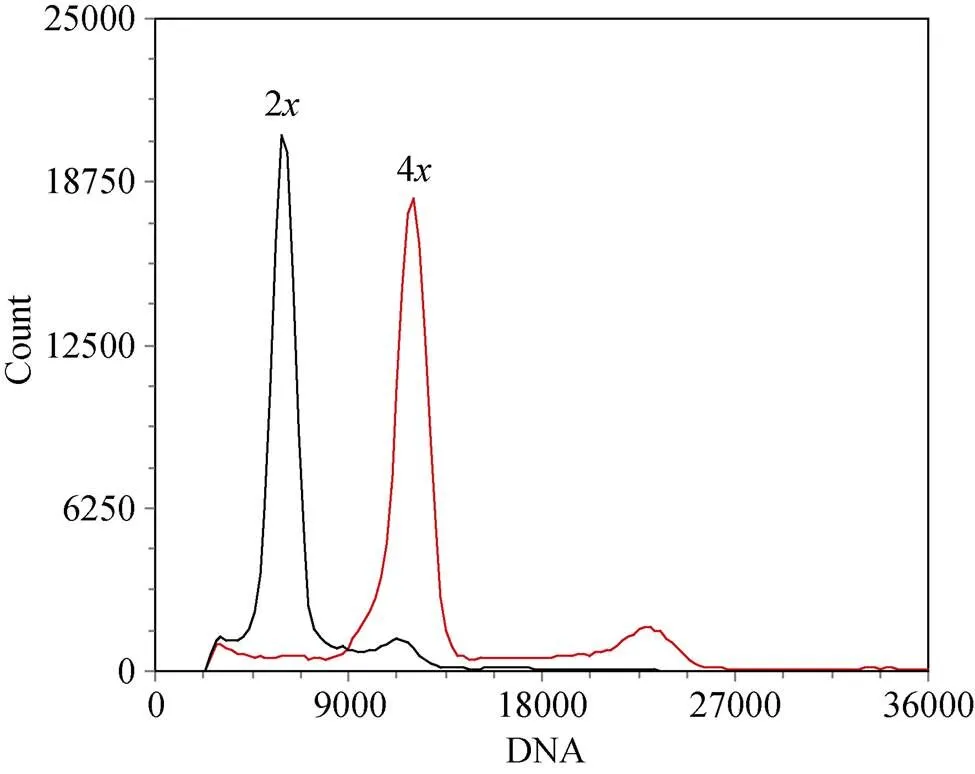
图1 海稻86-2x与海稻86-4x的细胞核DNA含量分析
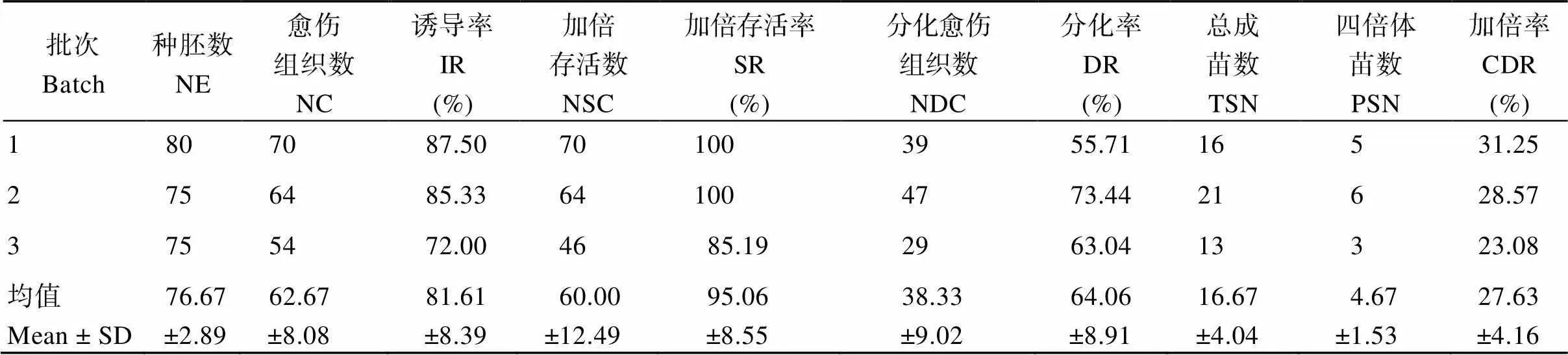
表1 海稻86的染色体加倍数据统计
NE: the number of embryos; NC: the number of calluses; IR: the induction rate; NSC: the number of survival calluses; SR: survival rate; NDC: the number of differentiated calluses; DR: the differentiation rate; TSN: the total seedling number; PSN: the polyploid (tetraploid) seedling number; CDR: chromosome doubling rate.
2.2.2 根尖染色体数目 染色体计数是鉴定倍性最准确的方法, 本研究对流式细胞分析确定的四倍体植株进一步通过根尖染色体制片鉴定其倍性, 结果如图2所示, 海稻86-2的根尖染色体数目为24条, 而染色体加倍后海稻86-4的根尖染色体数目为48条, 进一步证实了四倍体植株的真实性。
2.2.3 形态及农艺性状 与海稻86-2相比, 海稻86-4植株形态及重要农艺性状发生了明显变化(表2和图3)。海稻86-4植株变矮, 茎秆变粗, 单株有效穗数减少, 穗子变短; 芒长增加, 籽粒及千粒重明显增大, 千粒重增幅达36.31%, 表现出明显的器官巨大性效应; 其中穗长的差异达到显著水平, 株高、单株有效穗数、粒长、粒宽、千粒重的差异达到极显著水平。每穗总粒数和每穗实粒数均极显著减少, 其中实粒数降幅更大, 导致结实率极显著降低, 仅为32.74%, 符合同源四倍体育性降低的变化规律[42]。
2.3 发芽期胁迫处理后表型指标分析
2.3.1 相对发芽势和相对发芽率 盐、碱及渗透胁迫处理3 d和7 d后统计发芽种子数, 计算相对发芽势和相对发芽率。如图4所示, 随着盐、碱及渗透胁迫浓度的升高, 海稻86-2、海稻86-4和黄华占的相对发芽势和相对发芽率均呈现下降趋势。3种胁迫因子对种子萌发的影响程度不同, 渗透胁迫的影响最大, 碱胁迫次之, 盐胁迫的影响最小。与对照黄华占相比, 海稻86-2和海稻86-4的相对发芽势和相对发芽率在相同胁迫条件下下降幅度较小, 特别是海稻86-4。另外值得注意的是, 在100 mmol L–1NaCl胁迫处理下, 海稻86-2和海稻86-4仍能保持98%以上的发芽率, 但黄华占的发芽率仅为82.37%; 在10 mmol L–1PEG胁迫处理下, 海稻86-4的发芽势和发芽率仍为100%, 但海稻86-2的发芽势和发芽率分别仅为81.50%和88.90%, 黄华占的发芽势和发芽率更低, 分别为76.70%和80.00%;在50 mmol L–1PEG胁迫处理下, 黄华占和海稻86-2的种子均不能萌发, 但海稻86-4还有9.57%的种子可以萌发。可见, 海稻86-2发芽期的耐盐、碱及渗透胁迫的能力较强, 而海稻86-4具有更强的耐盐、碱及渗透胁迫能力。
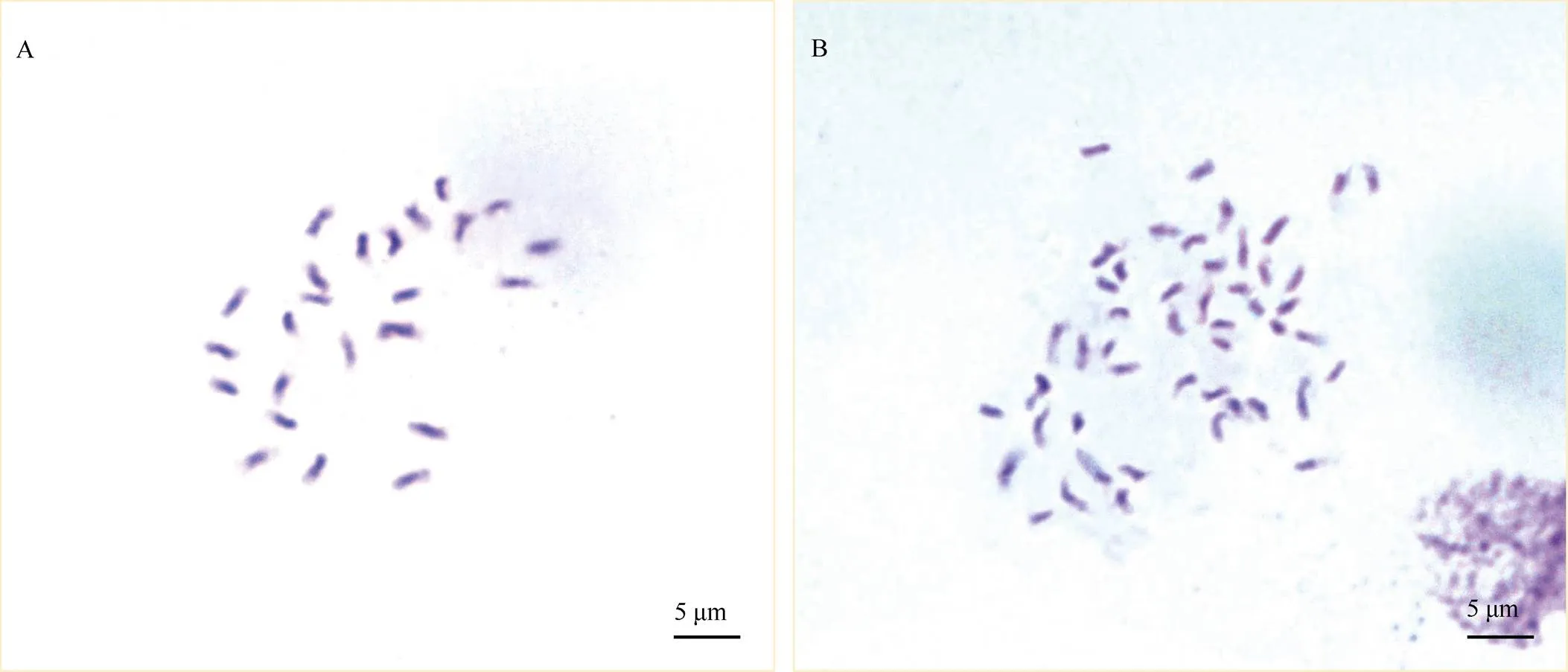
图2 海稻86-2x与海稻86-4x的根尖染色体数目分析
A: 海稻86-2(2=2=24); B: 海稻86-4(2=4=48)。
A: Haidao 86-2(2=2=24); B: Haidao 86-4(2=4=48).

图3 海稻86-2x与海稻86-4x的形态比较
A: 植株; B: 穗部; C: 粒长; D: 粒宽。A: plants; B: panicles; C: grain length; D: grain width.
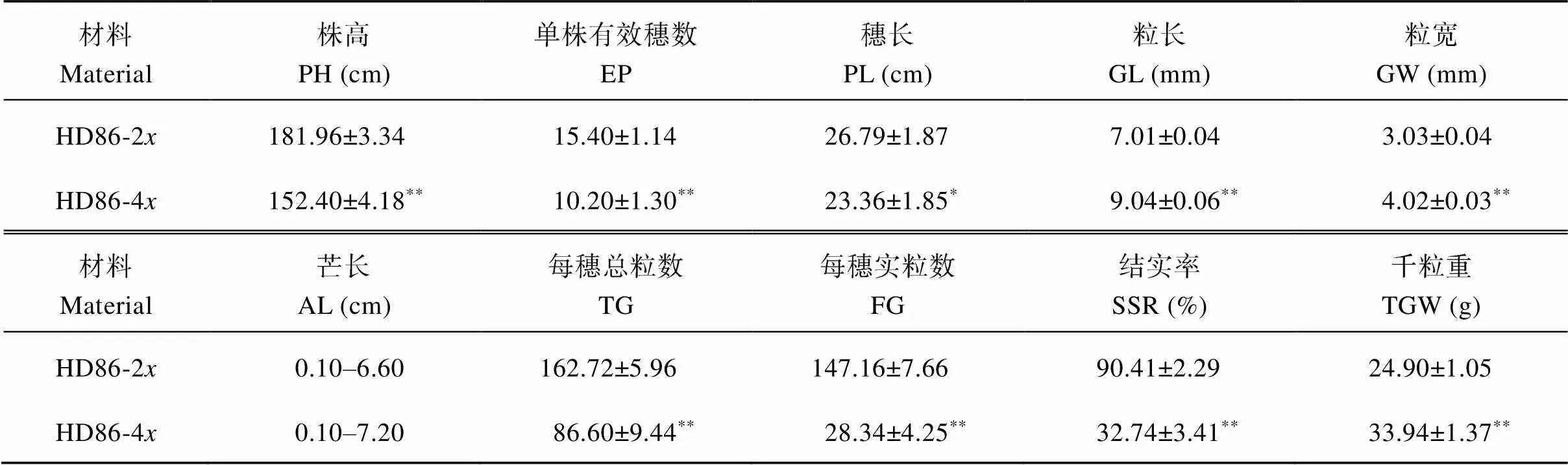
表2 海稻86-2x与海稻86-4x的主要农艺性状
表中数据表示均值±标准差(除芒长数据外)。*和**分别表示在0.05和0.01概率水平差异显著。
Value represents mean ± SD (except for awn length data).*and**indicate significantly different at the 0.05 and 0.01 probability levels, respectively. PH: plant height; EP: the effective panicle number per plant; PL: panicle length; GL: grain length; GW: grain width; AL: awn length; TG: the total grain number per panicle; FG: the filled grain number per panicle; SSR: seed-setting rate; TGW: 1000-grain weight.
2.3.2 盐碱害率及盐碱害等级 根据盐、碱及渗透胁迫下种子的发芽率计算盐碱害率和盐碱害等级,结果如表3所示。可见, 随着盐、碱及渗透胁迫浓度的升高, 海稻86-2、海稻86-4和黄华占的盐碱害率均呈增高趋势, 盐碱害等级也逐渐提高。相同胁迫条件下, 海稻86-4的盐碱害率最低, 海稻86-2次之, 黄华占的盐碱害率最高。在所有胁迫条件下, 海稻86-4与黄华占的盐碱害率差异都达到显著水平; 大部分胁迫条件下, 海稻86-2与黄华占的盐碱害率差异也达到显著水平; 部分胁迫条件下, 海稻86-4与海稻86-2的盐碱害率差异达到显著水平。在低浓度胁迫条件下, 3种材料的盐碱害等级相同或相近, 但随着胁迫浓度的升高, 盐碱害等级差异逐渐增大, 海稻86-4的盐碱害等级最低, 海稻86-2次之, 黄华占的盐碱害等级最高。海稻86-4在最高盐胁迫浓度下盐碱害等级仅为1级, 在最高碱浓度下盐碱害等级仅为3级; 但在50 mmol L–1PEG-6000渗透胁迫条件下, 3种材料的盐碱害等级都达到9级, 说明此渗透胁迫条件已经达到或接近材料耐受性的极限。以上结果表明, 海稻86-2和海稻86-4, 特别是后者具有较强的耐盐、碱及渗透胁迫能力。
2.3.3 相对芽长、根长和根数 盐、碱及渗透胁迫下海稻86-2、海稻86-4和黄华占的相对芽长、根长、根数如表4所示。可见, 随着盐、碱及渗透胁迫浓度的升高, 3种材料的芽长、根长和根数总体上均呈现出逐渐减小的趋势。相同胁迫条件下, 海稻86-4的相对芽长、根长和根数基本都是最大, 海稻86-2次之, 黄华占最小; 少数情况下海稻86-4低于海稻86-2, 但差异不显著; 而海稻86-4和黄华占之间的差异基本都达到显著水平; 部分胁迫条件下, 海稻86-4和海稻86-2之间的差异达到显著水平。说明海稻86-4的生长受到盐、碱及渗透胁迫的影响最小, 海稻86-2次之, 黄华占受到的影响最大, 反映出海稻86-2和海稻86-4, 特别是后者具有较强的耐盐、碱及渗透胁迫能力。另外, 同样可以发现3种胁迫因子中, 渗透胁迫对幼苗生长的影响也是最大, 碱胁迫次之, 盐胁迫对幼苗生长的影响最小。
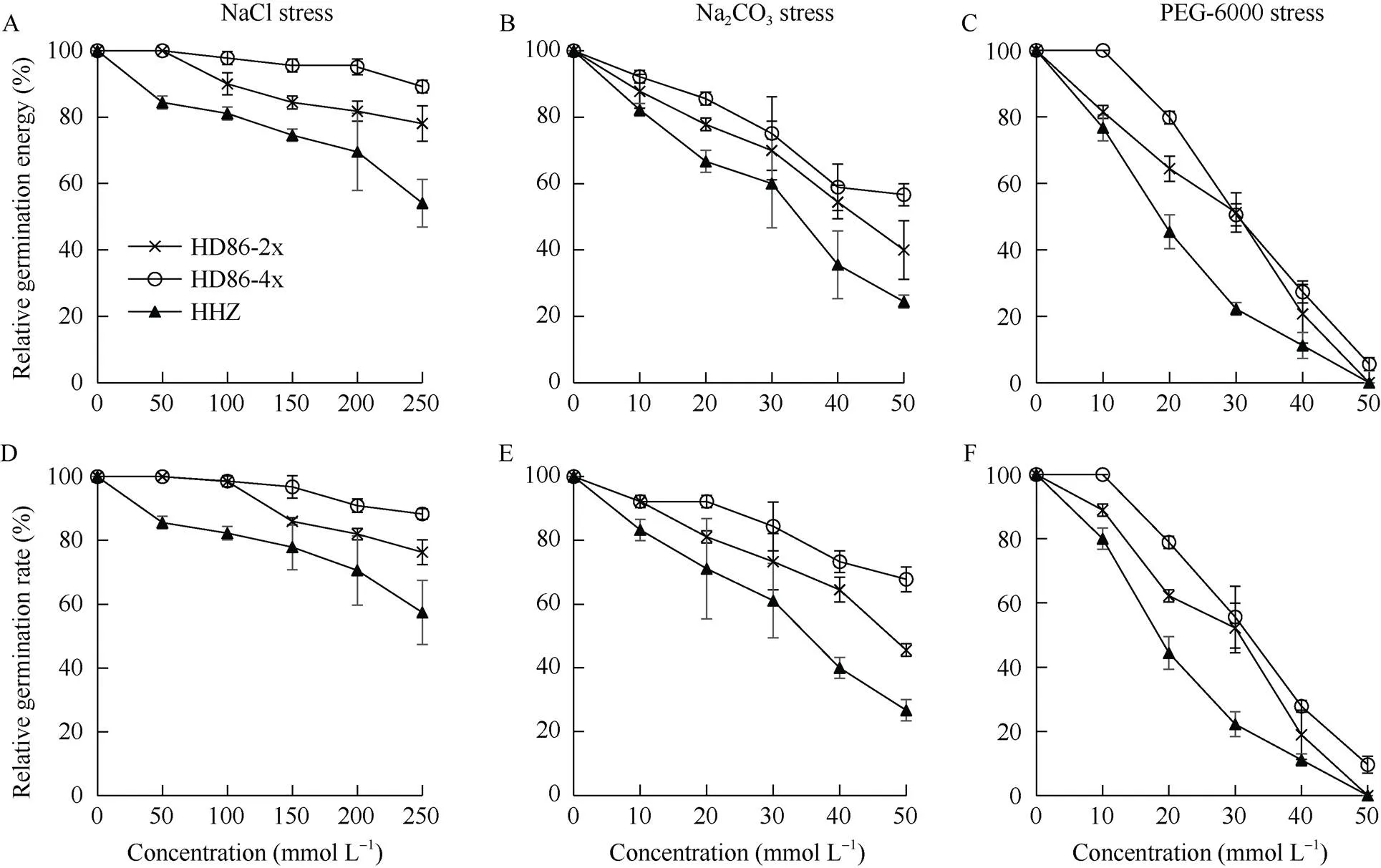
图4 盐碱及渗透胁迫处理下种子的相对发芽势(A, B, C)和相对发芽率(D, E, F)
A, D: NaCl胁迫; B, E: Na2CO3胁迫; C, F: PEG-6000胁迫。
A, D: saline stress by NaCl; B, E: alkaline stress by Na2CO3; C, F: osmotic stress by PEG-6000.
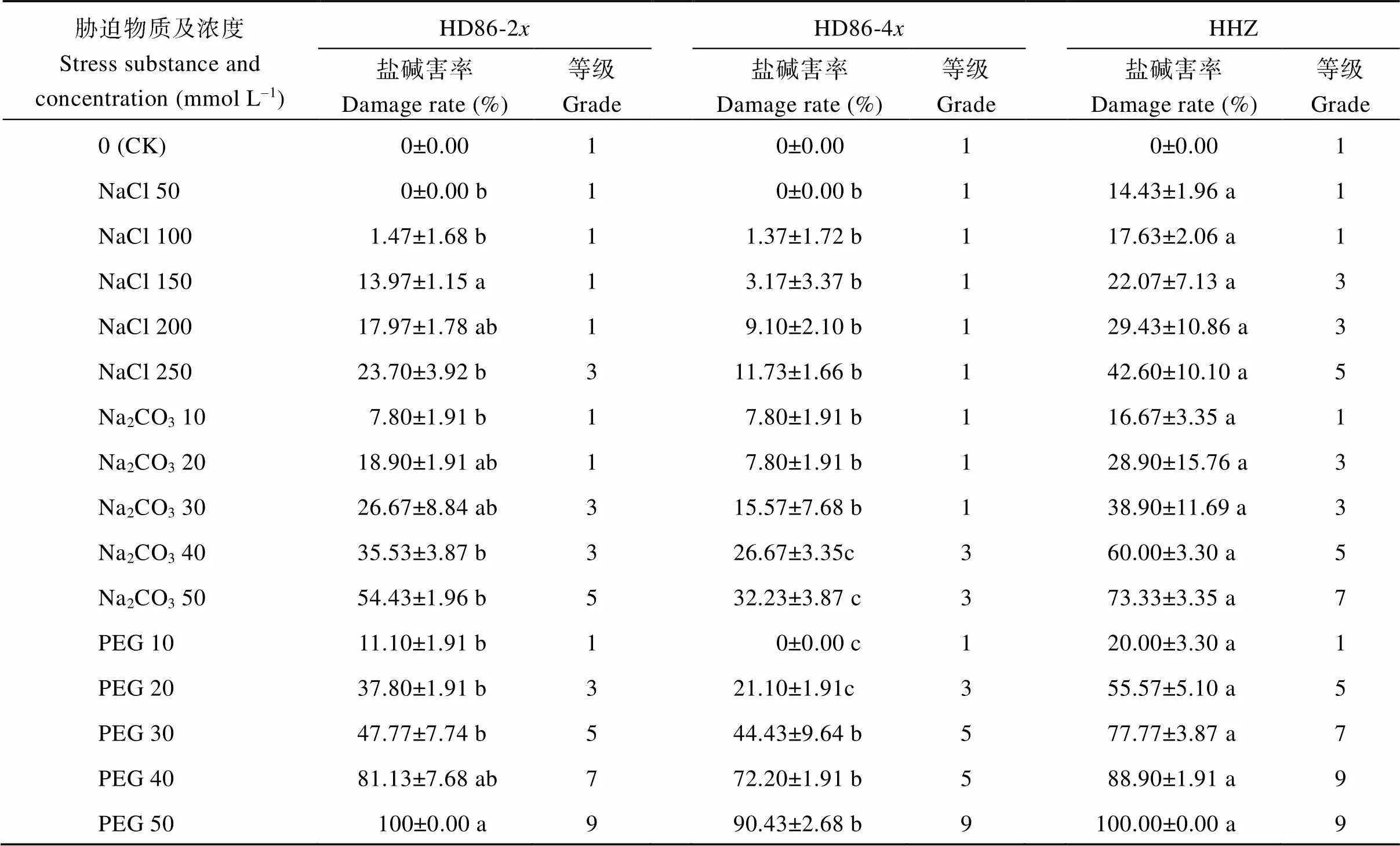
表3 盐碱及渗透胁迫下的盐碱害率和盐碱害等级
表中数据表示均值±标准差。同行数据标不同小写字母表示在0.05概率水平差异显著。
Value represents mean ± SD. Different lowercase letters in the same row indicate significant difference at the 0.05 probability level.

2.3.4 相对含水量 盐、碱及渗透胁迫下海稻86-2、海稻86-4和黄华占幼苗的相对含水量如图5所示。可见, 随着盐、碱及渗透胁迫浓度的升高, 3种材料的相对含水量都呈现出逐渐降低的趋势, 而且黄华占的降低幅度明显大于海稻86-2和海稻86-4。相同胁迫条件下, 海稻86-4的相对含水量最高, 海稻86-2次之, 黄华占最低; 在高浓度胁迫条件下, 海稻86-4与黄华占之间的差异都达到显著水平; 在30 mmol L–1Na2CO3、50 mmol L–1PEG-6000胁迫条件下, 海稻86-4与海稻86-2之间的差异达到显著水平; 海稻86-2与黄华占之间的差异多数也达到显著水平。说明海稻86-4幼苗的生长受到盐、碱及渗透胁迫的影响最小, 海稻86-2次之, 黄华占受到的影响最大, 反映出海稻86-2和海稻86-4, 特别是后者具有较强的耐盐、碱及渗透胁迫能力。
图5 盐碱及渗透胁迫下幼苗的相对水含量
Fig. 5 Relative water content of seedling under saline, alkaline and osmotic stress
A: NaCl胁迫; B: Na2CO3胁迫; C: PEG-6000胁迫。同一处理标不同小写字母表示在0.05概率水平差异显著。
A: saline stress by NaCl; B: alkaline stress by Na2CO3; C: osmotic stress by PEG-6000. Different lowercase letters in the same treatment indicate significant difference at the 0.05 probability level.
2.4 幼苗期胁迫处理后生理生化指标分析
2.4.1 脯氨酸含量 脯氨酸是植物在逆境胁迫下的主要渗透调节物质之一, 对提高植物的抗逆性起到重要作用。植物体内脯氨酸的含量在一定程度上反映了植物的抗逆性[16]。由图6可见, 未受盐碱胁迫时, 海稻86-2的脯氨酸含量最高, 黄华占次之, 海稻86-4的脯氨酸含量最低, 但差异不显著。随着盐碱胁迫浓度的升高, 三者的脯氨酸含量均呈增加趋势。相同胁迫条件下, 海稻86-4的脯氨酸含量最高, 海稻86-2次之, 黄华占的脯氨酸含量最低; 在150 mmol L–1NaCl及20 mmol L–1Na2CO3胁迫条件下, 海稻86-4的脯氨酸含量显著高于黄华占和海稻86-2。
2.4.2 叶绿素含量 盐碱胁迫条件下, 叶绿体是最敏感的细胞器之一, 结构会遭到破坏, 使叶绿素含量下降[19]。叶绿素含量下降幅度越低, 说明植物耐盐碱能力越强。如图6所示, 未受盐碱胁迫时, 海稻86-2的叶绿素含量最高, 海稻86-4次之, 黄华占的叶绿素含量最低, 但差异不显著。随着盐碱胁迫浓度的升高, 三者的叶绿素含量均呈下降趋势。相同胁迫条件下, 海稻86-4的叶绿素含量最高, 海稻86-2次之, 黄华占的叶绿素含量最低; 而且海稻86-4的叶绿素含量, 在所有胁迫条件下都显著高于黄华占; 在20 mmol L–1Na2CO3胁迫条件下显著高于海稻86-2。
2.4.3 MDA含量 MDA是膜脂过氧化作用的终产物, 其含量能直接反映细胞膜受损程度[19]。如图6所示, 未受盐碱胁迫时, 海稻86-4的MDA含量最高, 海稻86-2次之, 黄华占的MDA含量最低, 但差异不显著。随着盐碱胁迫浓度的升高, 三者的MDA含量都呈增加趋势, 其中黄华占的增加幅度明显更大。100 mmol L–1NaCl胁迫条件下, 黄华占的MDA含量低于海稻86-2和海稻86-4, 但差异不显著; 其余胁迫条件下则表现为, 黄华占的MDA含量最高, 海稻86-2次之, 海稻86-4的MDA含量最低, 而且海稻86-4的MDA含量都显著低于黄华占, 在150 mmol L–1NaCl和20 mmol L–1Na2CO3胁迫条件下显著低于海稻86-2。
2.4.4 相对电导率 相对电导率可以反映植物细胞膜在逆境条件下透性的变化和受损程度[43]。相对电导率越低, 表明细胞质电解液外渗越少, 细胞膜受损程度越低, 细胞受到的伤害越小。由图6可见, 未受盐碱胁迫时, 海稻86-4的相对电导率最高, 黄华占次之, 海稻86-2的相对电导率最低, 但差异不显著。随着盐碱胁迫浓度的升高, 三者的相对电导率都呈上升趋势, 其中黄华占的上升幅度明显更大。相同胁迫条件下, 黄华占的相对电导率最高, 海稻86-2次之, 海稻86-4的相对电导率最低; 而且所有胁迫条件下, 海稻86-4与黄华占的相对电导率差异都达到显著水平; 在150 mmol L–1NaCl和20 mmol L–1Na2CO3胁迫条件下, 海稻86-4与海稻86-2的相对电导率差异达到显著水平。
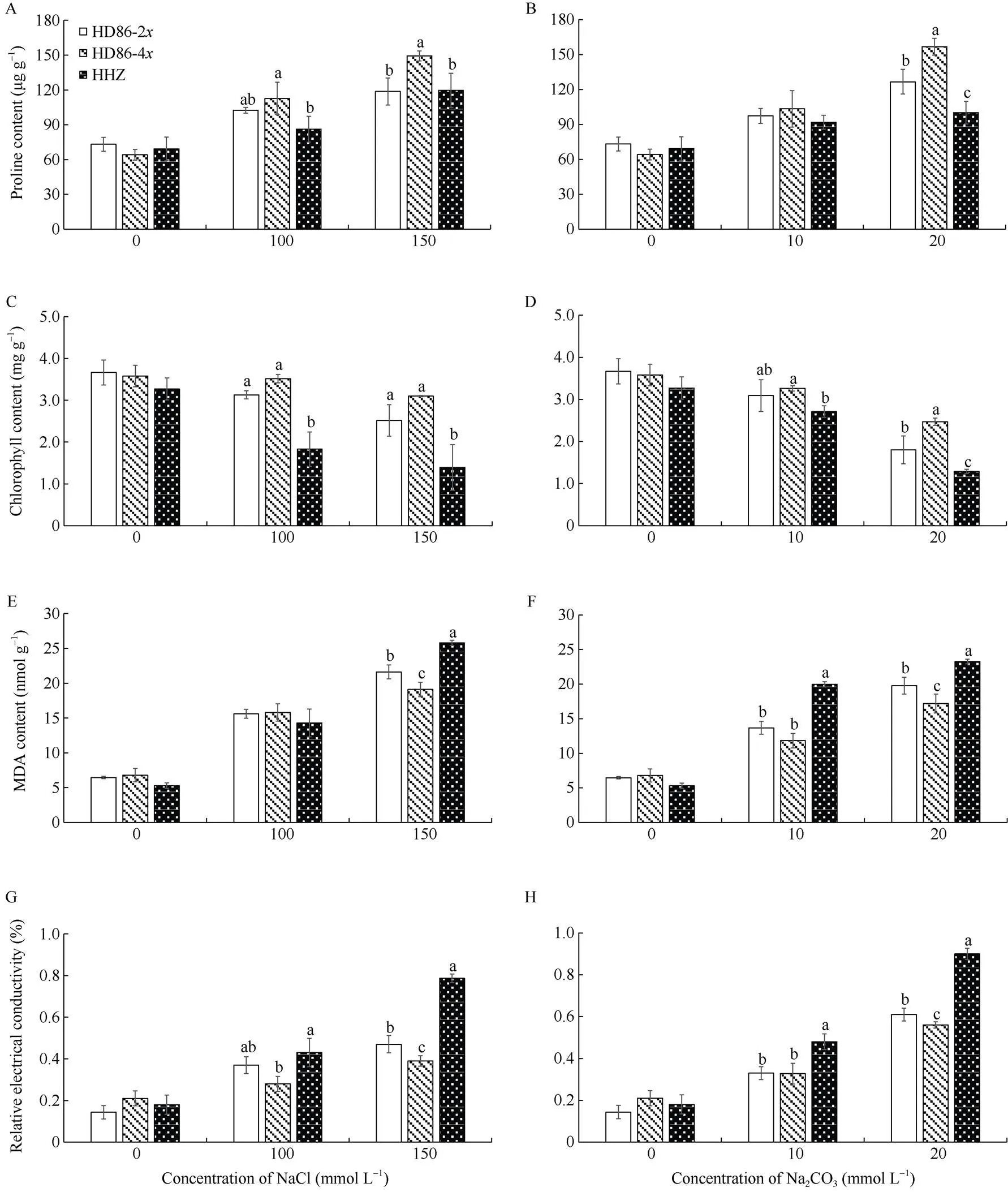
图6 盐碱胁迫处理后材料的脯氨酸(A, B)、叶绿素(C, D)、丙二醛(E, F)含量及相对电导率(G, H)
A, C, E, G: NaCl胁迫; B, D, F, H: Na2CO3胁迫。同一处理标不同小写字母表示在0.05概率水平差异显著。
A, C, E, G: saline stress by NaCl; B, D, F, H: alkaline stress by Na2CO3. Different lowercase letters in the same treatment indicate significant difference at the 0.05 probability level.
2.4.5 SOD和POD活性 为了抵抗逆境造成的伤害, 植物可以利用活性氧清除系统来清除氧自由基, 阻止氧化损伤, 其中的抗氧化酶主要有SOD、POD等[19]。由图7可见, 在未受盐碱胁迫时, 海稻86-4的SOD和POD活性最高, 与黄华占的POD活性差异达到显著水平。随着盐碱胁迫浓度的升高, 三者的SOD和POD活性都呈上升趋势; 相同盐碱胁迫条件下, 海稻86-4的SOD和POD活性仍然最高, 海稻86-2次之, 黄华占的SOD和POD活性最低; 而且三者相互之间的差异都达到显著水平。
A, C: NaCl胁迫; B, D: Na2CO3胁迫。同一处理标不同小写字母表示在0.05概率水平差异显著。
A, C: saline stress by NaCl; B, D: alkaline stress by Na2CO3. Different lowercase letters in the same treatment indicate significant difference at the 0.05 probability level.
3 讨论
多倍体水稻具有茎秆粗壮、籽粒增大、营养成分增加、抗逆性增强等明显优势, 具有大幅度增产的潜力[42,44-48], 因此开展多倍体水稻研究对开辟水稻育种新途径及相关基础研究具有重要意义。多倍体水稻研究可追溯至1933年Nakamori发现四倍体水稻[49], 20世纪60年代前国际上曾出现多倍体水稻育种的热潮, 但因结实率低的问题难以解决而大都中断[50]。我国多倍体水稻育种研究由鲍文奎和严育瑞开创于1951年[51], 后来几十年中在多倍体水稻育种方法、细胞遗传学、花药培养以及优良株系无性系繁殖等方面进行了系列研究并获得重要进展[52-54],为我国多倍体水稻育种的发展积累了宝贵经验, 但多倍体水稻结实率低的问题仍未能很好地解决[42,54-55]。20世纪90年代以后, 国内陆续有多家单位开展多倍体水稻研究, 在多倍体水稻的高效诱导、多倍体水稻低结实率的细胞和分子机制、高结实率多倍体水稻材料的创建等方面取得了重要进展。针对传统活体加倍方法存在诱导率低(<5%)、易形成嵌合体的缺陷, 蔡得田等研发了“组织培养和秋水仙素处理相结合高效诱导多倍体水稻”的离体染色体加倍技术, 将诱导率提高到46.7%, 而且基本不会产生嵌合体[56-57]。低结实率是多倍体水稻育种的瓶颈问题, 严重制约了多倍体水稻的生产应用。研究发现, 多倍体水稻花粉母细胞减数分裂期间染色体行为普遍存在异常现象, 花粉和胚囊发育、受精、胚胎和胚乳发育过程中均存在不同程度的异常现象, 这些异常都可能是造成多倍体水稻低结实率的细胞学原因[58-65]。随着分子生物学和基因测序技术的发展, 发现多倍体水稻花粉和胚囊发育期间存在育性相关基因异常表达、甲基化程度改变和非编码RNA的差异表达等情况, 可能是导致多倍体水稻低结实率的分子机制[66-70]。
为了解决多倍体水稻的低结实率瓶颈问题, 我国科学家经过多年努力培育出多种高结实四倍体水稻新材料, 其中有代表性的主要有: (1) 中国科学院成都生物研究所培育的高结实四倍体水稻恢复系及组配的“三系”杂交组合[71-72]。(2) 华南农业大学培育的新型四倍体水稻[73-76]。 (3) 湖北大学培育的多倍体减数分裂稳定性(polyploid meiosis stability, PMeS)品系[36,75-76]。高结实四倍体水稻品系的成功培育, 突破了长期困扰多倍体水稻育种的低结实率瓶颈问题,有望使多倍体水稻得以应用。近来, 李家洋院士团队提出了“异源四倍体野生稻快速从头驯化”的育种策略, 通过对异源四倍体高秆野生稻()的落粒性、芒性、株型、籽粒大小及抽穗期等重要农艺性状基因进行编辑, 实现野生稻的快速和定向进化, 有望培育出新型多倍体水稻作物[30,34,77]。这不仅开辟了全新的作物育种方向, 也预示着水稻育种新时代的到来, 多倍体水稻育种将是未来水稻育种的重要方向。结合多倍体水稻的特征特性和目前研究进展情况, 笔者认为未来多倍体水稻育种研究工作可从以下5个方面开展:
(1) 多倍体常规稻育种。在高结实多倍体水稻培育成功的基础上, 实现多倍体水稻的生产应用成为下一阶段的首要目标。高结实多倍体水稻的结实率可以达到正常水平, 但存在单株穗数和穗粒数偏少、抗性较差等缺点, 与目前优良二倍体水稻品种相比还存在一定差距, 需进一步改良其农艺性状。可以将不同类型的优良二倍体水稻品种通过染色体加倍获得同源四倍体, 再与高结实多倍体水稻杂交, 选育出高结实且性状优良的多倍体水稻新品种。由于四倍体水稻染色体数目增加一倍, 减数分裂时染色体配对和分离情况复杂, 自交难以稳定, 导致育种周期要远长于二倍体育种。为解决这一问题, 笔者实验室正在探索花药培养(或未受精子房培养)结合离体染色体加倍的倍性循环育种技术, 以期缩短多倍体水稻育种周期。同时如有更多育种家进入多倍体水稻育种领域, 则更有希望早日实现多倍体水稻在应用上的突破。
(2) 多倍体杂交稻育种。水稻杂种优势的利用为我国和世界粮食安全做出了卓越贡献[78]。在四倍体水平上, 杂交稻同样具有明显的杂种优势, 比常规稻的增产潜力更大, 而且多倍体杂交稻还具有剩余杂种优势明显, 可以持续利用多代的优势[76,79-80]。杂交稻育种的关键是不育系的选育, 目前涂升斌等[71]选育出多个四倍体三系雄性不育系, Zhang等[81]选育出四倍体光温敏雄性不育系PS006和PS012, Chen等[82]通过基因编辑技术创建出2份新型四倍体水稻温敏不育品系H2s和H3s, 为进一步在多倍体水平上利用杂种优势打下基础。
(3) 多倍体特色稻育种。利用多倍体水稻营养成分增加、抗逆性增强等特性选育富营养、抗逆性强的特色稻新品种是多倍体水稻育种的重要方向。多倍体水稻种子的总蛋白、谷蛋白和氨基酸含量都比二倍体有显著增加, 具有更高的营养价值[42,83-84]。利用这一特点, 选育多倍体水稻高蛋白专用型品种, 用于高蛋白米粉、米奶等产品的生产, 可有效提升水稻产业的附加值, 提高经济效益。利用多倍体水稻抗逆性增强的特点, 选育耐盐碱、耐旱、耐寒等抗逆性强的多倍体水稻品种, 可有效拓展水稻种植区域。本研究以具有强耐盐碱能力的海稻86为材料, 通过离体染色体加倍获得了具有更强耐盐碱能力的四倍体海稻86, 但其结实率仅有30%左右, 不能直接应用。为解决四倍体海稻86的结实率问题, 目前已将其与本实验室选育的高结实PMeS品系杂交, 杂种F1的结实率达到82.17%, 后续将对杂种后代的耐盐碱性状和结实率性状进行筛选, 从杂种后代中选育既具有高结实特性又具有强耐盐碱特性的四倍体水稻新品种, 为盐碱地的开发利用提供优良水稻新品种。
(4) 异源多倍体水稻育种。稻属()物种资源丰富, 除了亚洲栽培稻()和非洲栽培稻()两个栽培种外, 还有20多个野生稻种, 其中包含5类异源四倍体[85-86]。野生稻生存于各种恶劣自然环境条件下, 在长期生存竞争和自然选择过程中, 形成了极其丰富的遗传多样性, 保存了栽培稻不具有或已消失的许多优良基因, 是栽培稻遗传改良的基因宝库[87-88]。但目前对野生稻资源的利用还局限于二倍体水平上杂交后连续回交的基因渐渗方法, 其缺点和局限性在于: 1) 种间杂种育性低甚至不育, 产生可育配子的几率低, 从而造成回交效率低; 2) 通过回交育种往往只能获得个别性状得到改良的新品种, 不能充分利用远缘杂交产生的变异。多倍体化是植物进化和物种形成的加速器[28-31], 几乎所有被子植物都经历过一次或多次多倍化事件, 现存高等植物70%以上是多倍体, 异源基因组结合和多倍体化带来了基因组的杂合性, 基因组容量增大, 遗传变异范围更广, 对不利因素具有更强的耐受力[31,89-91]。主要粮棉油作物, 小麦()、棉花()和油菜()都是植物多倍体进化的典范, 多倍体化后不仅产生了丰富的遗传多样性, 而且产量大幅增加[92]。在自然界植物进化的启示下, 蔡得田等提出了“利用远缘杂交和多倍体双重优势选育超级稻”的育种策略, 并分为亚种间(籼稻与粳稻)、种间(栽培稻与A基因组野生稻)和基因组间(栽培稻与非A基因组野生稻)杂交和多倍体化3个实施阶段[44]。该策略不同于二倍体水平的基因渐渗方法, 是利用异源多倍体化固定杂合性, 具体来说就是首先通过远缘杂交获得包含野生稻完整基因组的远缘杂种, 然后通过染色体加倍获得远缘杂种多倍体(异源多倍体), 克服远缘杂种的不育性或低育性, 从而直接利用异源多倍体的基因组杂合性和多倍体双重优势[93], 异源多倍体还可以通过与栽培稻回交改良获得异源多倍体衍生品种[94], 因而可获得远比二倍体回交途径更加丰富的变异。第一阶段研究中, 通过广泛的籼粳亚种间杂交、复交选育出PMeS品系, 突破了多倍体水稻的低结实率瓶颈问题[36]。第二阶段和第三阶段研究中, 为解决远缘杂交中存在的杂交不亲和、杂种夭亡、杂种不育等问题, 建立了“远缘杂交、胚挽救与离体染色体加倍相结合高效创建异源多倍体水稻”的技术体系[95], 利用该技术体系成功构建栽培稻与普通野生稻(, AA, 2=24)、巴蒂野生稻(, AA, 2=24)、尼瓦拉野生稻(, AA, 2=24)、长雄蕊野生稻(, AA, 2=24)的种间杂种二倍体及其四倍体, 栽培稻与斑点野生稻(, BB, 2=24)、药用野生稻(, CC, 2=24)、高秆野生稻(, CCDD, 2=48)、澳洲野生稻(, EE, 2=24)、疣粒野生稻(, GG, 2=24)[93,96-100]的基因组间杂种(二倍体或三倍体)及其多倍体(四倍体或六倍体)。但这些异源多倍体仍表现出一些野生或不利性状, 如落粒性、长芒、低育性, 甚至有些异源多倍体由于亲本亲缘关系太远, 仍表现不育, 增加了利用难度。短期内, 可以作为育种中间材料或用于稻属物种进化等基础研究; 长远看, 可以作为保存野生稻基因组和未来异源多倍体水稻育种的储备材料。近来, 李家洋院士团队成功实现了异源四倍体高秆野生稻的从头定向驯化[30], 由于上述人工异源多倍体本身具有栽培稻基因组, 如以其为底盘种质进行定向编辑, 则相对更容易获得可应用的异源多倍体水稻新品种。
(5) 多倍体水稻回复二倍体育种。四倍体水稻通过自然或人工减倍后获得的回复二倍体往往变异丰富且性状优良[101-103], 在利用籼粳亚种间杂种四倍体选育优良回复二倍体育种实践的基础上, 宋兆建等提出了“以多倍体为变异载体选育回复二倍体水稻”的育种思路[103]。该思路基于多倍体对不同亚种或物种异源基因组共存造成的不稳定性具有高度兼容的能力, 通过多倍体化提高籼粳亚种间杂种或栽野种间杂种的育性; 同时, 充分利用籼粳亚种间杂种多倍体或栽野种间杂种多倍体基因组内或不同基因组间广泛的重组, 将其作为促进不同亚种或物种间染色体交换、易位、基因转换、转座等重组过程的载体, 使染色体的结构和组成发生改变, 创造出丰富的变异。而后, 利用杂种多倍体产生的具有丰富变异的雌、雄配子, 通过未受精子房培养或花药培养获得兼有不同亚种或物种遗传成分的系列回复二倍体水稻。这些回复二倍体水稻经历了不同亚种或物种染色体间的重组, 大大拓宽了材料的遗传变异范围, 具有广泛的遗传基础和丰富的遗传多样性, 可有效解决水稻育种亲本遗传基础狭窄的问题, 为水稻育种提供了新的思路和途径。
4 结论
通过离体染色体加倍获得了海稻86-4, 并通过流式细胞分析、根尖染色体计数、形态及农艺性状比较等方法进行四倍体的鉴定。海稻86-4在发芽期的发芽势、发芽率、芽长、根长、根数、含水量和盐碱害率等表型指标, 幼苗期的脯氨酸含量、叶绿素含量、丙二醛含量、相对电导率、超氧化物歧化酶和过氧化物酶活性等生理生化指标上, 均表现出明显的耐盐碱性优势, 与海稻86-2相比具有更强的耐盐碱能力。本研究为深入解析海稻86的耐盐碱机制奠定了基础, 也为耐盐碱四倍体水稻新品种的选育提供了材料基础和理论依据。
致谢: 湖北荆楚种业股份有限公司段洪波研究员、中国水稻研究所龚俊义研究员提供实验材料, 谨此致谢。
[1] Liang W J, Ma X L, Wan P, Liu L Y. Plant salt-tolerance mechanism: a review., 2018, 495: 286–291.
[2] Sun H, Meng M H, Yan Z H, Lin Z X, Nie X H, Yang X Y. Genome-wide association mapping of stress tolerance traits in cotton., 2019, 7: 77–88.
[3] 巫明明, 曾维, 翟荣荣, 叶靖, 朱国富, 俞法明, 张小明, 叶胜海. 水稻耐盐分子机制与育种研究进展. 中国水稻科学, 2022, 36: 551–561. Wu M M, Zeng W, Zhai R R, Ye J, Zhu G F, Yu F M, Zhang X M, Ye S H. Research progress in molecular mechanism and breeding status of salt tolerance in rice., 2022, 36: 551–561 (in Chinese with English abstract).
[4] 颜佳倩, 顾逸彪, 薛张逸, 周天阳, 葛芊芊, 张耗, 刘立军, 王志琴, 顾骏飞, 杨建昌, 周振玲, 徐大勇. 耐盐性不同水稻品种对盐胁迫的响应差异及其机制. 作物学报, 2022, 48: 1463–1475. Yan J Q, Gu Y B, Xue Z Y, Zhou T Y, Ge Q Q, Zhang H, Liu L J, Wang Z Q, Gu J F, Yang J C, Zhou Z L, Xu D Y. Different responses of rice cultivars to salt stress and the underlying mechanisms., 2022, 48: 1463–1475 (in Chinese with English abstract).
[5] 孙平勇, 张武汉, 舒服, 何强, 张莉, 阳祝红, 彭志荣, 谢芸, 邓华凤. 水稻资源芽期和苗期耐盐碱性综合评价及耐盐基因分析. 生物工程学报, 2022, 38: 252–263.Sun P Y, Zhang W H, Shu F, He Q, Zhang L, Yang Z H, Peng Z R, Xie Y, Deng H F. Comprehensive evaluation of salt-alkali tolerance of rice germplasms at germination and seedling stages and analysis of salt-tolerant genes., 2022, 38: 252–263 (in Chinese with English abstract).
[6] Foolad M R, Jones R A. Mapping salt-tolerance genes in tomato () using trait-based marker analysis., 1993, 87: 184–192.
[7] 陈二影, 王润丰, 秦岭, 杨延兵, 黎飞飞, 张华文, 王海莲, 刘宾, 孔清华, 管延安. 谷子芽期耐盐碱综合鉴定及评价. 作物学报, 2020, 46: 1591–1604. Chen E Y, Wang R F, Qin L, Yang Y B, Li F F, Zhang H W, Wang H L, Liu B, Kong Q H, Guan Y A. Comprehensive identification and evaluation of foxtail millet for saline-alkaline tolerance during germination., 2020, 46: 1591–1604 (in Chinese with English abstract).
[8] 徐婷, 柳延涛, 王海江, 李强, 王鹏, 董红业. 盐碱胁迫对花生种子发芽特性影响及盐害综合鉴定评价. 中国油料作物学报, 2022, 44: 1037–1047. Xu T, Liu Y T, Wang H J, Li Q, Wang P, Dong H Y. Effects of saline-alkali stress on germination characteristics of peanut seeds and comprehensive identification and evaluation of salt damage., 2022, 44: 1037–1047 (in Chinese with English abstract).
[9] Lee S Y, Ahn J H, Cha Y S, Yun D W, Lee M C, Ko J C, Lee K S, Eun M Y. Mapping QTLs related to salinity tolerance of rice at the young seedling stage., 2007, 126: 43–46.
[10] 程海涛, 姜华, 薛大伟, 郭龙彪, 曾大力, 张光恒, 钱前. 水稻芽期与幼苗前期耐碱性状QTL定位. 作物学报, 2008, 34: 1719–1727. Cheng H T, Jiang H, Xue D W, Guo L B, Zeng D L, Zhang G H, Qian Q. Mapping of QTLs underlying tolerance to alkali at germination and early seedling stages in rice., 2008, 34: 1719–1727 (in Chinese with English abstract).
[11] Wang H, Wu Z, Chen Y, Yang C, Shi D. Effects of salt and alkali stresses on growth and ion balance in rice (L.)., 2011, 57: 286–294.
[12] 张静, 高文博, 晏林, 张宗文, 周海涛, 吴斌. 燕麦种质资源耐盐碱性鉴定评价及耐盐碱种质筛选. 作物学报, 2023, 49: 1551–1561. Zhang J, Gao W B, Yan L, Zhang Z W, Zhou H T, Wu B. Identification and evaluation of salt-alkali tolerance and screening of salt-alkali tolerant germplasm of oat (L.)., 2023, 49: 1551–1561 (in Chinese with English abstract).
[13] 程海涛, 姜华, 颜美仙, 董国军, 钱前, 郭龙彪. 两个水稻DH群体发芽期和幼苗前期耐碱性状QTL定位比较. 分子植物育种, 2008, 6: 439–450. Cheng H T, Jiang H, Yan M X, Dong G J, Qian Q, Guo L B. QTL-mapping comparison of tolerance to alkali at germination period and early seeding stage between two different double haploid populations in rice., 2008, 6: 439–450 (in Chinese with English abstract).
[14] 祁栋灵, 郭桂珍, 李明哲, 杨春刚, 张俊国, 曹桂兰, 张三元, 徐锡哲, 周庆阳, 韩龙植. 碱胁迫下粳稻幼苗前期耐碱性的数量性状基因座检测. 作物学报, 2009, 35: 301–308. Qi D L, Guo G Z, Lee M C, Yang C G, Zhang J G, Cao G L, Zhang S Y, Suh S C, Zhou Q Y, Han L Z. Identification of quantitative trait loci for alkaline tolerance at early seedling stage under alkaline stress inrice., 2009, 35: 301–308 (in Chinese with English abstract).
[15] Ghoulam C, Foursy A, Fares K. Effects of salt stress on growth, inorganic ions and proline accumulation in relation to osmotic adjustment in five sugar beet cultivars., 2002, 47: 39–50.
[16] 武永军, 何国强, 史艳茹, 梁宗锁. 不同pH值缓冲液处理下蚕豆叶片相对含水量、脯氨酸及丙二醛含量的变化. 干旱地区农业研究, 2009, 27(6): 169–172. Wu Y J, He G Q, Shi Y R, Liang Z S. Change of relative water content, proline content and malondialdehyde content ofleaves under different pH buffer treatments., 2009, 27(6): 169–172 (in Chinese with English abstract).
[17] 孙聪聪, 赵海燕, 郑彩霞. NaCl胁迫对银杏幼树渗透调节物质及脯氨酸代谢的影响. 植物生理学报, 2017, 53: 470–476. Sun C C, Zhao H Y, Zheng C X. Effects of NaCl stress on osmolyte and proline metabolism inseedling., 2017, 53: 470–476 (in Chinese with English abstract).
[18] Xu S, Li J L, Zhang X Q, Wei H, Cui L J. Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress., 2006, 56: 274–285.
[19] 杨升, 张华新, 张丽. 植物耐盐生理生化指标及耐盐植物筛选综述. 西北林学院学报, 2010, 25(3): 59–65. Yang S, Zhang H X, Zhang L. Physiological and biochemical indices of salt tolerance and scanning of salt-tolerance plants: a review., 2010, 25(3): 59–65 (in Chinese with English abstract).
[20] 徐涵, 郭容芳, 张玉苗, 李蓉, 肖学宸, 曹子谊, 王姗姗, 张可轩, 陈晓慧, 陈晓东, 陈裕坤, 叶炜, 叶开温, 林玉玲, 赖钟雄. 植物耐盐性: 演化和盐基因组学. 热带作物学报, 2020, 41: 1979–1989. Xu H, Guo R F, Zhang Y M, Li R, Xiao X C, Cao Z Y, Wang S S, Zhang K X, Chen X H, Chen X D, Chen Y K, Ye W, Ye K W, Lin Y L, Lai Z X. Plant halotolerance: evolution and halogenomics., 2020, 41: 1979–1989 (in Chinese with English abstract).
[21] Li Q, Yang A, Zhang W H. Comparative studies on tolerance of rice genotypes differing in their tolerance to moderate salt stress., 2017, 17: 141.
[22] 张晓婷, 王雪松, 贾文飞, 徐振彪, 王颖, 吴林. 植物在盐处理下的研究进展. 北方园艺, 2021, (6): 137–143. Zhang X T, Wang X S, Jia W F, Xu Z B, Wang Y, Wu L. Research progress of plants under salt treatment., 2021,(6): 137–143 (in Chinese with English abstract).
[23] 王宝山. 生物自由基与植物膜伤害. 植物生理学通讯, 1988, (2): 12–16. Wang B S. Biological free radicals and membrane damage of plants., 1988, (2): 12–16 (in Chinese).
[24] Gupta B, Huang B. Mechanism of salinity tolerance in plants: physiological, biochemical, and molecular characterization., 2014, 2014: 701596.
[25] 彭振, 何守朴, 孙君灵, 许菲菲, 贾银华, 潘兆娥, 王立如, 杜雄明. 陆地棉苗期耐盐性的高效鉴定方法. 作物学报, 2014, 40: 476–486. Peng Z, He S P, Sun J L, Xu F F, Jia Y H, Pan Z E, Wang L R, Du X M. An efficient approach to identify salt tolerance of upland cotton at seedling stage., 2014, 40: 476–486 (in Chinese with English abstract).
[26] 凌云鹤, 周瑶, 景兵, 李春莲, 肖恩时, 王中华. 盐胁迫对向日葵幼苗生长及生理特性的影响. 干旱地区农业研究, 2019, 37(4): 139–145. Ling Y H, Zhou Y, Jing B, Li C L, Xiao E S, Wang Z H. Effects of salt stress on growth and physiological characteristics of sunflower at seedling stage., 2019, 37(4): 139–145 (in Chinese with English abstract).
[27] Chen R S, Cheng Y F, Han S Y, Van Handel B, Dong L, Li X M, Xie X Q. Whole genome sequencing and comparative transcriptome analysis of a novel seawater adapted, salt-resistant rice cultivar-sea rice 86., 2017, 18: 655.
[28] Comai L. The advantages and disadvantages of being polyploid., 2005, 6: 836–846.
[29] Fang Z, Morrell P L. Domestication: polyploidy boosts domestication., 2016, 2: 16116.
[30] Yu H, Lin T, Meng X B, Du H L, Zhang J K, Liu G F, Chen M J, Jing Y H, Kou L Q, Li X X, Gao Q, Liang Y, Liu X D, Fan Z L, Liang Y T, Cheng Z K, Chen M S, Tian Z X, Wang Y H, Chu C C, Zuo J R, Wan J M, Qian Q, Han B, Zuccolo A, Wing R A, Gao C X, Liang C Z, Li J Y. A route todomestication of wild allotetraploid rice., 2021, 184: 1–15.
[31] Cao Y, Zhao K L, Xu J X, Wu L, Hao F Y, Sun M P, Dong J, Chao G T, Zhang H, Gong X F, Chen Y G, Chen C L, Qian W, Pires J C, Edger P P, Xiong Z Y. Genome balance and dosage effect drive allopolyploid formation in., 2023, 120: e2217672120.
[32] Sattler M C, Carvalho C R, Clarindo W R. The polyploidy and its key role in plant breeding., 2016, 243: 281–296.
[33] Svacina R, Sourdille P, Kopecky D, Bartos J. Chromosome pairing in polyploid grasses., 2020, 11: 1056.
[34] 张静昆, 曾鹏, 余泓, 孟祥兵, 李家洋. 多倍体水稻从头驯化: 育种策略与展望. 中国科学: 生命科学, 2021, 51: 1467–1476. Zhang J K, Zeng P, Yu H, Meng X B, Li J Y.domestication of polyploid rice: a novel breeding strategy and future prospects.(Vitae), 2021, 51: 1467–1476 (in Chinese with English abstract).
[35] Shi Q H, Guo X R, Su H D, Zhang Y X, Hu Z M, Zhang J, Han F P. Autoploid origin and rapid diploidization of the tetraploidrevealed by genome differentiation and chromosome pairing in meiosis., 2023, 113: 536–545.
[36] Cai D T, Chen J G, Chen D L, Dai B C, Zhang W, Song Z J, Yang Z F, Du C Q, Tang Z Q, He Y C, Zhang D S, He G C, Zhu Y G. The breeding of two polyploid rice lines with the characteristic of polyploid meiosis stability.(Ser C, Life Sci Edn), 2007, 50: 356–366.
[37] 李懋学, 张赞平. 作物染色体及其研究技术. 北京: 中国农业出版社, 1996. pp 23–39. Li M X, Zhang Z P. Crop Chromosome and Research Techniques. Beijing: China Agriculture Press, 1996. pp 23–39 (in Chinese).
[38] 盖钧镒. 作物育种学各论(第2版). 北京: 中国农业出版社, 2006. pp 47–49. Gai J Y. Crop Breeding, 2nd edn. Beijing: China Agriculture Press, 2006. pp 47–49 (in Chinese).
[39] 祁栋灵, 韩龙植, 张三元. 水稻耐盐/碱性鉴定评价方法. 植物遗传资源学报, 2005, 6: 226–231. Qi D L, Han L Z, Zhang S Y. Methods of characterization and evaluation of salt or alkaline tolerance in rice., 2005, 6: 226–231 (in Chinese with English abstract).
[40] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. pp 134–137. Li H S. Principles and Techniques of Plant Physiology and Biochemistry Experiments. Beijing: Higher Education Press, 2000. pp 134–137 (in Chinese).
[41] 汪洪艳. 海稻86耐盐机理及基因定位的研究. 湖南师范大学硕士学位论文, 湖南长沙, 2019. Wang H Y. Physiological and Gene Mapping for Salt Tolerance of Sea Rice 86. MS Thesis of Hunan Normal University, Changsha, Hunan, China, 2019 (in Chinese with English abstract).
[42] 宋文昌, 张玉华. 水稻四倍化及其对农艺性状和营养成分的影响. 作物学报, 1992, 18: 138–144. Song W C, Zhang Y H. Rice tetraploid and its effect on agronomic traits and nutritional constituents., 1992, 18: 137–144 (in Chinese with English abstract).
[43] McKay H M, Mason W L. Physiological indicators of tolerance to cold storage inand Douglas-fir seedlings., 1991, 21: 890–901.
[44] 蔡得田, 袁隆平, 卢兴桂. 二十一世纪水稻育种的新战略: II. 利用远缘杂交和多倍体双重优势进行超级稻育种. 作物学报, 2001, 27: 110–116. Cai D T, Yuan L P, Lu X G. A new strategy of rice breeding in the 21st century: II. Searching a new pathway of rice breeding by utilization of double heterosis of wide cross and polyploidization., 2001, 27: 110–116 (in Chinese with English abstract).
[45] Jiang A M, Gan L, Tu Y, Ma H X, Zhang J M, Song Z J, He Y C, Cai D T, Xue X Q. The effect of genome duplication on seed germination and seedling growth of rice under salt stress., 2013, 7: 1814–1821.
[46] Tu Y, Jiang A M, Gan L, Hossain M, Zhang J M, Peng B, Xiong Y G, Song Z J, Cai D T, Xu W F, Zhang J H, He Y C. Genome duplication improves rice root resistance to salt stress., 2014, 7: 15.
[47] Yang P M, Huang Q C, Qin G Y, Zhao S P, Zhou J G. Different drought-stress responses in photosynthesis and reactive oxygen metabolism between autotetraploid and diploid rice., 2014, 52: 193–202.
[48] 刘向东, 吴锦文, Shahid M Q. 新型四倍体水稻创制及其杂种优势利用研究进展. 生物技术通报, 2022, 38(1): 44–50. Liu X D, Wu J W, Shahid M Q. Development of neo-tetraploid rice and research progress on its heterosis mechanism., 2022, 38(1): 44–50 (in Chinese with English abstract).
[49] Nakamori E. On the occurrence of the tetraploid plant of rice,L., 1933, 9: 340–341.
[50] Nayar N M. 顾铭洪译. 水稻的起源和细胞遗传. 北京: 农业出版社, 1981. p 4. Nayar N M. Gu M H, trans. Origin and Cytogenetics of Rice. Beijing: Agriculture Press, 1981. p 4 (in Chinese).
[51] 鲍文奎, 严育瑞. 几种禾谷类作物的同源多倍体和双二倍体的研究初报. 植物学报, 1956, 5: 297–316. Bao W K, Yan Y R. A preliminary report on investigations of auto-polyploids and amphidiploids in some cereal crops., 1956, 5: 297–316 (in Chinese with English abstract).
[52] 鲍文奎, 秦瑞珍, 吴德瑜, 陈志勇, 宋文昌, 张玉华. 高产四倍体水稻无性系. 中国农业科学, 1985, 18(6): 64–66. Bao W K, Qin R Z, Wu D Y, Chen Z Y, Song W C, Zhang Y H. High yielding tetraploid rice clones., 1985, 18(6): 64–66 (in Chinese with English abstract).
[53] 秦瑞珍, 吴德瑜, 陈志勇, 宋文昌, 张玉华, 鲍文奎. 四倍体水稻杂种选株无性系的研究. 作物学报, 1986, 12: 63–65. Qin R Z, Wu D Y, Chen Z Y, Song W C, Zhang Y H, Bao W K. Investigation on the autotetraploid rice clones derived from elite plants of hybrid progenies., 1986, 12: 63–65 (in Chinese).
[54] 秦瑞珍, 程治军, 郭秀平. 利用同源四倍体花培途径创建水稻突变体群的研究. 作物学报, 2005, 31: 392–394. Qin R Z, Cheng Z J, Guo X P. The establishment of mutant pool using anther culture of autotetrapolyploid rice., 2005, 31: 392–394 (in Chinese with English abstract).
[55] 陈志勇, 吴德瑜, 宋文昌, 张玉华, 秦瑞珍, 鲍文奎. 同源四倍体水稻育种研究的近期进展. 中国农业科学, 1987, 20: 20–24. Chen Z Y, Wu D Y, Song W C, Zhang Y H, Qin R Z, Bao W K. Recent advanced in the autotetraploid rice breeding., 1987, 20: 20–24 (in Chinese with English abstract).
[56] 蔡得田, 陈冬玲, 陈建国, 刘幼琪. 组织培养和化学诱导相结合培育水稻多倍体的方法. 中国专利: ZL01133529.7, (2004-05-19). Cai D T, Chen D L, Chen J G, Liu Y Q. A method of inducing polyploid rice through tissue culture together with chemical agent. Chinese Patent: ZL01133529.7, (2004-05-19) (in Chinese).
[57] Chen R R, Feng Z Y, Zhang X H, Song Z J, Cai D T. A new way of rice breeding: polyploid rice breeding., 2021, 10: 422.
[58] 黄群策, 孙敬三, 白素兰. 同源四倍体水稻的生殖特性研究. 中国农业科学, 1999, 32(2): 14–18. Huang Q C, Sun J S, Bai S L. Study on reproductive characters of autotetraploid rice., 1999, 32(2): 14–18 (in Chinese with English abstract).
[59] 黄春梅, 黄群策, 李志真. 同源四倍体水稻雌雄配子体的多态性. 福建农业大学学报, 1999, 28(1): 18–21. Huang C M, Huang Q C, Li Z Z. Polymorphism of male and female gametophytes in autotetraploidy rice., 1999, 28(1): 18–21 (in Chinese with English abstract).
[60] 何金华, 程杏安, 陈志雄, 郭海滨, 刘向东, 卢永根. 同源四倍体水稻花粉母细胞减数分裂期间微管骨架组织和结构变化. 作物学报, 2010, 36: 1777–1785. He J H, Cheng X A, Chen Z X, Guo H B, Liu X D, Lu Y G. Changes in the pattern of organization of microtubules during meiosis in pollen mother cell of autotetraploid rice., 2010, 36: 1777–1785 (in Chinese with English abstract).
[61] 张华华, 冯九焕, 卢永根, 杨秉耀, 刘向东. 利用激光扫描共聚焦显微镜观察同源四倍体水稻胚囊的形成与发育. 电子显微学报, 2003, 22: 380–384. Zhang H H, Feng J H, Lu Y G, Yang B Y, Liu X D. Observation on formation and development of autotetraploid rice embryo sac using laser scanning confocal microscope., 2003, 22: 380–384 (in Chinese with English abstract).
[62] 郭海滨, 刘向东, 卢永根, 冯九焕. 同源四倍体水稻成熟胚囊的结构及异常现象. 中国水稻科学, 2006, 20: 283–289. Guo H B, Liu X D, Lu Y G, Feng J H. Structure of mature embryo sac and its abnormal phenomena in autotetraploid rice., 2006, 20: 283–289 (in Chinese with English abstract).
[63] 王兰, 刘向东, 卢永根, 冯九焕, 徐雪宾, 徐是雄. 同源四倍体水稻胚乳发育: 极核融合和胚乳细胞化. 中国水稻科学, 2004, 18: 281–289. Wang L, Liu X D, Lu Y G, Feng J H, Xu X B, Xu S X. Endosperm development in autotetraploid rice: the fusion of polar nuclei and the formation of endosperm cell wall., 2004, 18: 281–289 (in Chinese with English abstract).
[64] 张华华, 刘向东, 卢永根, 冯九焕. 同源四倍体水稻受精与胚胎形成过程的观察. 激光生物学报, 2006, 15(1): 9–14. Zhang H H, Liu X D, Lu Y G, Feng J H. Observation on the double fertilization and embryogenesis in autotetraploid rice., 2006, 15(1): 9–14 (in Chinese with English abstract).
[65] He Y C, Ge J, Wei Q, Jiang A M, Gan L, Song Z J, Cai D T. Using a polyploid meiosis stability (PMeS) line as a parent improves embryo development and the seed set rate of a tetraploid rice hybrid., 2011, 91: 325–335.
[66] Wu J W, Shahid M Q, Guo H B, Yin W, Chen Z X, Wang L, Liu X D, Lu Y G. Comparative cytological and transcriptomic analysis of pollen development in autotetraploid and diploid rice., 2014, 27: 181–196.
[67] Li X, Shahid M Q, Xia J, Lu Z J, Fang N, Wang L, Wu J W, Chen Z X, Liu X D. Analysis of small RNAs revealed differential expressions during pollen and embryo sac development in autotetraploid rice., 2017, 18: 129.
[68] Li X, Yu H, Jiao Y M, Shahid M Q, Wu J W, Liu X D. Genome-wide analysis of DNA polymorphisms, the methylome and transcriptome revealed that multiple factors are associated with low pollen fertility in autotetraploid rice., 2018, 13: e201854.
[69] Chen L, Shahid M Q, Wu J, Chen Z X, Wang L, Liu X D. Cytological and transcriptome analyses reveal abrupt gene expression for meiosis and saccharide metabolisms that associated with pollen abortion in autotetraploid rice., 2018, 293: 1407–1420.
[70] Li X, Shahid M Q, Wen M S, Chen S L, Yu H, Jiao Y M, Lu Z J, Li Y J, Liu X D. Global identification and analysis revealed differentially expressed lncRNAs associated with meiosis and low fertility in autotetraploid rice., 2020, 20: 82.
[71] 涂升斌, 孔繁伦, 徐琼芳, 何涛. 水稻同源四倍体杂种优势利用技术新体系的研究. 中国科学院院刊, 2003, 18: 426–428. Tu S B, Kong F L, Xu Q F, He T. Breakthrough in hybrid rice breeding with autotetraploid., 2003, 18: 426–428 (in Chinese with English abstract).
[72] Tu S B, Luan L, Liu Y H, Long W B, Kong F L, He T, Xu Q F, Yan W G, Yu M Q. Production and heterosis analysis of rice autotetraploid hybrids., 2007, 47: 2356–2363.
[73] Guo H B, Mendrikahy J N, Xie L, Deng J F, Lu Z J, Wu J W, Li X, Shahid M Q, Liu X D. Transcriptome analysis of neo-tetraploid rice reveals specific differential gene expressions associated with fertility and heterosis., 2017, 7: 40139.
[74] Yu H, Shahid M Q, Li Q H, Li Y D, Li C, Lu Z J, Wu J W, Zhang Z M, Liu X D. Production assessment and genome comparison revealed high yield potential and novel specific alleles associated with fertility and yield in neo-tetraploid rice., 2020, 13: 32.
[75] Koide Y, Kuniyoshi D, Kishima Y. Fertile tetraploids: New resources for future rice breeding?, 2020, 11: 1231.
[76] 刘向东, 吴锦文, 陆紫君, Shahid M Q. 同源四倍体水稻: 低育性机理、改良与育种展望. 遗传, 2023, 45: 781–792. Liu X D, Wu J W, Lu Z J, Shahid M Q. Autotetraploid rice: challenges and opportunities.(Beijing), 2023, 45: 781–792 (in Chinese with English abstract).
[77] 谭禄宾, 孙传清. 四倍体野生稻快速驯化: 启动人类新农业文明. 植物学报, 2021, 56(2): 1–4.Tan L B, Sun C Q. Rapid domestication of wild allotetraploid rice: starting a new era of human agricultural civilization., 2021, 56(2): 1–4 (in Chinese with English abstract).
[78] 朱英国. 杂交水稻研究50年. 科学通报, 2016, 61: 3740–3747. Zhu Y G. Fifty years of hybrid rice research in China., 2016, 61: 3740–3747 (in Chinese with English abstract).
[79] 宋兆建, 杜超群, 戴兵成, 陈冬玲, 陈建国, 蔡得田. 两个强优势多倍体籼粳亚种杂交稻生长习性研究. 中国农业科学, 2006, 39: 1–9. Song Z J, Du C Q, Dai B C, Chen D L, Chen J G, Cai D T. Studies on the growth habits and characteristics of two polyploidhybrid rice with powerful heterosis., 2006, 39: 1–9 (in Chinese with English abstract).
[80] 刘建新, 陈建国, 陈冬玲, 宋兆建, 戴兵成, 蔡得田. 强优势多倍体杂交水稻亲本的生长特性和开花习性. 中国农业科学, 2008, 41: 3456–3464. Liu J X, Chen J G, Chen D L, Song Z J, Dai B C, Cai D T. Studies on growth and flowering characteristics of polyploid hybrid rice parents with strong heterosis., 2008, 41: 3456–3464 (in Chinese with English abstract).
[81] Zhang X H, Zuo B, Song Z J, Wang W, He Y C, Liu Y H, Cai D T. Breeding and study of two new photoperiod- and thermos- sensitive genic male sterile lines of polyploid rice (L.)., 2017, 7: 14744.
[82] Chen Y, Shahid M Q, Wu J W, Deng R L, Chen Z X, Wang L, Liu G Q, Zhou H, Liu X D. Thermo-sensitive genic male sterile lines of neo-tetraploid rice developed through gene editing technology revealed high levels of hybrid vigor., 2022, 11: 1390.
[83] Gan L, Huang B S, Song Z J, Zhang Y C, Zhang Y J, Chen S, Tong L Q, Wei Z S, Yu L X, Luo X B, Zhang X H, Cai D T, He Y C. Unique glutelin expression patterns and seed endosperm structure facilitate glutelin accumulation in polyploid rice seed., 2021, 14: 61.
[84] 湛明月. 四倍体水稻高蛋白品系的蛋白品质及其机理初步研究. 湖北大学硕士学位论文, 湖北武汉, 2023. Zhan M Y. Preliminary Studies on the Protein Quality and Its Mechanism of High Protein Tetraploid Rice Lines. MS Thesis of Hubei University, Wuhan, Hubei, China, 2023 (in Chinese with English abstract).
[85] Ge S, Sang T, Lu B R, Hong D Y. Phylogeny of rice genomes with emphasis on origins of allotetraploid species., 1999, 96: 14400–14405.
[86] Wing R A, Purugganan M D, Zhang Q F. The rice genome revolution: from an ancient grain to green super rice., 2018, 19: 505–517.
[87] 何光存. 细胞工程与分子生物学相结合: 野生稻优异种质资源利用的有效途径. 生物工程进展, 1998, 18(2): 41–45. He G C. Cellular and molecular approaches in exploitation of useful genes in wild rice., 1998, 18(2): 41–45 (in Chinese with English abstract).
[88] Sun C Q, Wang X K, Li Z C, Yoshimura A, Iwata N. Comparison of the genetic diversity of common wild rice (Griff.) and cultivated rice (L.) using RFLP markers., 2001, 102: 157–162.
[89] Soltis P S. Ancient and recent polyploid in angiosperm., 2005, 166: 1–5.
[90] Otto S P. The evolutionary consequences of polyploidy., 2007, 131: 452–462.
[91] Jiang W K, Liu Y L, Xia E H, Gao L Z. Prevalent role of gene features in determining evolutionary fates of whole-genome duplication duplicated genes in flowering plants., 2013, 161: 1844–1861.
[92] Lagudah E S, Appels R. Wheat as a model system. In: Chapman G P, eds. Grass Evolution and Domestication. Cambridge: Cambridge University Press, 1992. pp 225–265.
[93] Wang A Y, Zhang X H, Yang C H, Song Z J, Du C Q, Chen D L, He Y C, Cai D T. Development and characterization of synthetic amphiploid (AABB) betweenand., 2013, 189: 1–8.
[94] Zhang X H, Wang W, Jin J J, Liao S R, Liu X N, Song Z J, Cai D T. Cytomorphological characterization of the backcross progeny of synthetic amphiploid rice (AABB) and tetraploid(AAAA)., 2013, 5(12): 30–37.
[95] Zhang X H, Wang A Y, Du C Q, Song Z J, Wang W, He Y C, Cai D T. An efficient method of developing synthetic allopolyploid rice (spp.)., 2014, 61: 809–816.
[96] 王爱云. 水稻异源多倍体的构建及其细胞遗传学研究. 湖北大学硕士学位论文, 湖北武汉, 2003. Wang A Y. Construction and Cytogenetical Study of Rice Allopolyploid. MS Thesis of Hubei University, Wuhan, Hubei, China, 2003 (in Chinese with English abstract).
[97] 杜超群. 栽培稻/野生稻杂种及杂种多倍体的创造和研究. 湖北大学硕士学位论文, 湖北武汉, 2006. Du C Q. Creation and Studies of Hybrids and Polyploid Hybrids between Cultivated Rice and Wild Rice. MS Thesis of Hubei University, Wuhan, Hubei, China, 2006 (in Chinese with English abstract).
[98] 祝剑峰, 刘幼琪, 王爱云, 宋兆建, 陈冬玲, 蔡得田. 异源六倍体水稻AACCDD和三倍体水稻ACD生殖特性的细胞胚胎学研究. 植物遗传资源学报, 2008, 9: 350–357. Zhu J F, Liu Y Q, Wang A Y, Song Z J, Chen D L, Cai D T. Cellular and embryologic studies on allohexaploid rice AACCDD and triploid rice ACD., 2008, 9: 350–357 (in Chinese with English abstract).
[99] 宋兆建, 杜超群, 胡亚平, 唐志强, 陈冬玲, 何玉池, 何光存, 蔡得田. 栽培稻与疣粒野生稻杂种二倍体和四倍体的鉴定及比较. 作物学报, 2010, 36: 1144–1152.Song Z J, Du C Q, Hu Y P, Tang Z Q, Chen D L, He Y C, He G C, Cai D T. Identification and comparison of diploid and tetraploid hybrids of×., 2010, 36: 1144–1152 (in Chinese with English abstract).
[100] He W T, Zhang X H, Lv P C, Wang W, Wang J, He Y C, Song Z J, Cai D T. Full‑length transcriptome reconstruction reveals genetic differences in hybrids ofandwith different ploidy and genome compositions., 2022, 22: 131.
[101] 秦瑞珍, 宋文昌, 郭秀平. 同源四倍体水稻花药培养在育种中的应用. 中国农业科学, 1992, 25: 6–13. Qin R Z, Song W C, Guo X P. Studies on the application of anther culture of autotetraploid rice in breeding., 1992, 25: 6–13 (in Chinese with English abstract).
[102] 丁乙. 水稻籼粳交四倍体回复二倍体后代的遗传效应分析. 吉林农业大学硕士学位论文, 吉林长春, 2022. Ding Y. Analysis of Genetic Effects of Tetraploid Reverted Diploid Progenies ofRice. MS Thesis of Jilin Agricultural University, Changchun, Jilin, China, 2022 (in Chinese with English abstract).
[103] 宋兆建, 冯紫旖, 屈天歌, 吕品苍, 杨晓璐, 湛明月, 张献华, 何玉池, 刘育华, 蔡得田. 四倍体水稻回复二倍体品系的籼粳属性鉴定和杂种优势利用初探. 作物学报, 2023, 49: 2039–2050. Song Z J, Feng Z Y, Qu T G, Lyu P C, Yang X L, Zhan M Y, Zhang X H, He Y C, Liu Y H, Cai D T.attribute identification and heterosis utilization of diploid rice lines reverted from tetraploid rice., 2023, 49: 2039–2050 (in Chinese with English abstract).
Induction, identification and salt-alkali tolerance evaluation of tetraploid Haidao 86
LI Hang-Yu1, LIU Xin-Cheng1, HE Wen-Ting1, LIU Ke-Yi1, QIAO Zhen-Hua1, LYU Pin-Cang1, ZHANG Xian-Hua1, HE Yu-Chi1, CAI De-Tian1,2, and SONG Zhao-Jian1,*
1School of Life Sciences, Hubei University, Wuhan 430062, Hubei, China;2Wuhan Polyploid Biotechnology Co., Ltd., Wuhan 430345, Hubei, China
Polyploidization is an important trend in plant evolution. Polyploid plants often have stronger resistance to stress than diploid ones. Haidao 86 is a rice germplasm resource with strong salt-alkali tolerance, which has important utilization value for the application of saline-alkaline land and the increase of grain yield. To make full use of the advantages of enhanced stress resistance in polyploid plants and breed new tetraploid rice varieties with stronger salt-alkali tolerance, diploid Haidao 86 was submitted forchromosome doubling to create autotetraploid Haidao 86 in this study. After stress treatment with NaCl, Na2CO3, and PEG-6000, the phenotypic indexes, physiological and biochemical indexes of tetraploid and diploid Haidao86 at germination and seedling stages were detected to understand the salt-alkali tolerance characteristics and differences between them. The results showed as follows: (1) Bychromosome doubling, tetraploid plants can be efficiently induced, with a doubling rate of 27.63%. (2) Compared with diploid Haidao 86, the nuclear DNA content and root tip chromosome number of tetraploid Haidao 86 was doubled. There were significant changes in morphology and agronomic traits, such as plants becoming shorter, stems becoming thicker, effective panicles per plant decreasing, grain and thousand grain weight increasing, total grains per panicle, and filled grains per panicle decreasing, and seed setting rate decreasing. (3) At germination stage, the germination energy, germination rate, shoot length, root length, root number, and water content of tetraploid Haidao 86 were the highest, followed by diploid Haidao 86, and the control Huanghuazhan was the lowest. Tetraploid Haidao 86 had the lowest salt alkali damage rate and grade, followed by diploid Haidao 86, and the control Huanghuazhan had the highest salt alkali damage rate and grade. (4) At seedling stage, tetraploid Haidao 86 had the highest proline and chlorophyll content, the lowest malondialdehyde content and relative electrical conductivity, the highest superoxide dismutase and peroxidase activity, followed by diploid Haidao 86, and the control Huanghuazhan had the lowest proline and chlorophyll content, the highest malondialdehyde content and relative electrical conductivity, and the lowest superoxide dismutase and peroxidase activity. So tetraploid Haidao 86 had significant advantages in salt-alkali tolerance in both phenotypic indexes, and physiological and biochemical indexes, and had stronger salt-alkali tolerance than diploid Haidao 86. The results lay the foundation for in-depth research on the salt-alkali tolerance mechanism of Haidao 86, and provide the material and theoretical basis for the breeding of new salt-alkali resistant tetraploid rice varieties.
Haidao 86;chromosome doubling; tetraploid; salt-alkali tolerance; germination energy; germination rate; physiological and biochemical indexes
10.3724/SP.J.1006.2024.32035
本研究由武汉市重大科技专项和武汉市品牌农业发展计划项目资助。
This study was supported by the Major Science and Technology Project of Wuhan and the Brand Agriculture Development Plan of Wuhan.
宋兆建, E-mail: zjsong99@126.com
E-mail: 782115250@qq.com
2023-08-29;
2023-10-23;
2023-11-13.
URL: https://link.cnki.net/urlid/11.1809.S.20231110.1434.010
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

