甘蓝型油菜苗期响应渍害胁迫的生理调控机制
周香玉 徐劲松 谢伶俐 许本波 张学昆
甘蓝型油菜苗期响应渍害胁迫的生理调控机制
周香玉 徐劲松 谢伶俐*许本波*张学昆
湿地生态与农业利用教育部工程研究中心 / 长江大学, 湖北荆州 434025
长江流域是中国油菜主产区, 该区域常年湿润多雨, 且产区实行油菜-水稻轮作制度, 导致渍害频发。为明确甘蓝型油菜(L.)对苗期渍害的响应机制, 本研究采用盆栽试验, 以强耐渍品系YZ12、中等耐渍品系YZ45和不耐渍品系YZ59为试验材料, 研究苗期淹水对油菜表型性状、生理特性、光合作用、相关基因相对转录水平等的影响, 同时分析了外源激素抑制剂对油菜渍害胁迫的影响。结果表明, 淹水胁迫严重抑制油菜生长, 根系活力可作为衡量淹水胁迫对油菜生长影响的指示指标。根细胞超微结构观察发现, 淹水胁迫导致油菜根系细胞发生质壁分离及细胞器破碎解体, 强、中耐渍油菜的细胞器受损程度较小, 能够在淹水胁迫中维持较为正常的细胞形态; 淹水胁迫下根部细胞骨架相关基因、、、相对转录水平显著下调至对照水平(CK)的0.2~0.5倍; 无氧呼吸相关基因、、表达量显著升高, 为CK的3~6倍, 且在中、强耐渍油菜中诱导表达水平更高。过氧化物酶(peroxidase, POD)、超氧化物歧化酶(superoxide dismutase, SOD)活性随淹水时间延长呈先升后降趋势, 过氧化氢酶(catalase, CAT)活性和丙二醛(malondialdehyde, MDA)含量呈升高趋势, 其中强耐渍品系抗氧化酶活性相对较高, 而MDA增幅较小。淹水胁迫严重影响油菜叶片光合效率及叶绿素含量, 导致油菜叶绿素含量、光合速率、气孔导度和蒸腾速率显著下降, 胞间CO2浓度显著升高, 且不耐渍品系变化幅度相对较大。淹水胁迫导致油菜乙烯(ethylene, ET)和脱落酸(abscisic acid, ABA)含量显著升高, 其中强耐渍品系ET含量较高, 不耐渍品系ABA含量较高; 强耐渍品系的ET信号相关基因、相对转录水平显著上调, 不耐渍品系ABA合成相关基因相对转录水平上调。外源喷施激素抑制剂可改善淹水胁迫对油菜的伤害, 但不同外源激素抑制剂效果差异明显。综上, 不同耐渍性甘蓝型油菜苗期对淹水胁迫响应在表型、生理代谢、光合、激素和基因转录水平存在差异。甘蓝型油菜通过调控细胞骨架、无氧呼吸、激素代谢相关基因的相对转录水平, 引起植株内抗氧化酶活性、激素水平、光合效率、根部超微结构及根系活力改变, 进而响应淹水胁迫。
甘蓝型油菜; 淹水胁迫; 根系超微结构; 光合特性; 抗氧化酶活性; 激素水平; 转录调控
油菜是中国第一大油料作物。菜籽油占国内油料作物产油量的55%以上, 但中国食用油自给率不足30%, 油菜籽严重依赖进口。因此, 发展油菜生产对维护国家食用油供给安全具有重要的战略意义[1]。长江流域是中国冬油菜主产区, 该区域常年湿润多雨, 实行油菜-水稻轮作制度, 水旱栽培模式使得土壤黏度增大、通透性变差, 渍害严重[2-4]。据统计, 渍害胁迫威胁到中国20%种植面积的油菜[5], 导致油菜产量降低、品质下降[6-7]。因此, 提高油菜品种的耐渍能力已成为长江流域地区油菜育种的主要目标之一。
渍害也称湿害, 是因洪、涝积水或地下水位过度升高, 造成土壤含水率过高甚至饱和, 导致作物根系长期缺氧并引起植株发育不良而减产[8]。植物根系是受渍害胁迫最直接、最敏感的部位。渍水胁迫导致根系活力降低、根系吸收能力减弱、植株光合作用下降, 进而引起生长受阻、产量大幅降低甚至死亡[9-10]。植物生长调节剂为重要的逆境响应物质,广泛参与植物耐渍调控。研究发现, ET作为信号分子, 在渍涝胁迫下ET释放速率迅速提高, 耐渍/淹植物可通过ET感知低氧或厌氧胁迫并通过与ABA、赤霉素(gibberellins, GA)等激素互作诱发适应性反应[11]。拟南芥、水稻中ET通过与植物激素如IAA、ABA、GA、细胞分裂素(cytokinin, CTK)、茉莉酸(jasmonic acid, JA)和油菜素内酯(brassinosteroid, BR)的相互作用调控根系发育[12]。水稻通过ET与GA正向协同调控响应淹水胁迫, 与ABA拮抗调控节间伸长[13]。
目前油菜耐渍研究主要集中在耐渍性筛选与鉴定、渍害胁迫下生理生化变化及产量品质形成[5,14-19];耐渍机理研究方面主要涉及O2的吸收和转运, 保护酶活性变化及保护性物质合成[17-21], 但油菜对淹水胁迫的抗逆性机制尚不完全清楚, 特别是根系结构、激素水平与油菜的耐渍性的关系尚不明确。长江大学油料作物团队从国内外收集油菜种质资源6000余份, 在前期工作中, 从1700份核心种质资源中筛选到不同耐渍甘蓝型油菜种质资源100余份。本研究选择3个油菜品系(强耐渍、中等耐渍、不耐渍)为试验材料, 从表型、根系细胞超微结构、生理、激素、逆境相关基因相对转录水平及外源激素抑制剂对淹水胁迫下油菜伤害的调节等方面全面分析不同耐渍性油菜品系苗期响应渍害的差异, 揭示油菜响应渍害胁迫的机理, 为探讨增强甘蓝型油菜耐渍性的途径和寻找减缓渍害的方法提供理论依据和指导。
1 材料与方法
1.1 试验地点及材料
试验于2021年3月至2022年12月在长江大学生命科学学院实验室进行。
供试材料为甘蓝型油菜强耐渍品系YZ12、中等耐渍品系YZ45、不耐渍品系YZ59, 由长江大学油料作物团队提供。
1.2 试验设计
选取籽粒饱满, 大小均匀, 无病虫害的供试材料种子, 双层滤纸法萌发后点播到种植盘中, 置于温度25℃, 光周期16 h光照/8 h黑暗, 光强52 μmol m–2s–1, 相对湿度为80%条件下培养7 d后, 移栽到装有育苗基质的盆钵中继续培养。
淹水处理: 幼苗培养至三至四叶期淹水处理及观测。共设2个处理, 分别为CK (正常供水)、T (淹水处理, 水面高出土面1 cm)。
外源生长调节剂处理: 幼苗培养至七叶至八叶期, 进行淹水及外源生长调节剂处理。共设4个处理, 分别为CK (正常供水)、T1 (淹水处理+喷施蒸馏水)、T2 (淹水处理+喷施GA抑制剂烯效唑uniconazole)、T3 (淹水处理+喷施ET抑制剂硫代硫酸银STS)、T4 (淹水处理+喷施ABA抑制剂去甲二氢愈创木酸NDGA)。
上述处理过程中光照及温度条件一致, 每个处理重复3次。
1.3 指标测定及方法
1.3.1 表型观察及根系活力测定 淹水处理: 植株出现明显发黄、轻微萎蔫(淹水处理6 d)时随机选取不同处理5株植株, 考察株高、叶长、叶宽、根长等表型性状并测定根系活力; 根系活力测定采用四氮唑(2,3,5-tripheyl tetrazolium chloride, TTC)还原法测定[22]。外源生长调节剂处理: 淹水处理7 d并每天同一时间喷施外源生长调节剂至油菜叶片表面均匀覆盖液体为止, 之后正常供水下恢复生长7 d, 进行表型观察。
1.3.2 抗氧化酶活性及丙二醛含量测定 淹水处理0 d、6 d、9 d、12 d取各处理第2、3片成熟叶片测定抗氧化酶活性及MDA含量。采用氮蓝四唑光还原法测定SOD活性, 愈创木酚法测定POD活性[22], 紫外吸收法测定CAT活性[23], 硫代巴比妥酸法测定MDA含量[22]。每个处理3次生物学重复。
1.3.3 光合速率及叶绿素含量的测定 淹水处理0 d、6 d、12 d选取各处理长势一致的油菜植株第2、3片成熟的健康叶片, 使用LI-6400XT光合仪进行净光合速率、气孔导度、叶间CO2浓度和蒸腾速率测定, 每个处理5次生物学重复, 3次技术重复。采用乙醇丙酮法测定叶绿素含量[22], 每个处理3次生物学重复。
1.3.4 内源激素含量的测定 淹水处理0 d、6 d、9 d、12 d时选取长势一致的幼苗, 取相同叶位的嫩叶及下部幼嫩根系制备混合样, 取样后立即于液氮中速冻,-80℃保存, 用于内源GA、ABA、ET提取。采用甲醇浸提法提取内源GA、ABA[24], 高效液相色谱仪(Waters e2695, 美国)测定其含量。色谱柱Waters Symmetry Shield RP18 (4.6 mm×150 mm, 5 μm), 流动相为甲醇和1%的乙酸溶液(甲醇∶乙酸溶液=50∶50), 柱温35℃, 流速1 mL min-1, 检波254 nm, 进样量10 µL。使用酶联生物植物乙烯(ETH) ELSA试剂盒测定ET含量。每个材料3次生物学重复, 3次技术重复。
1.3.5 根系细胞超微结构观察 将油菜培养至三至四叶期, 淹水处理至植株开始出现明显发黄、轻微萎蔫(淹水处理6 d左右)时取油菜根尖, 参照Ali等[25]及徐国伟等[26]方法稍加改良观察根尖细胞超微结构。用锋利刀片将根样切成1 mm左右的小段, 立即投入到2.5%戊二醛中于4℃冰箱中预固定过夜; 0.1 mol L–1磷酸缓冲液(PBS, pH 7.2)冲洗3次, 每次15~20 min; 通风橱中1% OsO4固定4 h后PBS清洗3次, 每次15~20 min; 再经梯度浓度乙醇脱水, 丙酮过渡, 树脂浸透和包埋固化后在Leica EM UC7超薄切片机上切成70 nm左右的切片, 2% (w/v)醋酸双氧铀和柠檬酸铅双重染色, 最后置于透射电镜(日立HT7800, 日本)下观察根细胞形态, 并照相记录。
1.3.6 根部相关基因表达水平分析 将油菜培养至三叶至四叶期, 淹水处理48 h后选取各处理长势一致的幼苗, 取中下部根系, 取样后立即于液氮中速冻,-80℃保存。用TRIzol (Invitrogen, 美国)法提取RNA, 并用HiScript III 1st Strand cDNA Synthesis Kit试剂盒(Vazyme)完成反转录。利用Primer软件设计油菜根部相关基因荧光定量PCR引物(表1), 以甘蓝型油菜(基因编号为NM_001316010.1)为内参基因, 在CFX96TM荧光定量PCR仪(Bio- Rad, 美国)完成qRT-PCR, 用2–DDCT法计算目的基因相对转录水平。
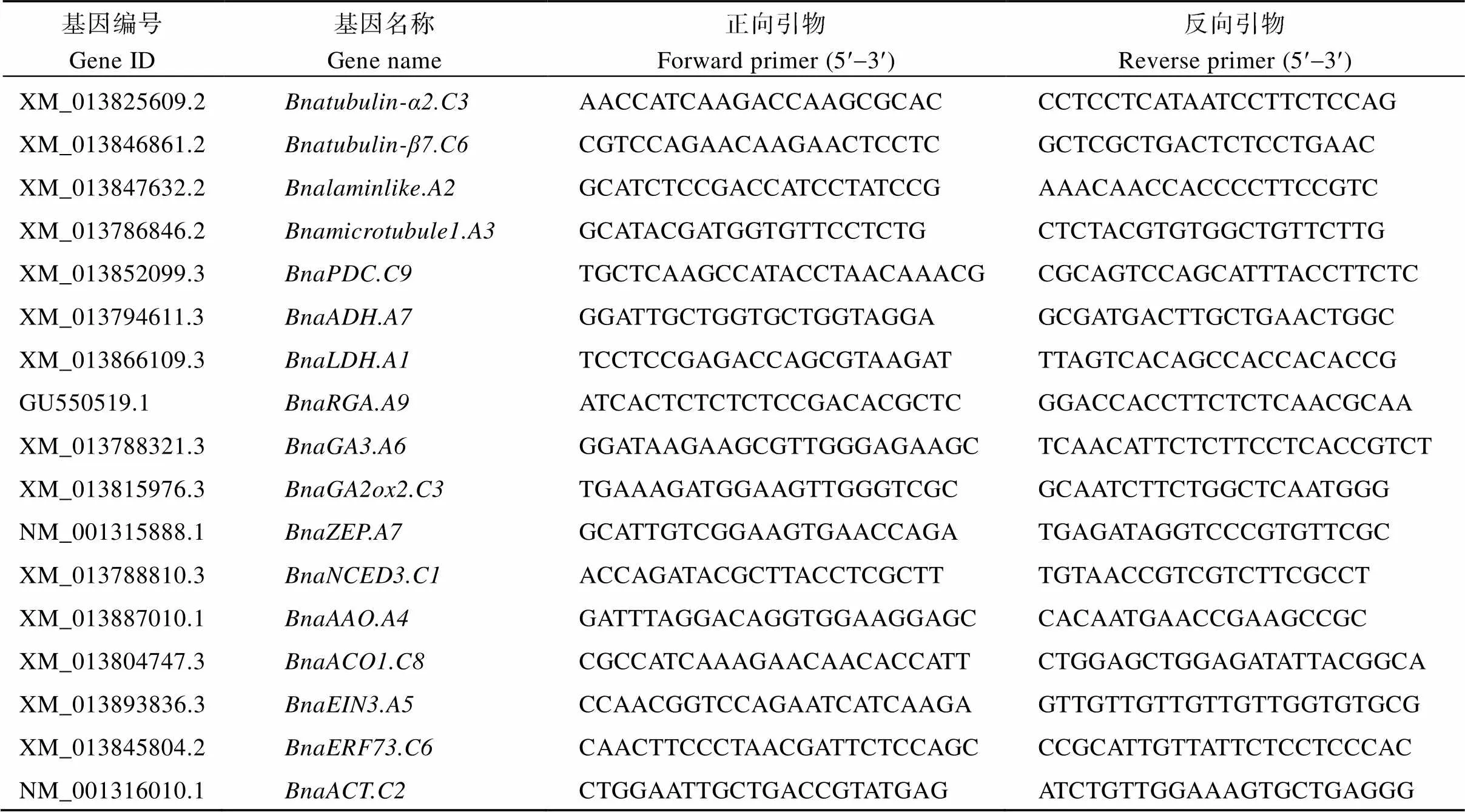
表1 qRT-PCR所用引物序列
1.4 数据统计及分析
采用Microsoft Excel进行原始数据录入、计算和整理, 利用DPS 7.05数据处理系统进行统计分析, Craphpad prism 9软件作图。采用最小显著差异法(Least Significant Difference, LSD)进行处理间比较。
2 结果与分析
2.1 淹水胁迫对甘蓝型油菜生长的影响
由图1和表2可知, 淹水胁迫严重影响甘蓝型油菜幼苗生长。与正常供水对照(CK)相比, 淹水处理(T)油菜植株明显较矮, 叶片较小, 有变黄萎焉趋势, 根长变短, 侧根数增加。其中强耐渍品系YZ12生长情况相对较好, 不定根数量多, 不耐渍品系YZ59植株弱小, 中等耐渍品系YZ45长势介于两者之间(图1)。
由表2可知, 强耐渍品系YZ12、中等耐渍品系YZ45、不耐渍品系YZ59淹水胁迫下根长、株高、叶长、叶宽以及地上部鲜重显著降低, 根长分别比CK下降30.39%、42.04%、61.39%, 株高分别比CK下降25.39%、22.47%、24.68%, 叶长分别比CK下降45.45%、42.31%、46.78%, 叶宽分别比CK下降46.51%、42.94%、51.27%, 地上部鲜重分别比CK下降34.58%、39.56%、71.11%。淹水胁迫导致各品系油菜根系活力显著降低, 其中不耐渍油菜品系YZ59根系活力降幅最大, 比CK下降29.49%, 而强耐渍品系YZ12仅下降15.11%, 在淹水胁迫下仍能保持相对较高的根系活力水平。
参照胡亚丽等[27]方法, 将地上部鲜重为参考数列, 株高、叶长、根系活力等5个指标设为比较数列, 对不同耐渍性油菜品系各指标进行灰色关联度分析(表3), 其关联顺序依次为根系活力>叶宽>根长>叶长>株高, 说明根系活力、叶宽、根长对地上部鲜重(生物量)的影响最大, 表明根系活力可作为衡量淹水胁迫对甘蓝型油菜生长影响的指示指标。

图1 淹水胁迫6 d不同耐渍性甘蓝型油菜形态
CK: 正常供水; T: 淹水处理6 d。
CK: normal water supply; T: waterlogging treatment for 6 days.
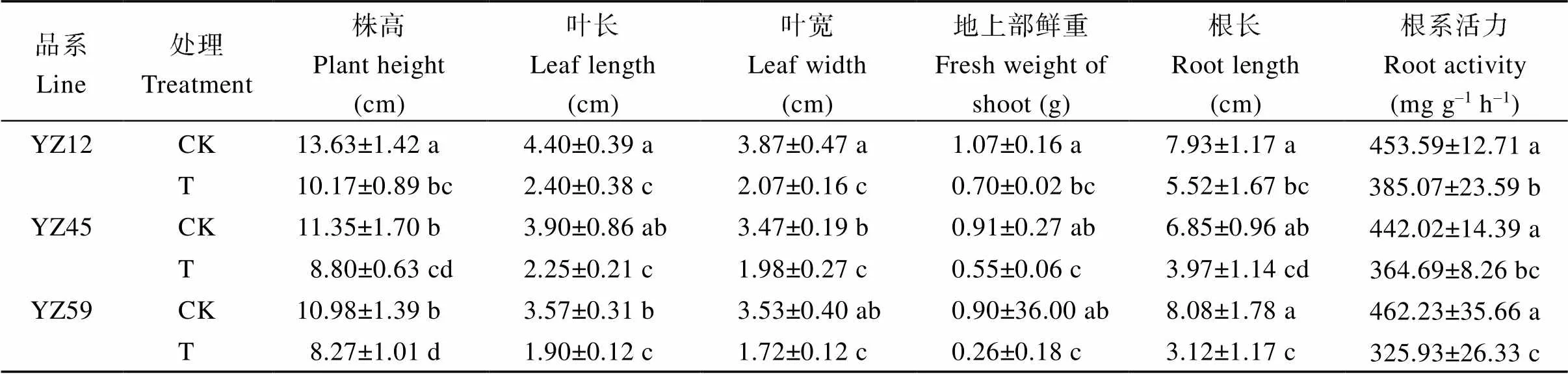
表2 淹水6 d时3个油菜品系形态指标及根系活力
表中数据为平均值±标准误, 同列不同小写字母表示处理间在0.05概率水平差异显著。CK: 正常供水; T: 淹水处理6 d。
Data in the table are means ± SEs. Different lowercase letters in the same column indicate significant difference at the 0.05 probability level. CK: normal water supply; T: waterlogging treatment for 6 days.
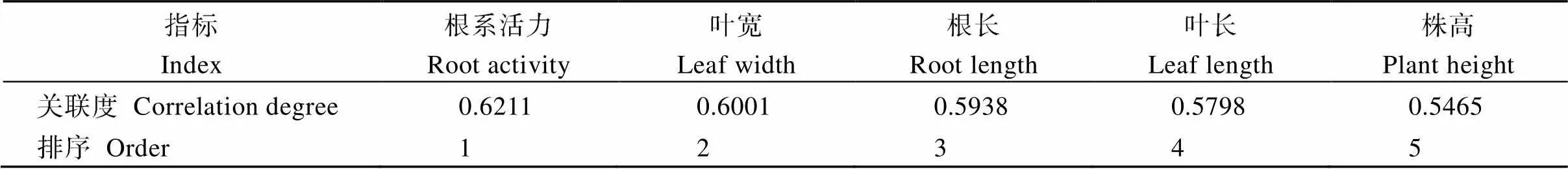
表3 淹水6 d时3个油菜品系各指标的灰色关联分析
2.2 淹水胁迫下甘蓝型油菜根系超微结构观察及根中相关基因相对转录水平分析
根系超微结构观察发现, 正常供水情况下(CK, 图2-A~C), 油菜根部各细胞之间排列紧密, 细胞壁结构完整, 无质壁分离现象, 细胞内细胞器完整丰富, 均以正常状态分布于细胞边缘。淹水胁迫6 d时, 不耐渍品系YZ59根细胞空腔, 几乎看不到细胞器, 细胞膜降解严重并向细胞中心收缩, 周围可见少数细胞器降解残骸, 细胞壁明显变薄(图2-D); 中等耐渍品系YZ45根细胞清晰可见且排列紧密, 但也有空泡化现象, 细胞器破碎降解现象严重, 有大量细胞器残骸及其内含物分布于细胞膜附近, 出现质壁分离现象, 部分细胞膜破碎消失, 细胞壁略微变薄(图2-E); 强耐渍品系YZ12的根细胞结构完整, 形态正常, 各细胞紧密排列, 但部分细胞出现空泡化现象, 细胞内细胞核、线粒体等细胞器被挤压, 更贴合于细胞壁, 另外个别细胞内细胞核变形, 核膜降解形成小碎片分布在细胞内(图2-F)。说明强耐渍性品系YZ12对淹水胁迫有更强的耐受性, 根系结构损伤较小, 从而保持较强的根系活力。

图2 不同耐渍性甘蓝型油菜根细胞超微结构
CK: 正常供水; T: 淹水处理6 d; A~C: 正常供水状态下不同耐渍性油菜根细胞超微结构; D~F: 淹水胁迫下不同耐渍性油菜根细胞超微结构。
CK: normal water supply; T: waterlogging treatment for 6 days; A, B, C: root cells ultrastructure ofwith different waterlogging tolerance under normal water supply conditions; D, E, F: ultrastructure of root cells inwith different waterlogging tolerance under flooding stress.
对根中细胞骨架相关基因相对转录水平分析发现(图3), 正常供水情况下(CK), 3种不同耐渍性甘蓝型油菜根部细胞骨架相关基因的相对转录水平差异不显著; 淹水胁迫48 h (T)后根部细胞骨架相关基因的相对转录水平显著下调, 降为CK的0.2~0.5倍。其中不耐渍品系YZ59根部微管相关蛋白基因()和微管结合蛋白相关基因()相对转录水平显著低于强耐渍品系YZ12 (图3-A, D)。
对根中无氧呼吸相关基因相对转录水平分析发现, 正常供水情况下(CK), 不同耐渍性甘蓝型油菜根中无氧呼吸相关基因、和的相对转录水平差异不显著, 但淹水胁迫48 h(T)后其相对转录水平显著上调(图4)。淹水处理48 h, 强、中等和不耐渍油菜品系相对转录水平分别是CK的3.47倍、5.06倍和5.82倍, 且中等、不耐渍品系相对转录水平显著高于强耐渍品系(图4-A)。强、中等耐渍油菜相对转录水平高于不耐渍品系(图4-B); 强耐渍品系相对转录水平是CK的6.21倍, 显著高于中等、不耐渍品系(图4-C)。表明, 淹水胁迫引起根中细胞骨架、无氧呼吸相关基因转录水平发生变化, 破坏油菜根部细胞的细胞骨架结构, 进而影响根系结构及根系活力, 但因敏感性不同, 在不同耐渍性品系中表现出明显差异。
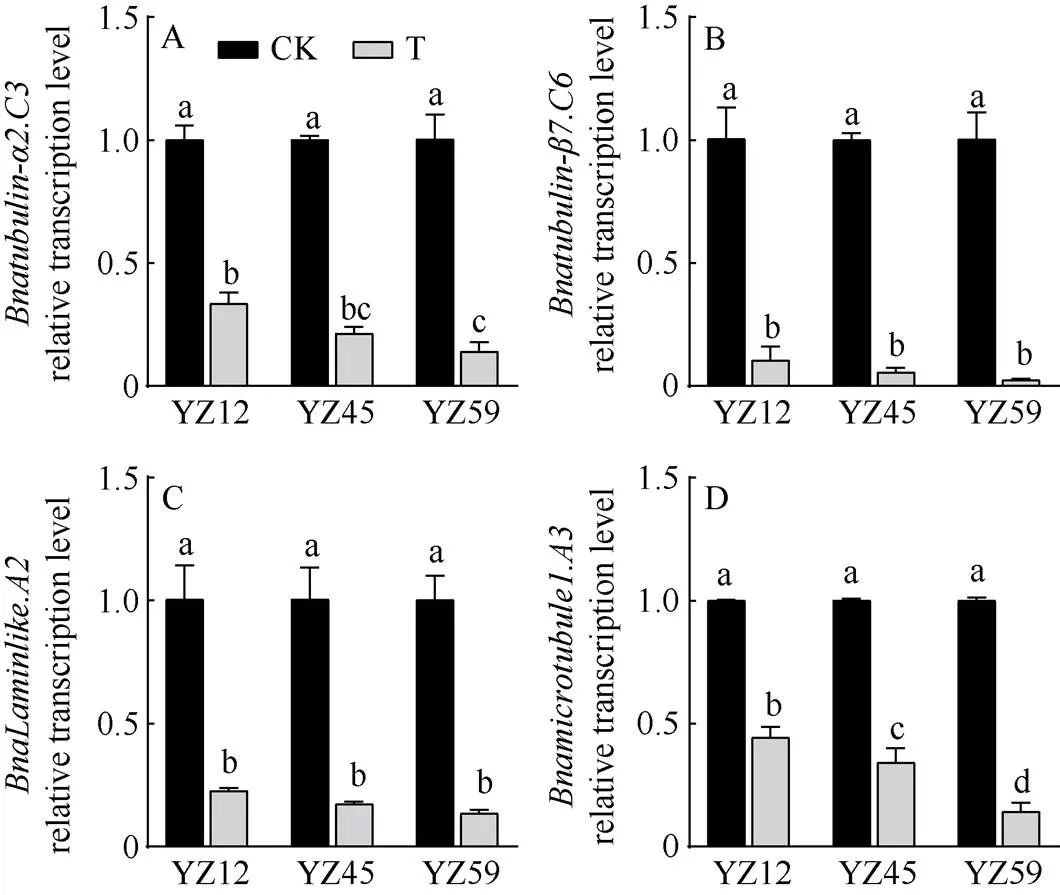
图3 根中细胞骨架相关基因转录水平分析
CK: 正常供水; T: 淹水处理48 h。不同小写字母表示处理间在0.05概率水平差异显著。
CK: normal water supply; T: waterlogging treatment for 48 hours. Different lowercase letters indicate significant differences at the 0.05 probability level.
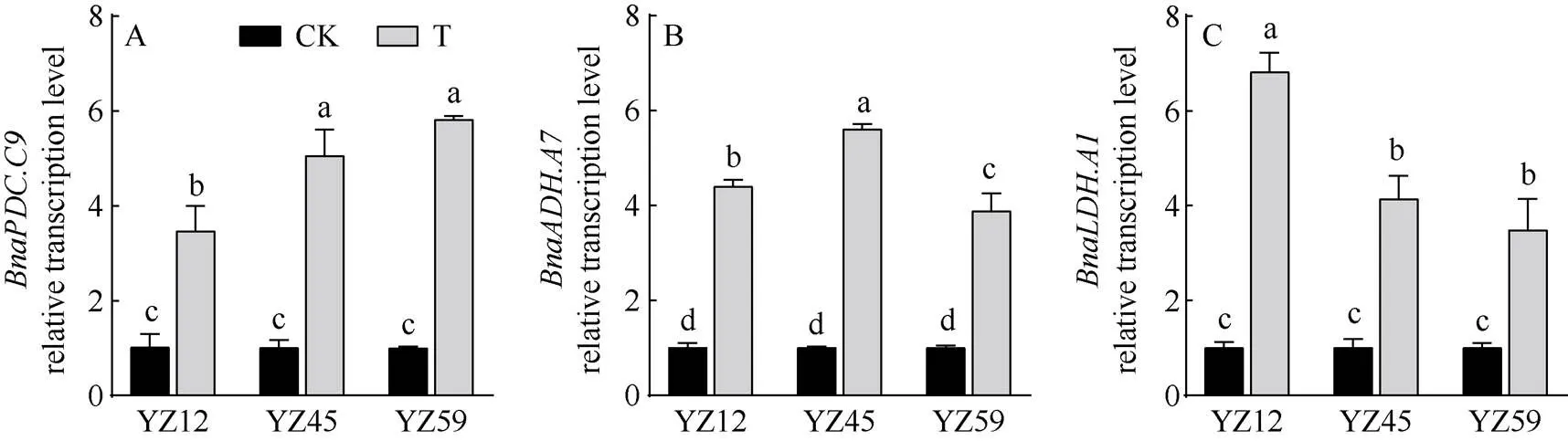
图4 根中无氧呼吸相关基因转录水平分析
CK: 正常供水; T: 淹水处理48 h。不同小写字母表示处理间在0.05概率水平差异显著。
CK: normal water supply; T: waterlogging treatment for 48 hours. Different lowercase letters indicate significant differences at the 0.05 probability level.
2.3 淹水胁迫对甘蓝型油菜内源激素的影响
淹水胁迫下不同耐渍性甘蓝型油菜GA含量变化趋势存在差异, 强、中等耐渍品系的GA含量随淹水时间延长呈上升趋势, 而不耐渍品系YZ59呈先升后降趋势。淹水处理0 d时, 3个不同耐渍品系GA含量差异不显著, 但随淹水时间延长, 强、中等耐渍品系GA含量显著高于不耐渍品系; 淹水处理6 d、9 d时, 强、中等耐渍品系GA含量差异不显著, 但12 d时强耐渍品系显著高于中等耐渍品系(图5-A)。淹水胁迫导致甘蓝型油菜ABA含量呈先升后降趋势。淹水处理6 d时强耐渍品系ABA含量达到最大值(2.14 μg g–1), 随后逐渐降低; 淹水处理9 d时中等、不耐渍品系ABA含量达到最大值, 其中不耐渍品系ABA含量高达3.72 μg g–1, 显著高于强、中等耐渍品系(图5-B)。随淹水时间的延长, 不同耐渍性甘蓝型油菜ET含量均呈上升趋势。淹水处理0 d时, 3个不同耐渍品系ET含量差异不显著; 淹水处理6 d、12 d时, 强耐渍品系ET含量显著高于中等、不耐渍品系, 中等、不耐渍品系ET含量差异不显著; 淹水处理9 d时, 强耐渍品系ET含量显著高于中等耐渍品系, 但与不耐渍品系差异不显著(图5-C)。
根中激素相关基因相对转录水平分析发现(图6), 正常供水情况下(CK), 油菜根中激素代谢相关基因相对转录水平差异不显著。淹水48 h, GA代谢相关基因、和在不同耐渍性油菜中相对转录水平变化差异明显, 编码DELLA蛋白的相对转录水平显著下调, 且强耐渍性品系相对转录水平显著高于中等、不耐渍性品系, 但中等、不耐渍品系间相对转录水平差异不显著(图6-A); 强耐渍品系中参与编码GA生物合成的相对转录水平与CK差异不显著, 中等、不耐渍品系中相对转录水平显著下调, 但二者之间差异不显著(图6-B); 参与调控GA失活的相对转录水平在强耐渍性品系中显著上调, 而中等、不耐渍油菜显著下调(图6-C)。ABA合成相关的3个重要基因的相对转录水平除上调外,和均显著下调。强耐渍油菜中相对转录水平与CK变化不大, 中等、不耐渍的油菜呈显著上调趋势, 分别比CK提高75.61%、95.07% (图6-D); 淹水胁迫导致和相对转录水平显著下调, 但3种不同耐渍性油菜品系间差异不显著(图6-E, F)。强、中等耐渍油菜ET合成相关基因以及ET响应因子相对转录水平显著上调, 显著高于不耐渍品系; 不耐渍品系淹水处理后显著下调(图6-G, I)。3种不同耐渍性油菜的相对转录水平淹水处理后呈下调趋势, 但与CK差异不显著(图6-H)。

图5 淹水胁迫下不同耐渍性甘蓝型油菜内源激素含量的变化
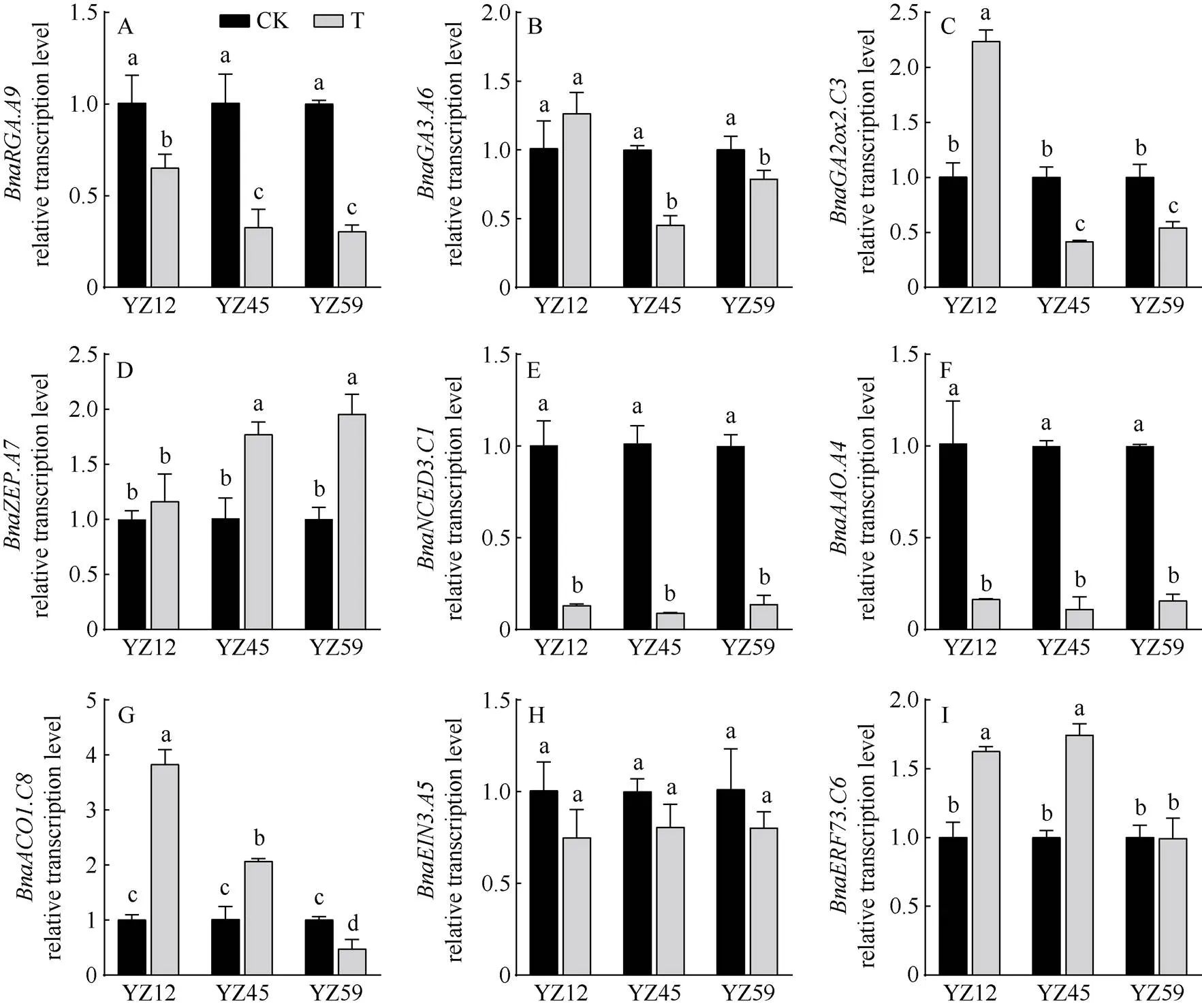
图6 根中激素代谢相关基因转录水平分析
CK: 正常供水; T: 淹水处理48 h。不同小写字母表示处理间在0.05概率水平差异显著。
CK: normal water supply; T: waterlogging treatment for 48 hours. Different lowercase letters indicate significant difference at the 0.05 probability level.
综上, 淹水胁迫下, 根中激素代谢相关基因差异表达, 导致不同耐渍性油菜的GA、ABA、ET含量显著升高, 并随时间延长而表现出不同的变化趋势, 强耐渍品系在受到淹水胁迫时, 可迅速产生大量GA、ET应对胁迫。
2.4 淹水胁迫对甘蓝型油菜抗氧化酶活性及MDA含量的影响
随淹水处理时间延长, 油菜POD活性均呈先升后降趋势。强耐渍品系淹水处理9 d时POD活性达到最高(2363.79 U g–1), 显著高于其他品系; 中等耐渍品系POD活性在淹水处理6 d时达到最高(1606.41 U g–1); 而不耐渍品系POD活性变化幅度较小, 维持在1182.08 U g–1左右; 淹水12 d时, 各油菜品系间POD活性差异不显著(图7-A)。随淹水时间延长, 强耐渍品系CAT活性呈先升后降趋势, 淹水处理9 d时CAT活性达到最高(569.3 U g–1), 显著高于0 d、6 d, 但与12 d时差异不显著。中等、不耐渍品系CAT活性随淹水时间延长逐渐升高, 均于淹水处理12 d时达到最高水平, 显著高于强耐渍品系(图7-B)。不同品系油菜SOD活性随淹水时间延长呈先升后降趋势, 淹水处理6 d时SOD活性最高(图7-C)。淹水处理6 d和9 d时, 强、中等耐渍品系SOD活性显著高于不耐渍品系, 而在处理12 d时各品系的SOD活性趋于同一水平, 无显著差异。MDA含量反映植物细胞破损程度, 淹水胁迫下, 不同耐渍性油菜品系的MDA含量均高于CK, 且随淹水时间的延长逐渐升高(图7-D)。淹水处理12 d时, 不耐渍品系MDA含量最高, 显著高于中等、强耐渍品系。表明淹水胁迫可导致活性氧(reactive oxygen species, ROS)清除系统的酶活性增加, 且强耐渍品系ROS清除能力较强, 不耐渍品系ROS清除能力相对较弱。随淹水时间延长, 不耐渍品系膜脂过氧化程度较高, 细胞损伤严重。
2.5 淹水胁迫对甘蓝型油菜光合特性及叶绿素含量的影响
淹水胁迫显著降低甘蓝型油菜光合速率, 随胁迫时间的延长呈逐渐降低趋势, 且不耐渍品系降幅最大, 淹水处理12 d时光合速率最低(3.82 μmol m–2s–1),显著低于中、强耐渍品系(图8-A)。淹水胁迫导致植物气孔关闭, 淹水处理后各品系油菜的气孔导度显著降低, 淹水6 d时趋于平稳, 保持在0.02 mol m–2s–1(图8-B)。胞间CO2浓度在淹水胁迫下呈先升高后下降的趋势, 淹水胁迫下各油菜品系的胞间CO2浓度是处理前的2~3倍, 其中不耐渍品系胞间CO2浓度变化幅度最大, 显著高于强耐渍品系(图8-C)。此外, 植物叶片的蒸腾速率也会受到淹水胁迫的影响, 各品系叶片蒸腾速率随着淹水时间延长显著下降。淹水处理6 d时, 叶片蒸腾速率表现为强耐渍品系YZ12>中等耐渍品系YZ45>不耐渍品系YZ59, 且差异显著; 但淹水处理12 d时, 各品系蒸腾速率差异不显著, 均保持在0.3 μmol m–2s–1(图8-D)。淹水胁迫显著降低各油菜品系叶绿素含量, 不同淹水处理时间下强耐渍品系YZ12叶绿素含量均显著高于中等、不耐渍品系; 淹水处理6 d、9 d时, 中等、不耐渍品系叶绿素含量差异不显著; 但淹水处理12 d时, 叶绿素含量表现为强耐渍品系>中等耐渍品系>不耐渍品系, 且差异显著(图8-F)。表明淹水胁迫严重影响了甘蓝型油菜叶片光合效率和叶绿素含量, 其中不耐渍品系变化幅度较大, 所受胁迫较为严重。
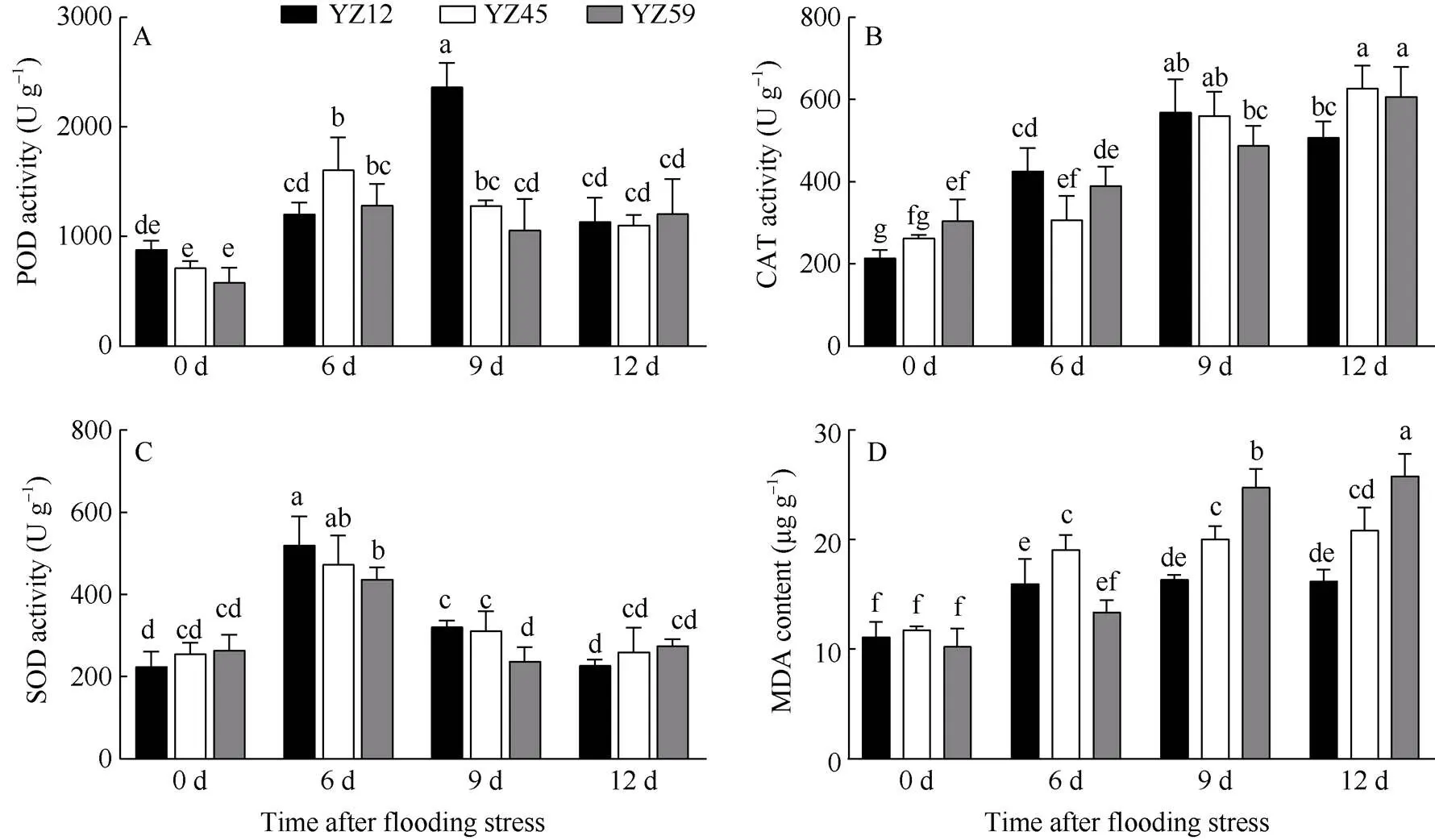
图7 淹水胁迫对甘蓝型油菜抗氧化酶活性及MDA含量的影响
不同小写字母表示处理间在0.05概率水平差异显著。
Different lowercase letters indicate significant difference at the 0.05 probability level.
2.6 不同耐渍性甘蓝型油菜根系活力和生理指标相关性分析
由根系活力和生理指标相关性分析(图9)可知, 根系活力与POD活性、SOD活性、胞间CO2浓度、ABA含量显著负相关; 与光合速率、气孔导度、蒸腾速率、叶绿素含量显著正相关; 与CAT活性、MDA含量、GA含量、ET含量相关关系不显著。
2.7 外源生长调节剂对淹水胁迫下甘蓝型油菜生长的影响
由图10-A可知, 淹水处理7 d, 各处理油菜植株均出现不同程度的萎焉, 叶片变黄, 大量脱落。T2组绿叶数量较多, 说明喷施UNICONAZOLE可有效缓解淹水胁迫下叶片变黄脱落现象。T3、T4组油菜植株叶片严重变黄脱落, 说明喷施STS和NDGA加重了淹水胁迫下油菜变黄脱落的程度。
由图10-B可知, 淹水处理7 d后恢复生长7 d, 不同处理下强耐渍品系油菜的生长情况整体比中等、不耐渍品系好。在强耐渍品系中, T2组油菜生长情况较好, 叶片虽有枯黄脱落, 但绿叶数量较多, T4组油菜植株没有倒伏, 但叶片几乎都枯黄脱落; 中等耐渍品系中, T2组油菜植株少部分叶片脱落, 但生长状况较好, T3、T4处理未有效缓解淹水胁迫对油菜的伤害; 不耐渍品系抵御渍害能力较弱, 喷施激素抑制剂未能缓解油菜受渍害胁迫的程度, 各处理组油菜均枯黄死亡。
3 讨论
3.1 根系是影响甘蓝型油菜耐渍性的核心因素
淹水处理影响油菜地上部生长、根系发育及最终产量, 特别是根系受害最严重。Hong等[28]发现耐渍油菜根长、根冠比均高于不耐渍油菜。宋丰萍等[2]发现渍水影响油菜各生育期根系发育、地上部生长及最终产量形成, 并存在品种间差异。谢云韵等[20]发现不定根大量形成可能是油菜适应低氧胁迫的一种重要生理机制。本研究也发现, 淹水胁迫影响油菜苗期根部正常生长发育, 限制油菜植株生长, 不同耐渍性品系表型差异明显, 耐渍品系对淹水胁迫耐受性更强, 表型性状优于不耐渍品系。
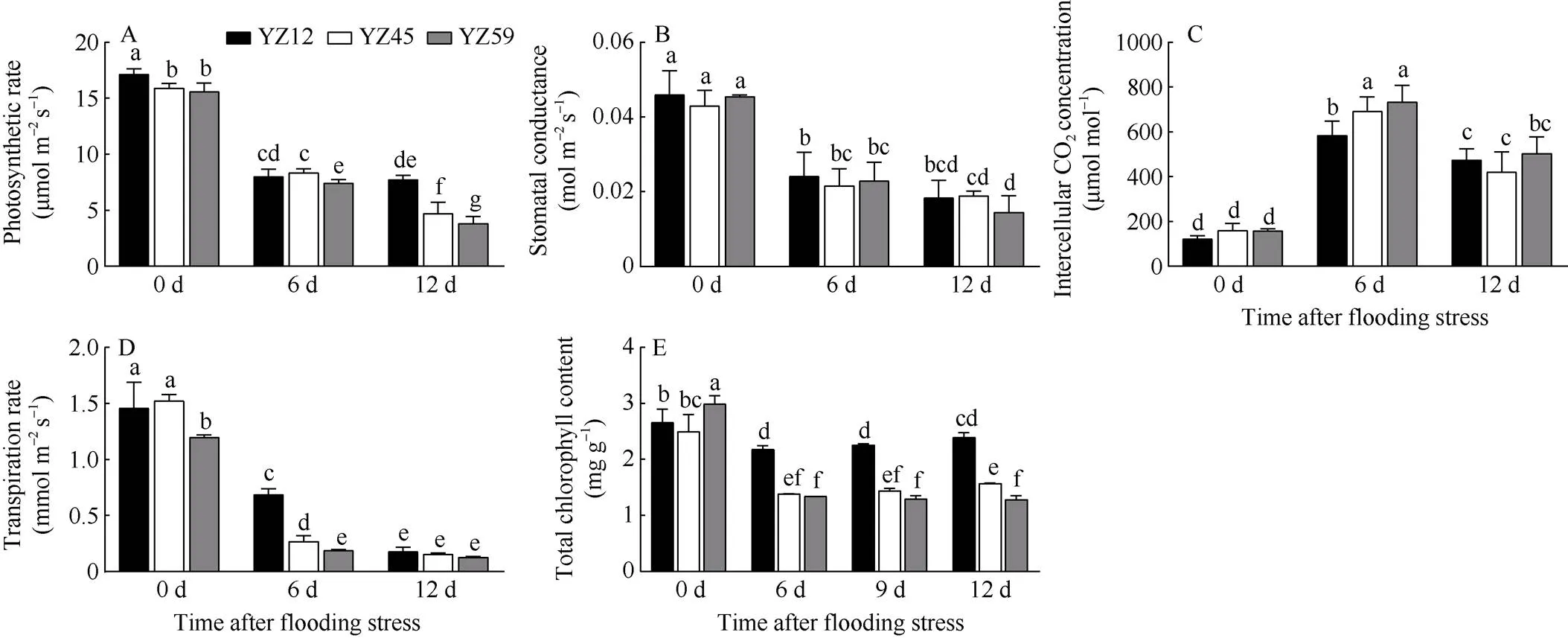
图8 淹水胁迫对甘蓝型油菜光合性状及叶绿素总量的影响
不同小写字母表示处理间在0.05概率水平差异显著。
Different lowercase letters indicate significant difference at the 0.05 probability level.
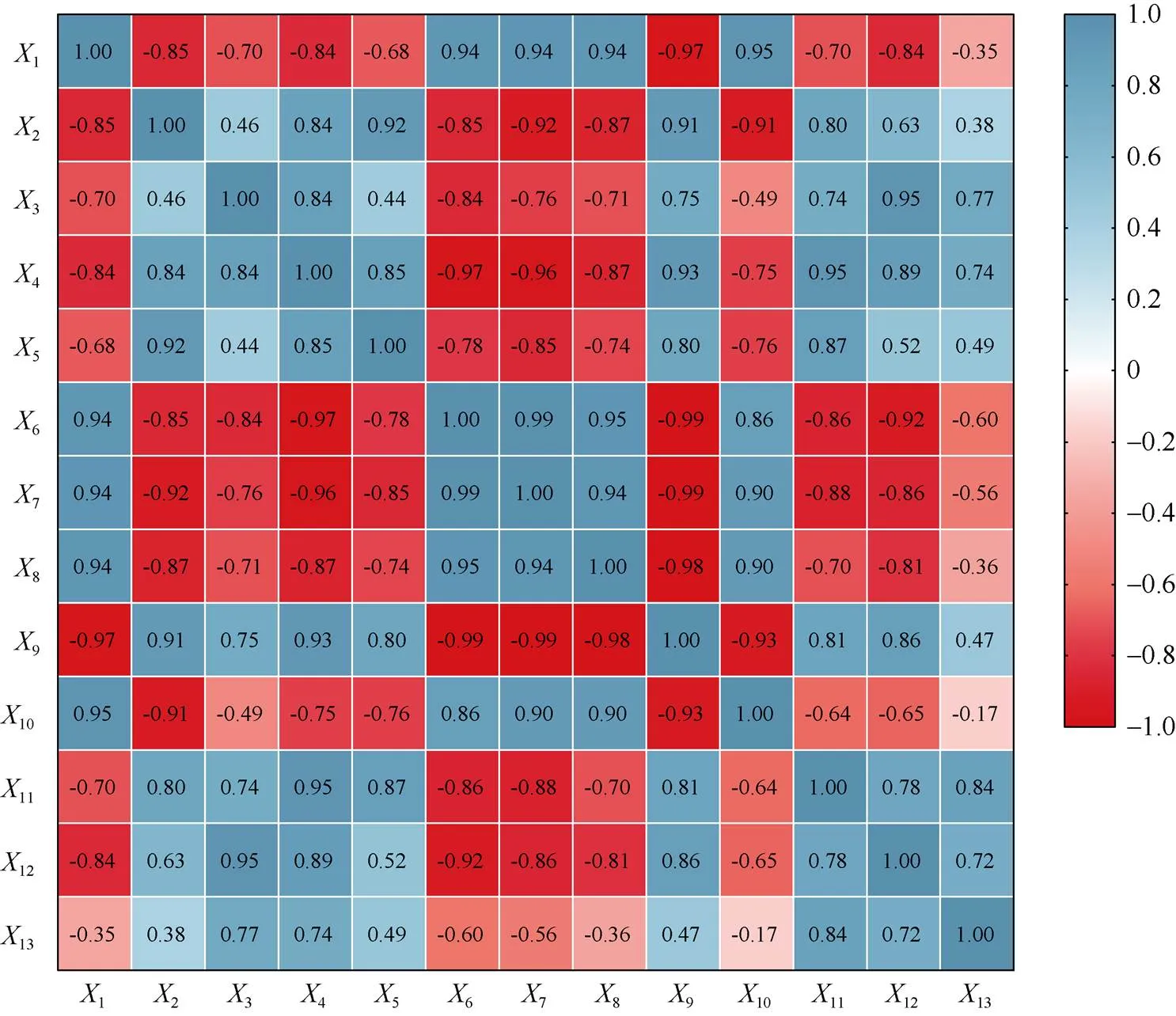
图9 甘蓝型油菜根系活力与生理指标相关性分析
图中数据为Pearson。1: 根系活力;2: POD活性;3: CAT活性;4: SOD活性;5: MDA含量;6: 光合速率;7: 气孔导度;8: 蒸腾速率;9: 胞间CO2浓度;10: 叶绿素含量;11: GA含量;12: ABA含量;13: ET含量。
The data in the figure is Pearson.1: root activity;2: POD activity;3: CAT activity;4: SOD activity;5: MDA content;6: photosynthetic rate;7: stomatal conductance;8: intercellular CO2concentration;9: transpiration rate;10: total chlorophyll content;11: GA content;12: ABA content;13: ET content.

图10 外源生长调节剂对淹水胁迫下甘蓝型油菜表型的影响
CK: 正常供水; T1: 淹水处理+喷施蒸馏水; T2: 淹水处理+喷施GA抑制剂UNICONAZOLE; T3: 淹水处理+喷施ET抑制剂STS; T4: 淹水处理+喷施ABA抑制剂NDGA。
CK: normal water supply; T1: flooding stress + spray distilled water; T2: flooding stress + spraying GA inhibitor UNICONAZOLE; T3: flooding stress + spraying ET inhibitor STS; T4: flooding stress + spraying ABA inhibitor NDGA.
根部细胞超微结构观察发现, 不耐渍油菜根细胞细胞器破损更严重。强耐渍品系的根细胞结构完整, 形态正常, 各细胞紧密排列。Zou等[29-30]和本研究结果均发现, 淹水胁迫过程中, 与细胞骨架发育相关基因转录水平下调。本研究进一步发现淹水胁迫下油菜根部细胞骨架相关基因、、的相对转录水平显著低于CK, 且不耐渍品系降幅大于中等、强耐渍油菜品系。Peng等[31]在美洲黑杨()研究中发现低氧胁迫下根系比叶片遭受更严重的解剖和超微结构损伤。因此推测, 淹水胁迫严重影响油菜根系细胞骨架, 损害根细胞超微结构, 导致根系活力下降, 但不同品系油菜对淹水胁迫耐受能力不同, 受损程度也不同, 进而表现出表型上的差异。
3.2 保护酶活性和MDA含量调控根系活力并影响甘蓝型油菜耐渍性
植物在遭受胁迫时会产生大量ROS, ROS积累过多会对细胞产生毒害, 为维持体内ROS水平的相对稳定, POD、CAT、SOD等抗氧化酶大量产生, 清除细胞内积累的ROS以应对外界胁迫[32]。何激光等[16]发现随渍水时间的延长, 油菜不同生育期MDA、SOD的含量均增加; Cheng等[33]发现长期渍害导致不耐渍品系小麦中SOD和CAT活性显著降低, 而强耐渍品系具有更强的ROS稳态能力; 陶霞等[34]发现油菜渍水胁迫后, MDA含量显著上升, 膜脂过氧化程度加剧, 活性氧代谢失衡, 敏感品种较抗性品种变化幅度更大。本研究也发现, ROS清除系统的酶活性越高, 油菜对淹水胁迫的抗性越强, 而相关性分析进一步发现POD活性、SOD活性与根系活力显著负相关(图9), 说明保护酶及MDA含量可调节根系活力, 从而影响植物耐渍性。
植物根部是受渍害最严重的部位, 且最先感受到外界缺氧的环境, 为获得足够的能量, 植物选择进行无氧代谢途径来应对渍害胁迫。Zhang等[35]研究表明, 渍害导致植物、、基因上调表达, 且过表达的可提高拟南芥的耐渍能力。本研究发现淹水胁迫下, 油菜根部无氧呼吸相关代谢基因在不同耐渍性油菜根部响应胁迫的方式不同。
叶肉细胞中的叶绿体是正常叶片光合作用的基本组成部分, 淹水胁迫导致玉米叶肉细胞叶绿体结构受损, 叶绿素含量降低, 光合作用减弱[36]。Zhang等[37]发现渍害胁迫下, 耐渍高粱具有较强的抗氧化能力, 可减轻对光合系统和叶绿体超微结构的损害, 保持较高的净光合速率。本研究相关分析表明根系活力与光合速率、气孔导度、蒸腾速率、叶绿素含量显著正相关, 主要是由于强耐渍材料能通过保护酶活性等物质的调节, 较好的保护了根系, 提高了植株后期的光合能力。
3.3 根系结构受激素水平响应差异影响
淹水胁迫中, 植物借助于一切诱导的或组成的形态变化以改善气体交换, 多种植物激素、ROS和信号传导物质参与根系发育。ET作为植物响应渍害的关键激素, 可在植物根部大量积累, 调控根长及根细胞分化[38]。ACO为ET合成的关键限速酶, 较高的表达可导致耐渍植物中ET含量的大量积累[39]。拟南芥中过表达可提高厌氧处理下幼苗的存活率, 并导致表达上调[40]。植物通过调控GA合成与失活维持胞内相对稳定的环境。GA3、GA20-氧化酶(GA20ox)和GA3-氧化酶(GA3ox)是GA合成关键酶;主要对GA生物活性进行调控, 通过使有活性的GA失活来调节GA浓度[41-43]。ABA在水分缺乏时可作为信号分子介导气孔关闭, 促进主根伸长; 水分充足时, 添加外源ABA会抑制根的生长[44]。Kim等[45]发现耐涝大豆品系ABA含量显著低于敏感品系, 表明ABA可能与耐渍性呈负相关。De等[46]发现ABA可抑制侧根分生组织的活化。本研究发现, 淹水胁迫导致强、中等耐渍油菜根部、相对转录水平迅速升高,、.相对转录水平在强耐渍品系中上调, 在中等、不耐渍油菜品系中显著下降,.在各耐渍性油菜根中的相对转录水平均下调;在中等、不耐渍油菜品系根中相对转录水平显著升高,和相对转录水平呈显著降低趋势。激素含量测定发现, 淹水处理6 d、12 d时强耐渍油菜ET含量显著高于不耐渍油菜; 强耐渍品系GA含量随淹水时间延长呈上升趋势, 不耐渍品系GA含量变化不明显; 淹水处理6 d时, 不同耐渍性油菜ABA含量差异不大, 但淹水处理9 d和12 d时, 强耐渍品系ABA含量显著低于不耐渍品系。表型观察发现强耐渍品系主根长度变短,侧根数量大幅度增加, 不耐渍品系主根长度及侧根数量与CK相比差异不明显, 因此推测淹水胁迫下, ET、GA、ABA代谢相关基因相互协调, 共同调节淹水胁迫下油菜的激素水平, 进而影响油菜根系发育。
植物对渍害的响应是一个复杂的过程, 前人研究发现, 用ABA处理渍水的大豆或水稻, 可有效提高其存活率[47-48]; Uniconazole通过改善抗氧化防御机制, 延缓脂质过氧化程度, 缓解渍水胁迫对大豆的伤害[49]; 外施ABA、Uniconazole等植物调节剂能部分缓解油菜渍害[50]。ET信号传导也通过DELLA机制影响根系生长, DELLA和依赖于CTR1的ET反应途径在EIN3互作, 以提高非生物胁迫耐受性[51]。ET通过介导的ABA途径抑制根系生长[52], ET抑制ABA信号传导, ABA通过影响ET生物合成关键基因以调控ET生物合成, 如乙烯反应因子11 (ERF11)、酰基辅酶A合成酶5 (ACS5)和9-顺式环氧类胡萝卜素双加氧酶(NCED)[53]。本研究发现, 喷施STS和NDGA抑制ET和ABA加重了油菜渍害, 喷施Uniconazole抑制GA合成, 减轻了油菜渍害, 表明GA、ABA和ET参与油菜对渍害的响应, GA与ET在油菜响应渍害胁迫中起正向调控作用, 与ABA拮抗, 共同调节油菜对淹水胁迫的响应, 与其他作物中研究结果基本相符。
综上所述, 内源激素ET、GA和ABA相互协作或相互拮抗共同调控甘蓝型油菜根系的生长, 进而改变生理代谢及光合效率响应淹水胁迫(图11)。
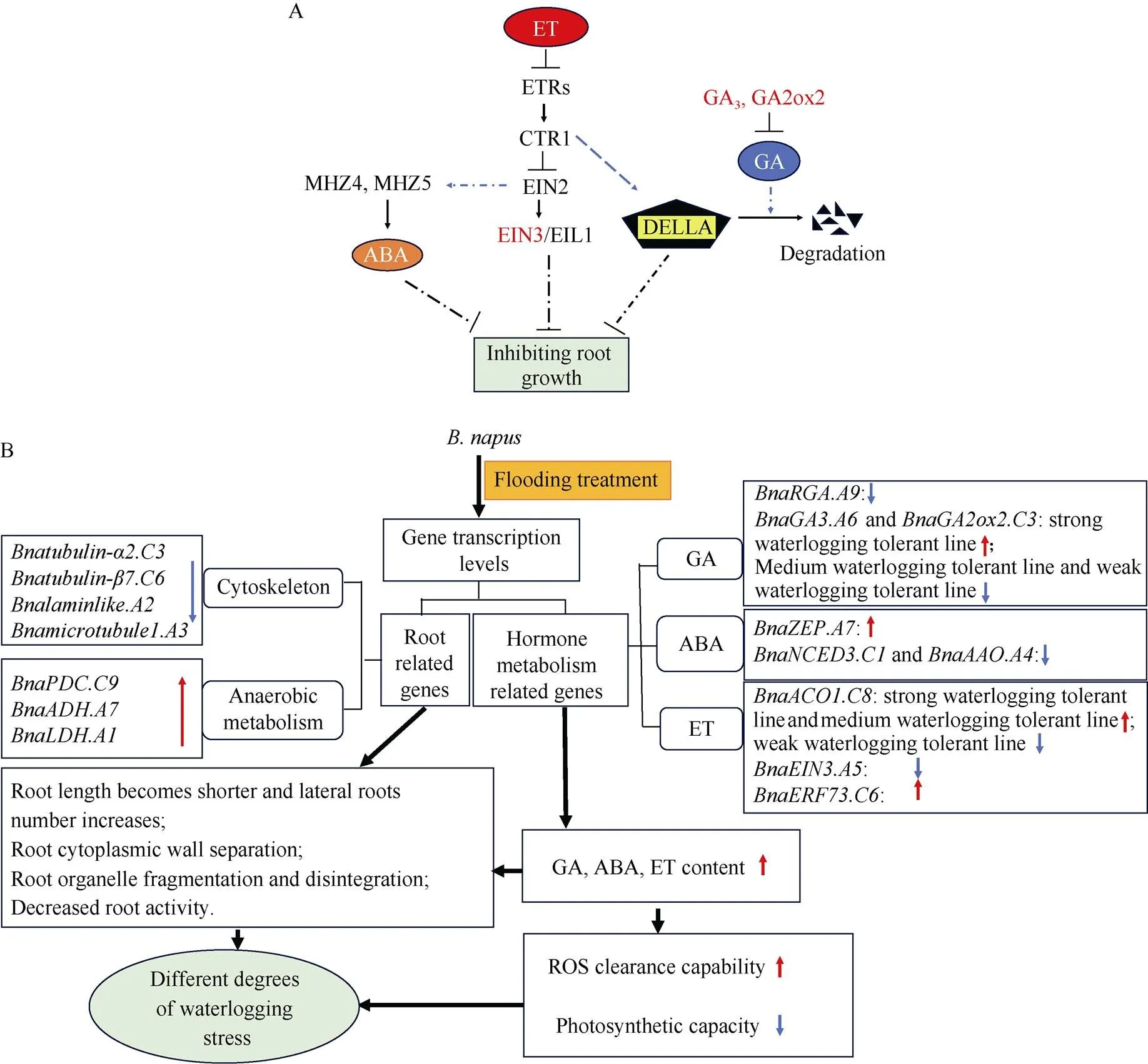
图11 淹水胁迫对甘蓝型油菜苗期生长的影响及响应机制
A: 激素调控根系生长信号通路图[12,50-53], 实线表示直接相互作用, 虚线表示间接相互作用。箭头表示刺激作用, ⊥表示抑制作用; B: 甘蓝型油菜苗期响应渍害胁迫的生理调控机制。
A: A diagram representing the hormone-regulated root growth signaling pathway[12,50-53]. The solid lines indicate direct interactions, and the dashed lines indicate indirect interactions. The arrows indicate stimulatory effects, whereas the ⊥ symbols indicate inhibitory effects. B: Physiological mechanism in response to waterlogging during seedling stage of.
4 结论
甘蓝型油菜苗期对淹水胁迫的响应在生理代谢、光合效率、激素水平和基因转录水平存在明显差异。不同耐渍性甘蓝型油菜细胞骨架、激素代谢等相关基因差异表达, 引起植株内激素水平、根部超微结构改变, 根系活力降低, 抗氧化酶活性增强、光合效率下降, 进而调控不同耐渍性甘蓝型油菜淹水胁迫响应过程。耐渍品系对淹水胁迫耐受性更强, 激素响应、活性氧清除等生物学过程显著优于不耐渍品系。
[1] 王汉中. 以新需求为导向的油菜产业发展战略. 中国油料作物学报, 2018, 40: 613–617. Wang H Z. New-demand oriented oilseed rape industry developing strategy., 2018, 40: 613–617 (in Chinese with English abstract).
[2] 宋丰萍, 胡立勇, 周广生, 吴江生, 傅廷栋. 渍水时间对油菜生长及产量的影响. 作物学报, 2010, 36: 170–176. Song F P, Hu L Y, Zhou G S, Wu J S, Fu T D. Effects of waterlogging time on rapeseed (L.) growth and yield., 2010, 36: 170–176 (in Chinese with English abstract).
[3] 张佩, 吴洪颜, 江海东, 高苹, 徐敏. 长江中下游油菜春季湿渍害灾损风险评估研究. 气象与环境科学, 2019, 42(1): 11–17. Zhang P, Wu H Y, Jiang H D, Gao P, Xu M. Risk assessment study on rapeseed suffering from spring wet damages in the middle and lower reaches of Yangtze River., 2019, 42(1): 11–17 (in Chinese with English abstract).
[4] Wang Z Y, Han Y L, Luo S, Rong X M, Song H X, Jiang N, Li C W, Yang L. Calcium peroxide alleviates the waterlogging stress of rapeseed by improving root growth status in a rice-rape rotation field., 2022, 13: 1048227.
[5] 杨海云, 艾雪莹, Batool M, 刘芳, 蒯婕, 王晶, 汪波, 周广生. 油菜响应水分胁迫的生理机制及栽培调控措施研究进展. 华中农业大学学报, 2021, 40(2): 6–16. Yang H Y, Ai X Y, Batool M, Liu F, Kuai J, Wang J, Wang B, Zhou G S. Progress on physiological mechanisms of response to water stress and measures of cultivation controlling in rapeseed., 2021, 40(2): 6–16 (in Chinese with English abstract).
[6] 张学昆, 陈洁, 王汉中, 李加纳, 邹崇顺. 甘蓝型油菜耐湿性的遗传差异鉴定. 中国油料作物学报, 2007, 29: 98–102. Zhang X K, Chen J, Wang H Z, Li J N, Zou C S. Genetic difference of waterlogging tolerance in rapeseed (L.)., 2007, 29: 98–102 (in Chinese with English abstract).
[7] Champolivier L, Merricen A. Effects of water stress applied at different growth stages tosL. var.on yield, yield components and seed quality., 1996, 5: 153–160.
[8] 俄有浩, 马玉平. 农田涝渍灾害研究进展. 自然灾害学报, 2022, 31(4):12–30. E Y H, Ma Y P. Advances in research on cropland waterlogging disaster., 2022, 31(4): 12–30 (in Chinese with English abstract).
[9] 张树杰, 廖星, 胡小加, 谢立华, 余常兵, 李银水, 车志, 廖祥生. 渍水对油菜苗期生长及生理特性的影响. 生态学报, 2013, 33: 7382–7389. Zhang S J, Liao X, Hu X J, Xie L H, Yu C B, Li Y S, Che Z, Liao X S. Effects of waterlogging on the growth and physiological properties of juvenile oilseed rape., 2013, 33: 7382–7389 (in Chinese with English abstract).
[10] Li J J, Iqbal S, Zhang Y T, Chen Y H, Tan Z D, Ali U, Guo L. Transcriptome analysis reveals genes of flooding-tolerant and flooding-sensitive rapeseeds respond to flooding at the germination stage., 2021, 10: 693.
[11] Kuroha T, Nagai K, Gamuyao R, Wang D, Furuta T, Nakamori M, Kitaoka T, Adachi K, Minami A, Mori Y, Mashiguchi K, Seto Y, Yamaguchi S, Kojima M, Sakakibara H, Wu J, Ebana K, Mitsuda N, Ohme-Takagi M, Yanagisawa S, Yamasaki M, Yokoyama R, Nishitani K, Mochizuki T, Tamiya G, McCouch S, Ashikari M. Ethylene-gibberellin signaling underlies adaptation of rice to periodic flooding., 2018, 361: 181–186.
[12] Qin H, He L, Huang R F. The coordination of ethylene and other hormones in primary root development., 2019, 10: 874.
[13] Fukushima A, Kuroha T, Nagai K, Hattori Y, Kobayashi M, Nishizawa T, Kojima M, Utsumi Y, Oikawa A, Seki M, Sakakibara H, Saito K, Ashikari M, Kusano M. Metabolite and phytohormone profiling illustrates metabolic reprogramming as an escape strategy of deepwater rice during partially submerged stress., 2020, 10: 68.
[14] Cheng Y, Gu M, Cong Y, Zou C S, Zhang X K, Wang H Z. Combining ability and genetic effects of germination traits ofL. under waterlogging stress condition., 2010, 9: 951–957.
[15] Leul M, Zhou W J. Alleviation of waterlogging damage in winter rape by application of uniconazole: effects on morphological characteristics, hormones and photosynthesis., 1998, 59: 121–127.
[16] 何激光, 官春云, 李凤阳, 阴长发. 不同渍水处理对油菜产量及生理特性的影响. 作物研究, 2011, 25: 313–315. He J G, Guan C Y, Li F Y, Yin C F. Effects of different waterlogging treatments on the yield and physiological characteristics of rape., 2011, 25: 313–315 (in Chinese with English abstract).
[17] 李玲, 张春雷, 张树杰, 李光明. 渍水对冬油菜苗期生长及生理的影响. 中国油料作物学报, 2011, 33: 247–252. Li L, Zhang C L, Zhang S J, Li G M. Effects of waterlogging on growth and physiological changes of winter rapeseed seedling (L.)., 2011, 33: 247–252 (in Chinese with English abstract).
[18] Kuai J, Li X Y, Xie Y, Li Z, Wang B, Zhou G S. Leaf characteristics at recovery stage affect seed oil and protein content under the interactive effects of nitrogen and waterlogging in rapeseed., 2020, 10: 207.
[19] 张维, 李云, 戚存扣, 陈松, 王晓东. 淹水胁迫对耐淹和不耐淹油菜光合参数影响差异的研究. 中国农学通报, 2019, 35(7): 28–35. Zhang W, Li Y, Qi C K, Chen S, Wang X D. Effects of waterlogging stress on photosynthetic parameters of waterlogging-tolerant and susceptible rapeseed lines., 2019, 35(7): 28–35 (in Chinese with English abstract).
[20] 谢云韵, 余常兵, 侯加佳, 胡小加, 李银水, 沈宏, 廖星. 低氧胁迫对油菜幼苗不定根生长的影响. 中国油料作物学报, 2013, 35: 284–289. Xie Y Y, Yu C B, Hou J J, Hu X J, Li Y S, Shen H, Liao X. Effect of low oxygen stress on adventitious roots of rape seedlings., 2013, 35: 284–289 (in Chinese with English abstract).
[21] Guo Y Y, Chen J, Kuang L H, Wang N J, Zhang G P, Jiang L X, Wu D Z. Effects of waterlogging stress on early seedling development and transcriptomic responses in., 2020, 40: 4917–4929.
[22] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. Li H S. Principles and Techniques of Plant Physiological and Biochemical Experiments. Beijing: Higher Education Press, 2000 (in Chinese).
[23] 杨志敏. 生物化学实验. 北京: 高等教育出版社, 2015. Yang Z M. Biochemistry Experiments. Beijing: Higher Education Press, 2015 (in Chinese).
[24] 徐爱军, 高桂枝, 汤莉莉. 梯度洗脱测定植物源调节剂中内源激素方法探讨. 分析试验室, 2007, 26(9): 51–55. Xu A J, Gao G Z, Tang L L. Study on the determination of intrinsic hormones in plant growth regulator from plants by HPLC with gradient elution., 2007, 26(9): 51–55 (in Chinese with English abstract).
[25] Ali B, Qian P, Sun R, Farooq M A, Gill R A, Wang J, Azam M, Zhou W J. Hydrogen sulfide alleviates the aluminum-induced changes inas revealed by physiochemical and ultrastructural study of plant., 2015, 22: 3068–3081.
[26] 徐国伟, 孙会忠, 陆大克, 王贺正, 李友军. 不同水氮条件下水稻根系超微结构及根系活力差异. 植物营养与肥料学报, 2017, 23: 811–820. Xu G W, Sun H Z, Lu D K, Wang H Z, Li Y J. Differences in ultrastructure and activity of rice roots under different irrigation and nitrogen supply levels., 2017, 23: 811–820 (in Chinese with English abstract).
[27] 胡亚丽, 聂靖芝, 吴霞, 潘姣, 曹珊, 岳娇, 罗登杰, 王财金, 李增强, 张辉, 吴启境, 陈鹏. 水杨酸引发对红麻幼苗耐盐性的影响. 中国农业科学, 2022, 55: 2696–2708. Hu Y L, Nie J Z, Wu X, Pan J, Cao S, Yue J, Luo D J, Wang C J, Li Z Q, Zhang H, Wu Q J, Chen P. Effect of salicylic acid priming on salt tolerance of kenaf seedlings., 2022, 55: 2696–2708 (in Chinese with English abstract).
[28] Hong B, Zhou B Q, Peng Z C, Yao M Y, Wu J J, Wu X P, Guan C Y, Guan M. Tissue-specific transcriptome and metabolome analysis reveals the response mechanism ofto waterlogging stress., 2023, 24: 3–23.
[29] Zou X L, Tan X Y, Hu C W, Zeng L, Lu G Y, Fu G P, Cheng Y, Zhang X K. The transcriptome ofL. roots under waterlogging at the seedling stage., 2013, 14: 2637–2651.
[30] Zou X L, Zeng L, Lu G Y, Xu J S, Zhang X K. Comparison of transcriptomes undergoing waterlogging at the seedling stage between tolerant and sensitive varieties ofL., 2015, 14: 1723–1734.
[31] Peng Y J, Zhao Z X, Tong R G, Hu X Y, Du K B. Anatomy and ultrastructure adaptations to soil flooding of two full-sib poplar clones differing in flood-tolerance., 2017, 233: 90–98.
[32] Hasanuzzaman M, Bhuyan M, Zulfiqar F, Raza A, Mohsin S M, Mahmud J A, Fujita M, Fotopoulos V. Reactive oxygen species and antioxidant defense in plants under abiotic stress revisiting the crucial role of a universal defense regulator., 2020, 9: 681.
[33] Cheng X X, Yu M, Zhang N, Zhou Z Q, Xu Q T, Mei F Z, Qu L H. Reactive oxygen species regulate programmed cell death progress of endosperm in winter wheat (L.) under waterlogging., 2016, 253: 311–327.
[34] 陶霞, 李慧琳, 万林, 周琴, 江海东. 叶面喷施吲哚乙酸对油菜蕾薹期渍水的缓解效应. 中国油料作物学报, 2015, 37: 55–61. Tao X, Li H L, Wan L, Zhou Q, Jiang D H. Alleviation effects of IAA foliar spray on waterlogging stressed rapeseed at budding stage., 2015, 37: 55–61 (in Chinese with English abstract).
[35] Zhang J Y, Huang S N, Wang G, Xuan P J, Guo Z R. Overexpression ofdeliciosa pyruvate decarboxylase 1 gene enhances waterlogging stress in transgenic., 2016, 106: 244–252.
[36] 魏和平, 利容千, 王建波. 淹水对玉米叶片细胞超微结构的影响. 植物学报, 2000, 42: 811–817. Wei H P, Li R Q, Wang J B. Ultrastructural changes in leaf cells of submerged maize., 2000, 42: 811–817 (in Chinese with English abstract).
[37] Zhang R D, Zhou Y F, Yue Z X, Chen X F, Cao X, Xu X X, Xing Y F, Jiang B, Ai X Y, Huang R D. Changes in photosynthesis, chloroplast ultrastructure, and antioxidant metabolism in leaves ofunder waterlogging stress., 2019, 57: 1076–1083.
[38] Reinbardt D, Mandel T, Kuhlemeier C. Auxin regulates the initiation and radial position of plant lateral organs., 2000, 12: 507–518.
[39] Hinz M, Wilson I W, Yang J, Buerstenbinder K, Llewellyn D, Dennis E S, Sauter M, Dolferus R.RAP2.2: an ethylene response transcription factor that is important for hypoxia survival., 2010, 153: 757–772.
[40] Licausi F, Van Dongen J T, Giuntoli B, Novi G, Santaniello A, Geigenberger P, Perata P. HRE1 and HRE2, two hypoxia-inducible ethylene response factors, affect anaerobic responses in., 2010, 62: 302–315.
[41] Nguyen T N, Tuan P A, Mukherjee S, Son S H, Ayeke B T. Hormonal regulation in adventitious roots and during their emergence under waterlogged conditions in wheat., 2018, 69: 4065–4082.
[42] 谢伶俐, 韦丁一, 章子爽, 徐劲松, 张学昆, 许本波. 甘蓝型油菜发育进程中赤霉素动态变化及其与产量的关系. 中国农业科学, 2022, 55: 4793–4807. Xie L L, Wei D Y, Zhang Z S, Xu J S, Zhang X K, Xu B B. Dynamic changes of gibberellin content during the development and the relationship between gibberellin and yield ofL.., 2022, 55: 4793–4807 (in Chinese with English abstract).
[43] O’neill D P, Davidson S E, Clarke V C, Yamauchi Y, Yamauchi S, Kamiya Y, Reid J B, Ross J J. Regulation of the gibberellins pathway by auxin and DELLA proteins., 2010, 232: 1141–1149.
[44] Sharp R E, Lenoble M E. ABA, ethylene and the control of shoot and root growth under water stress., 2002, 53: 33–37.
[45] Kim Y H, Hwang S J, Waqas M, Khan A L, Lee J H, Lee J D, Nguyen H T, Lee I J. Comparative analysis of endogenous hormones level in two soybean (L.) lines differing in waterlogging tolerance., 2015, 6: 714.
[46] De S L, Signora L, Beeckman T, Inze D, Foyer C H, Zhang H. An abscisic acid-sensitive checkpoint in lateral root development of., 2003, 33: 543–555.
[47] Komatsu S, Han C, Nanjo Y, Altaf-Un-Nahar M, Wang K, He D L, Yang P F. Label-free quantitative proteomic analysis of abscisic acid effect in early-stage soybean under flooding., 2013, 12: 4769–4784.
[48] Saha I, Hasanuzzaman M, Dolui D, Sikdar D, Debnath S C, Adak M K. Silver-nanoparticle and abscisic acid modulate sub1A quantitative trait loci functioning towards submergence tolerance in rice (L.)., 2021, 181: 104276.
[49] Wang S Y, Zhou H, Feng N J, Xiang H T, Liu Y, Wang F, Li W, Feng S J, Liu M L, Zheng D F. Physiological response of soybean leaves to uniconazole under waterlogging stress at R1 stage., 2022, 268: 153579.
[50] 王琼. 几种植物生长调节剂对油菜渍害的缓解作用及机理研究. 中国农业科学院硕士学位论文, 北京, 2012. Wang Q. Studies on Mitigative Effects of Plant Growth Regulators on Rapeseed Subjected to Waterlogging. MS Thesis of Chinese Academy of Agricultural Sciences Dissertation, Beijing, China, 2012 (in Chinese with English abstract).
[51] Achard P, Cheng H, De Grauwe L, Decat J, Schoutteten H, Moritz T, Van Der Straeten D, Peng J R, Harberd N P. Integration of plant responses to environmentally activated phytohormonal signals., 2006, 311: 91–94.
[52] Ma B, Yin C C, He S J, Lu X, Zhang W K, Lu T G, Chen S Y, Zhang J S. Ethylene-induced inhibition of root growth requires abscisic acid function in rice (L.) seedlings., 2014, 10: e1004701.
[53] Li Z F, Zhang L X, Yu Y W, Quan R D, Zhang Z J, Zhang H W, Huang R F. The ethylene response factor AtERF11 that is transcriptionally modulated by the bZIP transcription factoris a crucial repressor for ethylene biosynthesis in., 2011, 68: 88–99.
Physiological mechanisms in response to waterlogging during seedling stage ofL.
ZHOU Xiang-Yu, XU Jin-song, XIE Ling-li*, XU Ben-bo*, and ZHANG Xue-kun
Engineering Research Center of Ecology and Agricultural Use of Wetland, Ministry of Education / Yangtze University, Jingzhou 434025, Hubei, China
The Yangtze River basin is the main producing area of rapeseeds in China, which is wet and rainy all the year round, and the rapeseed-rice rotation system is implemented in the producing area, resulting in frequent waterlogging. To explore the effects of waterlogging at seedling stage on phenotypic traits, physiological characteristics, photosynthesis, relative gene transcriptional levels, and the regulation of exogenous hormone inhibitors on rapeseed damage under waterlogging, a pot experiment was conducted, and the strong waterlogging tolerant line YZ12, medium waterlogging tolerant line YZ45, and weak waterlogging tolerant line YZ59 were used as the experimental materials. The results indicated that flooding stress severely inhibited the growth of rapeseed, and root activity could be used as an indicator to measure the impact of flooding stress on rapeseed growth. The observation of root cell ultrastructure showed that flooding stress led to plasmolysis and organelle fragmentation of rape root cells. The organelle of strong and medium waterlogging resistant rape was less damaged, and it could maintain a more normal cell morphology under flooding stress. The relative transcriptional levels of cytoskeletal genes,,, andin rape roots were significantly decreased under flooding stress, which were 0.2–0.5 times that of the control (CK) samples. The relative expressional levels of,, andassociated to anaerobic respiration were significantly increased, which was 3–6 times higher than that of CK, and higher expression levels were observed in medium and strong waterlogging tolerant rapeseed seedlings than in weak waterlogging tolerant line YZ59. During waterlogging, the activities of POD and SOD increased first and then decreased, while the activity of CAT and the content of MDA increased. Among them, the enzyme activities of YZ12 line such as POD, SOD, CAT were relatively high, and the increase of MDA was small. The photosynthetic efficiency and chlorophyll content of rapeseed leaves were seriously affected by flooding stress. The chlorophyll content, photosynthetic rate, stomatal conductance and transpiration rate of rapeseed decreased significantly, and the intercellular CO2concentration increased significantly, and the change range of the weak waterlogging tolerant line YZ59 was larger than that of the other two lines. Under flooding stress, ET and ABA contents of rapeseed increased significantly. Among the three lines, YZ12 had higher ET content, while YZ59 had higher ABA content. The relative transcriptional levels of ET related genes,were significantly up-regulated in the strong waterlogging tolerant line YZ12, while the relative transcriptional level of ABA-related genewas up-regulated in the weak waterlogging tolerant line YZ59. Exogenous application of hormone inhibitors could improve the damage of flooding stress to rapeseed, but the effects of different exogenous hormone inhibitors varied significantly. In conclusion, there were differences in physiological metabolism, photosynthesis, hormone, and gene transcriptional levels in response to flooding stress at seedling stage inwith different waterlogging tolerance.responsed to flooding stress by regulating the relative transcription levels of genes related to cytoskeleton, anaerobic respiration, hormone metabolism, causing changes in antioxidant enzyme activity, hormone levels, photosynthetic efficiency, root ultrastructure and root vitality.
L.; flooding stress; root ultrastructure; photosynthetic characteristics; antioxidant enzyme activity; hormone levels; transcriptional regulation
10.3724/SP.J.1006.2024.34116
本研究由农业生物育种重大项目(2023ZD04042), 农业农村部项目(15214011)和湖北省农业厅项目(鄂农油[2022]7号)资助。
This study was supported by the Major Projects of Agricultural Biology Breeding of China (2023ZD04042), the Entrusted Program of Ministry of Agriculture and Rural Affairs of China (15214011) and the Hubei Provincial Department of Agriculture Project (Hubei Province Nongyou [2022] 7).
谢伶俐, E-mail: linglixie@yangtzeu.edu.cn; 许本波, E-mail: benboxu@yangtzeu.edu.cn
E-mail: 2844804442@qq.com
2023-07-06;
2023-10-23;
2023-11-15.
URL: https://link.cnki.net/urlid/11.1809.S.20231115.0931.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

