烟草叶片响应镉胁迫的差异表达基因鉴定及分析
张 慧 张欣雨 袁 旭 陈伟达 杨 婷
烟草叶片响应镉胁迫的差异表达基因鉴定及分析
张 慧 张欣雨 袁 旭 陈伟达 杨 婷*
江汉大学生命科学学院 / 汉江流域特色生物资源保护开发与利用工程技术研究中心, 湖北武汉 430056
烟草具有超富集镉的能力, 严重降低烟叶品质, 影响其经济价值。为了阐释烟草响应镉胁迫的分子机制, 本研究采集了镉浓度为0和500 μmol L–1培养条件下的烟草叶片进行转录组测序。共获得76.94 Gb有效数据(Clean data), Q30 碱基百分比均达到95.43%以上; 在镉胁迫的烟草叶片中, 共筛选出7735个差异表达基因, 其中4833个基因表达上调, 2902个基因表达下调, 并通过qRT-PCR分析验证了转录组数据的可靠性。对差异转录本进行GO和KEGG富集分析, GO注释表明差异基因涉及代谢过程、应激反应、细胞结构体、催化活性和转录调节活性等; KEGG富集分析表明上调差异基因主要富集在氨基酸的生物合成、碳代谢、氧化磷酸化和柠檬酸循环等通路, 下调差异基因则主要富集在光合作用、次生代谢产物的生物合成、代谢途径和植物激素信号转导途径。进一步分析植物激素信号转导通路发现, 共有8条植物激素途径以不同的表达方式参与烟草对镉胁迫的响应。激素喷施烟草的实验结果表明, 叶片通过调控赤霉素、油菜素内酯和茉莉酸途径以应对镉胁迫; 拟南芥激素信号缺失突变体验证实验表明赤霉素、油菜素内酯、茉莉酸和乙烯途径均响应镉胁迫。综上所述, 本文以转录组分析探究了烟草叶片响应镉胁迫的调控网络, 以期为提高作物抗逆性的遗传改良提供理论依据。
普通烟; 镉胁迫; 转录组分析; 调控机制; 植物激素
目前, 全球的土壤普遍受到不同程度的重金属污染[1], 镉(Cd)是最具毒性的重金属, 其毒害作用使得农业Cd污染问题备受关注[2]。Cd易在植物中积累, 并通过食物链进入人体而危害人类健康, 如肾损伤、心血管疾病和癌症等[3], 已成为威胁世界粮食生产安全的重要元素。在中国, 随着工业的发展和城市化进程的加快, 含Cd矿源的开采与冶炼以及含Cd工业“三废”的排放, 造成农田土壤Cd污染问题日益严重[4]。因此, 深入研究植物响应镉胁迫的分子机制, 可为品种的遗传改良提供理论依据, 对治理镉污染和保障粮食安全具有重要意义。
土壤中离子态的Cd极易被植物根部吸收, 而Cd的运输和分布则依赖于植物体内金属转运蛋白, 包括ATP结合盒转运蛋白(ATP-binding cassette transporter, ABC)、阳离子交换体(cation exchanger, CAX)、重金属ATP酶(heavy metal ATPase, HMA)、天然抗性相关巨噬细胞蛋白(natural resistance- associated macrophage proteins, NRAMP)和寡肽转运体(oligopeptide transporter, OPT)等[5-6]。Cd进入植物细胞后会诱导活性氧过量积累, 使得蛋白质发生氧化损伤, 甚至造成细胞坏死[7]。此外, Cd通过金属转运蛋白转移到地上组织后, 不仅扰乱植物水分平衡、气孔导度和CO2利用率以改变叶片的光合速率, 还会阻碍叶绿素色素与特定蛋白质的结合, 致使光系统、光收集复合物和光合酶失去原有功能, 破坏叶绿素的合成[8]。另有研究表明, 高浓度Cd诱导叶绿体内淀粉粒体积和数量的增加, 破坏叶绿体结构, 导致体内干物质大量减少, 而且Cd会抑制植物种子的萌发, 严重降低作物的生产力[9-11]。
为了应对不利的生存环境, 植物已经进化出一系列的响应调节机制和防御策略, 包括对干旱、高温和金属的适应。如, 在缺乏铁元素的情况下, 水稻可以通过调节体内赤霉素的含量减缓叶片铁缺乏的症状[12]。盐生植物对高盐土壤的适应则是通过胁迫感知、信号转导和代谢途径改变来实现[13]。油菜和小麦等农作物为了应对干旱胁迫, 通过促发糖酵解到醋酸合成的动态代谢能量转换以启动茉莉酸信号通路, 从而提高植物耐旱性[14]。为了减缓重金属Cd的毒害作用, 植物利用激素合成通路和抗氧化系统进行抵御。拟南芥通过调节乙烯含量从而降低植物体内超氧阴离子的积累, 以改善镉胁迫下根系的发育[15], 植物体内脯氨酸的积累可促进糖和有机酸的合成, 减少氧化损伤并调节细胞渗透压, 维持细胞结构的稳定[16]。龙葵通过诱导生长素在根部的重新分布, 调控一氧化氮的积累量, 从而缓解镉毒性[17]。大量报道关注植物根部对重金属Cd的响应, 但对叶片响应Cd胁迫的调控机制却缺乏深入研究。
烟草(L.)作为我国重要的经济作物, 极易超富集Cd, 且烟草Cd含量的50%以上积累在叶片[18-19], 严重影响烟叶的品质。越来越多的研究表明, 吸烟已成为烟民身体中重金属Cd的主要来源之一[20-21], 而非吸烟者则可能通过二手烟加剧Cd的吸入[22-23], 但关于烟草响应镉胁迫的分子机制尚待解析。因此, 本文以烤烟作为研究材料, 利用高通量测序技术对Cd胁迫和正常生长的烟草叶片进行转录组测序(RNA-Seq), 以获得差异基因的功能注释。此外, 通过外施激素和激素信号突变体明确激素对Cd的调控, 旨在揭示烟草叶片响应Cd胁迫的分子机制, 进一步丰富烟草对逆境的调控网络, 为提高作物抗逆性的遗传改良奠定理论基础。
1 材料与方法
1.1 试验材料
供试烟草材料为本实验室保存的烟草栽培品种NC89 (L. cv. NC89)。野生型拟南芥(, Col-0)和拟南芥油菜素内酯信号缺失突变体由本实验室保存, 拟南芥其他激素信号缺失突变体、、、和由广西民族大学丰景老师提供。
1.2 材料处理及生理参数的测定
烟草NC89种植在温室, 温室培养条件为相对湿度75%、光周期12 h光照/12 h黑暗、温度24℃ ± 2℃。首先, 将烟草种子用水浸泡1 d, 随后均匀播撒在营养土中萌发生长12~14 d, 将萌发的材料移栽至穴盘继续培养13~17 d, 最后用清水洗净幼苗的根部,并用海绵夹住下胚轴基部, 使其固定在KT板上进行水培预培养(5 d)。最后, 将烟苗放置在Cd浓度为0 (对照, CK)和500 μmol L–1(Cd处理组)的1/2霍格兰营养液中进行胁迫处理, 胁迫1周后的烟草用标尺测量其叶长、叶宽、根长, 并称量地上部和根部的鲜重。
1.3 转录组测序和基因文库建立
胁迫1周后采集对照组(CK)和Cd处理组(Cd)同一叶位的2片烟草叶片, 立刻用液氮速冻研磨, 使用干冰运输至上海凌恩生物科技有限公司进行二代转录组测序。每一个样品由10棵烟草的叶肉组织混合组成, 并设置3个生物学重复样品(CK-1、CK-2、CK-3和Cd-1、Cd-2、Cd-3)。提取样本的总RNA后, 采用Illumina Truseq RNA sample prep Kit方法将富集得到的RNA反转录形成双链cDNA, 修复cDNA双末端, 加上接头, PCR扩增后构建文库。使用Agilent 2100 bioanalyzer对文库进行质检, 合格后利用Illumina NovaSeq 6000测序仪进行测序。
1.4 差异基因的筛选和功能注释
将原始数据进行质控, 去除接头序列和低质量序列, 以获得高质量的序列(Clean data)。利用HISAT2软件, 并以烟草栽培品种K326的核酸序列为参考基因组对Clean data进行比对分析[24]。利用FPKM法消除基因长度和测序量差异对计算基因表达的影响, 将调整后的值(FDR < 0.05)和|log2(FC)|≥1作为筛选标准, 使用EdgeR软件获取Cd处理组与CK对照组之间的差异表达基因(Differentially Expressed Genes, DEGs)。为了研究差异基因的生物学功能, 使用Goatools软件进行基因集富集。同时利用KEGG (Kyoto Encyclopedia of Genes and Genomes, 京都基因与基因组百科全书)数据库对差异基因进行Pathway分析, 以鉴定差异基因主要影响的生物学功能或调控通路。
1.5 实时荧光定量PCR验证差异基因的表达
为验证转录组数据的可靠性, 随机选择7个差异基因(, NADH氧化酶基因;, 脂氧合酶基因;, AP2/ERF转录因子基因;, WRKY转录因子基因;, 天线蛋白基因;, 核糖体蛋白基因;, 抗坏血酸过氧化物酶基因)进行实时荧光定量PCR (qRT-PCR), 并选用烟草转录延伸因子(,)作为内参基因, 通过Primer Premier 5设计基因的特异性引物(表1)。使用Eastep Super总RNA提取试剂盒提取叶片RNA, 随后采用Invitrogen SuperScript反转录酶进行反转录, 合成cDNA。实时荧光定量PCR使用Hieff qPCR SYBR Green Master Mix (No Rox)试剂盒(YESEN公司), 试验过程参照试剂盒的操作说明。qRT-PCR的反应条件为: 94℃预变性3 min; 94℃变性20 s, 60℃退火45 s, 72℃延伸30 s, 40个扩增循环; 在延伸阶段采集荧光, 并插入溶解曲线。本试验包含3次生物学重复, 以2-ΔΔCT法进行定量数据分析[25]。

表1 实时荧光定量PCR引物序列
1.6 植物激素信号转导通路的调控
将拟南芥种子(WT、、、、、和)用含1% Triton的75%乙醇溶液消毒20 min (旋转), 在超净工作台内用无水乙醇清洗3次, 将其放在滤纸上晾干后, 均匀撒播在Cd浓度为0 (对照组)和50 μmol L–1的1/2 MS培养基中。随后, 培养基平板置于黑暗条件下4℃培养3 d, 再将平板移至培养箱(温度22~24℃, 光暗周期16 h光照/8 h黑暗, 相对湿度70%)生长, 观察表型并测定生理参数。此外, 利用外源激素6-BA (细胞分裂素的一种, 40 μmol L–1)、BL (活性最高的一种BR, 10 μmol L–1)、GA3(赤霉素的一种, 100 μmol L–1)、MeJA (茉莉酸甲酯, 200 μmol L–1)喷施烟草, 水(Water)作为对照, 2 d后将烟草移至Cd浓度为0和500 μmol L–1的1/2霍格兰营养液中进行培养, 观察表型并测量相关生理参数, 以确定激素响应Cd胁迫的机制。
1.7 数据方差分析
本研究所有实验处理均包含至少3组生物学重复。利用GraphPad Prism 9.0软件对数据进行单因素或双因素方差分析并作图,< 0.05表示差异显著,< 0.01表示差异极显著。
2 结果与分析
2.1 Cd抑制了烟草的生长
为探究Cd胁迫对烟草生长发育的影响, 选取野生型烟草, 进行Cd胁迫处理。如图1-A所示, 在正常条件下(CK), 烟草叶片和根系均呈现生长茂盛的情况, 叶片翠绿, 根系发达。但在Cd胁迫条件下(Cd), 烟草的生长受到显著的抑制, 叶片叶绿素降解明显、黄化程度增加、叶面积减小, 而根系发育不良, 呈现为褐化状态。进一步对烟草叶宽、叶长和根重、根长以及地上部分的生物量进行了测量, 结果表明Cd导致烟草叶片的长度、宽度以及根重、根长和地上部分的重量都受到显著的抑制(图1-B), 表明Cd抑制了烟草的生长。
2.2 获得高质量转录组数据
为了阐明烟草响应镉胁迫的调控网络, 我们采集生长环境Cd浓度为0 (CK)和500 μmol L-1(Cd)的烟草叶片进行转录组测序。测序结果显示, 每个样本的测序原始数据分别从78,412,514到78,412,514不等。经过质量过滤后, 每个样本产生77,125,276~ 114,117,568干净读长, 有效碱基为11.09~16.28 Gb, 共获得76.94 Gb有效数据(Clean data), 平均GC含量为46.38%, 有效序列的Q30均超过95.43% (表2)。采用Pearson方法进行样品间相关性检验, 结果表明同组生物学重复样品间的表达模式高度一致, 相关系数均在0.98以上(图2-A)。以上数据说明了本次转录组数据的高质量, 可用于后续分析。
为了确定对照组(CK)和实验组(Cd)之间基因表达的差异性, 根据EdgeR分析结果, 以<0.05和|log2FC|≥1作为标准进行筛选。与对照组相比, 实验组共筛选出7735个差异表达基因(DEGs), 其中有4833个基因(占总DEGs的62.5%)在Cd胁迫环境中的表达上调, 2902个基因(占总DEGs的37.5%)在Cd胁迫环境中的表达下调(图2-B)。

图1 镉抑制了烟草的生长
A: Cd对烟草表型的影响; B: 定量分析烟草的生理参数。误差线表示平均值 ± 标准差。*表示< 0.05水平差异显著; **表示< 0.01水平差异极显著; 叶长、叶宽和根长的单位为cm; 鲜重单位为g。
A: phenotypic changes of tobacco under Cd stress conditions; B: measurements of physiological parameter. The error line represents the mean ± standard deviation; *:< 0.05; **:< 0.01. The unit of leaf length, leaf width, and root length is cm; The unit of fresh weight is g. CK: 0 μmol L–1Cd; Cd: 500 μmol L–1Cd.

表2 样品测序输出数据的质量评价

图2 样品相关性及差异基因分析
A: 样品相关性分析; B: 差异表达基因火山图。
A: sample correlation analysis; B: volcano map of differentially expressed genes.
2.3 qRT-PCR验证差异表达基因
为了验证转录组数据的可靠性, 本研究以烟草作为内参基因, 随机筛选了在转录组数据中有显著变化的7个差异表达基因进行qRT-PCR检测。RNA-seq测序结果表明, Cd诱导了基因、、和的表达, 但是会抑制基因、、的转录(表3)。qRT-PCR检测结果与转录组数据变化趋势高度一致, 与对照组相比, Cd处理使得、、和分别上调了1.85、5.15、26.40, 3.47倍, 却使、、分别下调至0.81、0.71和0.62 (图3), 表明转录组数据的真实可靠。

表3 转录组的差异表达基因
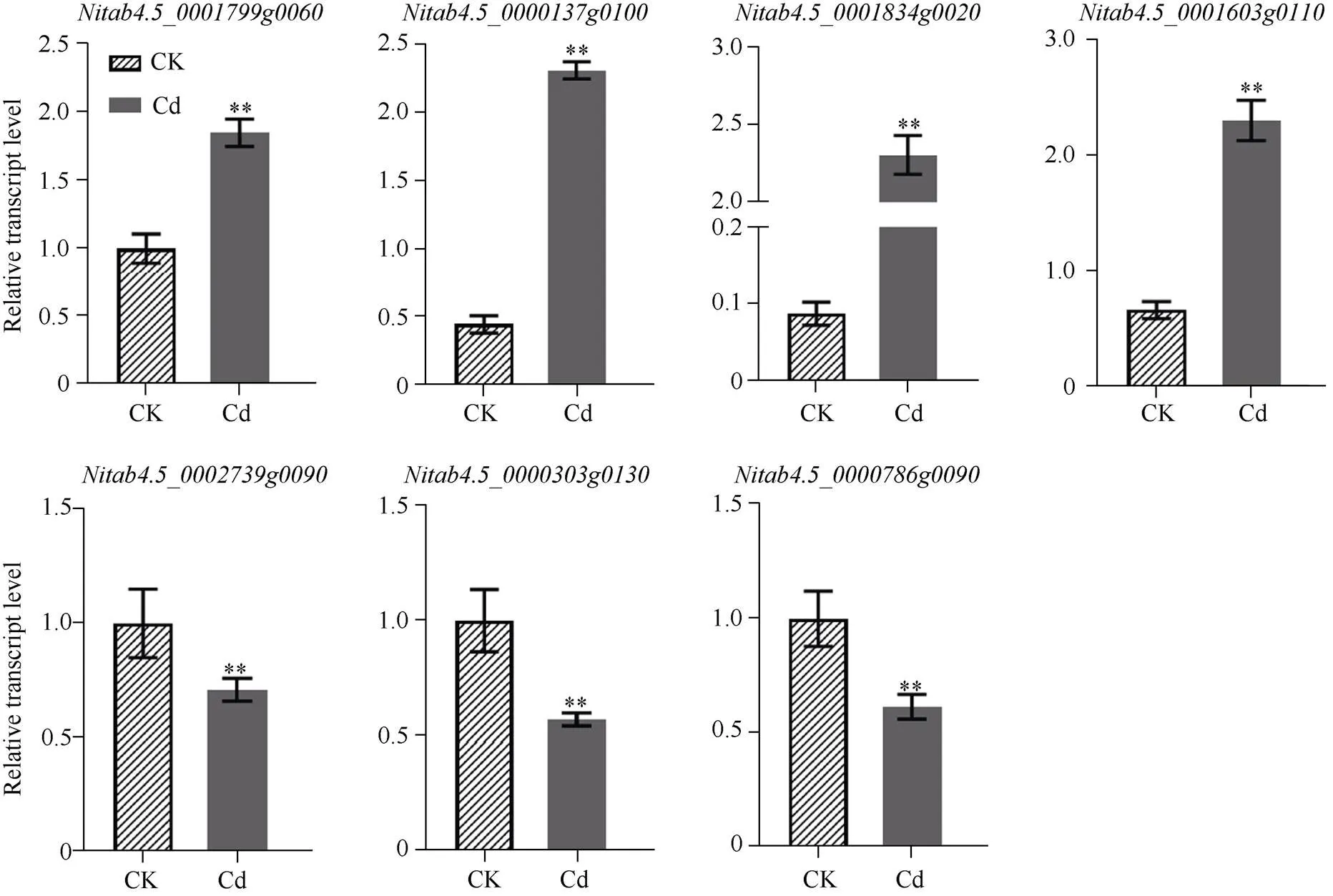
图3 差异表达基因的qRT-PCR验证
误差线表示平均值 ± 标准差。*表示< 0.05水平差异显著; **表示< 0.01水平差异极显著。
The error line represents the mean ± standard deviation; *:< 0.05; **:< 0.01.
2.4 镉诱导金属转运相关基因的差异表达
研究表明, 植物根部吸收的Cd通过金属转运蛋白转移到地上组织, 使得作物叶片变黄, 生长出现迟缓现象[26]。为了探究烟草叶片对Cd转运的响应机制, 本文对镉转运相关蛋白的差异表达基因进行了分析。在Cd胁迫条件下, 负责Cd长距离运输的金属转运蛋白和的基因表达量大部分上调, 少部分基因表达量下调; 负责将Cd转运到液泡储存以减缓植物毒害作用的和基因被显著诱导表达; 此外, 为了维护细胞稳态, 细胞质膜上的金属转运蛋白会将过量的Cd运送至细胞外, 涉及的转运蛋白基因家族的表达水平多数提高, 个别表达水平受到抑制; 提高植物Cd抗性的金属转运蛋白基因的表达量均上调(表4)。转录组数据表明, 镉胁迫诱导叶片金属转运相关基因的差异表达。
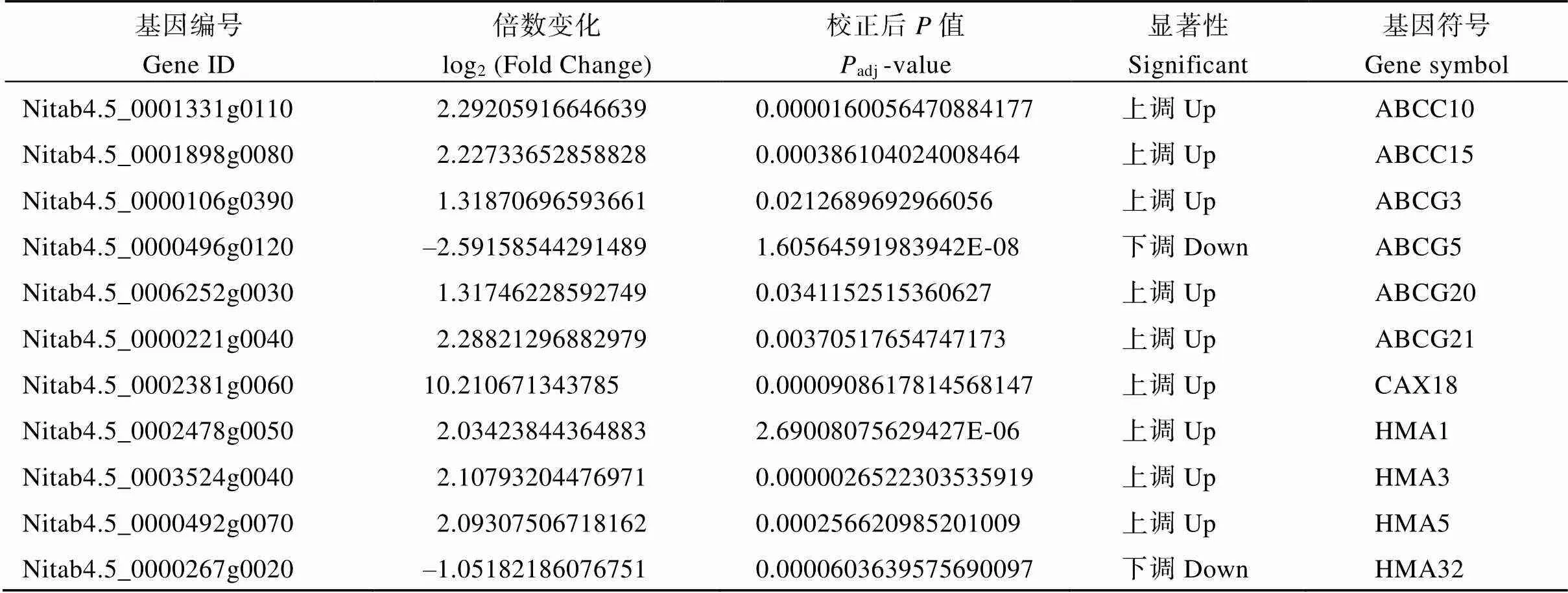
表4 烟草叶片中镉转运相关基因的差异表达
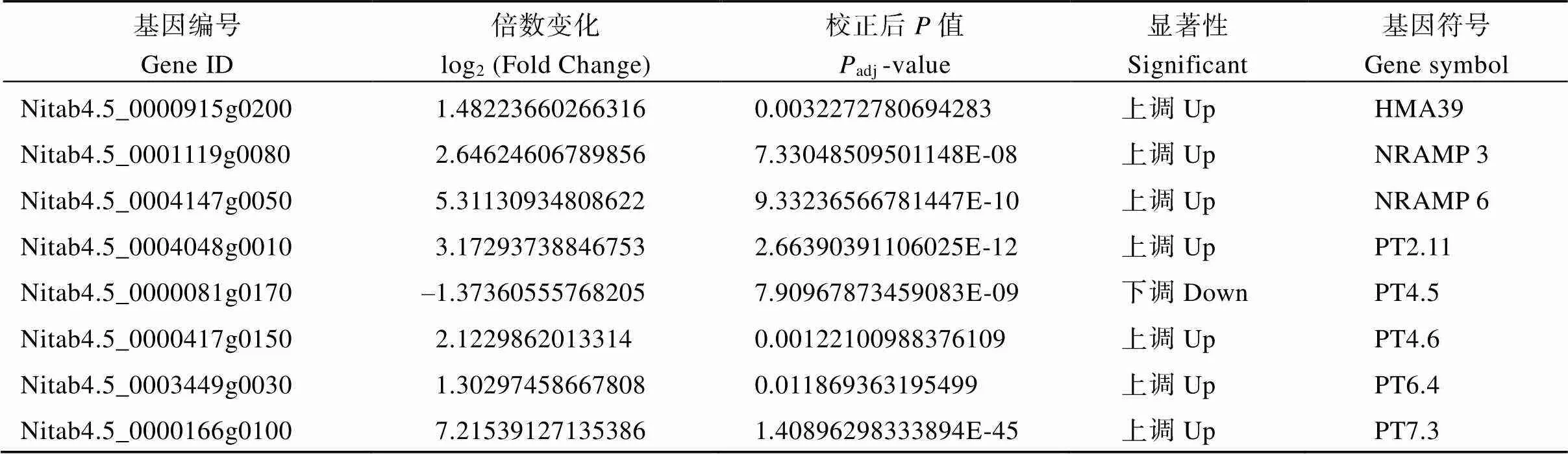
(续表4)
2.5 差异表达基因GO功能注释
为进一步探究烟草对Cd的响应过程, 本研究利用Goatools软件对所有DEGs进行GO分析, 发现共有2459个上调差异基因和1443个下调差异基因获得了注释, 根据基因数目筛选出36条最显著的条目(图4)。结果表明, Cd处理后烟草DEGs可分为3个主要功能类别, 分别是生物学过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF), 特别是在生物学过程中高度集中。在生物学过程中, 差异基因主要分布在生物调节(biological regulation)、细胞过程(cellular process)、代谢过程(metabolic process)、多细胞生物过程(multicellular organismal process)、应激反应(response to stimulus)等条目。细胞组分功能模块基因数目最多的条目为细胞内(intracellular)和细胞结构体(cellular anatomical entity)。分子功能注释的基因大部分集中在结合(binding)、催化活性(catalytic activity)、转录调节活性(transcription regulator activity)等条目。
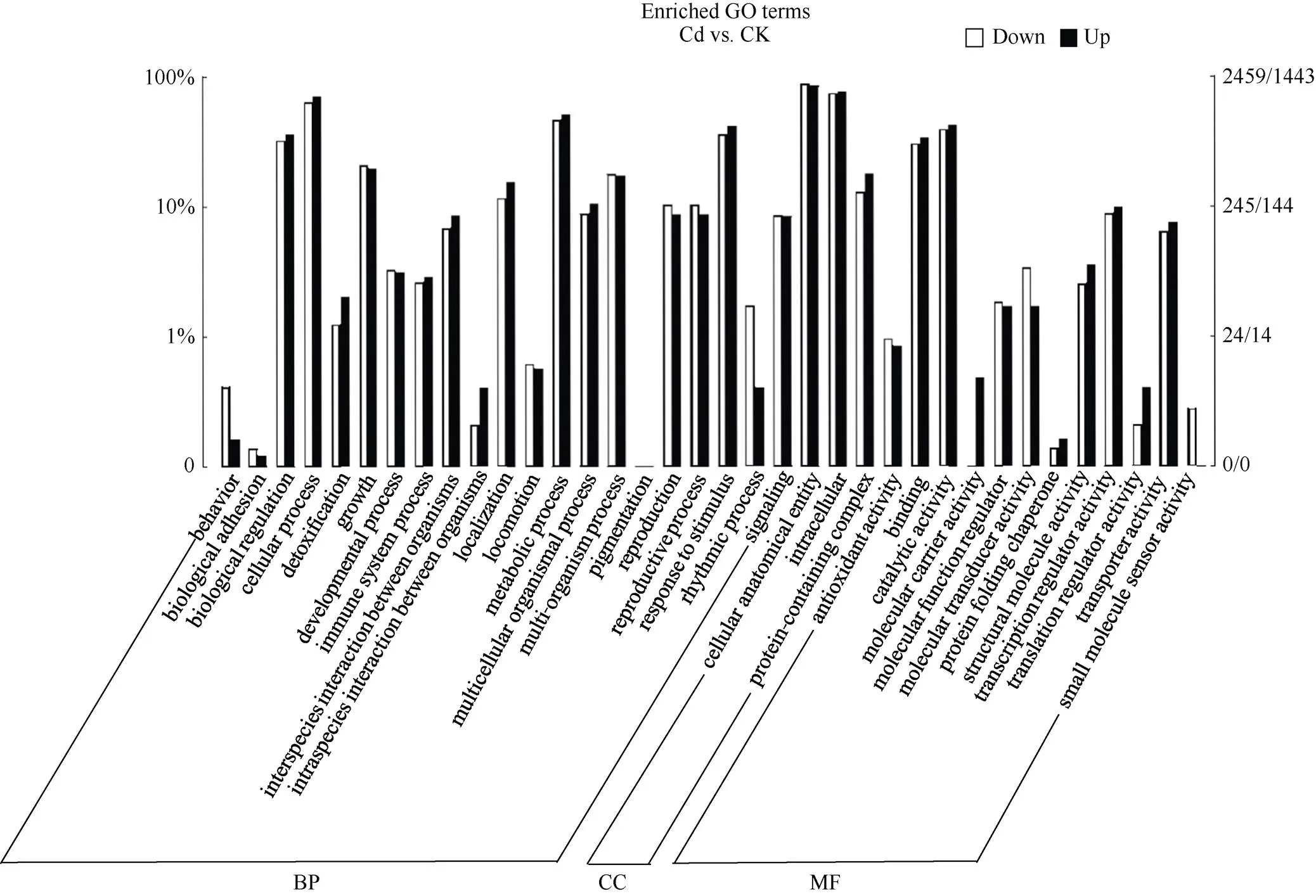
图4 差异表达基因 GO功能注释
图中左侧纵坐标表示注释到某一GO term的基因数占所有GO注释基因总数的比例, 右侧纵坐标表示注释到某一GO term的基因个数, 横坐标表示GO的每一详细分类。
The left vertical axis in the figure represents the proportion of genes annotated to a certain GO term to the total number of genes annotated with GO, the right vertical axis represents the number of genes annotated to a certain GO term, and the horizontal axis represents each detailed classification of GO.
2.6 差异基因KEGG富集分析
根据KEGG (Kyoto Encyclopedia of Genes and Genomes)数据库开展通路富集分析, 通过解析差异表达基因对代谢通路的影响, 进一步揭示烟草响应Cd胁迫的生理机制。Cd胁迫下烟草的差异基因成功地被富集到210条KEGG通路上, 其中共有4400个基因上调, 1906个基因下调。上调基因富集途径主要与氨基酸的生物合成(biosynthesis of amino acids)、内质网中的蛋白质加工(protein processing in endoplasmic reticulum)、β-丙氨酸代谢(beta-alanine metabolism)、碳代谢(carbon metabolism)、柠檬酸循环(citrate cycle)、氧化磷酸化(oxidative phosphorylation)、脂肪酸降解(fatty acid degradation)等途径相关。下调基因则主要富集于植物激素信号转导(plant hormone signal transduction)、次生代谢产物的生物合成(biosynthesis of secondary metabolites)、代谢途径(metabolic pathways)、氰胺酸代谢(cyanoamino acid metabolism)、光合生物中的碳固定(carbon fixation in photosynthetic organisms)、戊糖和葡萄糖醛酸相互转化(pentose and glucuronate interconversions)、光合作用(photosynthesis)等通路(图5)。
2.7 植物激素信号通路的研究
植物激素信号分子广泛存在于在生命体中, 不仅参与植物生长发育的调控, 而且在帮助植物适应不利的生存环境等方面起着至关重要的作用。由图6可知, KEGG富集分析表明大量差异基因被富集在植物激素信号转导途径, 共有8种不同的植物激素信号通路参与烟草对Cd胁迫的响应, 包括生长素(Auxin)、细胞分裂素(CTK)、乙烯(ET)、油菜素内酯(BR)、茉莉酸(JA)、赤霉素(GA)、脱落酸(ABA)和水杨酸(SA)。Auxin与CTK主要调节植物的生长与发育, 在响应Cd胁迫中, Auxin和CTK信号转导途径中的所有基因几乎都被差异富集, 导致了烟草生长状态的差异。植物生物胁迫抗性激素JA和SA信号通路的也被差异富集。在调节植物非生物胁迫的ABA信号通路中, Cd 诱导基因的表达, 抑制了和基因的表达。在GA信号转导途径中,基因的表达被诱导了。ET信号转导途径的基因表达均上调, 而BR信号转导途径的基因则主要是被下调表达。上述结果表明激素信号转导途径参与烟草对Cd胁迫的响应。
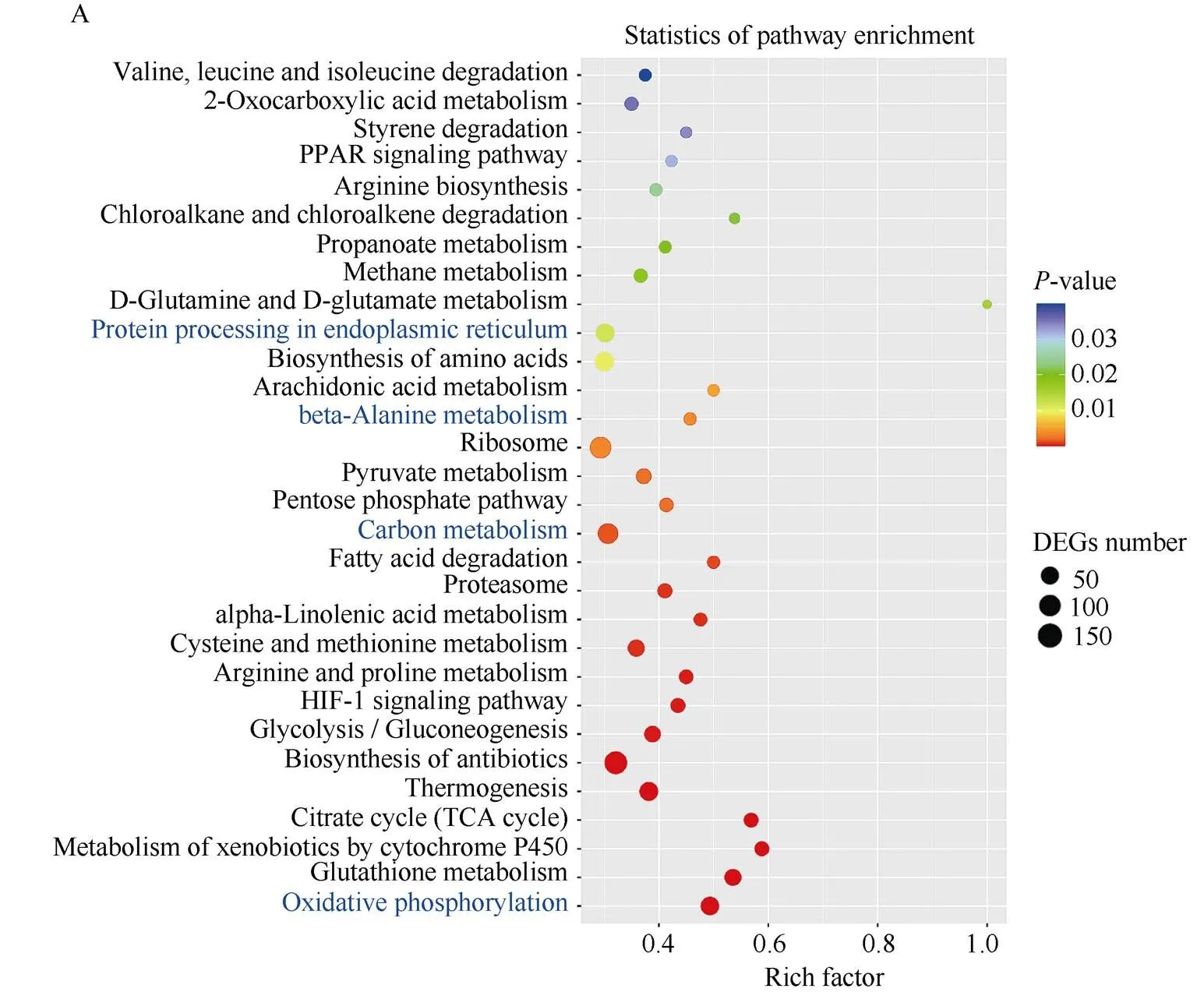
(图5)
A: 上调差异基因前30条途径的KEGG富集散点图; B: 下调差异基因前30条途径的KEGG富集散点图。Y轴表示富集的KEGG途径, X轴表示富集到KEGG通路DEG数量与DEGs总数的比率。
A: KEGG pathway up-regulated gene top 30 enrichment scatter plot; B: KEGG pathway down-regulated gene top 30 enrichment scatter plot. The Y-axis represents the enriched KEGG pathways, while the X-axis represents ratio of enriched DEGs in KEGG pathways to the total amount of DEGs.
2.8 植物激素通路响应镉胁迫
为了具体阐述植物激素对Cd胁迫的调控机制, 本研究使用外源激素喷施烤烟地上部分, 并利用拟南芥不同激素信号响应途径的缺失突变体进行镉暴露试验, 以探究植物激素是否参与烟草对Cd的响应。在植物喷施水(Water)的对照组中, Cd明显抑制了烟草的生长; 在喷施6-BA (细胞分裂素)的处理组中, Cd仍然会抑制植物的生长, 并且在Cd暴露条件下, 6-BA处理组烟草地上部分的重量与对照组喷施水(Water)的烟草重量无明显差别(图-7A, B)。在喷施GA3(赤霉素)、BL (油菜素内酯)和MeJA (茉莉酸甲酯)烟草的处理组中, 地上部分鲜重在正常生长环境(CK)与Cd胁迫(Cd)条件下无显著变化, 而在Cd条件下, 喷施GA3、BL和MeJA烟草的鲜重均明显高于喷施水(Water)的烟草重量(图-7A, B), 说明赤霉素、油菜素内酯和茉莉酸参与烟草对Cd的响应。在拟南芥材料中, 与 CK相比, 在Cd胁迫条件下赤霉素缺失突变体()、乙烯缺失突变体()和油菜素内酯缺失突变体()的鲜重和根长都没有发生显著变化(图7-C~E), 而野生型拟南芥(WT)、生长素突变体()、水杨酸突变体()和脱落酸突变体()的鲜重和根长都受到了显著抑制, 说明只有赤霉素、乙烯和油菜素内酯途径参与植物对Cd的响应。综上所述, 赤霉素、乙烯、油菜素内酯和茉莉酸参与植物对Cd胁迫的调控。
3 讨论
Cd是一种非必需且毒性很强的重金属元素, 可通过与膜蛋白竞争性结合进入植物或动物细胞[27-28]。Cd进入细胞后会诱导机体产生自由基引发活性氧的过量积累, 导致细胞器的功能紊乱和细胞氧化损伤[29]。当烟草体内的重金属Cd累积到一定浓度后, 会出现一系列复杂的生理生化与分子水平的响应, 其直观表现为: 植株生长迟缓、叶片失绿萎蔫、根系坏死(图1), 但是关于烟草对镉的响应机制还不清楚。转录组测序具有检测范围广、数据量大的特点, 可提供高分辨率的基因表达谱来分析差异基因表达模式[30]。近年来, 有研究利用RNA-Seq获得烟草在冷胁迫和病虫害侵染过程中的差异基因表达矩阵, 揭示了植物对胁迫的应答机制[31-32]。因此, 本研究首次利用RNA-Seq技术筛选烤烟叶片响应镉胁迫的差异基因, 并进行功能注释, 获得了特异性调控烟草抵抗镉胁迫的激素代谢途径, 最后利用植物激素信号转导突变体进行验证, 阐述了烟草响应镉胁迫的分子机制。本文的研究结果不仅丰富了烟草对重金属响应的调控网络, 而且还为提高作物抗性的遗传改良提供了理论依据。
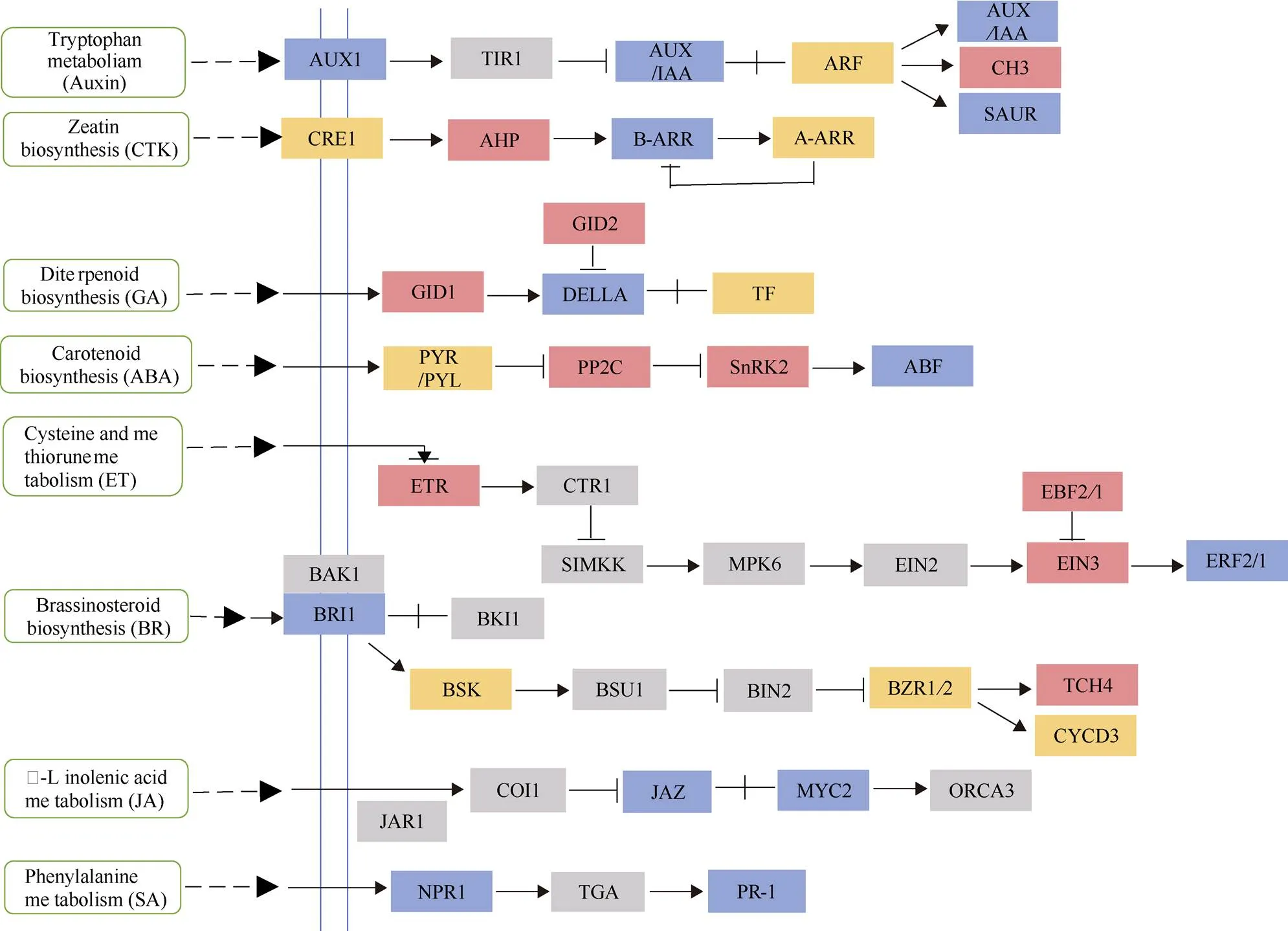
图6 植物激素信号转导示意图
图中底色为红色、黄色、蓝色的基因均属于差异表达基因, 其中红色代表基因上调表达, 黄色代表基因下调表达, 蓝色代表同时存在上调表达基因和下调表达基因。
The colors in the figure represent differentially significant genes. Red shows genes that are significantly up-regulated. Yellow shows genes that are significantly down-regulated. Blue indicates that there are both significantly up-regulated and down-regulated genes.
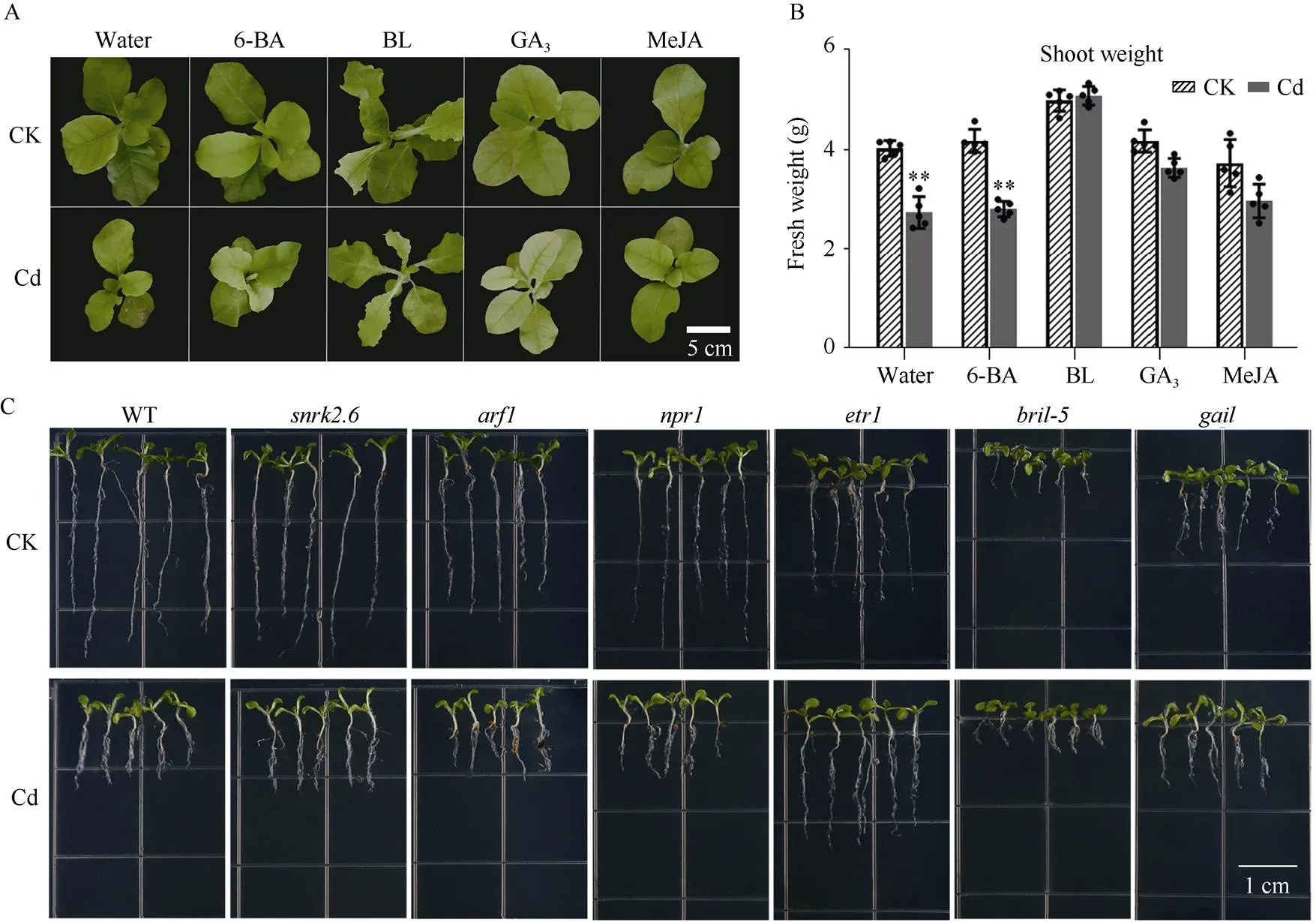
(图7)
A: 不同激素对烟草表型的影响; B: 烟草地上部分的鲜重; C: 镉对不同拟南芥突变体表型的影响; D: 拟南芥突变体根长的变化; E: 拟南芥鲜重的变化。根长的单位为cm; 拟南芥鲜重单位为mg; 烟草鲜重单位为g。误差线表示平均值 ± 标准差。*表示< 0.05水平差异显著; **表示< 0.01水平差异极显著。
A: the effects of hormone on tobacco phenotype under Cd stress conditions; B: the quantitative analysis of shoot biomass; C: the phenotypes ofmutants and wild-type plants under Cd stress conditions; D: the determination ofroot length; E: determination of Arabidopsis fresh weight. The error line represents the mean ± standard deviation; *:< 0.05; **:< 0.01. The unit of root length is cm; The fresh weight unit ofis mg, and the fresh weight unit of tobacco is g.
烟草叶片RNA-Seq数据表明镉胁迫诱导植物大量基因的差异表达。金属转运蛋白调控植物体内Cd的运输与储存, 为生物体维持重金属元素的稳态平衡做出重要贡献[6]。本文发现金属转运蛋白基因家族的表达水平差异显著, 故烟草叶片出现了Cd的超富集 (表4)。研究表明, Cd会影响叶绿素的合成, 抑制光合速率, 减少干物质的储存[9-10,33]。本文通过对差异表达基因进行GO功能注释和KEGG富集分析, 发现大量下调表达的差异基因富集在光合作用通路和碳固定通路中(图4), 说明Cd通过干扰光合作用, 影响光合生物的碳固定, 从而导致叶片面积减小, 烟草生物量降低。此外, 脂肪酸参与调节多种生命活动和逆境胁迫应答过程, 不仅可为植物储备能量, 还能为细胞膜形成屏障[34]。植物镉暴露五分钟后, 其根部大量的差异基因富集在脂质生物合成过程和脂肪酸生物合成过程[35]。在本研究中, 镉胁迫条件下, 烟草叶片上调的差异表达基因富集在脂肪酸降解途径, 说明脂肪酸代谢过程参与了烟草对镉胁迫的响应。此外, 有研究表明, 桂花树可通过大幅度降低体内脂肪酸含量以应对环境的高温胁迫[36]。因此, 当烟草响应Cd对植物光合作用的毒害作用时, 叶片可能通过促进脂肪酸的分解为生命代谢过程提供能量, 从而增强对重金属的抗性。
为了适应不利的生存环境, 植物在长期进化中已获得了一套复杂精细的调控机制以提高抗性。进一步对差异表达基因进行KEGG富集分析发现, 氨基酸的生物合成、植物激素信号转导、代谢途径、次生代谢产物的生物合成等与植物抗性相关的通路均参与烟草对Cd的响应。植物激素在调节植物的生长发育和对生物胁迫及非生物胁迫的防御反应中发挥着重要作用[37-38]。茉莉酸提高了草莓对水涝胁迫的抗性, 脱落酸通过调控气孔开关, 增强植物抵抗干旱胁迫的能力[39]。Kaya等[40]证实, 植物也可通过调控赤霉素来缓解盐碱胁迫带来的伤害。本文发现烟草叶片共有八种植物信号转导通路响应了Cd胁迫, 并且每种激素转导途径都富集了大量的差异表达基因, 说明植物激素信号通路在烟草抵抗Cd胁迫的响应中扮演重要角色。
近年来, 越来越多的研究表明激素可以缓解重金属对植物伤害, 外源生长素促进了芥菜在砷胁迫条件下的生长[41-42], 在本研究中, 激素信号转导缺失突变体和外源激素喷施的烟草实验表明乙烯、油菜素内酯、赤霉素和茉莉酸四种激素参与烟草对镉胁迫的调控。在蚕豆响应镉胁迫时, 茉莉酸通过改善渗透压和抗氧化酶活性提高植物抗性。油菜素内酯和乙烯可以提高植物抗氧化剂的表达水平以降低Cd的毒害作用[43-44]。赤霉素可以抑制Cd吸收和转运相关基因的表达, 增强生菜对镉的抗性[45]。而脱落酸通过调控Cd胁迫相关基因的表达, 促进Cd在景天植物的积累[46]。表明乙烯、油菜素内酯、茉莉酸和赤霉素广泛参与植物对Cd胁迫的调控机制, 而脱落酸则根据植物物种不同, 选择性参与植物对Cd的响应, 生长素、细胞分裂素、水杨酸不参与烟草叶片对Cd胁迫的调控作用, 但是否参与其他作物对Cd的响应仍需要更多的实验数据支撑。
4 结论
本研究利用RNA-seq转录组测序数据系统分析了烟草叶片响应Cd胁迫的差异表达基因, 发现 Cd诱导烟草碳水化合物代谢途径、氧化磷酸化途径相关基因的表达, 烟草通过调节抗氧化物质代谢、激素信号转导等途径以抵抗重金属Cd的毒害作用。激素信号缺失突变体和外施植物激素证明了烟草主要依赖乙烯、赤霉素、油菜素内酯和茉莉酸调控对Cd胁迫的适应机制。本研究阐述了烟草叶片响应Cd胁迫的调控机制, 可为提高作物抗逆性的遗传改良提供理论依据。
[1] 刘娟, 张乃明, 于泓, 张靖宇, 李芳艳, 于畅, 杜红蝶. 重金属污染对水稻土微生物及酶活性影响研究进展. 土壤, 2021, 53: 1152–1159. Liu J, Zhang L M, Yu H, Zhang J Y, Li F Y, Yu C, Du H D. Effects of heavy metal pollution on microorganism and enzyme activity in paddy soil: a review., 2021, 53: 1152–1159 (in Chinese with English abstract).
[2] 苏芸芸. 乙酰胆碱调节烟草Cd胁迫响应的生理机制. 西北农林科技大学博士学位论文, 陕西杨凌, 2021. Su Y Y. The Physiological Response Mechanism of Acetylcholine Regulating Cadmium Stress in Tobacco. PhD Dissertation of Northwest A&F University, Yangling, Shaanxi, China, 2021 (in Chinese with English abstract).
[3] Järup L, Akesson A. Current status of cadmium as an environmental health problem., 2009, 238: 201–208.
[4] Shifaw E. Review of heavy metals pollution in China in agricultural and urban soils., 2018, 8: 180607.
[5] Li D, He T, Saleem M, He G. Metalloprotein-specific or critical amino acid residues: perspectives on plant-precise detoxification and recognition mechanisms under cadmium stress., 2022, 23: 1734.
[6] Yang Z, Yang F, Liu J L, Wu H T, Yang H, Shi Y, Jie L, Zhang Y F, Luo Y R, Chen K M. Heavy metal transporters: functional mechanisms regulation and application in phytoremediation., 2022, 809: 151099.
[7] Haider F U, Cai L Q, Coulter J A, Cheema S A, Wu J, Zhang R Z, Ma W J, Farooq M. Cadmium toxicity in plants: Impacts and remediation strategies., 2021, 211: 111887.
[8] de Araújo R P, de Almeida A A F, Pereira L S, Mangabeira P A O, Souza J O, Pirovani C P, Ahnert D, Baligar V C. Photosynthetic, antioxidative, molecular and ultrastructural responses of young cacao plants to Cd toxicity in the soil., 2017, 144: 148–157.
[9] Dong X X, Yang F, Yang S P, Yan C Z. Subcellular distribution and tolerance of cadmium inL., 2019, 185: 109692.
[10] Guo L, Chen A, He N, Yang D, Liu M D. Exogenous silicon alleviates cadmium toxicity in rice seedlings in relation to Cd distribution and ultrastructure changes., 2018, 18: 1691–1700.
[11] Raza A, Habib M, Kakavand S N, Zahid Z, Zahra N, Sharif R. Hasanuzzaman M. Phytoremediation of cadmium: physiological, biochemical, and molecular mechanisms., 2020, 9: 177.
[12] Wang B, Wei H, Xue Z, Zhang W H. Gibberellins regulate iron deficiency response by influencing iron transport and translocation in rice seedlings ()., 2017, 119: 945–956.
[13] Kumari A, Das P, Parida A K, Agarwal P K. Proteomics, metabolomics, and ionomics perspectives of salinity tolerance in halophytes., 2015, 6: 537.
[14] Kim J M, To T K, Matsui A, Tanoi K, Kobayashi N I, Matsuda F, Habu Y, Ogawa D, Sakamoto T, Matsunaga S, Bashir1 K, Rasheed S, Ando M, Takeda H, Kawaura K, Kusano M, Fukushima A, Endo T A, Kuromori T, Ishida J, Morosawa T, Tanaka M, Torii C, Takebayashi Y, Sakakibara H, Ogihara Y, Saito K, Shinozaki K, Devoto A, Seki M. Acetate-mediated novel survival strategy against drought in plants., 2017, 3: 17097.
[15] Abozeid A, Ying Z, Lin Y, Liu J, Zhang Z, Tang Z. Ethylene improves root system development under cadmium stress by modulating superoxide anion concentration in., 2017, 8: 253.
[16] Borgo L, Rabêlo F H S, Budzinski I G F, Cataldi T R, Ramires T G, Schaker P D C, Ribas A F, Labate C A, Lavres J, Cuypers A, Azevedo R A. Proline exogenously supplied or endogenously overproduced induces different nutritional, metabolic, and antioxidative responses in transgenic tobacco exposed to cadmium., 2022, 41: 2846–2868.
[17] Xu J, Wang W Y, Sun J H, Zhang Y, Ge Q, Du L G, Yin H X, Liu X J. Involvement of auxin and nitric oxide in plant Cd-stress responses., 2011, 346: 107–119.
[18] Rosén K, Eriksson J, Vinichuk M. Uptake and translocation of 109Cd and stable Cd within tobacco plants ()., 2012, 113: 16–20.
[19] Liu H W, Wang H Y, Ma Y B, Wang H H, Shi Y. Role of transpiration and metabolism in translocation and accumulation of cadmium in tobacco plants (L.)., 2016, 144: 1960–1965.
[20] Bush P G, Mayhew T M, Abramovich D R, Aggett P J, Burke M D, Page K R. A quantitative study on the effects of maternal smoking on placental morphology and cadmium concentration., 2000, 21: 247–256.
[21] Li H Q, Wallin M, Barregard L, Sallsten G, Lundh T, Ohlsson C, Mellström D, Andersson E M. Smoking-induced risk of osteoporosis is partly mediated by cadmium from tobacco smoke: the MrOS Sweden Study., 2020, 35: 1424–1429.
[22] Regassa G, Chandravanshi B S. Levels of heavy metals in the raw and processed Ethiopian tobacco leaves., 2016, 5: 232.
[23] Wang X K, Shi M, Hao P F, Zheng W T, Cao F B. Alleviation of cadmium toxicity by potassium supplementation involves various physiological and biochemical features inL., 2017, 39: 132.
[24] Edwards K D, Fernandez-Pozo N, Drake-Stowe K, Humphry M, Evans A D, Bombarely A, Allen F, Hurst R, White B, Kernodle S P, Bromley J R, Sanchez-Tamburrino J P, Lewis R S, Mueller L A. A reference genome for Nicotiana tabacum enables map-based cloning of homeologous loci implicated in nitrogen utilization efficiency., 2017, 18: 448.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod.s, 2001, 25: 402–408.
[26] Eissa M A. Phytoextraction mechanism of Cd by Atriplex lentiform is using some mobilizing agents., 2017, 108: 220–226.
[27] Hasan M K, Ahammed G J, Yin L L, Shi K, Xia X J, Zhou Y H, Zhou J. Melatonin mitigates cadmium phytotoxicity through modulation of phytochelatins biosynthesis, vacuolar sequestration, and antioxidant potential inL., 2015, 6: 601.
[28] Cao Z W, Fang Y L, Lu Y H, Tan D X, Du C H, Li Y M, Ma Q L, Yu J M, Chen M Y, Zhou C, Pei L P, Zhang L, Ran H Y, He M D, Yu Z P, Zhou Z. Melatonin alleviates cadmium induced liver injury by inhibiting the TXNIP-NLRP3 inflammasome., 2017, 62: 12389.
[29] Khanna K, Kohli S K, Ohri P, Bhardwaj R, Ahmad P. Agroecotoxicological aspect of Cd in soil-plant system: uptake, translocation and amelioration strategies., 2022, 29: 30908–30934.
[30] Soniya E V, Srinivasan A, Menon A, Kattupalli D. Transcriptomics in Response of Biotic Stress in Plants. Academic Press, San Diego, CA, USA, 2023. pp 285–303.
[31] Ghorbel M, Brini F, Sharma A, Landi M. Role of jasmonic acid in plants: the molecular point of view., 2021, 40: 1471–1494.
[32] Abozeid A, Ying Z J, Lin Y C, Liu J , Zhang Z H, Tang Z H. Ethylene improves root system development under cadmium stress by modulating superoxide anion concentration in., 2017, 8: 253.
[33] Gallego S M, Pena L B, Barcia R A, Azpilicueta C E, Iannone M F, Rosales E P, Zawoznik M S, Groppa M D, Benavides M P. Unravelling cadmium toxicity and tolerance in plants: insight into regulatory mechanisms., 2012, 83: 33–46.
[34] De Carvalho C C C R, Caramujo M J. The various roles of fatty acids., 2018, 23: 2583.
[35] Li C Y, Hong Y, Sun J H, Wang G P, Zhou H N, Xu L T, Wang L, Xu G Y. Temporal transcriptome analysis reveals several key pathways involve in cadmium stress response inL., 2023, 14: 1143349.
[36] 王俊宇, 王晓东, 马元丹, 付璐成, 周欢欢, 王斌, 张汝敏, 高燕. ‛波叶金桂’对干旱和高温胁迫的生理生态响应. 植物生态学报, 2018, 42: 681–691. Wang J Y, Wang X D, Ma Y D, Fu L C, Zhou H H, Wang P, Zhang R M, Gao Y. Physiological and ecological responses to drought and heat stresses in Osmanthus fragrans ‘Boyejingui’., 2018, 42: 681–691 (in Chinese with English abstract).
[37] Waadt R, Seller C A, Hsu P K, Takahashi Y, Munemasa S, Schroede J. Plant hormone regulation of abiotic stress responses., 2022, 23: 680–694.
[38] Yosefi A, Mozafari A, Javadi T. Jasmonic acid improved in vitro strawberry (×Duch.) resistance to PEG- induced water stress., 2020, 142: 549–558.
[39] Liu J, Shu D F, Tan Z L, Ma M, Gou N, Gao S, Duan G Y, Kuai B K, Hu Y X, Li S P, Cui D Y. TheIDD14 transcription factor interacts with bZIP-type ABFs/AREBs and cooperatively regulates ABA-mediated drought tolerance., 2022, 236: 929–942.
[40] Kaya C, Tuna A L, Yokaş I, Ashraf M, Ozturk M, Athar H R. The Role of Plant Hormones in Plants under Salinity Stress. In: Salinity and Water Stress. Dordrecht: Springer Netherlands, 2009. pp 45–50.
[41] Srivastava S, Srivastava A K, Suprasanna P, D’Souza S F. Identification and profiling of arsenic stress-induced miRNAs in., 2013, 64: 303–315.
[42] Hac-Wydro K, Sroka A, Jablonaka K. The impact of auxins used in assisted phytoextraction of metals from the contaminated environment on thea alterations caused by lead (II) ions in the organization of model lipid membranes., 2016, 143: 124–130.
[43] Chen H F, Zhang Q, Lv W, Yu X Y, Zhang Z H. Ethylene positively regulates Cd tolerance via reactive oxygen species scavenging and apoplastic transport barrier formation in rice., 2022, 302: 119063.
[44] Hayat S, Ali B, Hasan S A, Ahmad A. Brassinosteroid enhanced the level of antioxidants under cadmium stress in., 2007, 60: 33–41.
[45] Chen H, Yang R X, Zhang X, Chen Y H, Xia Y, Xu X M. Foliar application of gibberellin inhibits the cadmium uptake and xylem transport in lettuce (L.)., 2021, 288: 110410.
[46] Lu Q Y, Chen S M, Li Y Y, Zheng F H, He B, Gu M H. Exogenous abscisic acid (ABA) promotes cadmium (Cd) accumulation inHance by regulating the expression of Cd stress response genes., 2020, 27: 8719–8731.
Transcriptome analysis of tobacco in response to cadmium stress
ZHANG Hui, ZHANG Xin-Yu, YUAN Xu, CHEN Wei-Da, and YANG Ting*
College of Life Sciences, Jianghan University / Hubei Engineering Research Center for Protection and Utilization of Special Biological Resources in the Hanjiang River Basin, Wuhan 430056, Hubei, China
With the development of industrialization process in society, the problem of cadmium (Cd) pollution in soil is increasing. However,has a strong Cd enrichment capacity in leaves, which seriously affects its economic value. To investigate the mechanism by which tobacco responds to Cd stress, tobacco leaves were harvested from the culture solution with Cd concentrations of 0 μmol L-1and 500 μmol L-1for subsequent transcriptome sequencing. In this study, a total of 76.94 Gb clean data was obtained, with Q30 base percentage exceeding 95.43%. The results showed that 7735 differentially expressed genes (DEGs) were screened under Cd stress conditions, including 4833 up-regulated genes and 2902 down-regulated genes. The reliability of transcriptome data was verified by qRT-PCR analysis to detect the expression patterns of candidate gene. Gene ontology (GO) annotation as well as Kyoto encyclopedia of genes and genomes (KEGG) pathway analysis were performed on differentially expressed transcripts. GO functional enrichment revealed that the differentially expressed genes were mainly distributed in metabolic processes, response to stimulus, cellular anatomical entity, catalytic activity, and transcription regulator activity. Meanwhile, KEGG analysis showed that the up-regulated differentially expressed genes were mainly involved in biosynthesis of amino acids, carbon metabolism, oxidative phosphorylation, and citrate cycle. Down-regulated differentially expressed genes were primarily enriched in photosynthesis, biosynthesis of secondary metabolites, metabolic pathways, and plant hormone signal transduction. Further analysis of plant hormone signal transduction pathways revealed that there were eight plant hormone pathways involved in response to cadmium stress in tobacco, and the relative expression patterns of different hormone gene member were also different. Experimental results from plant hormone application on tobacco leaves demonstrated that the regulation of gibberellins, brassinosteroids, and jasmonic acid pathways played roles in tobacco’s response to cadmium stress. The experimental results ofhormone signal mutant showed that plants respond to cadmium stress by regulating ethylene, gibberellin, brassinosteroid, and jasmonic acid pathways. In conclusion, this study not only explores the regulatory network of tobacco resistance to Cd stress, but also lays a theoretical foundation for the genetic improvement of crop resistance.
; cadmium stress; transcriptome analysis; regulatory mechanism; plant hormone
10.3724/SP.J.1006.2024.34141
本研究由湖北省自然科学基金计划项目(2022CFB909), 国家自然科学基金青年项目(31900095)和江汉大学一流学科建设重大专项计划项目(2023XKZ016)资助。
This study was supported by the Natural Science Foundation of Hubei Province of China (2022CFB909), the Youth Fund Project of the National Natural Science Foundation of China (31900095), and the First-Class Discipline Construction and Special Program of Jianghan University (2023XKZ016).
杨婷, E-mail: yangtingYT2016@163.com
E-mail: zhanghui313355@outlook.com
2023-08-15;
2023-10-23;
2023-11-15.
URL: https://link.cnki.net/urlid/11.1809.S.20231115.1006.004
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

