花生赤霉素3-β-双加氧酶(AhGA3ox)基因家族的全基因组鉴定及表达分析
李海芬 鲁 清 刘 浩 温世杰 王润风 黄 璐 陈小平 洪彦彬 梁炫强
花生赤霉素3-β-双加氧酶(AhGA3ox)基因家族的全基因组鉴定及表达分析
李海芬 鲁 清 刘 浩 温世杰 王润风 黄 璐 陈小平 洪彦彬 梁炫强*
广东省农业科学院作物研究所/ 广东省农作物遗传改良重点实验室/ 国家油料作物改良中心南方花生分中心, 广东广州 510640
赤霉素3-β-双加氧酶(gibberellin 3-beta-dioxygenase, GA3ox)是参与赤霉素生物合成的关键酶之一, 可通过影响赤霉素的形成调控植物的生长发育, 目前在花生中尚无系统研究。本研究利用生物信息学方法在花生栽培种基因组数据库中筛选花生GA3ox家族基因, 对鉴定出的7个在栽培种花生基因组中的分布、结构及进化特征、理化性质、启动子顺式作用元件进行分析, 并利用qRT-PCR技术对其进行花生组织结构表达模式分析, 同时对AhGA3ox家族基因在不同荚果大小的2个花生品系中的表达量进行分析。结果表明, 7个基因分布在7条染色体上, 均由1个内含子和2个外显子组成。花生AhGA3ox蛋白中均包含1个DIOX_N结构域和1个2OG-FeII_Oxy结构域, 系统进化分析表明与大豆的亲缘关系较近, 在根、茎、叶、花、果针5个组织中呈现出不同表达模式, 不仅在花生果壳不同发育时期的表达量不同, 在2个荚果大小不同的花生品系果壳相同发育时期的表达量也不相同, 但多数发育时期在大果品系中的表达量均显著高于小果品系, 推测该家族基因的表达可能对荚果的形成具有促进作用。
花生;; 表达分析; 生物信息学; 功能分析
赤霉素(gibberellins, GAs)是一种广泛存在于植物中的二萜类羧酸, 包括功能活性分子GA1、GA3、GA4、GA7, 以及非活性分子GA9、GA19、GA20、GA29、GA511。GAs具有多种生物学功能, 在植物的发育和生长过程中起着重要的调控作用, 如枝条伸长、叶片扩张和形状、开花、种子萌发和果实发育[1-5]。GA的生物合成和代谢由6种关键酶催化, 分别是: 古巴焦磷酸合成酶(ent-copalyl diphosphate synthase, CPS)、内根-贝壳杉烯合成酶(ent-kaurene synthase, KS)、内根-贝壳杉烯-19-氧化酶(ent-kaurene oxidase, KO)、内根-贝壳杉烯酸氧化酶(ent-kaurenoic acid oxidase, KAO)、GA20-氧化酶(GA20ox)和GA3-氧化酶(GA3ox)以及催化活性GAs失活或GAs前体消耗的GA2-氧化酶(GA2ox)[1,5]。GA3ox则是将非活性赤霉素前体GA5/GA9/GA20/GA44催化生成有活性的GA3/GA4/GA1/GA38[5-6]。目前, 已在水稻[6]、小麦[7]、葡萄[8]、豌豆[9]、桃子[10]和拟南芥[11]等物种中克隆了部分基因。在大多数植物物种中, GA3ox由多基因家族编码, 但目前尚不清楚每个基因组中存在多少基因, 其中在拟南芥中已鉴定出4个基因(~)[11-12], 殷小林等[12]以(LOC_Os05g08540)作为靶序列, 利用BlastP 在水稻基因组数据库中共检索到了24个同源基因, 同源性为80%~90%。He等[13]利用葡萄基因组数据库中的BLAST软件鉴定到6个基因。
研究发现,在玉米[14]、水稻[6]、拟南芥[11]和苜蓿[15]中的突变均导致植株矮秆。Wei等[16]利用西瓜正常品系M08和矮秆品系N21的F2分离群体, 在9号染色体32.88 kb的区域内精确定位了一个隐性矮秆等位基因(), 基因注释显示编码赤霉素3β-羟基化酶的cl015407基因可能是的最佳候选基因。Hu等[17]通过基因组重测序发现了一种有益的单倍型, 有助于提高种子重量, 并在大豆的遗传转化中得到了进一步证实。但目前有关花生GA3ox家族基因的研究报道却比较少, 本研究在花生栽培体基因组中对基因()进行鉴定, 并系统分析了基因的结构、染色体位置、保守基序、启动子区顺式作用元件、系统发育分类以及基因在不同组织器官和发育阶段的表达谱, 分析了AhGA3ox与拟南芥()、野生豆()、大豆()同源蛋白的系统发育关系, 并对AhGA3ox家族基因在花生不同组织器官以及在2个荚果大小不同的花生品系不同发育时期的果壳中的表达模式进行了分析本研究结果将为下一步明确AhGA3ox家族基因的功能, 促进其在作物遗传改良中的应用提供良好的基础。
1 材料与方法
1.1 植物材料种植
花生品系P92-1和P92是本课题组多年培育的重组自交系超大果和超小果品系, 种植于广东省农业科学院白云区试验基地。各品系按小区种植, 单粒播种, 每小区种植共4行, 每行播种5穴。株距20 cm, 行距23.3 cm。3次重复随机种植, 大田常规种植管理。花生果针刚开始向地伸长时系上标记塑料线, 其中P92-1系红色塑料线, P92系白色塑料线, 并在果针进入土壤后第10 (S1)、17 (S2)、24 (S3)、31 (S4)和38 (S5)天, 选取大小一致的荚果, 取果壳备用。每个品系每个发育时期取50个荚果, 各3个生物学重复。
1.2 AhGA3ox家族基因的鉴定及生物信息学分析
本研究中花生GA3ox家族基因信息参考“伏花生”分析结果, 参考基因组信息从Peanutbase (https:// www.peanutbase.org/)下载; Pfam (http://pfam.xfam. org/)下载所有的结构域的hmm格式文件, 基于TBtools[18]进行Simple HMM搜索, 寻找候选蛋白; 使用NCBI保守结构域库(CDD: https://www.ncbi. nlm.nih.gov/cdd)和SMART (http://smart.embl-heidelberg. de/)进行候选蛋白验证; 利用ExPASy的ProtParam软件(https://web.expasy.org/protparam/)对GA3ox家族基因编码的蛋白氨基酸序列、相对分子量(molecular weight, MW)、等电点(isoelectric point, pI)、总平均亲水性(grand average of hydrophilicity, GRAVY)等蛋白理化性质进行分析; 利用在线软件WoLF PSORT (https://wolfpsort.hgc.jp/)进行亚细胞定位预测; 使用MapChart分析AhGA3ox家族基因成员的染色体分布; 使用NCBI-Protein (https://www. ncbi.nlm.nih.gov/guide/proteins/)搜索其他物种包括大豆、水稻以及拟南芥GA3ox蛋白; 利用DNAMAN和BLAST检索多重序列比对和同源性分析; 利用MEGA11.0软件进行邻接法(Neighhbor-Joining, NJ)构建系统发育树; 使用MEME (http://MEME.nbcr. net/MEME/cgibin/MEME.cgi)进行保守结构域分析; 从花生栽培种基因组数据库中获得基因编码序列(coding sequence, CDS)上游2000 bp的基因组DNA序列, 利用PlantCARE (http://bioinformatics. psb.ugent.be/webtools/plantcare/html/)对启动子区域潜在的顺式元件进行分析。
1.3 花生AhGA3ox家族基因表达模式分析
分别提取大荚果材料P92-1和小荚果材料P92的根、茎、叶、花、果针5个不同组织的RNA, 进行表达量分析; 同样分别提取荚果膨大期5个关键发育时期(果针进入土壤后10、17、24、31和38 d)的果壳RNA, 进行实时荧光定量PCR分析, 所用引物可见表1。其中, RNA提取和反转录分别参照TaKaRa公司RNA提取和反转录试剂盒操作手册进行; qRT-PCR析在CFX96 (Bio-Rad)定量PCR仪中进行, 采用EvaGreen试剂盒(Bio-Rad), 根据操作手册进行, 分析方法采用2–ΔΔCT, 每个样本包含3个生物学重复。
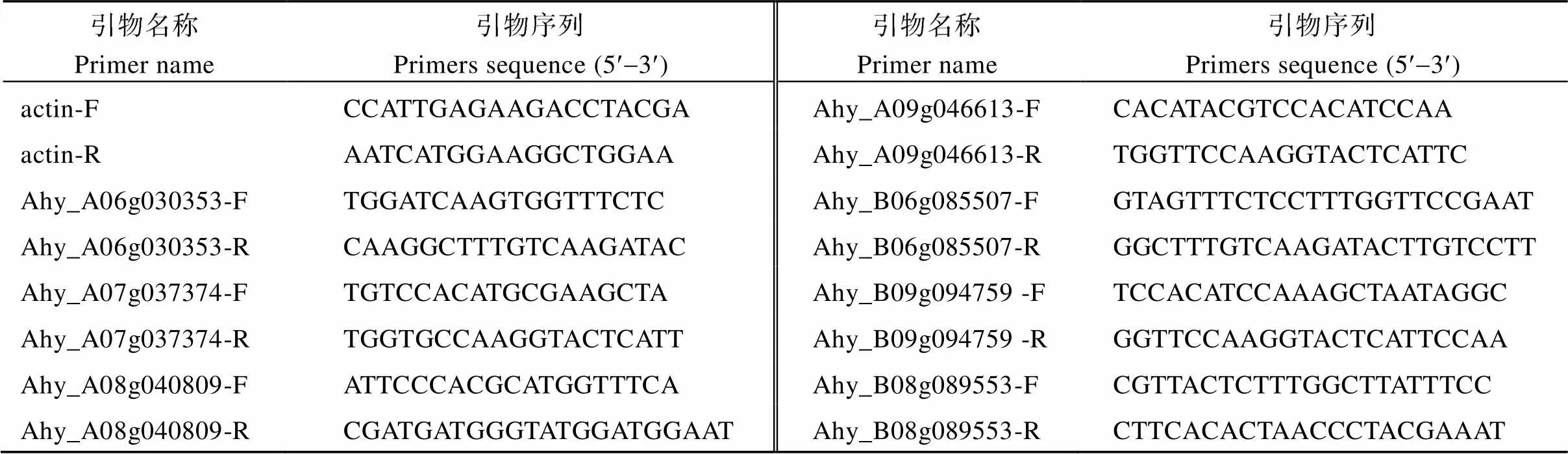
表1 qRT-PCR所用引物
1.4 数据统计和分析
用SPSS19.0 (SPSS Institute, Inc., 美国)进行数据统计分析, LSD法检验各比较组之间差异的显著性。
2 结果与分析
2.1 花生AhGA3ox基因鉴定
利用DIOX_N (PF14226)和2OG-FeII_Oxy (PF03171)结构域, 通过TBtools以及NCBI在线分析工具在花生四倍体栽培种“伏花生”全基因组中共发现7个基因。这7个基因的CDS长度在1047~1125 bp范围, 以Ahy_A07g037374最长, 编码产物含有375个氨基酸, 以Ahy_A06g030353, Ahy_ B06g085507最短, 编码产物仅含有349个氨基酸; 这些蛋白的等电点范围为5.53~8.11; 不稳定参数为36.94~57.23; 脂溶指数为75.79~86.29; 亲水性平均数–0.462~ –0.221; 带正电荷残基数目30~46; 带负电荷残基数目31~44。利用网站(https://wolfpsort. hgc.jp/)对7个AhGA3ox蛋白进行亚细胞定位预测发现, 该蛋白最可能出现在细胞核和细胞质中(表2)。根据基因组注释, 这7个分别分布在花生的7条染色体上, 包括A06、A07、A08、A09、B06、B08、B09染色体上(图1)。为研究AhGA3ox的进化关系, 利用其氨基酸序列构建了AhGA3ox蛋白的系统发育树。AhGA3ox家族成员分为2支(图2-A)。分支I由Ahy_A06g030353、Ahy_A08g040809、Ahy_ B06g085507、Ahy_B08g089553组成。分支II由Ahy_ A07g037374、Ahy_A09g046613、Ahy_B09g094759组成。

图1 AhGA3ox基因家族的染色体分布
黑色代表染色体, AhGA3ox家族基因标记在染色体右边, 左侧比例尺表示染色体长度。
The black bars represent the chromosomes. GA3ox genes are marked to the right of the chromosomes. The scale bar on the left indicates the length of the chromosomes.
为分析家族基因的结构, 通过比较基因组DNA和转录组序列来分析内含子和外显子的组成。所有均包含2个外显子(图2-A)。结合基因结构和系统发育树发现亲缘关系越近的基因, 它们之间基因结构越相似可能为花生A和B亚基因组的直系同源基因; 如Ahy_A06g030353与Ahy_ B06g085507、Ahy_A08g040809与Ahy_B08g089553、Ahy_A09g046613均含有2个内含子, 且结构、长度、分布差异较小(图2-B)。对AhGA3ox蛋白结构进行研究发现, 所有的AhGA3ox蛋白的N端都含有一个DIOX_N结构域, C端含有1个2OG-FeII_Oxy结构域(图2-B)。其中DIOX_N结构域是一个具有2-氧戊二酸/铁(II)依赖性双加氧酶活性的高度保守的N端区域。2OG-FeII_Oxy结构域中2种组氨酸和1种天冬氨酸残基催化结合金属离子, 通常是铁离子, 但在某些情况下, 另一种金属直接参与催化。靠近C端部分的保守的精氨酸或赖氨酸残基作为碱性残基与酸性底物相互作用[12]。
2.2 AhGA3ox基因的系统发育分析、基因结构和组成
为了解花生AhGA3ox家族各成员间亲缘关系与生物学功能, 明确花生与其他物种的GA3ox异同, 本研究对鉴定到的7个花生AhGA3ox与来自拟南芥()、水稻()、大豆()、野生大豆()、野生四倍体花生()、野生二倍体花生(,)的64个GA3ox进行多序列比对, 并构建系统进化树, 结果表明GA3ox蛋白可分为4类(图3), Class I类11个蛋白均来自拟南芥, Class II类的GA3ox成员最多, 共23个, Class III类15个, Class IV类22个。其中来自花生栽培种基因组的Ahy_B06g085507、Ahy_A06g030353、Ahy_A08g040809、Ahy_B08g089553属于Class II, Ahy_A07g037374、Ahy_B09g094759、Ahy_ A09g046613则属于Class IV, 这些基因均与花生四倍体野生种和二倍体野生种的距离较近。在不同的分支中, 拟南芥、水稻的GA3ox蛋白均分别成簇出现, 可见花生与拟南芥、水稻的亲缘关系较远, 与大豆的亲缘关系较近。
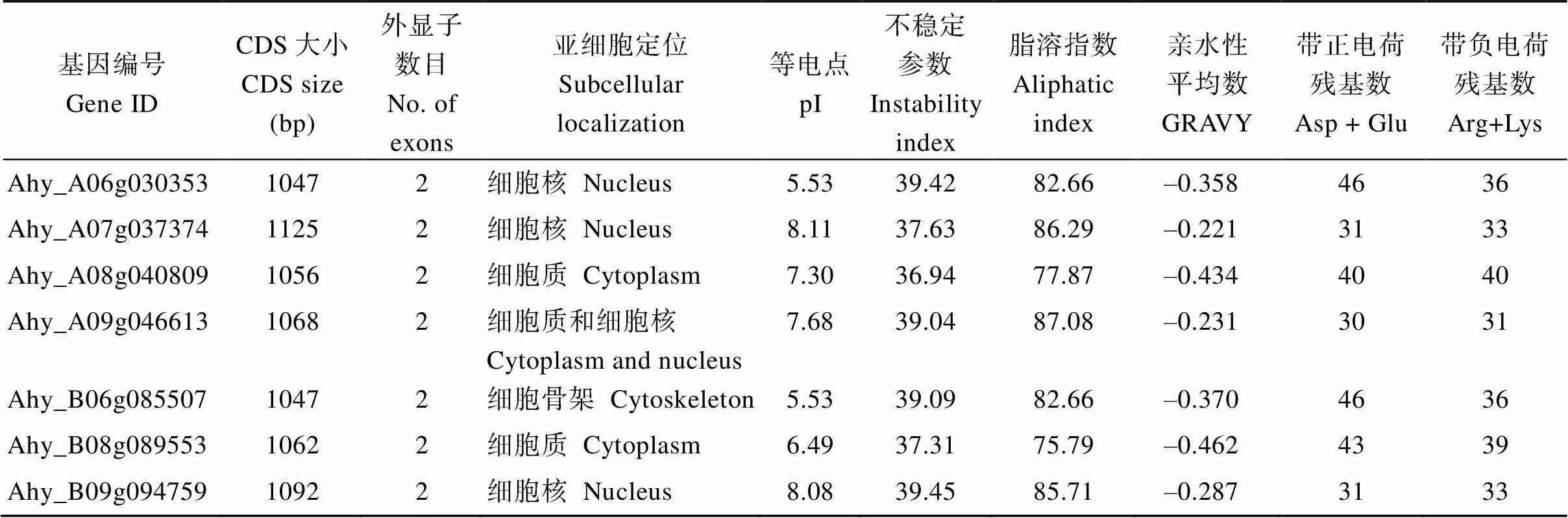
表2 AhGA3ox家族基因蛋白理化性质预测
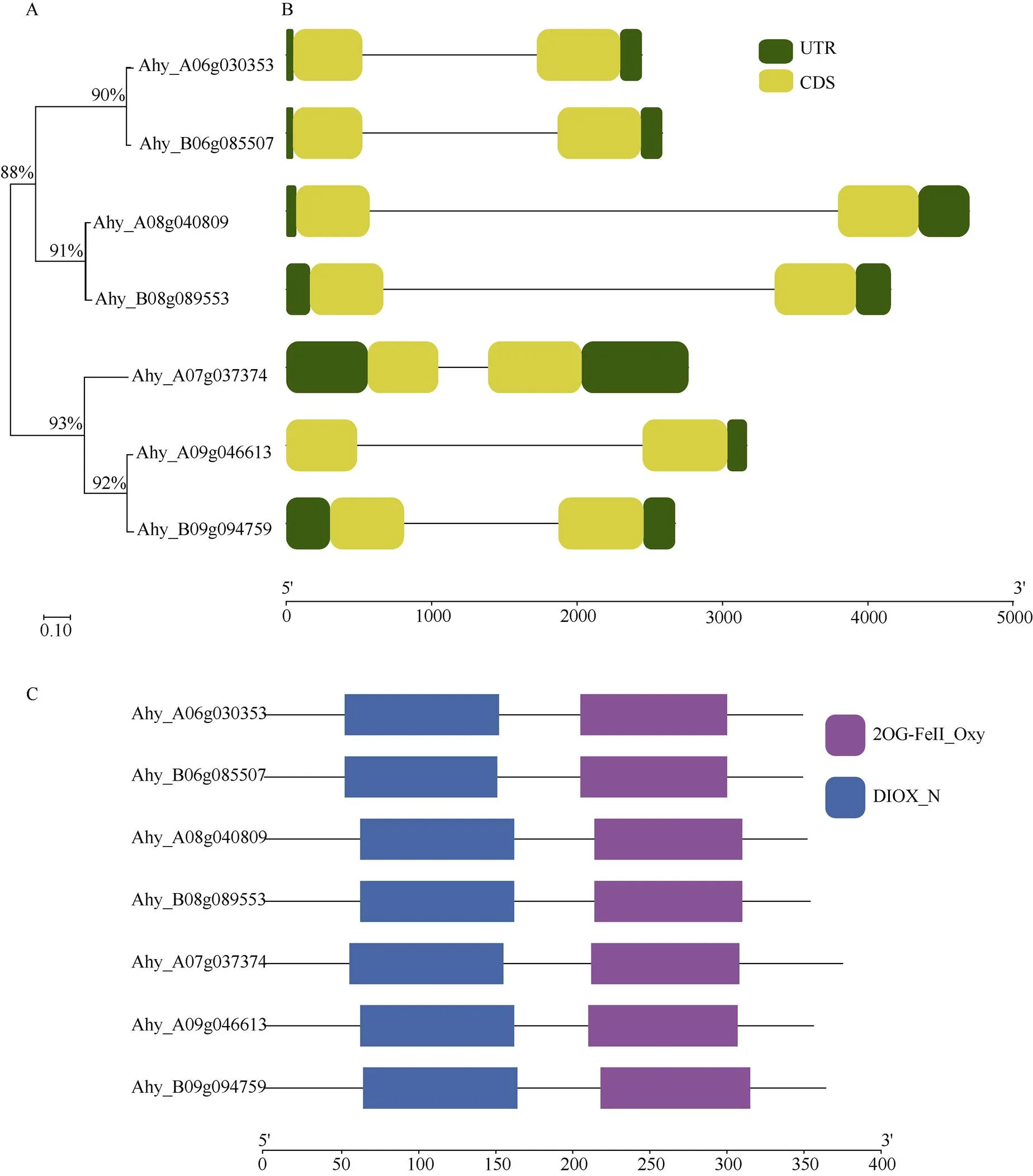
图2 花生AhGA3ox家族基因及编码蛋白的系统发育与结构分析
(A) 利用AhGA3ox的氨基酸序列构建系统发育树。(B)基因的结构。绿色矩形、黄色矩形和黑色线条分别代表UTR、CDS和内含子。底部比例尺代表UTR、CDS和内含子长度。(C) AhGA3ox蛋白的结构。蓝色和紫色矩形表示DIOX_N结构域, 2OG-FeII_Oxy结构域结构域。底部比例尺表示结构域长度。
(A) phylogenetic tree is constructed with amino acid sequences of AhGA3ox; (B) the structure ofgenes. Green rectangles, yellow rectangles, and black line represent UTR, CDS, and introns; (C) the structure of AhGA3ox protein. Blue and purple rectangles represent DIOX_N and 2OG-FeII_Oxy domains.
为进一步研究AhGA3ox蛋白的特性, 基于motif的序列分析工具MEME对来自拟南芥、水稻、大豆、野生大豆和花生5个物种71个GA3ox蛋白进行了在线分析(图4), 共得到10种保守基序, 大部分基因包含所有基序。花生栽培体基因组中, Ahy_A09g0466135、Ahy_A07g037374、Ahy_A08g040809、Ahy_B08g089553中包含所有的基序, Ahy_A06g030353包含9个motif,缺失motif 10。Ahy_B09g094759缺失motif 9, 来自花生四倍体野生种的5个基因中EVM0006872.1仅有7个基序, 缺失motif 2、motif 5、motif 9。EVM0038100.1、EVM0025264.1缺失motif 10。来自花生二倍体野生种B基因组的2个基因中araip.Araip.SF6BV则是缺失motif 6, araip.Araip. DQI4G.1则具有所有基序。
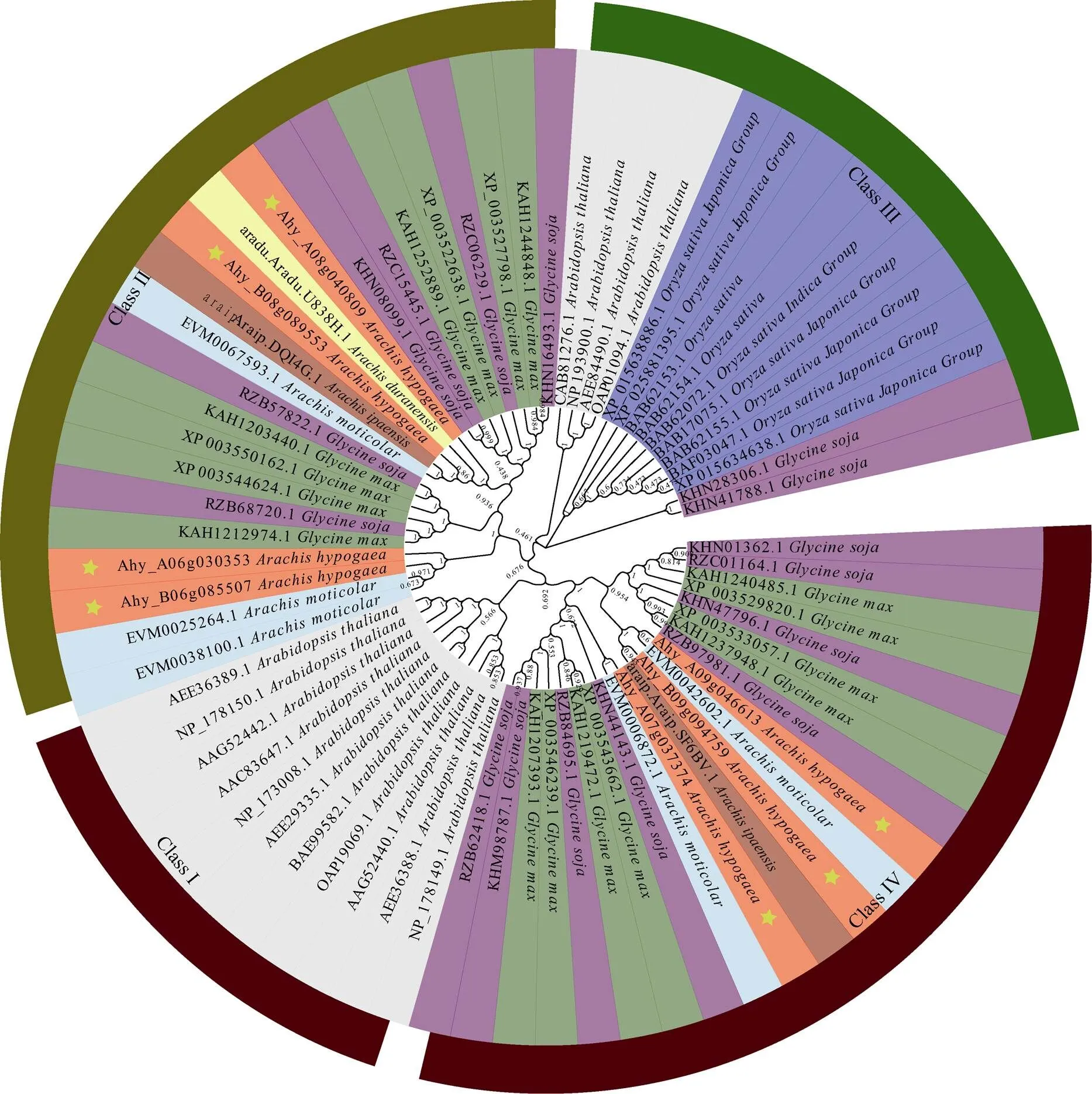
图3 GA3ox基因家族的系统发育分析
浅蓝色背景区域为四倍体野生种花生(), 绿色区域为栽培种大豆(), 蓝色区域为水稻(), 浅灰色区域为拟南芥(), 黄色区域为A基因组二倍体野生种花生(), 褐色区域为B基因组二倍体野生花生(), 紫色区域为野生种大豆(), 红色区域为四倍体栽培种花生(L.)。花生、拟南芥、水稻、大豆、野生豆系统发育分析将71个GA3ox蛋白分为4类。利用MEGA-X软件以GA3ox蛋白的氨基酸序列为基础, 采用最大似然法构建系统发育树。Bootstrap=1000。
The light blue background was tetraploid wild peanut (), the green area was cultivated soybean (), the blue area was rice (), the light gray area was(), the yellow area was A genomic diploid wild peanut (), the brown area was wild peanut with B genome diploid (), the purple area was wild soybean (), the red area was tetraploid cultivated peanut (L.). Phylogenetic relationships among 71 GA3ox proteins in peanut, arabidopsis, rice, soybean and wild soybean. GA3ox proteins were divided into 4 classes. The phylogenetic tree is built on the basis of the complete amino acid sequences of GA3ox proteins by MEGA-X with maximum likelihood method. Bootstrap=1000.
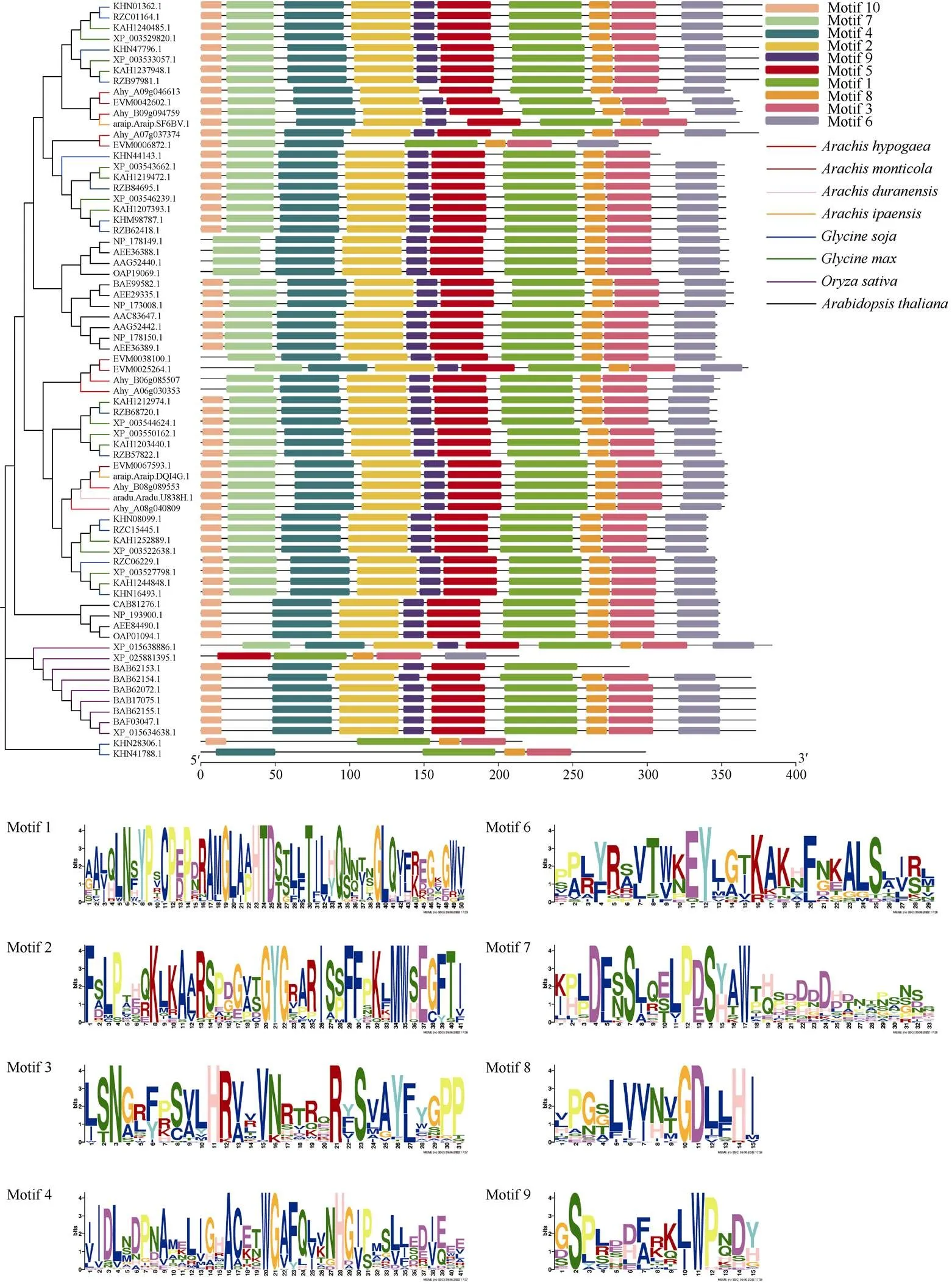
(图4)
Motif分析通过MEME在线分析完成, 不同氨基酸的高度代表可重复性, 底部的比例尺表示基序长度。左侧为蛋白系列名称, 右侧不同颜色分别对应不同的保守基序在系列上的位置。
Phantom analysis is performed by MEME program. The height of different amino acid represents repeatability. The scale bar at the bottom indicates the length of the motif protein sequence. On the left are the names of the protein series. The different colors on the right correspond to the positions of different conserved motifs on the series, respectively.
2.3 花生AhGA3ox顺式元件分析
启动子活性在基因功能调控中起着至关重要的作用。为了解花生的遗传功能、代谢网络和调控机制, 对其启动子区的顺式元件进行了分析。以的2000 bp上游序列作为假设的启动子, 利用PlantCARE对启动子区域潜在的顺式元件进行分析。结果显示, 这些基因启动子区包含多个顺式元件, 主要有ABA (ABRE)、auxin (TGA-box)、MeJA (TGACG-motif, CGTCA-motif)、GA (GARE-motif, TATC-box, P-box)和SA (TCA-element) 5种植物激素的顺式元件, 以及多个光响应(GATA-motif, TCT-motif, G-Box等)顺式作用元件(图5)。其中, 多个光响应元件在所有基因的启动子中都发现, 表明可能会受到光调控。仅Ahy_A08g040809、Ahy_ B06g085507、Ahy_B08g089553、Ahy_B09g094759的启动子中有GA响应元件, 表明这4个基因可能会由GA诱导产生。
2.4 AhGA3ox家族基因在花生各组织及果壳发育过程中的表达模式
为了进一步分析家族基因在花生发育过程中的表达情况及作用, 本研究选取了2个荚果大小不同的花生品系(农艺性状见表3), 并采用qRT-PCR技术分析了7个基因在花生植株不同组织器官中的表达量(图6)。结果表明,家族基因在2个荚果大小不同的花生品系中表达模式基本相同, 但在不同组织间表达水平不同。除Ahy_ A08g040809外(针对此基因在序列的前、中、后区段各尝试设计引物, 但均扩增失败), 其余6个基因在花生各个组织中均有表达, 其中Ahy_B08g089553在花中的表达量最高, Ahy_A09g046613、Ahy_ B09g094759在茎中的表达量最高, Ahy_ A06g030353、Ahy_B06g085507在果针中表达量最高, Ahy_ A07g037374则在根中的表达量最高。
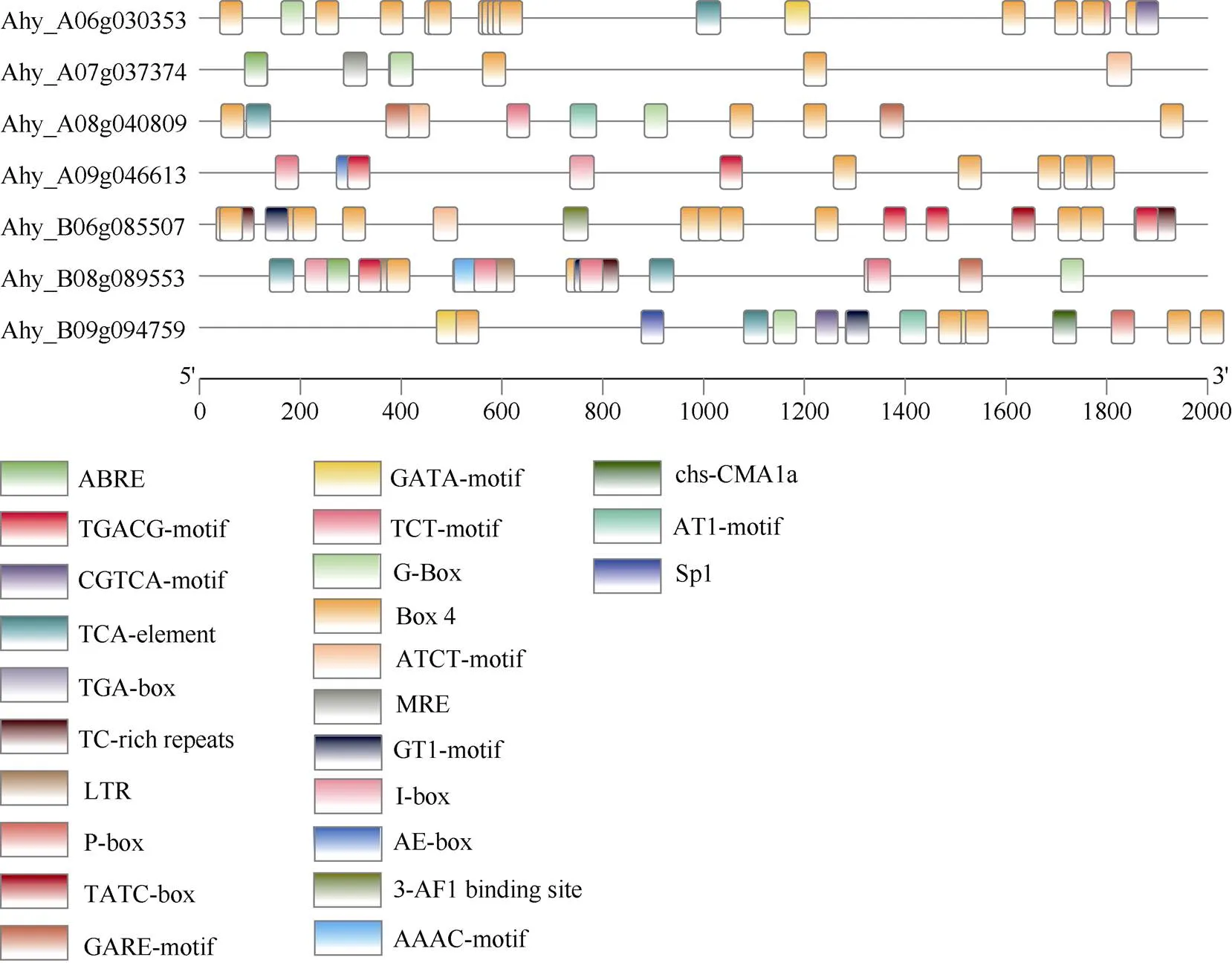
图5 AhGA3ox家族基因启动子中的顺式作用元件预测分析
不同颜色方框分别代表不同顺式元件, 底部的比例尺表示启动子序列的长度。
Different colored boxes represent different-elements, and the scale at the bottom represents the length of the promoter sequence.
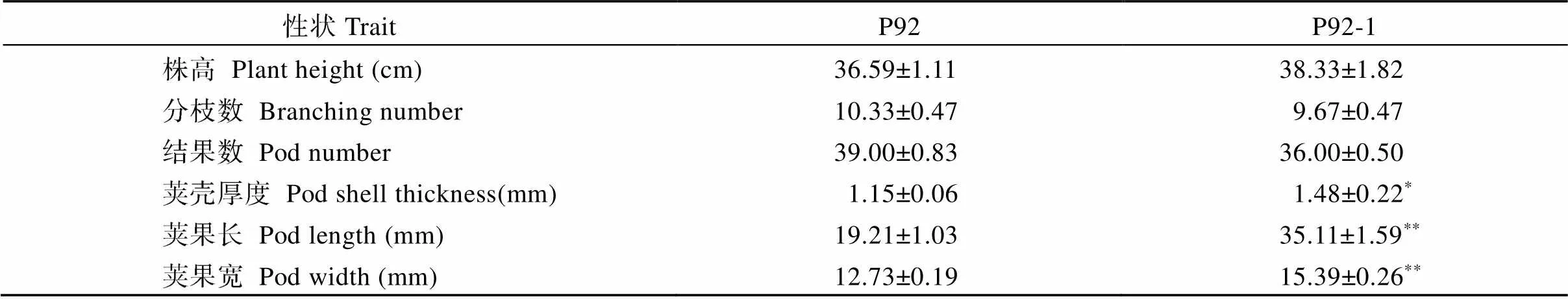
表3 2个花生品系农艺性状比较
*和**分别表示在0.05和0.01概率水平差异显著。
*and**mean significant difference at the 0.05 and 0.01 probability levels, respectively.
对不同发育阶段的果壳中家族基因的表达量进行分析(图7)发现, 该家族基因不仅在不同时期的表达量不同, 在2个品系相同发育时期的表达量也不同, 例如Ahy_B08g089553和Ahy_B06g085507在发育S1期表达量最高, 且在大果品系P92-1的5个发育时期的表达量均大于小果品系P92, 其中Ahy_B08g089553在发育前4期差异显著, Ahy_ B06g085507则在发育S1、S2、S4、S5期差异显著; 其余4个家族基因则在发育S5期的表达量最高, 其中Ahy_B08g089553的表达量在大果品系P92-1的S2、S4、S5期显著大于小果P92, Ahy_B06g085507的表达量在大果品系P92-1的S1、S4、S5期显著大于小果P92; Ahy_B09g094759的表达量在大果品系P92-1的S2、S5期显著大于小果P92, Ahy_A07g037374的表达量在大果品系P92-1的S4、S5期显著大于小果P92。
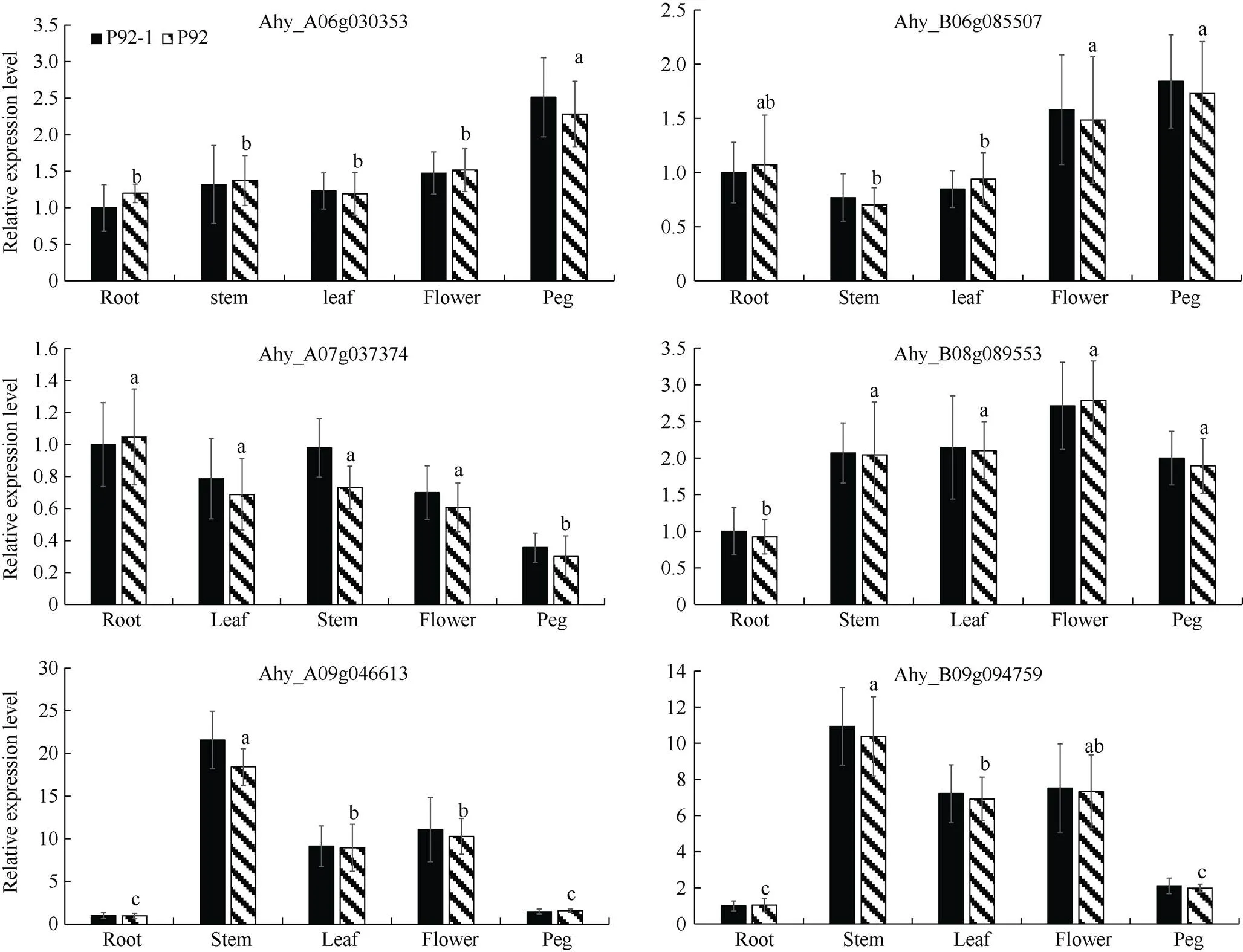
图6 6个AhGA3ox家族基因在花生品系P92及P92-1各组织中表达模式分析
不同小写字母表示不同花生组织在0.05概率水平差异显著。
Different lowercase letters means significant difference at the 0.05 probability level in peanut tissue.
3 讨论
3.1 AhGA3ox家族全基因组鉴定及表达分析
赤霉素是植物生长的重要激素, 在整个生长周期中发挥重要作用, 包括种子的萌发、下胚轴和茎的伸长、叶片扩张、毛状体发育、花粉成熟、果实发育等[19]。GAs包括有生物活性的GA1、GA3、GA4、GA7, 以及非生物活性分子GA9、GA19、GA20、GA29和GA51。GA生物合成分为3个阶段, 第1步是由牦牛儿基焦磷酸(GGPP)经古巴焦磷酸合成酶(CPS)以及内根-贝壳杉烯合成酶(KS)催化生成内根-贝壳杉烯来完成的[1,20]。第2步反应首先由内根-贝壳杉烯经内根-贝壳杉烯氧化酶(KO)催化生成内根-贝壳杉烯酸。随后内根-贝壳杉烯酸于内质网中经过内根-贝壳杉烯酸氧化酶(KAO)催化生成GA12[1,21]。最后由GA12作为前体物质, 经GA20ox以及GA3ox的催化生成有生物活性的GA1、GA3、GA4和GA7[5,19]。GA3ox是一类依赖于2-杨戊二酸的双加氧酶, 在赤霉素合成的第3个阶段参与催化GA20生成GA1以及催化GA9生物合成GA4, 直接决定植物体内生物活性GAs的水平[6,13]。在许多植物中,为多基因家族, 但各物种有多少个成员基因还不是很清楚。目前, 已在水稻[6]、拟南芥[14]、小麦[22]、紫花苜蓿[15]和西瓜[23]等物种中克隆了部分基因。
S1~S5分别表示果针进入土壤后第10、17、24、31和38天。*、**分别表示在0.05和0.01概率水平差异显著。
S1–S5 represents the 10th, 17th, 24th, 31st, and 38th day after the gynophore enters the soil, respectively. *, ** mean significant difference at the 0.05 and 0.01 probability levels, respectively.
本次研究在花生栽培种中共鉴定到7个基因。通过生物信息学方法对物理化学性质、染色体分布、进化关系、启动子顺势作用元件以及花生各植物组织表达模式进行分析发现, 这7个基因分别位于A06、B06、A07、A08、B08、A09、B09染色体上, 7个基因均包含2个外显子, 且基因进化关系相近的基因结构相似, 其中4个基因包含所有保守基序, 另外3个基因分别缺失1个基序。与拟南芥、水稻、大豆、野生大豆和野生花生5个物种的遗传进化分析发现, 与花生四倍体野生种距离较近。启动子顺势作用元件分析结果显示, 这些基因启动子区都具有多个顺式元件, 包括ABA (ABRE)、auxin (TGA-box)、MeJA (TGACG-motif、CGTCA-motif)、GA (GARE-motif、TATC-box、P-box)以及SA (TCA-element) 5种植物激素的顺式元件, 以及多个光响应(GATA-motif、TCT-motif、G-Box等)的顺式作用元件, 表明这些基因除受GA调控外, 也受ABA、IAA、MeJA、光信号调控。另外, 分析发现这些基因虽属于赤霉素氧化酶基因, 但部分基因如Ahy_A06g030353、Ahy_ A07g037374、Ahy_A09g046613启动子上并不含赤霉素相关作用元件, 原因可能是选取的启动子序列长度(上游2000 bp)较短, 或者是通过GA信号通路上的其他作用因子调控其响应内源GA含量变化, 从而调节植物体内GA水平[24]。
3.2 AhGA3ox基因在调节荚果长度方面具有一定作用
有关GA3ox家族基因的研究已有很多。其中拟南芥的赤霉素3-氧化酶由至少4个成员组成的多基因家族编码, 命名为到。拟南芥和在营养生长期负责具有生物活性的GA合成, 能打破种子休眠和萌发、促进茎尖伸长和类囊体合成,和则在生殖阶段中表达, 促进花、果荚等部位的形成[25], 而小麦能加快营养器官生长和开花[8]。水稻中,定位于第5染色体短臂, 主要在未开放的花中表达;定位于第1染色体短臂, 在伸长的叶片中高表达, 这2个基因可能影响水稻花药的发育[6,12]。葡萄中的3个基因分别在根, 花和胚珠中高表达, 表现出显著的组织特异性[13]。烟草中异源表达苹果发现过表达烟草在开花时间与对照存在差异, 证明主要在花中表达[26-27]。可见GA3ox基因存在显著的组织特异性。本次研究的7个基因不仅在花生不同组织部位的表达量不同, 且在不同发育阶段果壳中的表达量也不同, 表明不仅具有组织特异性, 还具有发育时期特异性。这可能与其不同的生物学功能有关。
目前已经在玉米、水稻、拟南芥、紫花苜蓿和西瓜等植物中鉴定到的基因突变体, 均导致植株矮化[6,13-15,22-23]。而基因的过表达则可以促进植株节间发育, 提高植物纤维素、木质素等的合成。例如, Radi等报道, 在拟南芥中过表达南瓜导致转基因植株对于野生型植株下胚轴、节间和叶片生长增加, 开花时间提前[28]。Reinecke等[29]在豌豆中过表达转基因植株节间、卷须和果实更长, 托叶更大, 开花延迟, 顶端分生组织寿命增加, 维管发育改变。但在转基因杂交白杨中的过表达并没有导致树木生长或形态的增加[30]。在本研究中, 通过qRT-PCR分析花生家族基因在2个大小果花生品系不同发育阶段的果壳中的表达量, 发现该家族基因不仅在果壳不同发育时期的表达量不同, 在大小果2个不同品系间的表达量也不相同, 但多数发育时期在大果品系中的表达量均显著大于小果品系,可见该家族基因的表达可能对荚果的形成具有促进作用。此前Reinecke等[29]也发现, 在豌豆中过表达会导致转基因植株果实更长。
4 结论
利用隐马可夫模型(HMM)在栽培种花生基因组中鉴定到7个AhGA3ox家族基因, 这些基因在花生7条染色体上呈不均匀分布。花生家族基因在花生根、茎、叶、花和果针5种组织中的表达量存在差异。另外, 花生家族基因在大果和小果花生品系中的表达也存在差异, 在多数发育时期中, 其在大果品系中的表达量均显著大于小果品系, 推测该家族基因的表达可能对荚果的形成具有促进作用。本研究将为后续解析花生荚果大小形成的分子机制及花生荚果大小的遗传改良提供理论基础和基因资源。
[1] Hedden P, Thomas S G. Gibberellin biosynthesis and its regulation., 2012, 444: 11–25.
[2] Yamaguchi S, Kamiya Y. Gibberellin biosynthesis: its regulation by endogenous and environmental signals., 2000, 41: 251–257.
[3] Yamaguchi S. Gibberellin metabolism and its regulation., 2008, 59: 225–251.
[4] Hedden P. Gibberellin metabolism and its regulation., 2001, 20: 317–318.
[5] Itoh H, Ueguchi-Tanaka M, Sentoku N, Kitano H, Matsuoka M, Kobayashi M. Cloning and functional analysis of two gibberellin 3 beta-hydroxylase genes that are differently expressed during the growth of rice., 2001, 98: 8909–8914.
[6] Hedden P, Phillips A L. Gibberellin metabolism: new insights revealed by the genes., 2000, 5: 523–530.
[7] Würschum T, Langer S M, Longin C F H, Tucker M R, Leiser W L. A modern Green Revolution gene for reduced height in wheat., 2017, 92: 892–903.
[8] Pearce S, Huttly A K, Prosser I M, Li Y D, Vaughan S P, Gallova B, Patil A, Coghill J A, Dubcovsky J, Hedden P, Phillips A L. Heterologous expression and transcript analysis of gibberellin biosynthetic genes of grasses reveals novel functionality in thefamily., 2015, 15: 130.
[9] Nomura T, Jager C E, Kitasaka Y, Takeuchi K, Fukami M, Yoneyama K, Matsushita Y, Nyunoya H, Takatsuto S, Fujioka S, Smith J J, Kerckhoffs L H J, Reid J B, Yokota T. Brassinosteroid deficiency due to truncated steroid 5α-reductase causes dwarfism in thelk mutant of pea., 2004, 135: 2220–2229.
[10] Cheng J, Zhang M, Tan B, Jiang Y, Zheng X, Ye X, Guo Z, Xiong T, Wang W, Li J, Feng J. A single nucleotide mutation in GID 1c disrupts its interaction with DELLA1 and causes a GA-insensitive dwarf phenotype in peach., 2019, 17: 1723–1735.
[11] Chiang H H, Hwang I, Goodman H M. Isolation of theGA4 locus., 1995, 7: 195–201.
[12] 殷小林, 张超, 王有成, 袁定阳, 谭炎宁, 段美娟. 水稻赤霉素3β羟化酶基因()同源基因的生物信息学分析. 分子植物育种, 2019, 17: 1054–1060. Yin X L, Zhang C, Wang Y S, Yuan D Y, Tan Y N, Duan M J. Bioinformatics analysis of homologous genes of gibberellin 3β hydroxylase gene () in rice., 2019, 17: 1054–1060 (in Chinese with English abstract).
[13] He H, Liang G, Lu S, Wang P, Liu T, Ma Z, Zuo C, Sun X, Chen B, Mao J. Genome-wide identification and expression analysis of GA2ox, GA3ox, and GA20ox are related to gibberellin oxidase genes in grape (L.).(Basel), 2019, 10: 680.
[14] Chen Y, Hou M, Liu L, Wu S, Shen Y, Ishiyama K, Kobayashi M, Mccarty D R, Tan B. The maize DWARF1 encodes a gibberellin 3-Oxidase and is dual localized to the nucleus and cytosol., 2014, 166: 2028–2039.
[15] Dalmadi A, Kalo P, Jakab J, Saskoi A, Petrovics T, Deak G, Kiss G B. Dwarf plants of diploidcarry a mutation in the gibberellin 3-beta-hydroxylase gene., 2008, 27: 1271–1279.
[16] Wei C, Zhu C, Yang L, Zhao W, Ma R, Li H, Zhang Y, Ma J, Yang J, Zhang X. A point mutation resulting in a 13 bp deletion in the coding sequence ofleads to a GA-deficient dwarf phenotype in watermelon., 2019, 6: 132.
[17] Hu D, Li X, Yang Z, Liu S, Hao D, Chao M, Zhang J, Yang H, Su X, Jiang M, Lu S, Zhang D, Wang L, Kan G, Wang H, Cheng H, Wang J, Huang F, Tian Z, Yu D. Downregulation of a gibberellin 3beta-hydroxylase enhances photosynthesis and increases seed yield in soybean., 2022, 235: 502–517.
[18] Chen C J, Chen H, Zhang Y, Thomas H R, Frank M H, He Y H, Xia R. TBtools: an integrative toolkit developed for interactive analyses of big biological data., 2020, 13: 1194–1202.
[19] Davière J, Achard P. Gibberellin signaling in plants., 2013, 140: 1147–1151.
[20] Tudzynski B, Kawaide H, Kamiya Y. Gibberellin biosynthesis in: cloning and characterization of the copalyl diphosphate synthase gene., 1998, 34: 234–240.
[21] van Schie C C, Ament K, Schmidt A, Lange T, Haring M A, Schuurink R C. Geranyl diphosphate synthase is required for biosynthesis of gibberellins., 2007, 52: 752–762.
[22] Appleford N E, Evans D J, Lenton J R, Gaskin P, Croker S J, Devos K M, Phillips A L, Hedden P. Function and transcript analysis of gibberellin-biosynthetic enzymes in wheat., 2006, 223: 568–582.
[23] Sun Y, Zhang H, Fan M, He Y, Guo P. A mutation in the intron splice acceptor site of agene confers dwarf architecture in watermelon (L.)., 2020, 10: 14915.
[24] Fukazawa J, Mori M, Watanabe S, Miyamoto C, Ito T, Takahashi Y. DELLA-GAF1 Complex is a main component in gibberellin feedback regulation of GA20 oxidase 2., 2017, 175: 1395–1406.
[25] Mitchum M G, Yamaguchi S, Hanada A, Kuwahara A, Yoshioka Y, Kato T, Tabata S, Kamiya Y, Sun T P. Distinct and overlapping roles of two gibberellin 3-oxidases indevelopment., 2006, 45: 804–818.
[26] 赵慧君, 仝宗勇, 余海忠, 孙永林. 苹果赤霉素3-氧化酶1 ()启动子区的克隆及序列分析. 中国农学通报, 2012, 28(10): 146–150. Zhao H J, Tong Z Y, Yu H Z, Sun Y L. Cloning and sequence analysis of the promoter region of gibberellin 3-oxidase 1 () in apple., 2012, 28(10): 146–150 (in Chinese with English abstract).
[27] 赵慧君, 余海忠, 王海燕, 朱文权. 苹果赤霉素3-氧化酶1 ()在烟草中的表达研究, 湖北文理学报, 36(2): 17–19. Zhao H J, Yu H Z, Wang H Y, Zhu W Q. Study on the expression of gibberellin 3-oxidase 1 () in apple in tobacco., 36(2): 17–19 (in Chinese with English abstract).
[28] Radi A, Lange T, Niki T, Koshioka M, Lange M J. Ectopic expression of pumpkin gibberellin oxidases alters gibberellin biosynthesis and development of transgenicplants., 2006, 140: 528–536.
[29] Reinecke D M, Wickramarathna A D, Ozga J A, Kurepin L V, Jin A L, Good A G, Pharis R P. Gibberellin 3-oxidase gene expression patterns influence gibberellin biosynthesis, growth, and development in pea., 2013, 163: 929–945.
[30] Israelsson M, Mellerowicz E, Chono M, Gullberg J, Moritz T. Cloning and overproduction of gibberellin 3-oxidase in hybrid aspen trees. Effects on gibberellin homeostasis and development., 2004, 135: 221–230.
Genome-wide identification and expression analysis of AhGA3ox gene family in peanut (L.)
LI Hai-Fen, LU Qing, LIU Hao, WEN Shi-Jie, WANG Run-Feng, HUANG Lu, CHEN Xiao-Ping, HONG Yan-Bin, and LIANG Xuan-Qiang*
Guangdong Provincial Key Laboratory of Crop Genetic Improvement / South China Peanut Sub-Center of National Center of Oilseed Crops Improvement / Crops Research Institute, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, Guangdong, China
Gibberellin 3-beta-dioxygenase (GA3ox) is one of the key enzymes involved in gibberellin biosynthesis, which can regulate plant growth and development by affecting gibberellin formation. There were no systematic studies in peanut genome. In this study, AhGA3ox family genes were identified from the genome database of cultivated peanut species by bioinformatics, and the distribution, structure, evolutionary characteristics, physical and chemical properties, promoter cis-acting elements were also analyzed. The relative expression pattern ofin different peanut tissues was analyzed by qRT-PCR, and the relative expression level of in shell of two peanut lines with different pod size were also analyzedThe results showed that 7were distributed on 7 chromosomes of peanut, all of which were composed of 1 intron and 2 exons. All the AhGA3ox proteins contained 1 DIOX_N domain and 1 2OG-FeII_Oxy domain. Phylogenetic analysis showed that they were closely related to GA3ox proteins of soybean,. Theshowed obvious tissue expression specificity in root, stem, leaf, flower and peg. The expression levels ofwere not only different in different development stages of the peanut shell, but also different at the same development stage of the two lines. Interestingly, the relative expression levels in large pod lines were significantly higher than those in small pod lines at most development stages. Therefore, we predict that the gene expression of AhGA3oxgene family may promote the formation of large pod.
peanut;; the relative expression analysis; bioinformatics; functional analysis
10.3724/SP.J.1006.2024.34122
本研究由广东省“十四五”农业科技创新十大重点项目公开竞争计划(2022SDZG05), 广东省重点研发计划-现代种业(2020B020219003, 2022B0202060004), 财政部和农业农村部国家现代农业产业技术体系建设专项(CARS-13), 国家自然科学基金项目(32001442, 32172051), 广东省基础与应用基础研究基金项目(2021A1515010811, 2023A1515010098), 广东省农业和农村厅科技专项资金项目(2019KJ136-02), 广东省海外名师计划项目(207124505346)和广东省农业科学院农业优势产业学科团队建设项目(202104TD)资助。
This study was supported by the Open Competition Program of Top Ten Critical Priorities of Agricultural Science and Technology Innovation for the 14th Five-Year Plan in Guangdong Province (2022SDZG05), the Guangdong Provincial Key Research and Development Program- Modern Seed Industry (2020B020219003, 2022B0202060004), the China Agriculture Research System of MOF and MARA (CARS-13), the National Natural Science Foundation of China (32001442, 32172051), the Guangdong Basic and Applied Basic Research Foundation (2021A1515010811, 2023A1515010098), the Technology Special Fund of Guangdong Province Agriculture and Rural Affairs Department (2019KJ136-02), the Guangdong Province Overseas Master Teacher Program (207124505346), and the Agricultural Competitive Industry Discipline Team Building Project of Guangdong Academy of Agricultural Sciences (202104TD).
梁炫强, E-mail: Liangxuanqiang@gdaas.cn
E-mail: lihaifen@gdaas.cn
2023-07-14;
2023-10-23;
2023-11-14.
URL: https://link.cnki.net/urlid/11.1809.S.20231110.1622.012
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

