基于QTL和转录组测序鉴定甘蓝型油菜耐旱候选基因
李阳阳 吴 丹 许军红 陈倬永 徐昕媛 徐金盼 唐钟林 张娅茹 朱 丽 严卓立 周清元 李加纳 刘列钊 唐章林,*
基于QTL和转录组测序鉴定甘蓝型油菜耐旱候选基因
李阳阳1,2,3吴 丹2,3许军红2,3陈倬永1,2,3徐昕媛1,2,3徐金盼1,2,3唐钟林1,2,3张娅茹1,2,3朱 丽1,2,3严卓立1,2,3周清元1,2,3李加纳1,2,3刘列钊1,2,3唐章林1,2,3,*
1西部(重庆)科学城种质创制大科学中心, 重庆 401329;2西南大学农学与生物科技学院, 重庆 400715;3西南大学农业科学研究院, 重庆 400715
干旱胁迫严重限制了甘蓝型油菜种植面积的扩大和产量的提升。耐旱性是由多基因控制的复杂数量性状, 将QTL定位与转录组测序相结合, 是鉴定甘蓝型油菜耐旱候选基因的有效手段。本研究对甘蓝型油菜干旱敏感品系三六矮和耐旱品系科里纳-2构建的F2:6和F2:8重组自交系群体幼苗进行正常灌溉和干旱胁迫处理, 测定地上部鲜重、地上部干重、叶片相对含水量、丙二醛和可溶性糖含量, 利用SSR和SNP多态性分子标记构建遗传连锁图谱, 鉴定耐旱相关QTL和候选区间, 结合耐旱材料No11和干旱敏感材料No28的转录组测序, 筛选耐旱相关候选基因。研究结果表明: 干旱胁迫使甘蓝型油菜幼苗地上部鲜重、地上部干重和叶片相对含水量下降, 使叶片丙二醛和可溶性糖含量上升; 耐旱相关QTL和候选区间分布于A01、A02、A06、A08、A09、A10、C02、C03、C04、C06和C09染色体; 对耐旱材料和干旱敏感材料正常灌溉、干旱24 h、36 h和48 h进行转录组分析, 主要差异表达基因显著富集到光合作用、脂肪酸代谢、氨基酸代谢、植物激素信号转导、核糖体、昼夜节律及角质、木栓素和蜡质的生物合成等相关途径; 将QTL与转录组测序相结合, 鉴定到28个耐旱相关候选基因, 主要编码FLC、bHLH105、TGA4、TEM1、ERF003、ACO3、CHLI1、LHCB6和PORC等, 具有转录因子活性、乙烯产生和信号传导、叶绿素生物合成与结合、叶绿素氧化还原酶以及编码核糖体相关蛋白等功能。这些结果可为揭示甘蓝型油菜耐旱机理及分子标记辅助选育耐旱新品种奠定基础。
甘蓝型油菜; 耐旱; QTL; 转录组; 候选基因
油菜是世界主要的油料作物之一, 也是我国食用植物油的主要来源[1-2]。长江流域是我国油菜主产区[3], 但年内降雨分布不均, 秋、冬季降雨较少, 季节性干旱严重[4], 致使油菜苗期常遭受干旱胁迫。干旱胁迫导致气孔关闭, 蒸腾速率降低, 光合速率下降, 严重影响有机物的积累, 导致苗小叶少, 难以形成壮苗越冬, 影响后期生长发育导致产量下降[5]。甘蓝型油菜(L.)因产量和含油量高且稳定被广泛种植, 而干旱胁迫的频发严重限制了其产量的提高和种植面积的扩大。
甘蓝型油菜耐旱性是非常复杂的数量性状, 由多基因控制[6]。前期, 较多报道用AFLP或SSR标记构建遗传连锁图谱, 定位到多个甘蓝型油菜耐旱相关的QTL。例如, 李真[7]基于双单倍体(doubled haploid, DH)群体, 利用183个SSR标记和157个AFLP标记构建遗传连锁图谱, 在正常灌溉和干旱胁迫两种水分条件下定位到50个QTL, 利用耐旱系数定位到19个QTL。王丹丹[8]利用重组自交系(recombinant inbred line, RIL)群体, 构建了一张包含120个SSR标记的遗传连锁图谱, 定位到8个耐旱相关QTL。但是, 大部分研究未鉴定到耐旱相关候选基因。近年来, 随着甘蓝型油菜基因组测序的完成, SNP、Indel等标记相继被开发, 通过QTL定位、全基因组关联分析(genome wide association study, GWAS)方法, 鉴定到一些耐旱候选基因。Gad等[9]基于DH群体, 利用SNP和Indel标记鉴定到39个甘蓝型油菜种子萌发期耐旱相关QTL和256个候选基因。Shahzad等[10]通过甘蓝型油菜GWAS, 鉴定到139个失水速率相关SNP位点和4个候选基因。Khanzada等[11]对228份甘蓝型油菜种质资源幼苗进行PEG模拟干旱胁迫处理, 通过GWAS鉴定到314个显著关联SNP标记和85个候选基因。Tan等[12]对甘蓝型油菜盐胁迫和PEG-6000模拟干旱胁迫下种子发芽率和发芽指数进行GWAS, 鉴定到43个显著关联SNP标记和37个候选基因。通过转录组测序, 可获得物种在某种状态下的所有转录本信息[13], 已被广泛应用于甘蓝型油菜耐旱相关研究。Liu等[14]对正常灌溉和干旱胁迫下甘蓝型油菜根和叶进行转录组测序, 在根和叶中分别发现6018个和5377个差异表达基因。Wang等[15]通过甘蓝型油菜耐旱和干旱敏感材料转录组测序, 筛选到169个差异表达基因。
已有QTL或GWAS研究所用群体及种植环境或胁迫处理方式不同, 检测到的QTL和候选基因不尽相同; 转录组测序结果差异表达基因数量庞大, 难以筛选出进一步开展功能验证的目标基因。因此, 将QTL或GWAS与转录组测序相结合, 可提高特定性状候选基因的鉴定效率, 已成为预测候选基因的有效手段。Zhou等[16]将GWAS和转录组分析相结合, 鉴定出甘蓝型油菜耐铝性候选基因。Jian等[17]结合QTL与转录组分析, 鉴定了甘蓝型油菜花期相关候选基因。Guo等[18]通过GWAS和转录组揭示了干旱胁迫下与玉米幼苗根长相关的候选基因。Sevanthi等[19]通过干旱和长期缺氮双胁迫下转录组测序和主效QTL整合挖掘到水稻关键胁迫响应基因。但截至目前, 尚未见有关于将QTL定位与转录组测序相结合用于鉴定甘蓝型油菜耐旱候选基因的报道。
本研究基于甘蓝型油菜干旱敏感品系三六矮与耐旱品系科里纳-2构建的F2:6和F2:8重组自交系群体, 利用多态性SSR和SNP标记分别构建遗传连锁图谱, 对耐旱相关性状进行QTL定位, 获得候选区间。对实验室筛选的甘蓝型油菜耐旱材料No11和干旱敏感材料No28进行转录组测序和差异表达基因分析, 结合QTL定位候选区间筛选出耐旱相关候选基因, 以期为进行功能验证揭示甘蓝型油菜耐旱机理和分子标记辅助选育耐旱新品种奠定基础。
1 材料与方法
1.1 试验材料与处理
本研究以盆钵(直径25 cm, 高30 cm)方式将甘蓝型油菜干旱敏感品系三六矮和耐旱品系科里纳-2构建的105个F2:6重组自交系家系种植于西南大学7号温室, 126个F2:8重组自交系家系种植于重庆市油菜工程技术研究中心歇马油菜基地旱棚。以均匀一致的大田表层土作为种植土, 定期间苗, 保持幼苗长势一致。当幼苗长至四叶一心时, 进行干旱胁迫(drought stress, DS)处理, 以正常灌溉为对照(control check, CK)。干旱胁迫组土壤含水量保持在9%~12%, 正常灌溉组土壤含水量保持在22%~27%, 利用浙江托普仪器有限公司的多参数土壤水分记录仪, 每隔3~5 d测定土壤含水量, 仪器探针入土深度为7 cm, 每盆测量3个不同位置取平均值, 根据装盆土壤干重计算应浇水量, 用烧杯均匀浇于盆钵表面。
甘蓝型油菜耐旱材料No11和干旱敏感材料No28以盆栽(长5 cm, 宽5 cm, 高5 cm)方式种植于RDN-300C-4 (宁波东南)人工气候箱, 腐植土和蛭石按照3∶1比例混合均匀后作为种植土, 每盆种植3株幼苗。正常灌溉期间, 光合有效辐射为270mmol m–2s–1, 光照和黑暗时长分别为16 h和8 h, 温度分别为24℃和22℃, 湿度为70%~80%。待幼苗长至三叶一心时, 选取长势一致的盆钵进行正常灌溉和干旱胁迫处理。干旱胁迫处理期间, 湿度参数为30%, 其他培养条件与正常灌溉相同。
1.2 取材与性状测定
干旱处理28 d后, 调查正常灌溉和干旱胁迫下甘蓝型油菜重组自交系各家系地上部鲜重(shoot fresh weight, SFW)、地上部干重(shoot dry weight, SDW)、叶片相对含水量(relative water content, RWC)、可溶性糖(soluble sugar, SUG)含量和丙二醛 (malondialdehyde, MDA)含量。F2:6重组自交系调查2个生物学重复, F2:8重组自交系调查3个生物学重复。对耐旱材料No11和干旱敏感材料No28正常灌溉及干旱后24 h、36 h和48 h进行RWC测定, 并取材进行SUG和MDA含量测定以及转录组测序。
1.2.1 地上部鲜重和干重测定 将植株从子叶节处剪开, 称其地上部鲜重, 然后于110℃杀青30 min后75℃烘至恒重, 称其地上部干重。


1.2.3 可溶性糖和丙二醛含量测定 选取新鲜倒数第2片叶, 采用荆蓉蓉[20]所用的蒽酮-硫酸法和硫代巴比妥酸法分别测定可溶性糖和丙二醛含量, 略有改动。
1.3 表型数据处理
利用R-4.3.1 (https://cloud.r-project.org/)进行方差分析, Microsoft Excel 2016进行性状描述统计分析, 用下式计算各耐旱相关性状的耐旱系数(drought resistance index, DRI):

1.4 SSR标记带型及SNP标记基因型分析
本研究所采用的SSR引物均由西南大学重庆市油菜工程技术研究中心实验室保存提供, 先对亲本进行聚丙烯酰胺凝胶电泳检测, 将带型清晰且有多态性的引物对F2:6重组自交系群体进行电泳检测, 将SSR引物于BnTIR (https://yanglab.hzau.edu.cn/ BnTIR)网站以Darmor. v4.1为参考基因组进行序列比对, 获取SSR标记物理位置; 以Darmor. v4.1为参考基因组序列, 采用中玉金标记生物有限公司(北京) 6K SNP芯片对亲本及F2:8重组自交系群体进行检测和带型分析。用“a”代表与母本三六矮相同的带型(基因型), “b”代表与父本科里纳-2相同的带型(基因型), “h”代表杂合带型(基因型), “-“代表缺失[8]。
1.5 遗传连锁图谱构建及QTL定位
采用JoinMap 4[21]分别进行SSR标记和SNP标记遗传连锁图谱构建, 采用MapQTL 6[22]对耐旱相关性状在正常灌溉和干旱胁迫下的表型值及耐旱系数进行QTL定位(取LOD值≥2.5), 利用MapChart 2.0[23]软件绘制QTL在各连锁群(染色体)的分布图。QTL命名以斜体加性状的英文缩写加处理组或耐旱系数英文缩写再加染色体命名, 例如“”[24]。
根据李阳阳等[25]连锁不平衡分析的甘蓝型油菜各染色体的衰减距离, 将QTL包含标记物理位置减去所在染色体衰减距离作为候选区间上游位点, 加上衰减距离作为候选区间下游位点, 以此获得候选区间。
1.6 转录组分析
由广州基迪奥生物科技有限公司完成叶片RNA提取和质量检测、文库制备、文库质检、上机测序、序列比对分析及基因表达量分析, 参考基因组为法国油菜(__v5)。
对基因表达量进行两两差异表达基因分析, 保留值≤0.01和| log2(FC) |≥1的基因。使用OmicShare云平台韦恩图在线软件(https://www. omicshare.com/tools/Home/Soft/venn)绘制韦恩图, 采用百迈客云平台(https://www.biocloud.net/) GO、KEGG分类富集软件进行KEGG富集分析, 使用OmicShare云平台热图在线软件(https://www. omicshare.com/tools/Home/Soft/heatmap)绘制热图。采用百迈客云平台(https://www.biocloud.net/) WGCNA在线分析软件进行WGCNA分析。
2 结果与分析
2.1 表型数据分析
对甘蓝型油菜F2:6和F2:8重组自交系群体的5个耐旱相关性状进行方差分析和描述统计分析发现,各性状在水分间、家系间以及水分×家系互作间均达到极显著差异(表1); 干旱处理后, 叶片相对含水量、地上部鲜重和地上部干重较对照极显著降低, 可溶性糖含量和丙二醛含量极显著升高(表2)。频数分布直方图显示各性状均呈连续近似正态分布(图1)。
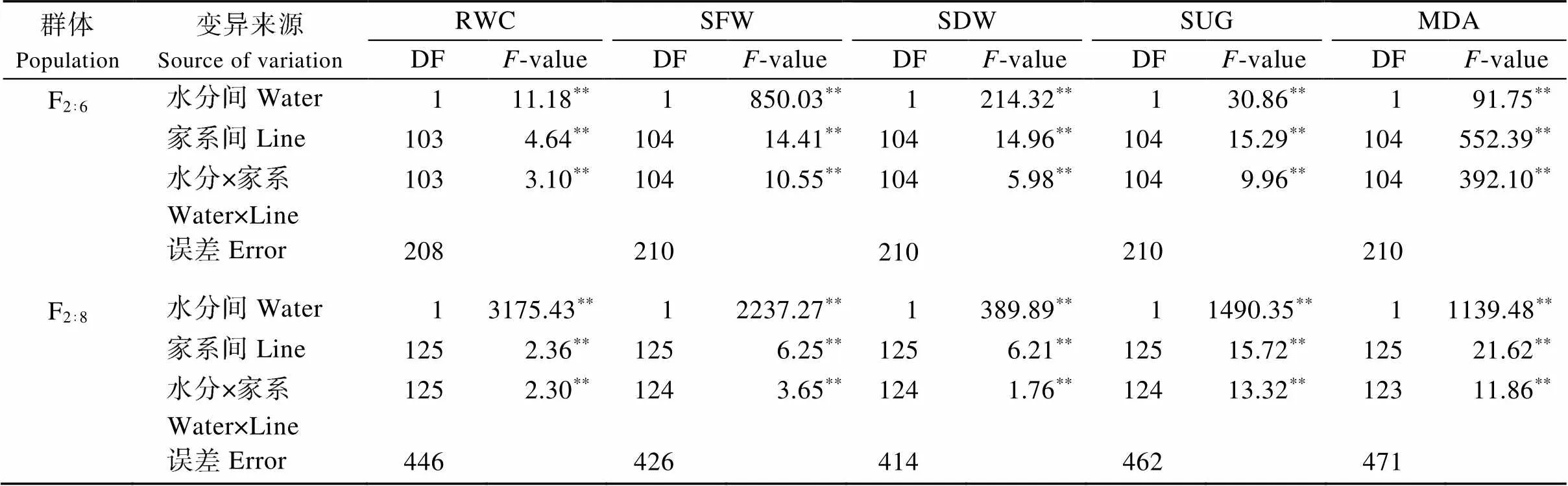
表1 甘蓝型油菜F2:6和F2:8重组自交系群体耐旱相关性状的方差分析
RWC: 叶片相对含水量; SFW: 地上部鲜重; SDW: 地上部干重; SUG: 可溶性糖含量; MDA: 丙二醛含量; DF: 自由度;-value:值;**:< 0.01。
RWC: the relative water content; SFW: shoot fresh weight; SDW: shoot dry weight; SUG: soluble sugar content; MDA: malondialdehyde content; DF: degree of freedom;value:-value of-test;**:< 0.01.
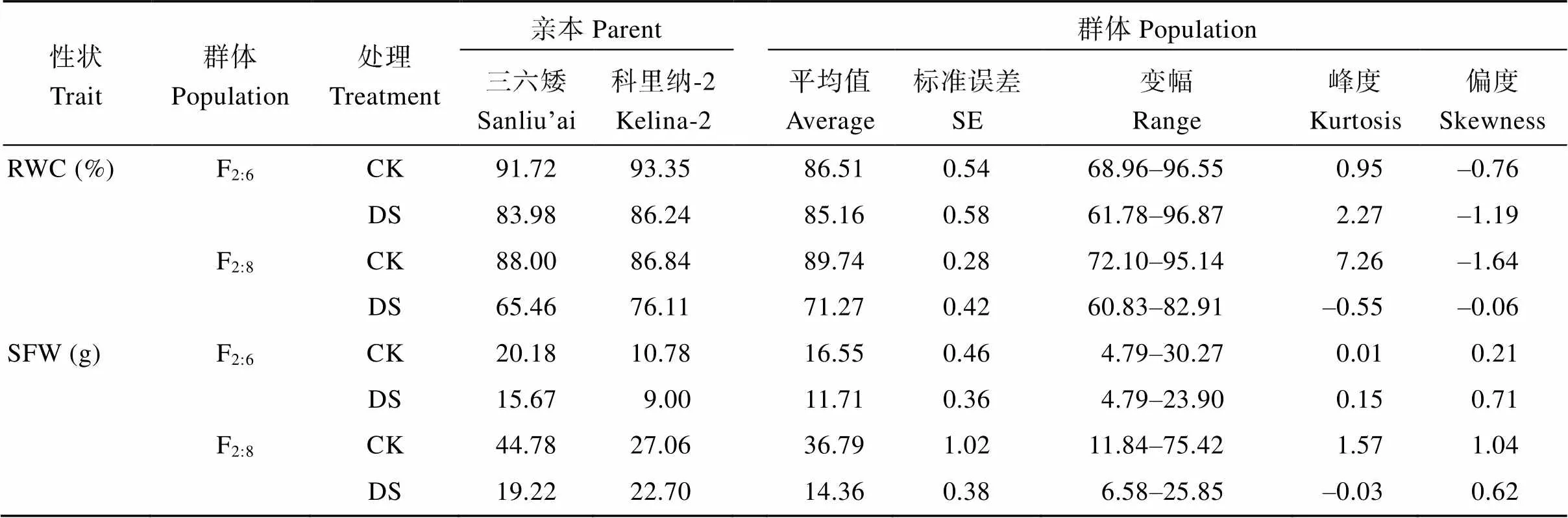
表2 甘蓝型油菜亲本及F2:6和F2:8重组自交系群体耐旱相关性状描述统计分析
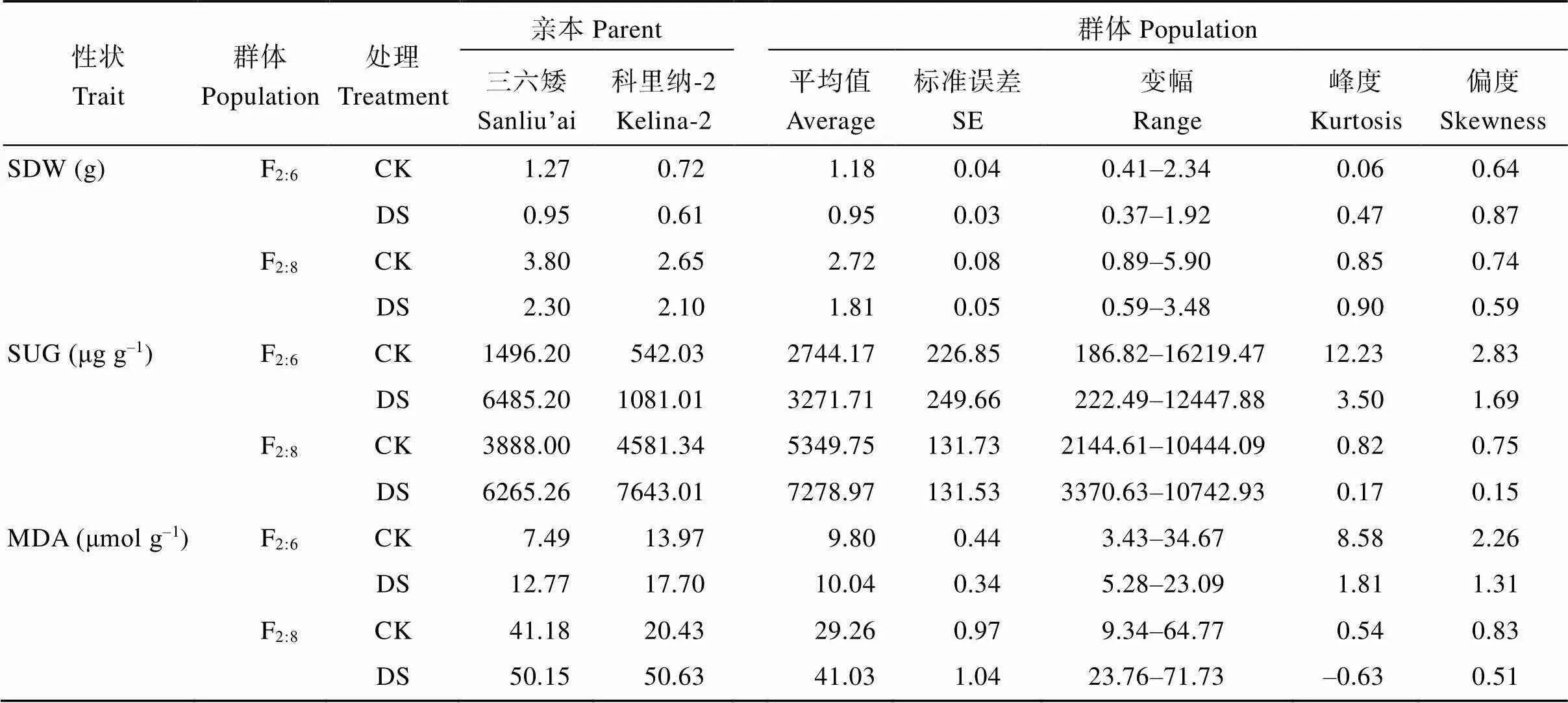
(续表2)
CK: 正常灌溉; DS: 干旱胁迫。其他缩写同表1。
CK: well water; DS: drought stress. The other abbreviations are the same as those given in Table 1.
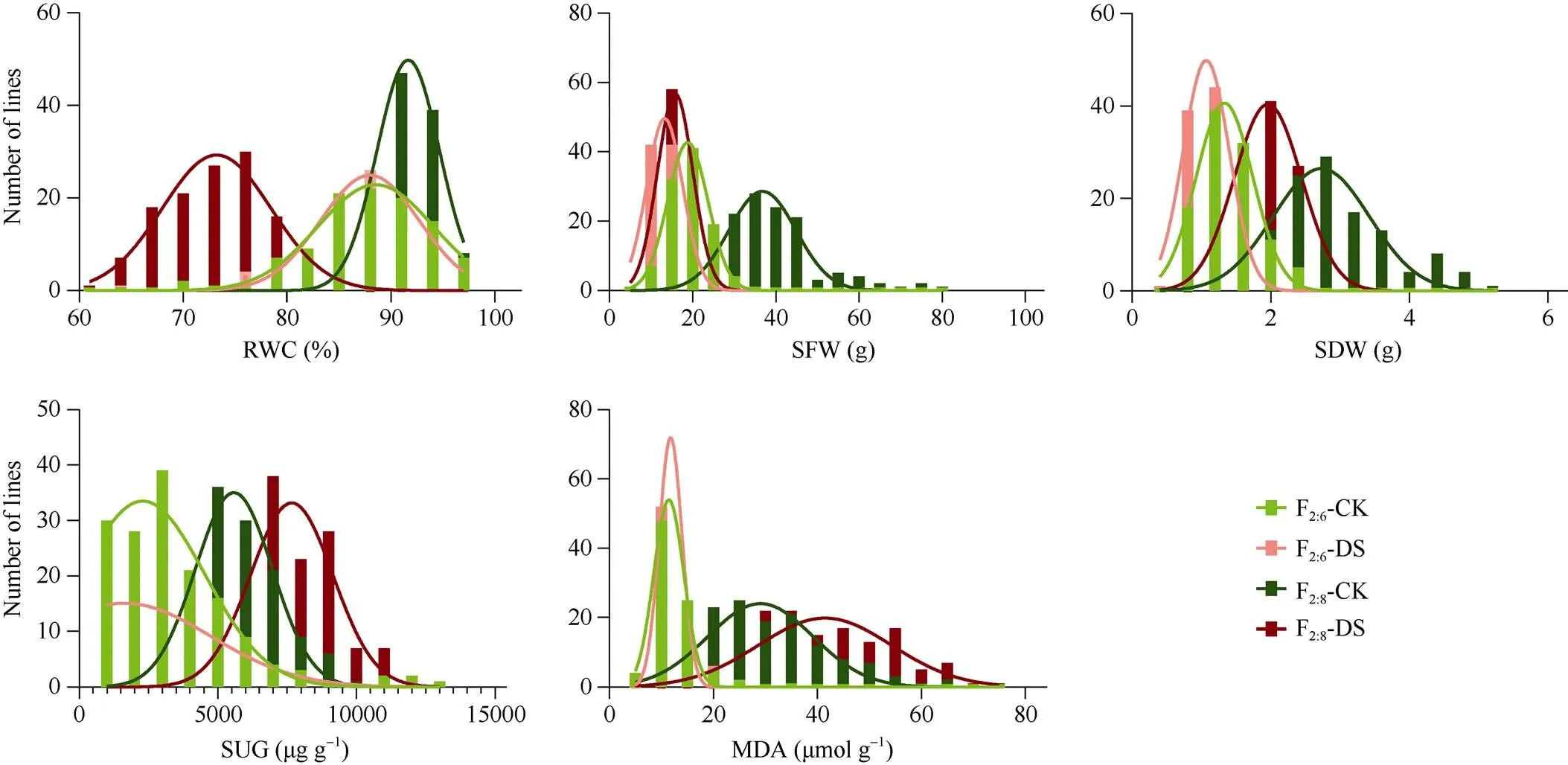
图1 甘蓝型油菜F2:6和F2:8重组自交系群体耐旱相关性状的频数分布图
缩写同表1和表2。Abbreviations are the same as those given in Tables 1 and 2.
测定耐旱和干旱敏感材料(No11和No28)叶片相对含水量、丙二醛和可溶性糖含量发现, 干旱24 h、36 h和48 h, 干旱敏感材料叶片相对含水量极显著低于耐旱材料; 干旱36 h和48 h, 干旱敏感材料丙二醛含量极显著高于耐旱材料, 而干旱24 h两材料间差异不显著; 干旱24 h和48 h, 干旱敏感材料可溶性糖含量极显著高于耐旱材料, 而干旱36 h差异未达到显著水平(图2)。说明干旱敏感材料较耐旱材料有更严重的失水和膜脂过氧化, 也积累了更多的渗透调节物质。
2.2 遗传连锁图谱构建及QTL定位
本研究对亲本及F2:6重组自交系群体进行SSR多态性标记检测, 共获得301个多态性SSR标记, 对其进行遗传连锁图谱构建, 获得了包含14个连锁群和181个多态性SSR标记的甘蓝型油菜遗传连锁图谱, 该图谱总长717.88 cM, 平均密度为5.69 cM (图3)。利用6K SNP芯片对亲本及F2:8重组自交系群体进行检测, 得到1074个多态性SNP位点, 构建了总长为2577.03 cM的甘蓝型油菜遗传连锁图谱, 该图谱覆盖19条染色体, 包含1041个多态性SNP位点, 平均密度为2.48 cM (图4)。
利用SSR标记遗传连锁图谱对F2:6重组自交系群体的耐旱相关性状进行QTL检测, 共获得6个QTL。其中正常灌溉下地上部干重检测到1个QTL, 包含2个A02染色体的SSR标记; 正常灌溉下丙二醛含量和干旱处理下叶片相对含水量检测到置信区间重叠的2个QTL, 包含1个A09染色体的SSR标记; 干旱处理下叶片相对含水量、叶片相对含水量耐旱系数和干旱处理下丙二醛含量检测到置信区间重叠的3个QTL, 包含4个SSR标记, 其中3个位于C02染色体, 另1个位于C02或A02染色体(图3和表3)。
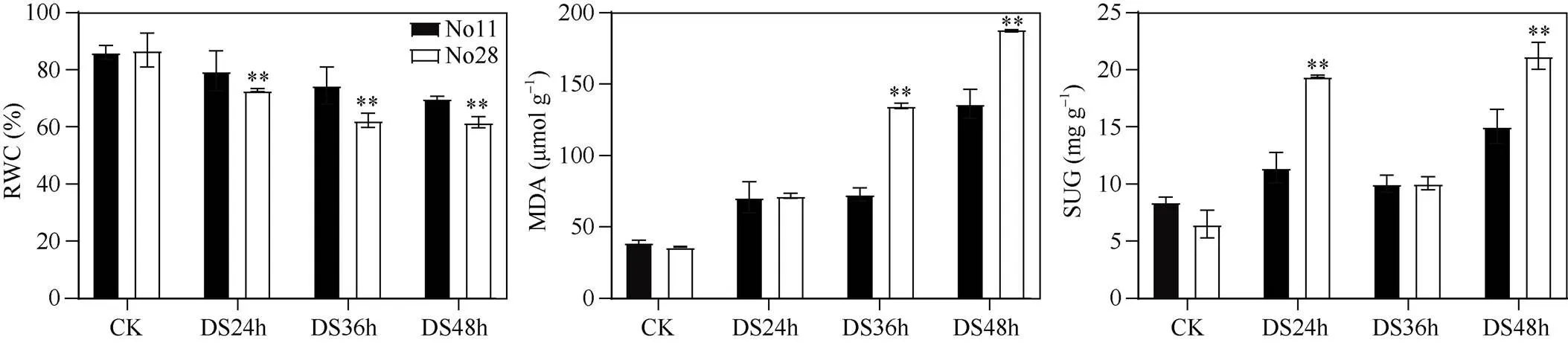
图2 甘蓝型油菜耐旱和干旱敏感材料耐旱相关性状
**:< 0.01。缩写同表1。**:< 0.01. Abbreviations are the same as those given in Table 1.

图3 SSR标记遗传连锁图谱及QTL分布
DRI: 耐旱系数。其他缩写同表1和表2。
DRI: drought resistance index. The other abbreviations are the same as those given in Tables 1 and 2.
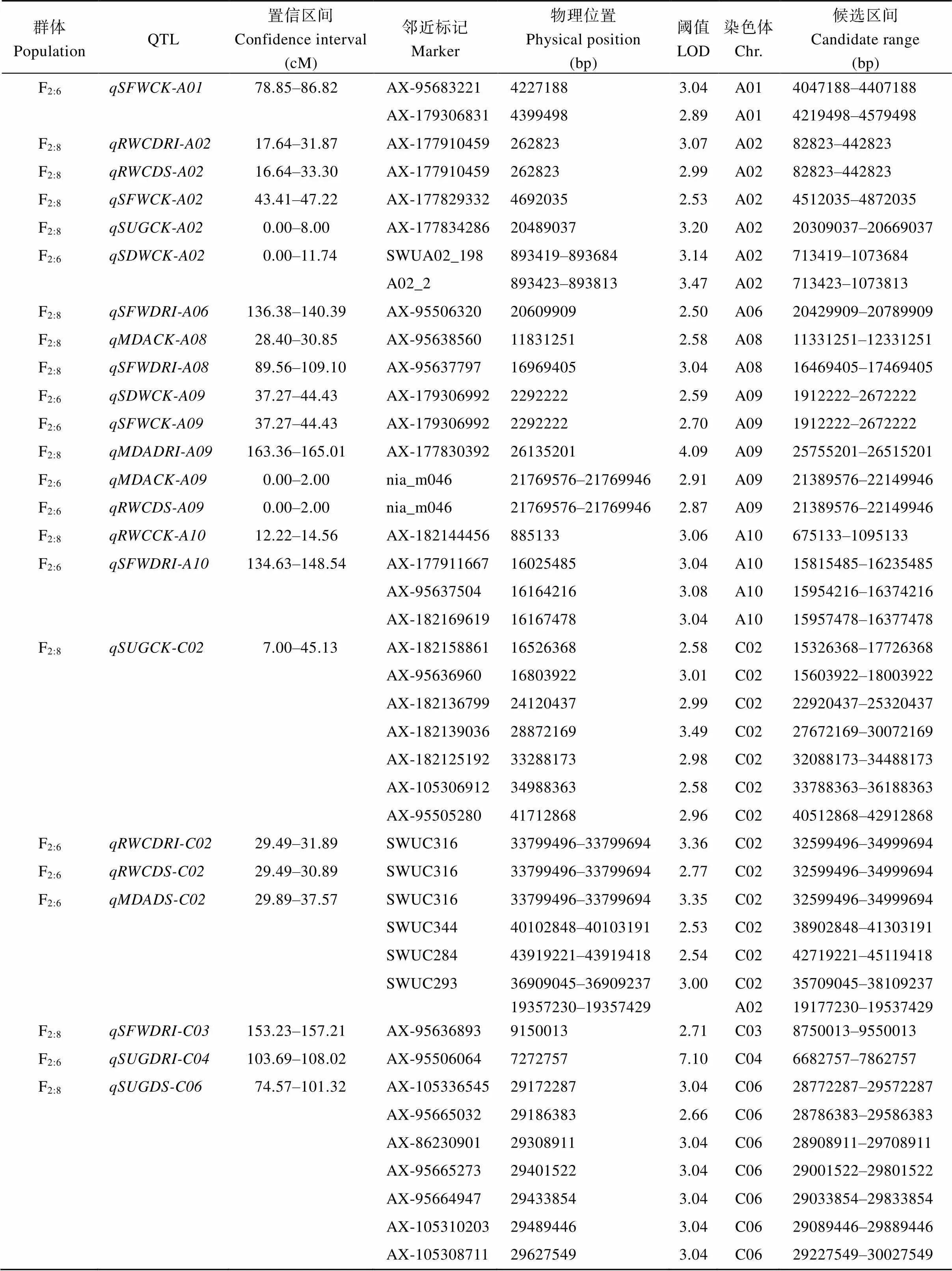
表3 甘蓝型油菜耐旱相关性状QTL及候选区间
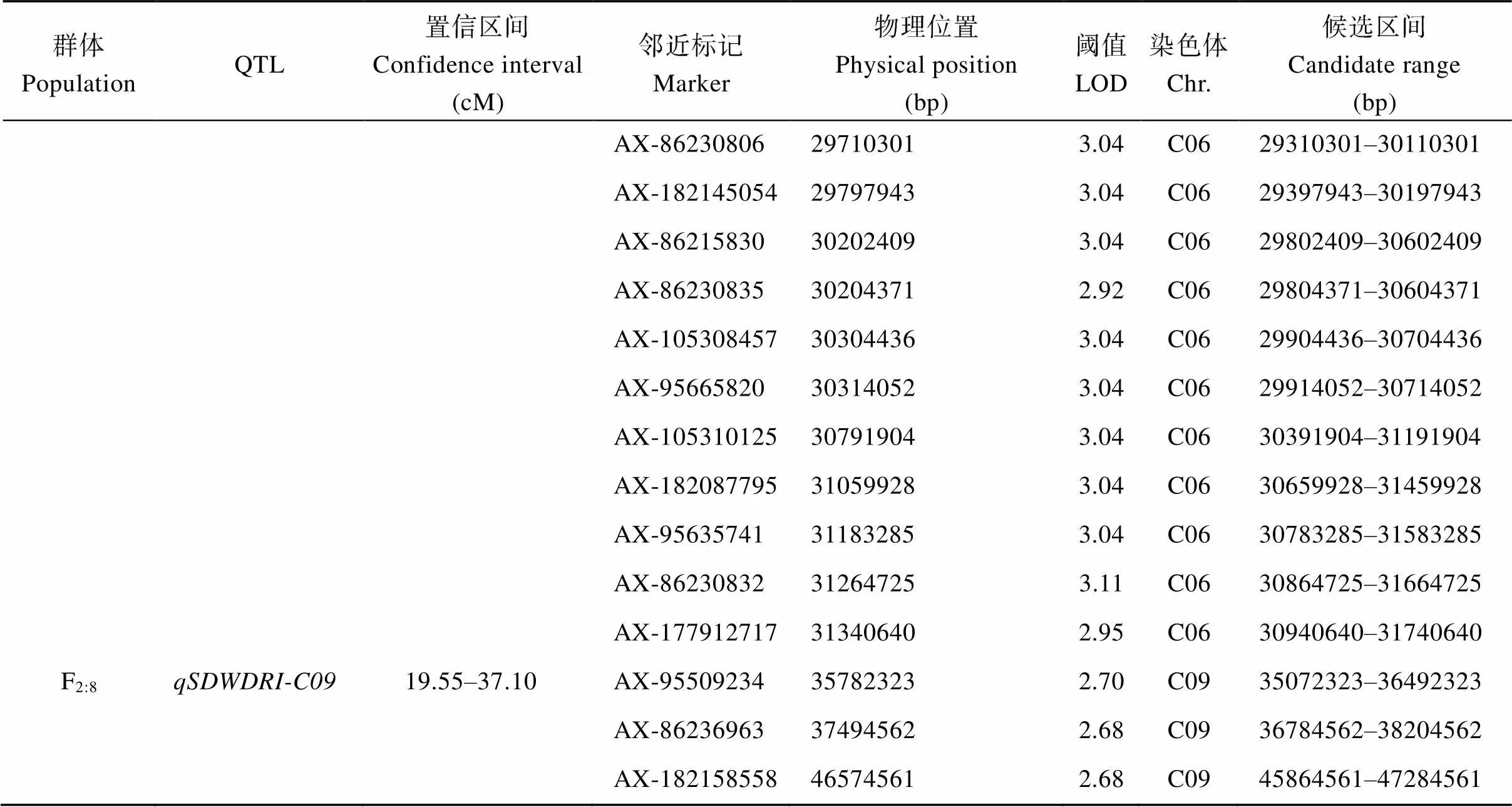
(续表3)
利用SNP标记遗传连锁图谱对F2:8和F2:6重组自交系群体进行QTL检测, 共检测到18个QTL, 分布于A01、A02、A06、A08、A09、A10、C02、C03、C04、C06和C09染色体, 包含44个SNP位点。其中, 基于F2:6重组自交系群体正常灌溉下地上部干重和地上部鲜重在A09染色体检测到相同的QTL位点, 基于F2:8重组自交系群体叶片相对含水量耐旱系数和干旱胁迫下叶片相对含水量在A02染色体检测到的QTL位点置信区间相重合(图4和表3)。
根据各染色体衰减距离, 共获得52个候选区间,其中QTL位点、、、、所鉴定到的多个候选区间存在重叠(表3)。基于SSR标记遗传连锁图谱定位到的QTL位点、和与基于SNP标记遗传连锁图谱定位到的QTL位点存在候选区间重叠。
2.3 转录组分析及候选基因鉴定
对耐旱和干旱敏感材料正常灌溉及干旱24 h、36 h、48 h的幼苗进行转录组测序发现, 2个材料的干旱处理与对照间均存在至少7000个差异表达基因(图5-A); 其中干旱48 h时, 两材料间差异表达基因最多, 耐旱材料较干旱敏感材料上调和下调表达的基因分别有4631个和5825个(图5-B)。在所有干旱处理条件下, 两材料间均存在的表达差异基因有1723个(图5-C), 2个材料的3个干旱时期均与对照存在表达差异的基因有1459个(图5-D), 对此3182个核心差异表达基因进行KEGG富集分析, 显著富集在赖氨酸降解及角质、木栓素和蜡质的生物合成途径(图5-E)。在核心差异表达基因的转录因子编码基因和显著富集的KEGG通路基因中, 有8个位于QTL定位鉴定的候选区间, 可认定为耐旱相关候选基因。其中, 编码ERF003的和在干旱处理下较正常灌溉下调表达; 干旱胁迫下, 耐旱材料的()、()和()基因表达水平低于干旱敏感材料,()和()基因表达水平高于干旱敏感材料;()在干旱处理24 h和36 h, 耐旱材料表达水平低于干旱敏感材料, 在干旱处理48 h高于干旱敏感材料(图5-F)。
基于耐旱和干旱敏感材料的表型和差异基因表达水平进行WGCNA分析(图6)发现, 各差异表达基因被分为14个模块, 与丙二醛含量最为正相关的模块为MEfirebrick2, 最为负相关的模块为MEdeeppink1; 与可溶性糖含量最为正相关的模块为MEplum, 最为负相关的模块为MEdeeppink1; 与叶片相对含水量最为正相关的模块为MEindianred4, 最为负相关的模块为MEfirebrick2。
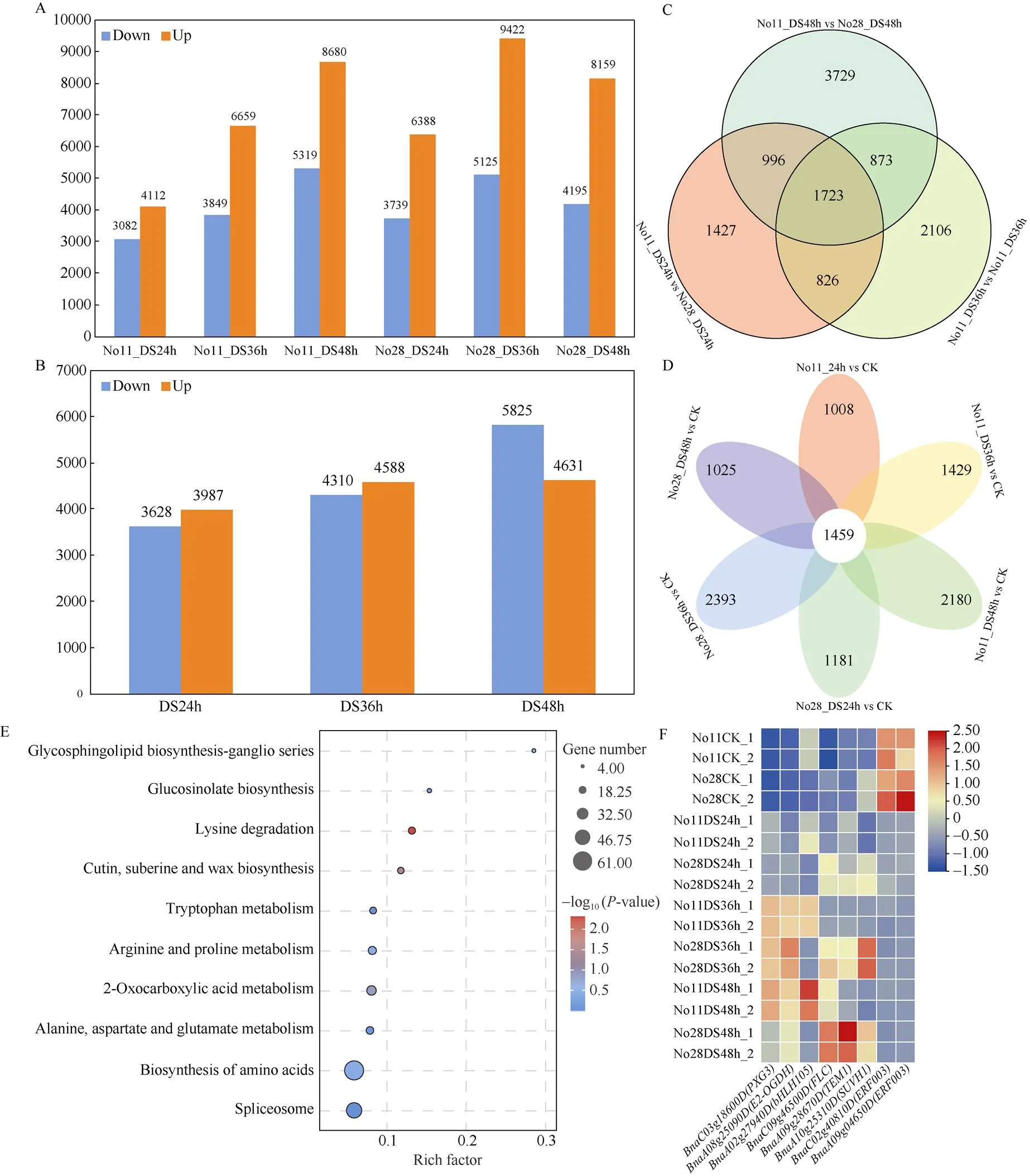
图5 正常灌溉与干旱胁迫处理下甘蓝型油菜耐旱和干旱敏感材料差异表达基因分析
A和D: 两材料各个干旱处理时期与对照间的差异基因数目和韦恩图; B和C: 各处理时期2个材料间的差异基因数目和韦恩图; E: 核心差异表达基因KEGG富集分析; F: 耐旱相关候选基因表达水平热图; No11: 耐旱材料; No28: 干旱敏感材料; CK: 正常灌溉; DS24h: 干旱处理24 h; DS36h: 干旱处理36 h; DS48h: 干旱处理48 h。
A and D: the number of differentially expressed genes and Venn diagram between each time under drought stress and well water in two materials; B and C: the number of differentially expressed genes and Venn diagrams between two materials; E: KEGG enrichment pathway of core differentially expressed genes; F: heatmap of candidate genes related to drought tolerance; No11: drought resistance material; No28: drought sensitivity material; CK: well water; DS24h: 24 h under drought stress; DS36h: 36 h under drought stress; DS48h: 48 h under drought stress.
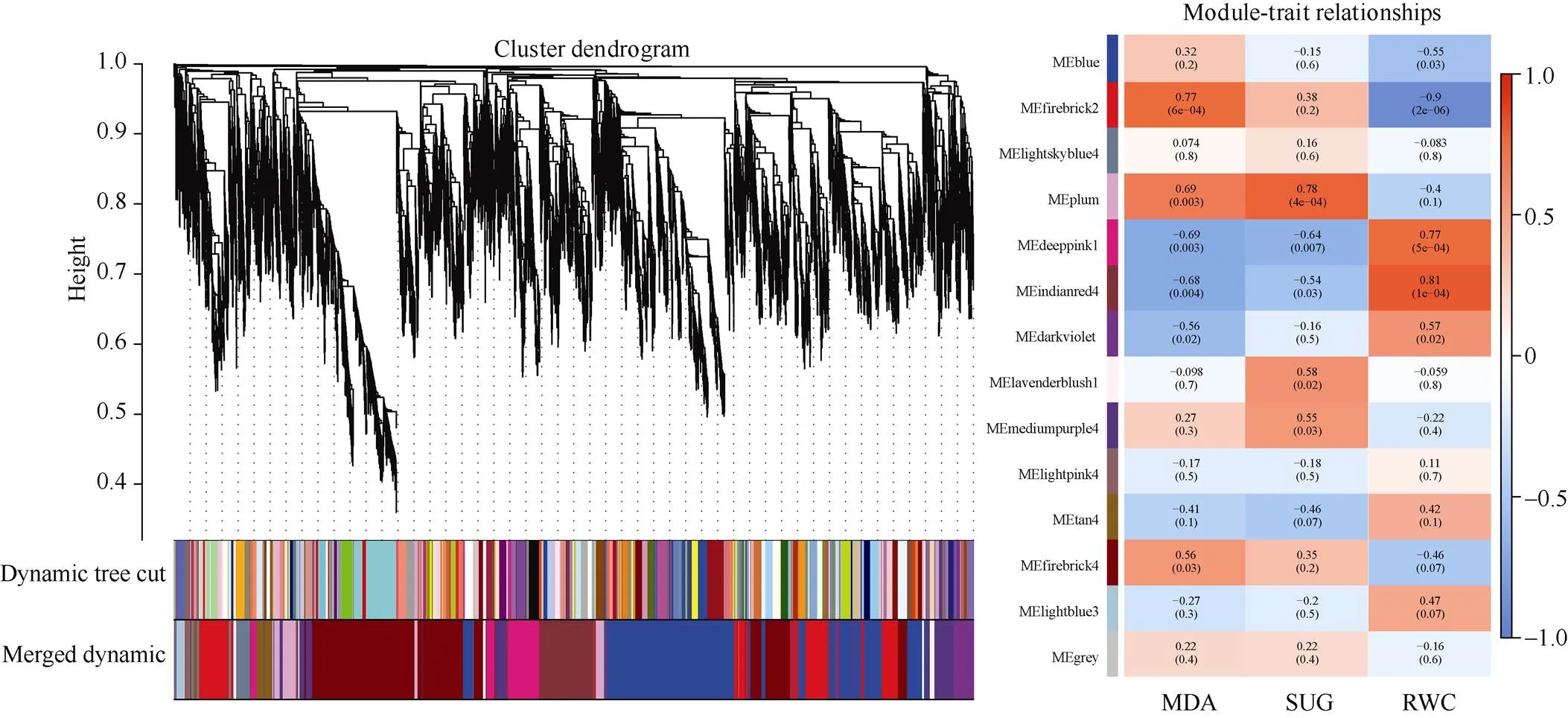
图6 WGCNA模块聚类树状图和各模块与性状的相关性
缩写同表1。Abbreviations are the same as those given in Table 1.
对MEdeeppink1、MEfirebrick2、MEindianred4和MEplum模块差异表达基因进行KEGG富集分析, MEdeeppink1模块显著富集到戊糖和葡萄糖醛酸相互转化、光合作用-天线蛋白、柠檬烯和松萜降解、氨基酸生物合成、淀粉和蔗糖代谢以及角质、木栓素和蜡质的生物合成途径(图7-A); MEfirebrick2模块显著富集到自噬调节、脂肪酸降解、脂肪酸代谢及缬氨酸、亮氨酸和异亮氨酸降解途径(图7-B); MEindianred4模块显著富集到光合作用、光合作用-天线蛋白、卟啉与叶绿素代谢、植物激素信号转导、核糖体和光合生物固碳作用途径(图7-C); MEplum模块显著富集到昼夜节律和萜类骨架生物合成途径(图7-D)。
4个模块所包含的转录因子编码基因和显著富集的KEGG通路基因中, 有23个基因位于QTL定位鉴定的候选区间, 可认定为耐旱相关候选基因(图7-E)。其中,()、()、()、()和()在干旱胁迫下较正常灌溉下调表达, 且在干旱敏感材料中表达水平更高, 其余基因随干旱胁迫下调表达。()、()、()、()、()和()表达水平在正常灌溉下, 耐旱材料显著高于干旱敏感材料;()、()、()、()表达水平在正常灌溉下, 耐旱材料低于干旱敏感材料;()、()、()、()、()、()、()和()表达水平在正常灌溉和干旱胁迫处理下, 耐旱材料低于干旱敏感材料, 且正常灌溉和干旱胁迫48 h最为明显(图7-E)。
综上所述, 将3182个核心差异表达基因以及MEdeeppink1、MEfirebrick2、MEindianred4和MEplum模块差异表达基因视为耐旱材料No11与干旱敏感材料No28响应干旱胁迫的主要差异表达基因, 显著富集到光合作用、脂肪酸代谢、氨基酸代谢、植物激素信号转导、核糖体、昼夜节律及角质、木栓素和蜡质的生物合成等相关途径。基于3182个核心差异表达基因和WGCNA分析, 分别鉴定到8个和23个候选基因, 其中位于和重叠QTL区间的()、位于和重叠QTL区间的()和位于区间的()被重复检测到(表4)。
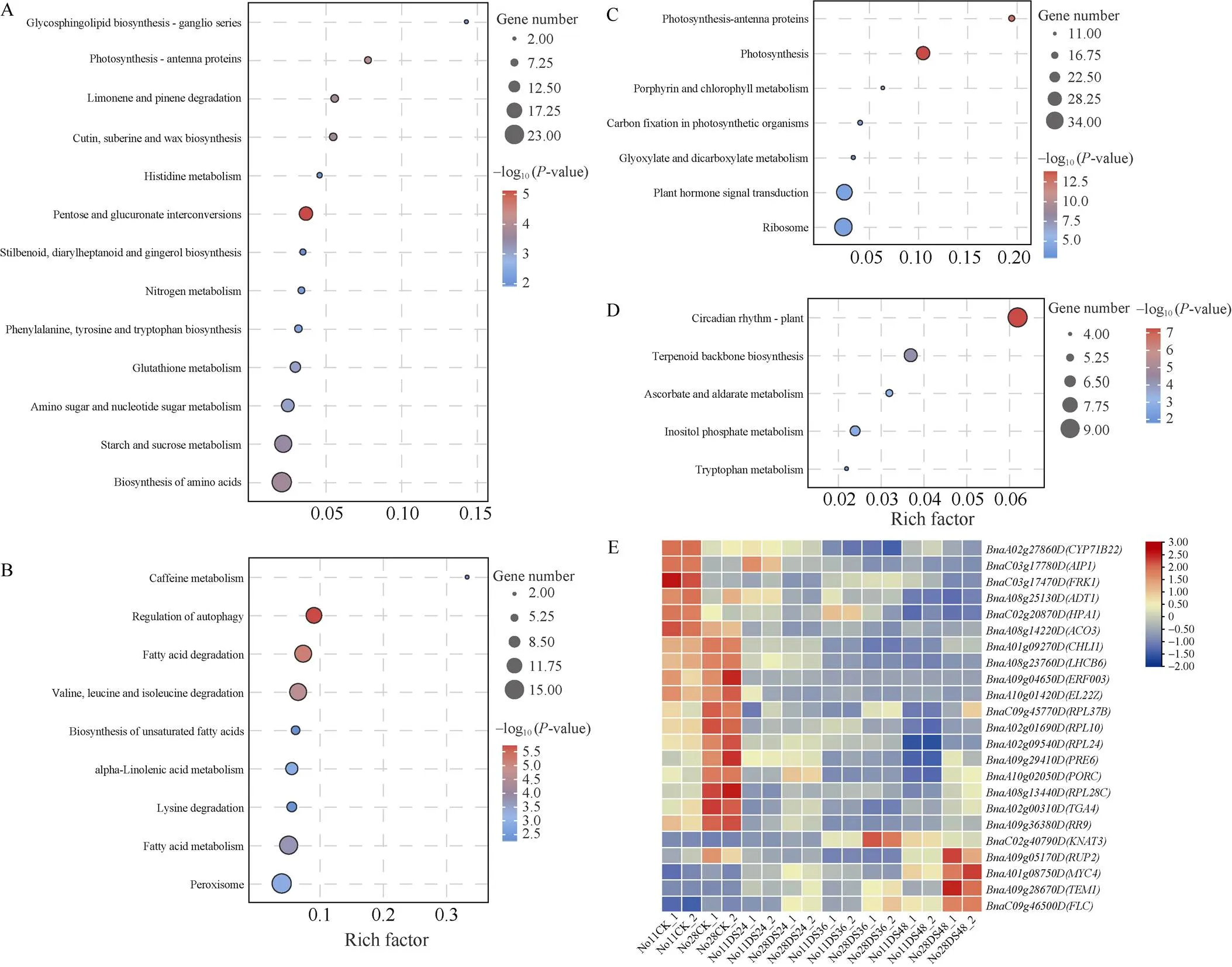
图7 各性状显著相关模块的KEGG富集分析和耐旱相关候选基因表达量热图
A: MEdeeppink1模块; B: MEfirebrick2模块; C: MEindianred4模块; D: MEplum模块; E: 热图。缩写同图5。
A: MEdeeppink1; B: MEfirebrick2; C: MEindianred4; D: MEplum; E: heatmap. Abbreviations are the same as those given in Fig. 5.
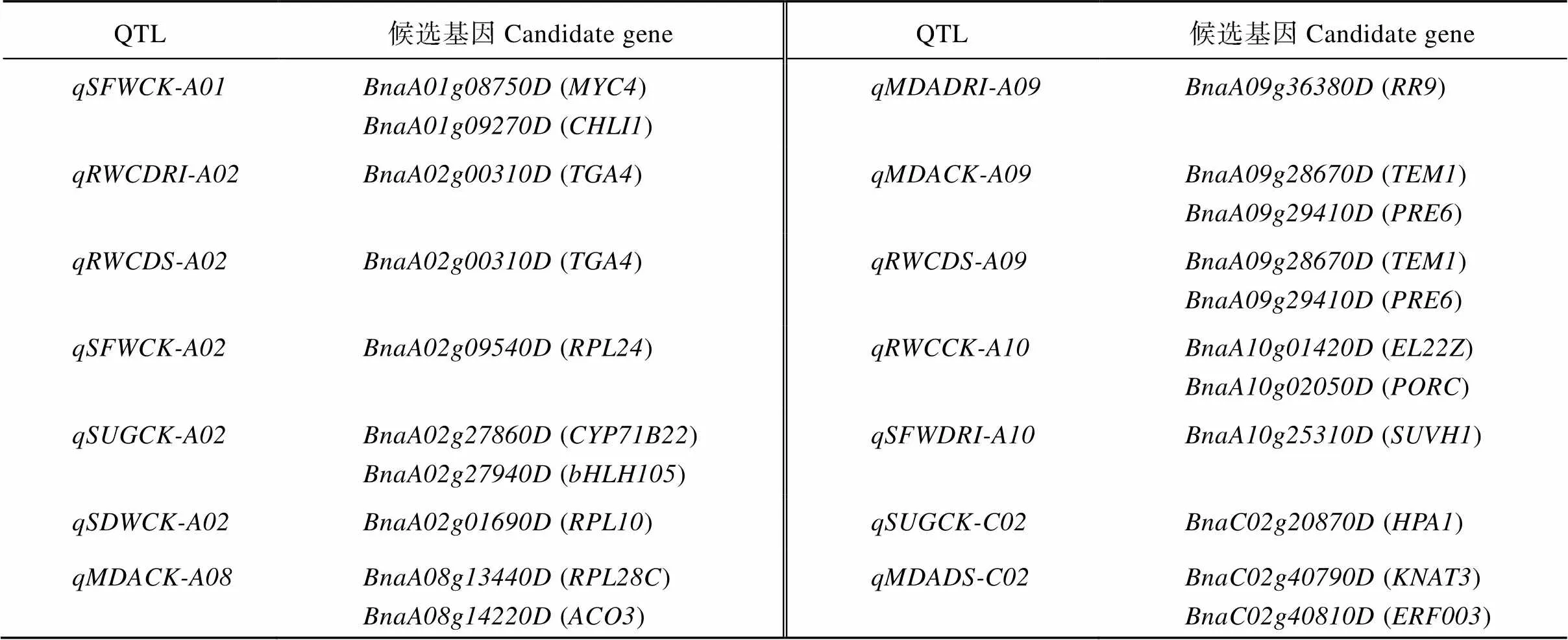
表4 甘蓝型油菜耐旱相关候选基因
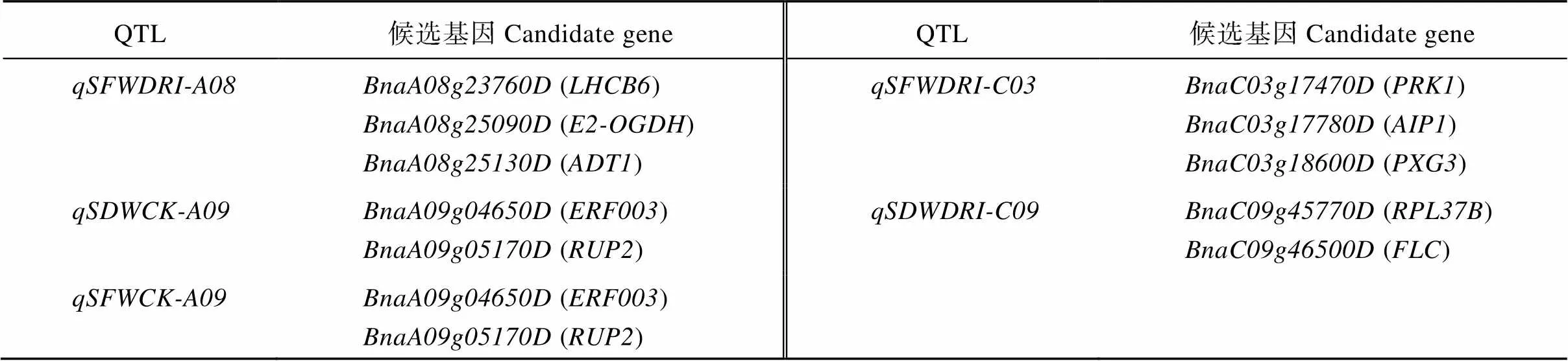
(续表4)
3 讨论
王瑞霞等[26]研究发现干旱胁迫使芥菜型春油菜地上部干重显著下降, 丙二醛含量显著上升。王丹丹[8]和石鹏程[27]对甘蓝型油菜进行干旱胁迫处理, 发现地上部鲜重和干重及叶片相对含水量显著下降,丙二醛和可溶性糖含量显著上升。谢小玉等[28]研究发现, 随着干旱胁迫时间延长和胁迫程度增加, 丙二醛和可溶性糖含量上升, 叶片相对含水量下降。本研究中, 干旱胁迫下地上部鲜重、地上部干重和叶片相对含水量显著低于正常灌溉, 丙二醛和可溶性糖含量显著高于正常灌溉, 与前人研究结果一致。
本研究通过SSR和SNP构建的甘蓝型油菜遗传连锁图谱, 定位到的耐旱相关QTL和候选区间分布于A01、A02、A06、A08、A09、A10、C02、C03、C04、C06和C09染色体。蒙姜宇等[6]和Gad等[9]定位到的甘蓝型油菜干旱胁迫相关QTL, 主要分布在A01、A02、A03、A05、A06、A07、A09、A10、C01、C02、C03和C09染色体; 洪双[29]、吴金锋[30]、石鹏程[27]和Khanzada等[11]通过GWAS, 在A01、A02、A03、A04、A05、A07、A08、A09、A10、C01、C02、C03、C04、C05、C06、C07和C09染色体检测到与甘蓝型油菜耐旱性状相关的SNP位点。由此可见, 甘蓝型油菜耐旱性是由多基因控制的复杂数量性状, 候选基因分布于A、C亚组的多条染色体。
Zhu等[31]对两种钾水平下耐旱材料和干旱敏感材料进行转录组比较分析, 差异基因主要富集到光合作用、谷胱甘肽生物合成、生长素信号转导、氨基酸生物合成、半胱氨酸和蛋氨酸代谢以及硫代葡萄糖苷生物合成途径; Fang等[32]对严重干旱和正常培养条件下甘蓝型油菜差异表达基因进行KEGG富集分析, 植物激素信号转导、脂肪酸降解、次生代谢产物生物合成和代谢、光合作用、卟啉和叶绿素代谢、碳代谢、氮代谢以及角质、木栓和蜡的生物合成等途径被显著富集到; Xiong等[33]研究发现, 干旱胁迫下秦优8号较对照下调的基因富集到核糖体途径, 上调的基因富集到次生代谢产物生物合成和植物激素信号转导途径; 本研究与上述研究结果基本一致, 对耐旱材料No11和干旱敏感材料No28进行转录组测序和分析, 主要差异表达基因显著富集到光合作用、脂肪酸代谢、氨基酸代谢、植物激素信号转导、核糖体、昼夜节律及角质、木栓素和蜡质的生物合成途径。
本研究基于QTL定位和转录组数据分析, 鉴定到的甘蓝型油菜耐旱候选基因涉及多种类型, 包括转录因子FLC、bHLH105、TGA4和TEM1编码基因, 乙烯产生和信号转导相关的ACO3和ERF003编码基因, 叶绿素相关蛋白CHLI1、LHCB6和PORC编码基因, CYP家族蛋白CYP71B22编码基因, E2亚基E2-OGDH编码基因以及核糖体相关蛋白编码基因等。Chen等[34]的研究结果揭示了拟南芥FRIGIDA在干旱胁迫下通过P5CS1途径增强耐旱性,且依赖于靶标基因FLC; Sun等[35]认为玉米bHLH105可能通过调节抗氧化机制介导的活性氧清除和Mn/Fe相关转运蛋白的表达提高锰胁迫耐受性, 可用于开发耐旱玉米新品种。Zhong等[36]发现过表达bZIP转录因子编码基因可提高拟南芥耐旱性。拟南芥基因是RAV转录因子亚家族成员, 过表达转基因拟南芥表现出相对电导率和丙二醛含量增加和脯氨酸含量降低, 而突变体植株耐旱性增强[37]。乙烯在非生物胁迫耐受机制中起着关键的信号传导作用, 编辑和的矮牵牛突变体乙烯的产生降低, 对盐和干旱胁迫更敏感[38]。乙烯响应因子包含单一AP2/ERF结构域, 在植物发育和生物与非生物胁迫响应中发挥着重要作用, 在盐和干旱胁迫下, 16个刚毛怪柳乙烯响应因子编码基因均在叶、茎或根中存在差异表达[39]。在小麦中, TaERF3通过激活胁迫相关基因积极调控对盐和干旱胁迫的响应[40]。光捕获叶绿素结合蛋白(LHCB)在保护细胞对ABA的信号传导中发挥积极作用,的过表达可增强气孔对ABA的敏感性[41]。当暴露于强光下时,过表达植物中单线态氧和丙二醛的产生均最少[42]。突变体表现出部分ABA不敏感[43]。Condori-Apfata等[44]研究表明E2亚基亚型2-OGDH功能缺失使植物生长加快, 暗呼吸降低, 碳水化合物代谢改变。Niu等[45]发现苹果MdSUVH1是耐旱性正调控因子, Seraj等[46]发现在乳蓟干旱胁迫下上调表达, Pandian等[47]认为CYP在植物非生物和生物胁迫响应中发挥着重要作用, Pal等[48]认为核糖体蛋白编码基因在生物和非生物胁迫下发挥着重要作用。由此可见, 本研究鉴定的甘蓝型油菜耐旱相关候选基因具有可靠性, 但还需进一步开展功能验证。
4 结论
干旱胁迫下, 甘蓝型油菜地上部鲜重、地上部干重和叶片相对含水量显著低于正常灌溉, 丙二醛和可溶性糖含量显著高于正常灌溉。通过SSR和SNP构建的甘蓝型油菜遗传连锁图谱, 在A01、A02、A06、A08、A09、A10、C02、C03、C04、C06和C09等11条染色体定位到耐旱相关QTL和候选区间。对耐旱材料No11和干旱敏感材料No28进行干旱胁迫处理和转录组测序分析, 主要差异表达基因显著富集到光合作用、脂肪酸代谢、氨基酸代谢、植物激素信号转导、核糖体、昼夜节律及角质、木栓素和蜡质的生物合成等相关途径。基于QTL定位和转录组数据分析, 鉴定到转录因子、乙烯产生和信号转导、叶绿素生物合成与结合、叶绿素氧化还原酶以及核糖体相关蛋白编码基因等28个耐旱候选基因, 编码FLC、bHLH105、TGA4、TEM1、ERF003、ACO3、CHLI1、LHCB6和PORC等。这些候选基因可为进一步进行基因功能验证、揭示甘蓝型油菜耐旱机制奠定基础, 将有助于耐旱新品种的培育。
[1] Batool M, El-Badri A M, Wang Z K, Mohamed I A A, Yang H Y, Ai X Y, Salah A, Hassan M U, Sami R, Kuai J, Wang B, Zhou G S. Rapeseed morpho-physio-biochemical responses to drought stress induced by PEG-6000., 2022, 12: 579.
[2] 周广生, 王晶, 蒯婕, 汪波. 专辑导读: 加强大田经济作物栽培措施与环境/资源配置的互作研究、推动产业高效优质发展. 作物学报, 2021, 47: 1633–1638. Zhou G S, Wang J, Kuai J, Wang B. Editorial: strengthening the research on the interaction between cultivated measures and environment/resource allocation of field economic crops to promote the development of industry with high efficiency and high quality., 2021, 47: 1633–1638 (in Chinese with English abstract).
[3] 宁宁, 莫娇, 胡冰, 李大双, 娄洪祥, 王春云, 白晨阳, 蒯婕, 汪波, 王晶, 徐正华, 李晓华, 贾才华, 周广生. 长江流域不同生态区油菜籽关键品质比较研究. 作物学报, 2023, 49: 3315–3327. Ning N, Mo J, Hu B, Li D S, Lou H X, Wang C Y, Xiang C Y, Kuai J, Wang B, Wang J, Xu Z H, Li X H, Jia C H, Zhou G S. Comparative study on the processing quality of winter rape in different ecological zones of the Yangtze River valley., 2023, 49: 3315–3327 (in Chinese with English abstract).
[4] 张佳运, 马淑梅, 余常兵, 王淑彬, 魏亚凤, 杨文钰, 王小春. 长江流域旱地多熟模式水分供需平衡特征与水分生产效益. 作物学报, 2022, 48: 2891–2907. Zhang J Y, Ma S M, Yu C B, Wang S B, Wei Y F, Yang W Y, Wang X C. Characteristics of water supply-demand equilibrium and water production benefits of the dryland multiple cropping patterns in the Yangtze Rive basin., 2022, 48: 2891–2907 (in Chinese with English abstract).
[5] 万林, 李张开, 李素, 刘丽欣, 马霓, 张春雷. 外源独脚金内酯对油菜苗期干旱胁迫的缓解效应. 中国油料作物学报, 2020, 42: 461–471. Wan L, Li Z K, Li S, Liu L X, Ma N, Zhang C L. Alleviation effects of exogenous strigolactone on growth ofL. seedling under drought stress., 2020, 42: 461–471 (in Chinese with English abstract).
[6] 蒙姜宇, 梁光伟, 贺亚军, 钱伟. 甘蓝型油菜耐盐和耐旱相关性状的QTL分析. 作物学报, 2021, 47: 462–471. Meng J Y, Liang G W, He Y J, Qian W. QTL mapping of salt and drought tolerance related traits inL., 2021, 47: 462–471 (in Chinese with English abstract).
[7] 李真. 甘蓝型油菜苗期耐湿性和抗旱性相关QTL分析. 华中农业大学硕士学位论文, 湖北武汉, 2008. pp 46–48. Li Z. Study on QTL Associated with Waterlogging Tolerance and Drought Resistance during Seedling Stage inL. MS Thesis of Huazhong Agricultural University, Wuhan, Hubei, China, 2008. pp 46–48 (in Chinese with English abstract).
[8] 王丹丹. 甘蓝型油菜遗传图谱构建及苗期耐旱相关性状的QTL定位. 西南大学硕士学位论文, 重庆, 2013. pp 32–33. Wang D D. Mapping and QTL Analysis of Genes to Drought Tolerance inL. MS Thesis of Southwest University, Chongqing, China, 2013. pp 32–33 (in Chinese with English abstract).
[9] Mahmoud G, Chao H B, Li H X, Zhao W G, Lu G Y, Li M T. QTL mapping for seed germination response to drought stress in., 2021, 11: 629970.
[10] Shahzad A, Qian M C, Sun B Y, Mahmood U, Li S T, Fan Y H, Chang W, Dai L S, Zhu H, Li J N, Qu C M, Lu K. Genome-wide association study identifies novel loci and candidate genes for drought stress tolerance in rapeseed., 2021, 6: 12–22.
[11] Khanzada H, Wassan G M, He H H, Mason A S, Keerio A A, Khanzada S, Faheem M, Solangi A M, Zhou Q H, Fu D H, Huang Y J, Rasheed A. Differentially evolved drought stress indices determine the genetic variation ofat seedling traits by genome-wide association mapping., 2020, 24: 447–461.
[12] Tan M, Liao F, Hou L T, Wang J, Wei L J, Jian H J, Xu X F, Li J N, Liu L Z. Genome-wide association analysis of seed germination percentage and germination index inL. under salt and drought stresses., 2017, 213: 40.
[13] 王浩. 基于GWAS和转录组测序鉴定谷子硒响应相关候选基因. 山西农业大学硕士学位论文, 山西太原, 2022. p 9. Wang H. Identification of Selenium-Responsive Candidate Genes in Foxtail Millet Based on GWAS and Transcriptome Sequencing. MS Thesis of Shanxi Agricultural University, Taiyuan, Shanxi, China, 2022. p 9 (in Chinese with English abstract).
[14] Liu C Q, Zhang X K, Zhang K, An H, Hu K N, Wen J, Shen J X, Ma C Z, Yi B, Tu J X, Fu T D. Comparative analysis of theroot and leaf transcript profiling in response to drought stress., 2015, 16: 18752–18777.
[15] Wang P, Yang C L, Chen H, Song C P, Zhang X, Wang D J. Transcriptomic basis for drought-resistance inL., 2017, 7: 40532.
[16] Zhou H W, Xiao X J, Asjad A, Han D P, Zheng W, Xiao G B, Huang Y J, Zhou Q H. Integration of GWAS and transcriptome analyses to identify SNPs and candidate genes for aluminum tolerance in rapeseed (L.)., 2022, 22: 130.
[17] Jian H J, Zhang A X, Ma J Q, Wang T Y, Yang B, Shuang L S, Liu M, Li J N, Xu X F, Paterson A H, Liu L Z. Joint QTL mapping and transcriptome sequencing analysis reveal candidate flowering time genes inL., 2019, 20: 21.
[18] Guo J, Li C H, Zhang X Q, Li Y X, Zhang D F, Shi Y S, Song Y C, Li Y, Yang D G, Wang T Y. Transcriptome and GWAS analyses reveal candidate gene for seminal root length of maize seedlings under drought stress., 2020, 292: 110380.
[19] Sevanthi A M, Sinha S K, Sureshkumar V, Rani M, Saini M R, Kumari S, Kaushik M, Prakash C, Venkatesh K, Singh G P, Mohapatra T, Mandal P K. Integration of dual stress transcriptomes and major QTL from a pair of genotypes contrasting for drought and chronic nitrogen starvation identifies key stress responsive genes in rice., 2021, 14: 49.
[20] 荆蓉蓉. 甘蓝型油菜苗期耐湿相关性状的全基因组关联分析. 西南大学硕士学位论文, 重庆, 2017. p 16. Jing R R. Genome-wide Assocaiton Mapping of Water Logging Traits inL. MS Thesis of Southwest University, Chongqing, China, 2017. p 16 (in Chinese with English abstract).
[21] Van Ooijen J W. JoinMap 4: Software for the Calculation of Genetic Linkage Maps in Experimental Populations, 2006. Wageningen: Kyazma B V. pp 1–63.
[22] Van Ooijen J W. MapQTL 6: Software for the Mapping of Quantitative Trait Loci in Experimental Populations of Diploid Species, 2009. Wageningen: Kyazma B V. pp 1–64.
[23] Voorrips R E, MapChart: software for the graphical presentation of linkage maps and QTL., 2002, 93: 77–78.
[24] 李星, 杨会, 骆璐, 李华东, 张昆, 张秀荣, 李玉颖, 于海洋, 王天宇, 刘佳琪, 王瑶, 刘风珍, 万勇善. 栽培种花生单仁重QTL定位分析. 作物学报, 2023, 49: 2160–2170. Li X, Yang H, Luo L, Li H D, Zhang K, Zhang X R, Li Y Y, Yu H Y, Wang T Y, Liu J Q, Wang Y, Liu F Z, Wan Y S. QTL mapping for single-seed weight of cultivated peanut., 2023, 49: 2160–2170 (in Chinese with English abstract).
[25] 李阳阳, 荆蓉蓉, 吕蓉蓉, 石鹏程, 李欣, 王芹, 吴丹, 周清元,李加纳, 唐章林. 甘蓝型油菜湿害胁迫响应性状的全基因组关联分析及候选基因预测. 作物学报, 2019, 45: 1806–1821. Li Y Y, Jing R R, Lyu R R, Shi P C, Li X, Wang Q, Wu D, Zhou Q Y, Li J N, Tang Z L. Genome-wide association analysis and candidate genes prediction of waterlogging-responding traits in., 2019, 45: 1806–1821 (in Chinese with English abstract).
[26] 王瑞霞, 杜海平, 田宏先. 干旱胁迫对不同生育期芥菜型春油菜幼苗生长的影响. 南方农业, 2019, 13(26): 140–143. Wang R X, Du H P, Tian H X. Effects of drought stress on the growth of seedlings at different growth stages in spring., 2019, 13(26): 140–143 (in Chinese).
[27] 石鹏程. 甘蓝型油菜苗期干旱及旱后复水相关性状的全基因组关联分析. 西南大学硕士学位论文, 重庆, 2019. p 15. Shi P C. Genome-wide Association Mapping for Drought and Rewatering Related Traits at Seedling Stage inL. MS Thesis of Southwest University, Chongqing, China, 2019. p 15 (in Chinese with English abstract).
[28] 谢小玉, 张霞, 张兵. 油菜苗期抗旱性评价及抗旱相关指标变化分析. 中国农业科学, 2013, 46: 476–485. Xie X Y, Zhang X, Zhang B. Evalution of drought resistance and analysis of variation of relevant parameters at seedling stage of rapeseed (L.)., 2013, 46: 476–485 (in Chinese with English abstract).
[29] 洪双. 全基因组关联分析挖掘甘蓝型油菜耐旱候选基因. 中国农业科学院硕士学位论文, 北京, 2018. pp 31–32. Hong S. Genome-wide Association Study Identifies Candidate Genes for Drought Tolerance in. MS Thesis of Chinese Academy of Agricultural Sciences, Beijing, China, 2018. pp 31–32 (in Chinese with English abstract).
[30] 吴金锋. 甘蓝型油菜SNP与SSR分析及耐旱性状的全基因组关联分析. 中国农业科学院博士学位论文, 北京, 2014. pp 27–28. Wu J F. SNP and SSR Analysis and Genome-wide Association Mapping of Drought Tolerance Trait in. PhD Dissertation of Chinese Academy of Agricultural Sciences, Beijing, China, 2014. pp 27–28 (in Chinese with English abstract).
[31] Zhu B, Xu H X, Guo X, Lu J X, Liu X Y, Zhang T. Comparative analysis of drought responsive transcriptome ingenotypes with contrasting drought tolerance under different potassium levels., 2023, 219: 25.
[32] Fang S, Zhao P M, Tan Z D, Peng Y, Xu L T, Jin Y T, Wei F, Guo L, Yao X. Combining physio-biochemical characterization and transcriptome analysis reveal the responses to varying degrees of drought stress inL., 2022, 23: 8555.
[33] Xiong J L, Dai L L, Ma N, Zhang C L. Transcriptome and physiological analyses reveal that AM1 as an ABA-mimicking ligand improves drought resistance in., 2018, 85: 73–90.
[34] Chen Q, Zheng Y, Luo L D, Yang Y P, Hu X Y, Kong X X. Functional FRIGIDA allele enhances drought tolerance by regulating the P5CS1 pathway in., 2018, 495: 1102–1107.
[35] Sun K L, Wang H Y, Xia Z L. The maize bHLH transcription factor bHLH105 confers manganese tolerance in transgenic tobacco., 2019, 280: 97–109.
[36] Zhong L, Chen D D, Min D H, Li W W, Xu Z S, Zhou Y B, Li L C, Chen M, Ma Y Z. AtTGA4, a bZIP transcription factor, confers drought resistance by enhancing nitrate transport and assimilation in., 2015, 457: 433–439.
[37] Luo G Y, Liu A L, Zhou X Y, Zhang X W, Peng Y, Chen X B.TEMPRANILLO1 transcription factor AtTEM1 negatively regulates drought tolerance., 2017, 83: 119–127.
[38] Naing A H, Campol J R, Kang H, Xu J P, Chung M Y, Kim C K. Role of ethylene biosynthesis genes in the regulation of salt stress and drought stress tolerance in., 2022, 13: 844449.
[39] Liu W J, Wang Y C, Gao C Q. The ethylene response factor (ERF) genes fromrespond to salt, drought and ABA treatment., 2013, 28: 317–327.
[40] Rong W, Qi L, Wang A Y, Ye X G, Du L P, Liang H X, Xin Z Y, Zhang Z Y. The ERF transcription factor TaERF3 promotes tolerance to salt and drought stresses in wheat., 2014, 12: 468–479.
[41] Xu Y H, Liu R, Yan L, Liu Z Q, Jiang S C, Shen Y Y, Wang X F, Zhang D P. Light-harvesting chlorophyll/-binding proteins are required for stomatal response to abscisic acid in., 2012, 63: 1095–1106.
[42] Pattanayak G K, Tripathy B C. Overexpression of protochlorophyllide oxidoreductase C regulates oxidative stress in., 2011, 6: e26532.
[43] Tomiyama M, Inoue S I, Tsuzuki T, Soda M, Morimoto S, Okigaki Y, Ohishi T, Mochizuki N, Takahashi K, Kinoshita T. Mg-chelatase I subunit 1 and Mg-protoporphyrin IX methyltransferase affect the stomatal aperture in., 2014, 127: 553–563.
[44] Condori-Apfata J A, Batista-Silva W, Medeiros D B, Vargas J R, Valente L M L, Pérez-Díaz J L, Fernie A R, Araújo W L, Nunes- Nesi A. Downregulation of the E2 subunit of 2-Oxoglutarate dehydrogenase modulates plant growth by impacting carbon- nitrogen metabolism in., 2021, 62: 798–814.
[45] Niu C D, Jiang L J, Cao F G, Liu C, Guo J X, Zhang Z T, Yue Q Y, Hou N, Liu Z Y, Li X W, Tahir M M, He J Q, Li Z X, Li C, Ma F W, Guan Q M. Methylation of a MITE insertion in the MdRFNR1-1 promoter is positively associated with its allelic expression in apple in response to drought stress., 2022, 34: 3983–4006.
[46] Seraj R G M, Tohidfar M, Irani M A, Esmaeilzadeh-Salestani K, Moradian T, Ahmadikhah A, Behnamian M. Metabolomics analysis of milk thistle lipids to identify drought-tolerant genes., 2022, 12: 12827.
[47] Pandian B A, Sathishraj R, Djanaguiraman M, Prasad P V V, Jugulam M. Role of cytochrome P450 enzymes in plant stress response., 2020, 9: 454.
[48] Pal G, Bakade R, Deshpande S, Sureshkumar V, Patil S S, Dawane A, Agarwal S, Niranjan V, PrasannaKumar M K, Vemanna R S. Transcriptomic responses under combined bacterial blight and drought stress in rice reveal potential genes to improve multi-stress tolerance., 2022, 22: 349.
Identification of candidate genes associated with drought tolerance based on QTL and transcriptome sequencing inL.
LI Yang-Yang1,2,3, WU Dan2,3, XU Jun-Hong2,3, CHEN Zhuo-Yong1,2,3, XU Xin-Yuan1,2,3, XU Jin-Pan1,2,3, TANG Zhong-Lin1,2,3, ZHANG Ya-Ru1,2,3, ZHU Li1,2,3, YAN Zhuo-Li1,2,3, ZHOU Qing-Yuan1,2,3, LI Jia-Na1,2,3, LIU Lie-Zhao1,2,3, and TANG Zhang-Lin1,2,3,*
1Integrative Science Center of Germplasm Creation in Western China (Chongqing) Science City, Chongqing 401329, China;2College of Agronomy and Biotechnology, Southwest University, Chongqing 400715, China;3Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China
Drought stress severely limits planting promotion and yield increase inL. Drought tolerance is a complex quantitative trait controlled by multiple genes. Combining QTL and transcriptome is an effective method for identifying candidate genes associated with drought tolerance in. In this study, the seedlings of F2:6and F2:8recombinant inbred lines, constructed by Sanliu’ai (drought sensitivity line) and Kelina-2 (drought tolerance line), were treated with drought stress and well watering at seedling stage. Shoot fresh weight, shoot dry weight, leaf relative water content, malondialdehyde content, and soluble sugar content were measured. The QTL and candidate intervals were identified based on genetic linkage maps, which were constructed using SSR and SNP markers with polymorphism. Subsequently, candidate genes associated with drought tolerance were screened by combining transcriptome sequencing of No11 (drought tolerance material) and No28 (drought sensitivity material). Drought stress decreased shoot fresh weight, shoot dry weight, and leaf relative water content, and increased the contents of malondialdehyde and soluble sugar. QTL and candidate intervals related to drought tolerance were distributed on chromosome A01, A02, A06, A08, A09, A10, C02, C03, C04, C06, and C09. By transcriptome analysis of drought tolerance and sensitivity materials under well water, drought stress for 24, 36, and 48 h, the major different expression genes were enriched in the pathways associated with photosynthesis, fatty acid metabolism, amino acid metabolism, plant hormone signal transduction, ribosome, circadian rhythm and biosynthesis of keratin, cork and wax. A total of 28 candidate genes related to drought tolerance were identified by combining QTL and transcriptome. They coded FLC, bHLH105, TGA4, TEM1, ERF003, ACO3, CHLI1, LHCB6, PORC, etc., which had transcription factor activity, ethylene production and signal transduction, chlorophyll biosynthesis and binding, chlorophyll oxidoreductase and encoding ribosome proteins. These results could provide a basis for revealing drought tolerance mechanism and molecular breeding of drought tolerance variety in.
L.; drought tolerance; QTL; transcriptome; candidate genes
10.3724/SP.J.1006.2024.34144
本研究由国家重点研发计划项目(2022YFD1201600)和重庆市技术创新与应用发展专项重点项目(cstc2021jscx-cylhX0003)资助。
This study was supported by the National Key Research and Development Program of China (2022YFD1201600) and the Chongqing Technology Innovation and Application Development Key Project (cstc2021jscx-cylhX0003).
唐章林, E-mail: tangzhlin@swu.edu.cn
E-mail: yyli1993swu@163.com
2023-08-24;
2023-10-23;
2023-11-13.
URL: https://link.cnki.net/urlid/11.1809.S.20231110.1316.008
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

