水稻类病变突变体lms1的表型鉴定与抗病分子机制分析
余 瑶 王紫瑶 周思睿 刘鹏程 叶亚峰 马伯军 刘斌美,* 陈析丰,*
水稻类病变突变体的表型鉴定与抗病分子机制分析
余 瑶1王紫瑶1周思睿1刘鹏程1叶亚峰2马伯军1刘斌美2,*陈析丰1,*
1浙江师范大学生命科学学院, 浙江金华 321004;2中国科学院合肥物质科学研究院, 安徽合肥 230031
类病变突变体是研究植物细胞死亡和抗病分子机制的重要遗传材料。通过辐射诱变粳稻品种武运粳7号, 获得一个少见的抗病性下降的类病变突变体()。与野生型相比, 该突变体叶片自发出现红褐色斑点, 其株高、穗长、每穗粒数以及单株产量降低, 但千粒重增加; 对水稻白叶枯病的抗性显著下降, 组织染色表明突变体的叶片中存在明显的细胞死亡以及活性氧的过量积累。遗传分析表明,突变体的表型受单隐性核基因控制, 利用图位克隆技术将基因精细定位于水稻9号染色体Indel7和Indel8两个分子标记间, 物理距离为62 kb。定位区间内候选基因的PCR扩增测序结果表明, 其中一个编码泛素羧基末端水解酶的()基因第1个外显子中插入了一段长度为654 bp的序列, 导致其蛋白翻译提前终止。利用蛋白组学技术分析了突变体与野生型对照的蛋白积累水平, 共鉴定到19个差异蛋白(7个上调、12个下调), 主要参与氧化还原、叶绿素合成、光合作用等代谢途径。上述结果为进一步研究基因的功能及其调控细胞程序性死亡与抗病性的分子机制提供借鉴。
水稻; 类病变;; 基因定位; 蛋白组学分析
类病变(,)是一类植物特有的、在没有病原菌的侵染下便能自发形成类似病变表型的突变体。目前, 在拟南芥、玉米、大麦和水稻等植物中均发现了大量的[1-4], 尤其是水稻, 作为单子叶模式植物和重要的粮食作物, 已经报道了200余种类病变相关突变体[5]。突变体与植物防卫过程中的超敏反应(hypersensitive response, HR)非常相似, 往往会表现出活性氧的迸发(oxidative burst)、防御相关(pathogenesis-related, PR)基因的诱导表达、细胞程序性死亡(programmed cell death, PCD)等表型。因此,是研究植物PCD与抗病分子机制的重要遗传材料。目前, 已报道的绝大部分植物突变体表现出抗病性增强, 如、和等突变体增强了对白叶枯病的抗性[6-8],、和等突变体增强了对稻瘟病的抗性[9-11], 而、、、和等突变体则表现为广谱的抗病性[12-16]。但是, 也有少数的抗病性没有显著性变化, 如水稻的、和等突变体[17]。
迄今, 从水稻类病变突变体中已经成功克隆了40多个基因[18]。其中,基因编码热激蛋白转录因子HSFA4, 在细胞凋亡过程中起到负调控作用[4];基因编码水稻中介复合体的第16亚基, 参与调控水稻的生长发育和防御反应[19];基因编码细胞色素P450单加氧酶, 参与调控叶绿体的发育[20];基因编码一种含有CUE结构域的蛋白质, 过表达或抑制表达该基因均能产生类病变表型[21];基因编码二氧四氢喋啶合酶, 参与核黄素的生物合成[22];基因编码一个环型E3泛素连接酶, 能与OsBAG4互作, 触发PCD和自身免疫应答[16]。我们前期也克隆了一个水稻基因, 其编码剪接因子复合体亚基SF3b3[23]。可见,基因的生物学功能非常多样化, 同时也说明植物类病变形成的分子机制非常复杂, 只有克隆更多的相关基因, 才能全面深入地解析植物PCD与抗病应答的分子机理。本研究利用人工辐射诱变, 从水稻品种武运粳7号的诱变库中筛选到一个抗病性下降的突变体, 命名为(), 并对该突变体进行了表型鉴定、遗传分析、基因克隆与蛋白组学分析, 为研究该基因的生物学功能与分子机制提供了一定的依据。
1 材料与方法
1.1 试验材料
利用重离子束对粳稻(L. subsp.)品种武运粳7号进行辐射诱变, 筛选到具有类病变表型的突变体, 经过多代自交, 其后代的突变表型遗传稳定。将突变体与籼稻(L. subsp.)品种9311杂交, F1代自交获得F2分离群体, 在F2群体中选取具有突变体表型单株的叶片, 用于进行基因定位。以上材料均种植于浙江师范大学的水稻试验田, 春季播种, 夏季移栽, 按照常规种植进行水肥管理。8个水稻白叶枯病菌(pv.,)生理小种PXO61、PXO86、PXO79、PXO71、PXO112、PXO145、PXO280和PXO124菌株, 由中国农业科学研究院作物科学研究所提供。
1.2 叶片组织的生化分析
在水稻移栽后1个月左右, 在突变体植株刚出现类病变表型时, 分别取突变体与野生型(WT)对照武运粳7号相同时期、相同叶位的叶片, 分别进行以下试验:
台盼蓝(Trypan blue, TB)染色[24]: 将叶片浸入含0.4%台盼蓝染液的离心管中, 抽真空处理30 min后, 黑暗放置12 h; 取出叶片, 转移到含水合三氯乙醛的离心管中, 进行沸水浴脱色处理, 直至叶片完全褪绿。
四唑氮蓝(nitroblue tetrazolium, NBT)染色[25]: 将叶片浸没在0.2 mg mL–1NBT溶液的离心管中, 抽真空处理10~15 min后, 置于黑暗中染色8 h, 取出叶片放于95%乙醇中, 利用沸水浴进行脱色。
二氨基联苯胺(diaminobenzidine, DAB)染色[26]: 将叶片浸泡在1 mg mL–1的DAB溶液(pH 5.8)的离心管中, 抽真空处理30 min后, 置于黑暗处染色8 h,取出叶片转入96%乙醇中, 在沸水浴中进行脱色, 再次转入95%乙醇中放置1~2 d。
活性氧含量及其酶活性测定: 采用H2O2含量检测试剂盒(Solarbio)测定H2O2含量, 采用POD活性检测试剂盒(Solarbio)测定过氧化物酶(peroxidase, POD)活性, 具体操作方法均参照产品说明书。
1.3 水稻植株农艺性状调查
在成熟期, 随机选取突变体与WT各10个单株, 分别统计株高、剑叶长、剑叶宽、有效分蘖数、穗长、穗粒数和结实率, 脱粒晒干后测量粒长、粒宽和千粒重等农艺性状; 取平均值, 计算标准差, 采用检验方法进行显著性检验(< 0.05)。
1.4 叶绿素含量测定
突变体与野生型对照各取3个生物重复, 叶片去掉主脉后, 每个样品称取0.1 g于15 mL的离心管, 每个管中加入3 mL 80%丙酮, 避光提取48 h以上; 以80%的丙酮为空白对照, 通过紫外分光光度计测量在664、647和470 nm处的OD值, 计算公式如下:
叶绿素浓度Chl= 13.71×A664–2.85×A647;
叶绿素浓度Chl= 22.39×A647–5.42×A664;
类胡萝卜素浓度Car = (1000×A470–3.27×Ca– 104×Cb)/229;
叶绿素或类胡萝卜素含量公式(mg g–1) = (c×V×n)/ (1000 m)。
式中, c: 叶绿素或类胡萝卜素浓度; V: 提取液体积, 单位为mL; n: 稀释倍数; m: 质量, g。
1.5 白叶枯病抗性鉴定
将菌株在PDA培养基(马铃薯300 g、蛋白胨5.0 g、琼脂17 g、蔗糖15 g、Na2HPO4·12H2O 2.0 g、Ca(NO3)2·4H2O 0.5 g, 加蒸馏水定容至1000 mL, pH 7.0)上接种, 于28℃培养2~3 d, 刮取菌落于适量无菌水中, 配制成1×109cfu mL–1菌悬液备用。在水稻分蘖盛期, 采用剪叶法[27]进行接种, 用消毒的剪刀先沾取菌液, 在完全展开的叶片顶端剪去2~3 cm,使其从伤口处侵染, 接菌14 d后测量接种叶片的病斑长度。
1.6 突变体lms1的遗传分析与目标基因精细定位
首先, 对突变体的表型进行遗传分析, 通过观察该突变体与9311杂交后F1植株、F2植株的表型, 统计F2群体中WT与突变表型的单株数, 计算WT与突变表型的分离比, 并进行χ2检验, 确定表型的显隐性、以及是否由单基因控制等。目的基因的定位采用图位克隆(map-based cloning)技术[28], 其中, 水稻叶片组织的基因组DNA提取采用CTAB法[29], 分子标记的PCR扩增体系为10 μL: 5 μL 2× PCR Mix (TaKaRa)、1 μL DNA模板、0.5 μL 10 μmol L–1引物、3.5 μL ddH2O。PCR程序为: 94℃ 5 min; 94℃ 30 s, 55~60℃ 30 s, 72℃ 30 s, 35个循环; 72℃ 10 min。PCR产物用4%琼脂糖凝胶电泳, 100 V电压进行分离, 再经溴化乙锭(EB)染色, 在凝胶成像仪中照相。目的基因的初步定位采用水稻已公布的SSR标记[30], 精细定位自行开发了8个Indel标记, PCR引物见表1。
1.7 候选基因的PCR测序与序列分析
采用高保真DNA聚合酶KOD-FX (TOYOBO)对WT和突变体的基因组DNA中候选基因()进行PCR扩增。PCR反应体系含25 μL 2× PCR buffer、2 μL DNA模板、10 μL 2 mmol L–1dNTPs、2 μL 10 μmol L–1引物(表2)、10 μL ddH2O、1 μL KOD FX。PCR程序为: 94℃ 5 min; 98℃ 10 s, 60℃ 30 s, 68℃ 2 min, 30个循环; 68℃ 10 min。将PCR产物寄送浙江尚亚生物技术有限公司(杭州), 并使用引物进行两端测序。PCR引物lms1-Chr.9用于鉴定基因中是否有654 bp的片段插入, PCR引物lms1-Chr.3用于鉴定3号染色体上是否有相应的片段缺失(表2)。采用2×PCR Mix试剂盒(TaKaRa)进行PCR扩增, 反应体系和操作均按照产品说明操作, PCR产物用1%琼脂糖凝胶电泳进行分离, 经EB染色后, 在凝胶成像系统中照相。

表1 用于基因精细定位的分子标记及引物序列

表2 用于目标基因扩增和鉴定的PCR引物
将OsLMP1蛋白的氨基酸序列与植物基因组数据库PLAZA (https://bioinformatics.psb.ugent.be/plaza/)进行Blastp比对, 获得其在其他植物中的同源蛋白, 采用MEGA7.0软件对蛋白序列进行Alignment分析, 并用最大似然法(Maximum Likelihood)构建系统发育树, Bootstrap值设定为1000[31]。
1.8 蛋白组学分析
在水稻分蘖期, 突变体类病斑表型开始出现后, 分别取突变体与WT相同时期、相同叶位的叶片, 各3个生物学重复, 共6个样品, 经液氮速冻后, 使用植物蛋白提取试剂盒(Solarbio)提取总蛋白, 采用聚丙烯酰胺凝胶电泳和BCA (bicinchnininc acid)法测定蛋白质量与浓度[32]。对样品蛋白质进行还原以及烷基化处理后, 每个样品分别取100 μg蛋白质进行酶解消化, 收集经脱盐处理的肽段进行非标定量法(Label-free)定量分析[33]。通过毛细管高效液相色谱仪将混合后的肽段进行组分分离, 并采用LC-MS/MS对肽段组分进行测序。
2 结果与分析
2.1 水稻类病变突变体lms1的表型鉴定
在苗期, 突变体的叶片上会出现零星的褐色斑点(图1-A), 随着植株的生长发育, 其叶片的斑点逐渐增多, 到结实期时其剑叶、倒二叶、倒三叶等都布满褐色斑点且叶色发黄(图1-B, C), 叶片的叶绿素含量显著低于WT (图1-D), 呈现早衰表型。类病变表型的出现往往是由于细胞坏死引起的, 对突变体叶片刚出现斑点时(图1-E), 将叶片进行台盼蓝染色后, 发现突变体叶片上有许多蓝色斑, 表明此处的细胞正在死亡, 而同时期的WT叶片染色后则没有(图1-F)。活性氧(reactive oxygen species, ROS)的积累是引起PCD的主要原因, 因此, 对同时期的突变体叶片进行了NBT (检测O2–)和DAB (检测H2O2)染色, 与野生型对照相比, 突变体的叶片分别出现了深蓝色(图1-G)和红褐色斑点(图1-H), 表明突变体的叶片中ROS过量积累。上述结果表明突变体叶片表现的是类似HR坏死斑, 属于典型的类病变表型。尽管绝大多数类病变在一定程度上能提高突变植株对病原菌的抵抗力, 但是突变体对8个水稻白叶枯病菌株的抗性却明显下降(图1-I, J)。从农艺性状上看,突变体的生长与发育受到抑制, 其株高、穗长、每穗粒数、结实率和单株产量等主要性状均显著性低于WT (图2-A~G, L), 其粒长(图2-H, M)和粒宽(图2-I, N)与WT没有显著性差异, 但是千粒重却显著高于WT (图2- K), 千粒重增加的主要原因可能是突变体穗粒数减少导致种子的灌浆更充分, 使得粒厚增加(图2-J, O)。

(图1)
A: 苗期植株; B: 成熟期植株; C: 旗叶; D: 叶绿素含量测定; E: 染色前的叶子; F~H: 分别被TB、NBT和DAB染色后的叶子; I: 被菌株感染的叶片照片; J:菌株感染叶片病斑长度的统计(用刻度尺测量病斑长度, 每个类型水稻至少测量15片剑叶, 最终取平均值作为其病斑长度)。使用检验测量显著性差异(*:< 0.05; **< 0.01, 下同), 标尺为2 cm (A, C~G, I~J), 标尺为10 cm (B)。
A: plants at the seedling stage; B: plants at the mature stage; C: flag leaves. D: chlorophyll contents. E: leaves before staining; F–H: leaves stained by TB, NBT, and DAB, respectively; I: photographs of the leaves infected bystrains; J: statistical results of the lesion length in the leaves infected bystrains (Measure the length of the diseased spot with a graduated ruler, measure at least 15 sword leaves for each type of rice, and finally take the average value as its diseased spot length). A two-tailed unpaired Student’s-test determined the statistical significance (hereafter). *:< 0.05; **< 0.01. Bar: 2 cm in (A, C–G, I–J), 10 cm in (B).
2.2 水稻lms1突变体的遗传分析
水稻突变体植株经过多代的自交, 其类病变表型能稳定遗传。将粳稻背景的突变体与籼稻9311杂交, 其F1代植株表型均无类病变表型; F1代植株自交得到包括1468个单株的F2代群体, 对F2群体中的WT类型植株和类病变植株的数量进行了调查统计, 发现WT为1114株、类病变为354株, 经χ2检验符合孟德尔遗传规律的3∶1分离比(χ2= 0.63;> 0.05), 这表明突变体的类病变性状受单隐性核基因控制。
2.3 突变体lms1目标基因的精细定位与测序鉴定
利用已公布的水稻SSR标记对突变体与籼稻9311两个杂交亲本进行PCR扩增, 筛选到分布于12条染色体的85对多态性分子标记。利用上述多态性标记对基因进行连锁分析, 发现的类病变表型在水稻9号染色体上存在连锁, 并利用42个F2代群体中突变表型的单株将目的基因初步定位在Indel1和RM24683之间(图3-A)。随后, 通过扩大F2突变表型单株的数目至354株, 进一步将该基因精细定位于Indel7和Indel8之间, 物理距离为62 kb (图3-B)。根据水稻参考基因组数据库(http: //rice.uga.edu/index.shtml)的注释信息, 此区间内包含9个注释基因(图3-C)。为了确定突变位点, 我们对定位区间内的所有注释基因进行PCR扩增和测序分析, 通过比较WT与突变体的序列, 发现突变体中基因的第一个外显子中插入了一段长度为654 bp的序列, 从而导致其编码蛋白翻译提前终止(图3-C, D), 其他基因及其启动子序列均未发生突变。
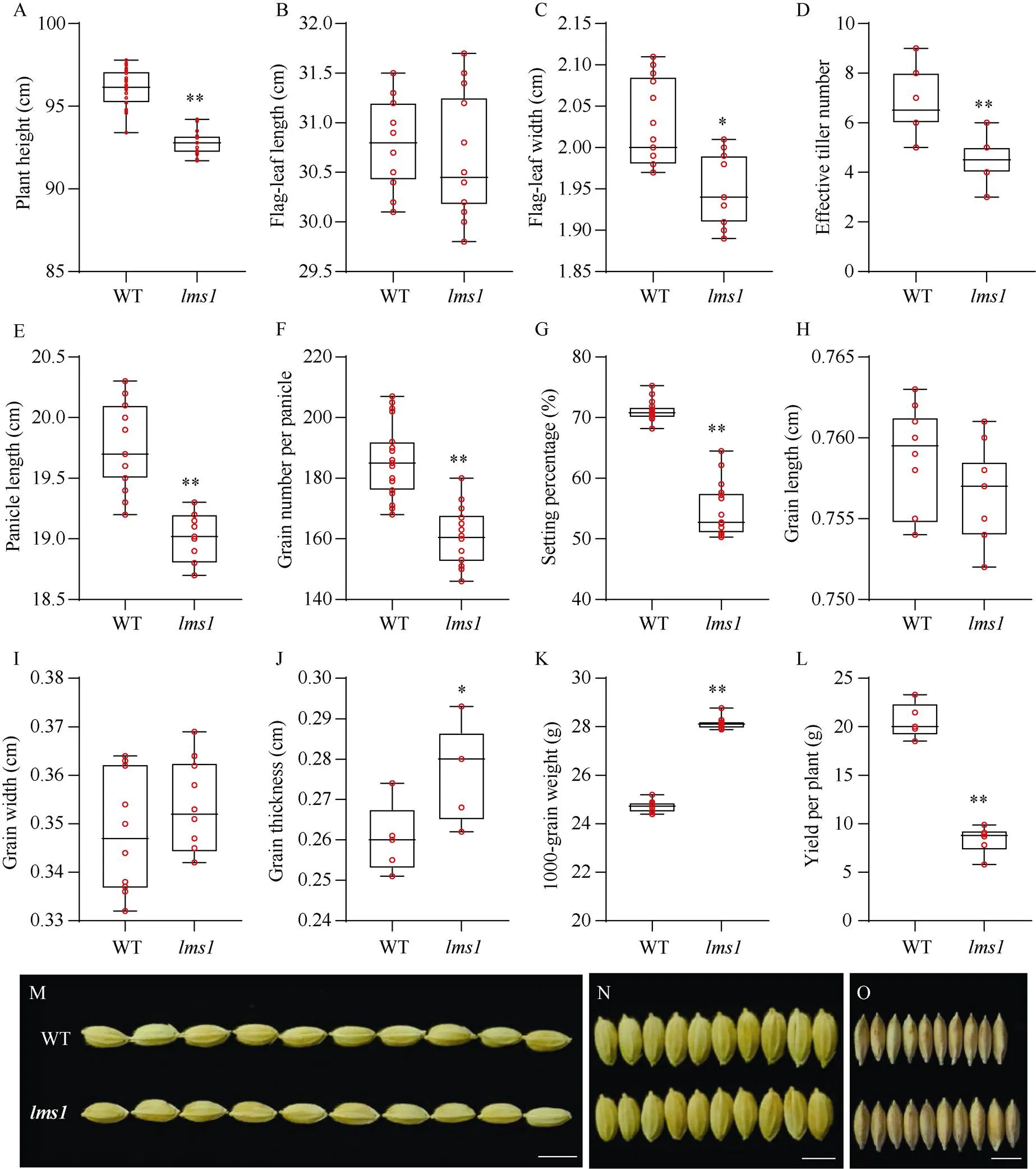
图2 水稻lms1突变体与WT的主要农艺性状比较
A~L: 分别为株高、旗叶长、旗叶宽、有效分蘖数、穗长、每穗粒数、结实率、粒长、粒宽、粒厚、千粒重和单株产量; M~O: WT和突变体的10粒种子的长度、宽度和厚度的照片, 标尺为1 cm。
Statistical results of plant height (A), flag-leaf length (B) and width (C), effective tiller number (D), panicle length (E), grains number per panicle (F), setting ratio (G), grain length (H), grain width (I), grain thickness (J), 1000-grain weight (K), and yield per plant (L); photograph of 10 grains in length (M), width (N) and thickness (O) between WT andmutant, scale bar: 1 cm.
该插入的654 bp序列与水稻基因组比对, 发现其来源于水稻3号染色体的短臂。由于突变体是辐射诱变而来, 我们推测辐射可能导致3号和9号染色体同时产生了DNA链的断裂, 3号染色丢失了一段序列, 在修复过程中被连接到9号染色体长臂上, 发生染色体易位(translocation) (图3-E)。为了进一步证实这一推测, 我们在2个位点分别设计了PCR引物进行扩增, PCR产物的电泳结果显示在突变体中3号染色体的区段发生了片段丢失, 而9号染色体发生了片段插入(图3-F)。对3号染色体的PCR产物进行测序, 证实丢失的序列就是插入到9号染色体基因的片段。同时, 我们用3号染色体的这对PCR引物, 对F2群体中呈现类病变表型的单株进行了扩增, 结果表明的类病变表型与3号染色体处的片段丢失不存在连锁现象, 表明突变体的类病变表型是由于9号染色体上基因的功能缺失所导致的。根据文献[34]显示,基因是近期被报道的类病变基因(),编码一种去泛素化酶,是基因的等位变异。
A, B:的初步定位和精细定位, “”代表使用的F2群体中突变型单株的数量, 每个标记物下方的数字表示该标记检测到的重组体数量; C: 62 kb区域内的注释基因以及候选基因的突变位点, 在第一个外显子上的第625 bp位点插入了一个654 bp的片段; D:中目标基因在突变位点的测序结果及与WT的对比, 黑框里为整个插入序列的片段; E:突变体染色体易位模式图, DSB, DNA双链断裂; NHEJ, 非同源末端连接; F: 利用突变位点两侧引物对WT和扩增后的PCR产物电泳结果。M代表DL2000分子标记。
A and B: preliminary and fine mapping genetic map of themutant; ‘’ refers to the number of F2mutants used; the number under each marker represents the recombinants detected by corresponding marker. C: annotation genes in the 62-kb region, and the mutation site of the candidate gene of; a 654-bp fragment was inserted into target gene at the 625 bp from the first codon. D: sequencing results ofgene in the mutation site comparing to WT, and the sequence boxed is the whole fragment inserted. E: model diagram of chromosome translocation inmutant. DSB, DNA double-strand break. NHEJ, non-homologous end joining; F: electrophoresis of PCR products amplified from WT andusing primers pair flanking by the mutation sites. M: molecular marker DL2000.
2.4 水稻OsLMP1蛋白的进化分析
OsLMP1蛋白属于UBP (ubiquitin-specific proteases)亚家族的一员, 包含锌指结构域和肽酶C19结构域。其中, 肽酶C19结构域中具有2个保守的催化基序: 半胱氨酸盒(Cysteine, Cys Box)和组氨酸盒(Histidine, His Box) (图4-A), 具有泛素水解酶的活性,可以通过切割肽键, 参与多泛素前体和泛素化蛋白的加工[34]。利用水稻OsLMP1蛋白序列, 在PLAZA植物基因组数据库中搜到莱氏衣藻()、小立碗藓()、拟南芥()、玉米()等25个物种的42个同源蛋白, 并构建了OsLMP1的系统发育树(图4-B), 从OsLMP1的同源蛋白的保守性和进化来看, 该基因起源于陆生植物分化之前, 在进化上其主要功能结构域较为保守, 在不同物种中可能存在相似的生物学功能。
2.5 水稻OsLMP1下游通路的蛋白组学分析
由于OsLMP1参与翻译后的蛋白水平调控, 我们利用Label-free蛋白质组技术比较了突变体与WT的蛋白组, 共筛选到19个差异蛋白(|log2FC|≥1), 其中7个蛋白含量增加, 12个蛋白含量降低(表3)。差异蛋白的GO分析结果显示: 以生物过程(biological process)分类, 主要涉及光合作用(GO: 0015979)、氧化还原(GO: 0055114)等; 以细胞器组成(cellular component)分类, 主要富集在质体、胞内膜细胞器、叶绿体中; 以分子功能(molecular function)分类, 大多与氧化还原酶活性相关(图5-A)。对差异蛋白的KEGG Pathway富集分析表明, 主要富集在萜类生物合成、基础代谢途径、光合作用、卟啉和叶绿素代谢等途径(图5-B)。
在这些差异蛋白中, Q8W250是脱氧木酮糖磷酸盐还原异构酶(1-deoxy-D-xylulose 5-phosphate reductoisomerase, DXR), 作为萜类化合物合成途径之一的一种限速酶[35], 其含量下调会抑制突变体中的萜类物质的合成。过氧化物酶(peroxiredoxin, POD)作为植物抗氧化的一种物质, 可以清除H2O2, 保护DNA和膜不被破坏[36], 其中Q69TY4在中下调, 而另外一种过氧化物酶POD, 即Q7F1U0却上调, 用试剂盒测定后, 发现中积累了大量的ROS, POD的活性显著高于野生型, 暗示后者可能发挥主效功能(图5-C, D)。香叶酰香叶醇还原酶基因(CHLP, EC: 1.3.1.111)是叶绿素(Chl)生物合成最后一步的关键酶, 参与叶绿素生物合成的末端氢化步骤[37-38], 即Q75IM9; A2Y8E0是铁氧还蛋白- NADP+-氧化还原酶(FNR, Ferredoxin-NADP+-Oxidoreductase)介导铁氧还原蛋白(Fd)与NADP+之间的电子转移, 是卡尔文循环中提供还原力的关键酶; Q84YK8是一种脂肪酸氧化酶, 其产物通常可以作为茉莉酸生物合成的中间体, 脂肪酸的过氧化物会使叶绿体的光反应失活并破坏细胞膜结构[39]。在突变体中Q75IM9和A2Y8E0表达下调, 而Q84YK8上调表达, 这就解释了的叶绿素含量减少, 叶片黄化, 光合作用减弱, 从而使得大部分农艺性状下降, 尤其单株产量。

(图4)
A: OsLMP1及其同源蛋白的序列比对, 下画线和框里为保守结构域; B: OsLMP1蛋白的系统发育树, 由MEGA v7.0软件用最大似然法构建, bootstrap=1000。
A: sequence alignment of OsLMP1 and its homologous proteins, and the conservation domain were underlined or boxed; B: phylogenetic tree of OsLMP1 proteins. The Maximum-Likelihood tree was generated by MEGA v7.0 with bootstrap-1000 repeats tests.
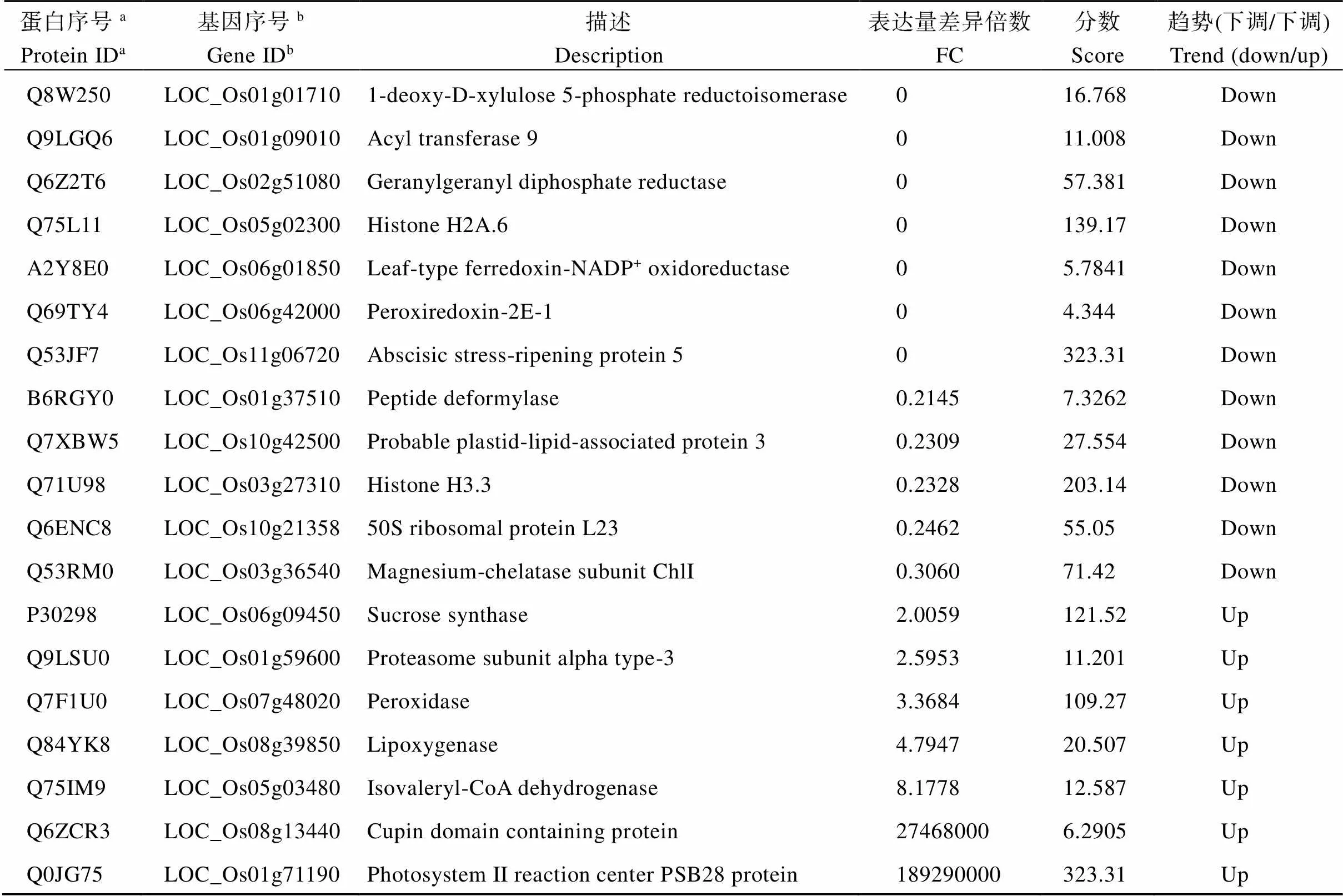
表3 差异表达蛋白的基本信息
a: 蛋白质ID来自于UniProt (https://www.uniprot.org/);b: 基因ID来自于日本晴基因组数据库(http://rice.uga.edu/index.shtml)。
a: protein ID comes from UniProt (https://www.uniprot.org/);b: gene ID comes from According to the reference genome of Nipponbare (http: //rice.uga.edu/index.shtml).
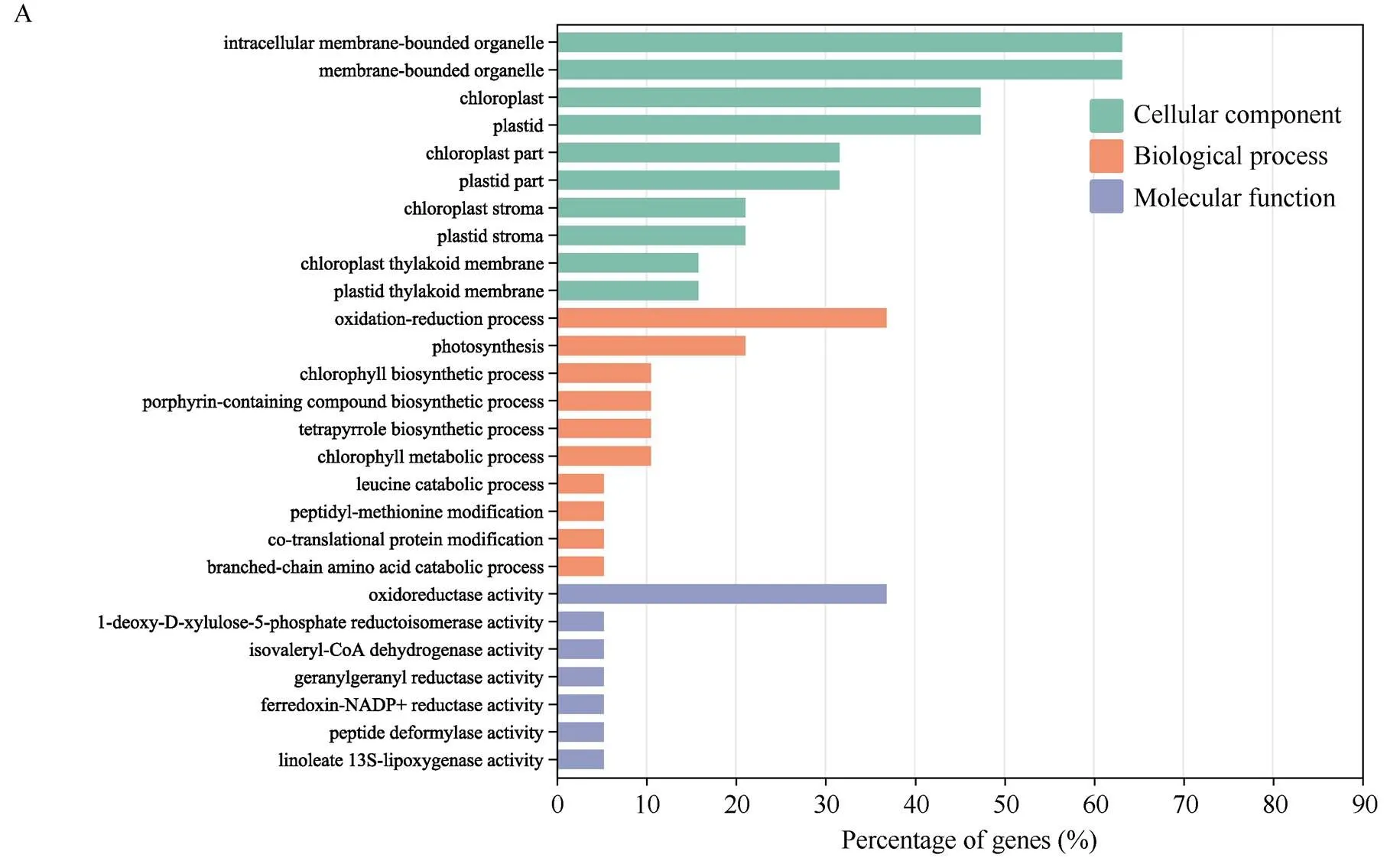
(图5)
A:突变体和WT之间的差异蛋白(DEP)的GO分析; B: DFP的KEGG富集, X轴表示富集率, Y轴表示KEGG途径, 气泡的大小表示蛋白质的数量, 颜色表示值的大小; C: H2O2的含量; D: POD的活性。
A: GO analysis of the differentially-expressed proteins (DEPs) betweenmutant and WT; B: KEGG enrichment of the DEPs. The X-axis indicates the enrichment ratio, the Y-axis indicates the KEGG pathway, and the bubble size indicates the number of proteins. The color represents the enriched-value; C: content of H2O2. D: POD activity.
3 讨论
本研究对一个水稻类病变突变体进行了表型鉴定, 该突变体出现典型的类病变, 但是与其他已发现的类病变突变体不同, 其抗病性显著降低; 通过图位克隆方法精细定位了基因, 并确定了其突变表型是由于编码去泛素化酶的目标基因的突变所导致, 其与近期报道的类病变突变体[34]一样都是基因的等位变异。水稻突变体是由于基因的编码区插入了1个碱基, 导致蛋白翻译提前终止, 缺失了His-box及其去泛素化酶的活性, 使得组蛋白H2B泛素化和组蛋白H3-K4me3/4甲基化水平升高, 激活SA合成基因和的表达, 提高了植株对PXO99的抗性[34]。然而, 我们获得的突变体虽然类病变表型与突变体非常相似, 但是却对PXO61、PXO71等多个水稻白叶枯病菌的抗性普遍下降, 这可能是由于本研究中的突变位点不同, 突变体本身呈现出早衰, 其基础免疫能力降低所导致。同时, 也不排除接种病原菌的发育时期不同, 以及突变体遗传背景的差异引起了突变体对白叶枯病菌的抗性不同。蛋白组学的分析结果也表明控制萜类物质合成途径的限速酶DXR在突变体中积累减少(表3), 可能是其导致抗病性下降的重要原因之一, 其Q84YK8上调会促进JA合成, JA可以拮抗SA, 因此, 也有可能产生与突变体抗病相反的表型。当然, 也可能是2个突变体的基因的变异方式不同所引起的,突变体是插入一个碱基, 而突变体则是插入了一大段序列, 尽管都导致了基因移码突变, 但是阅读框移码的位置及其后面错译的氨基酸序列都有不同, 产生的生物学作用也可能不同。
水稻突变体是通过人工用重离子束辐射诱变得到的。一般来说, 重离子束会造成密集性的DNA团簇发生损伤, 涉及DNA双链断裂(DNA double-strand break, DSB)、DNA单链断裂(DNA single-strand break, SSB)等类型, 损伤发生时会有同源重组(homologous recombination, HR)和非同源末端连接(non-homologous end joining, NHEJ)两个途径对其修复[40]。有趣的是, 在突变体中, 位于9号染色体的基因中插入了一段来自3号染色体的一个654 bp片段, 而在3号染色体的原位点处又刚好丢失了这段序列(图3-E, F)。由此可见, 在重离子束辐射下, 3号染色体的DSB造成了一个654 bp片段的断裂脱离, 同时9号染色体上也出现了DSB, 在修复过程中恰好与来自3号染色的脱离片段进行连接, 导致片段插入, 形成了染色体的片段易位。之后对F2群体的突变单株进行扩增, 发现不存在连锁现象, 这表明突变体类病变的发生与3号染色体上片段缺失没有关系, 而是由9号染色体基因的插入突变导致的。
此外, 水稻类病变的发生往往会影响植株的生长发育, 其主要农艺性状均比WT更差, 尤其是籽粒性状, 如[20]、、、、、[41-44,10]等突变体的千粒重都减少。而突变体的千粒重则显著增加, 其主要表现为粒厚的增加, 粒长和粒宽没有显著的差异。研究表明, 水稻粒厚调控的关键基因就是编码一种功能性去泛素化酶, 其突变体缺失去泛素化酶的活性, 会导致粒厚、粒宽和粒重有所增加[45]。与OsLMP1同属于UBPs (ubiquitin-specific proteases)家族的OsUBP15也是一种泛素特异性蛋白, 参与水稻籽粒的形态调控[46]。当然, 由于突变体的有效分蘖数和穗粒数显著减少, 同时结实率降低, 因此相比于野生型, 在灌浆期突变体中会残留更多的碳水化合物, 而在颖壳大小定形以后, 这些化合物会使得突变体灌浆更充分, 进而呈现出粒厚和千粒重的增加。此外, 已知Q84YK8上调会促进JA合成, JA合成关键酶Kat-2B又会促进小麦粒重的增加, 那么这个突变粒厚增加是不是也与JA合成关键酶Kat-2B相关[47], 这就需要我们进行更深一步的研究, 总的来说该基因的克隆可以为水稻抗性和粒型研究提供重要的遗传资源。
4 结论
通过对水稻突变体的表型观察与生理生化分析, 发现基因会导致植株的叶片出现斑点及黄化的表型, 使得水稻叶片中存在大量细胞死亡, ROS积累; 水稻中的叶绿素含量也显著下降, 对白叶枯病的抗性减弱。基因位于水稻9号染色体, 是编码一种去泛素化酶基因的新的等位基因, 其是在第一个外显子中插入了一段长度为654 bp的序列, 导致蛋白质翻译提前终止, 造成水稻植株出现红褐色病斑, 抗病性减弱及种子粒厚增加等表型, 这为后续揭示水稻的抗病机制以及培育高抗优质水稻奠定基础。
[1] Dietrich R A, Richberg M H, Schmidt R, Dean C, Dangl J L. A novel zinc finger protein is encoded by thegene and functions as a negative regulator of plant cell death., 1997; 88: 685–694.
[2] Gray J, Close P S, Briggs S P, Johal G S. A novel suppressor of cell death in plants encoded by thegene of maize., 1997, 89: 25–31.
[3] Büschges R, Hollricher K, Panstruga R, Simons G, Wolter M, Friiters A, van Daelen R, van der Lee T, Dierggaarda P, Groenendijk J, Töpsch S, Vos P, Salamini F, Schulze-Lefert P. The barleygene: a novel control element of plant pathogen resistance., 1997, 88: 695–705.
[4] Yamanouchi U, Yano M, Lin H, Askikari M, Yamada K. A rice spotted leaf gene,, encodes a heat stress transcription factor protein., 2002, 99: 7530–7535.
[5] Ma H G, Li J, Ma L, Wang P, Xue Y, Yin P, Xiao J H, Wang S P. Pathogen-inducible OsMPKK10.2-OsMPK6 cascade phosphorylates the Raf-like kinase OsEDR1 and inhibits its scaffold function to promote rice disease resistance., 2021, 14: 620–632.
[6] Yuan Y X, Zhong S H, Li Q, Zhu Z R, Lou Y G, Wang L Y, Wang J J, Wang M Y, Li Q L, Yang D L, He Z H. Functional analysis of rice NPR1-like genes reveals that OsNPR1/NH1 is the rice orthologue conferring disease resistance with enhanced herbivore susceptibility., 2007, 5: 313–324.
[7] Tong X H, Qi J F, Zhu X D, Mao B Z, Zeng L J, Wang B H, Li Q, Zhou G X, Xu X J, Lou Y G, He Z H. The rice hydroperoxide lyase OsHPL3 functions in defense responses by modulating the oxylipin pathway., 2012, 71: 763–775.
[8] Wang Z H, Wang Y, Hong X, Hu D H, Liu C X, Yang J, Li Y, Hung Y Q, Feng Y Q, Gong H Y, Li Y, Fang G, Tang H R, Li Y S. Functional inactivation of UDP-N-acetylglucosamine pyrophosphorylase 1 (UAP1) induces early leaf senescence and defence responses in rice., 2015, 66: 973–987.
[9] Wang J C, Liu X, Zhang A, Ren Y L, Wu F Q, Wang G, Xu Y, Lei C L, Zhu S S, Pan T, Wang Y F, Zhang H, Wang F, Tan Y Q, Wang Y P, Jin X, Luo S, Zhou C L, Zhang X, Liu J L, Wang S, Meng L Z, Wang Y H, Chen X, Lin Q B, Zhang X, Guo X P, Cheng Z J, Wang J L, Tian Y L, Liu S J, Jiang L, Wu C Y, Wang E T, Zhou J M, Wang Y F, Wang H Y, Wan J M. A cyclic nucleotide-gated channel mediates cytoplasmic calcium elevation and disease resistance in rice., 2019, 29: 820–831.
[10] Zhang Y, Liu Q, Zhang Y X, Chen Y Y, Yu N, Cao Y R, Zhan X D, Cheng S H, Cao L Y. LMM24 encodes receptor-like cytoplasmic kinase 109, which regulates cell death and defense responses in rice., 2019, 20: 3243.
[11] Wang L J, Pei Z Y, Tian Y C, He C Z. OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation., 2005, 18: 375–384.
[12] Wang S H, Lim J H, Kim S S, Cjo S H, Yoo S C, Koh H J, Sakuraba Y, Paek N C. Mutation of SPOTTED LEAF3 (SPL3) impairs abscisic acid-responsive signalling and delays leaf senescence in rice., 2015, 66: 7045–7059.
[13] Liu J, Park C H, He F, Nagano M, Wang M, Bellizzi M, Zhang K, Zeng X S, Liu W, Ning Y, Kawano Y, Wang G L. The RhoGAP SPIN6 associates with SPL11 and OsRac1 and negatively regulates programmed cell death and innate immunity in rice., 2015, 11: e1004629.
[14] Mori M, Tomita C, Sugimoto K, Hasegawa M, Hayashi N, Dubouzet J G, Ochiai H, Sekimoto H, Hirochika H, Kikuchi S. Isolation and molecular characterization of a Spotted leaf 18 mutant by modified activation-tagging in rice., 2007, 63: 847–860.
[15] Jiang C J, Shimono M, Maeda S, Inoue H, Mori M, Haegawa M, Sugano S, Takatsuji H. Suppression of the rice fatty-acid desaturase gene OsSSI2 enhances resistance to blast and leaf blight diseases in rice., 2009, 22: 820–829.
[16] You Q Y, Zhai K R, Yang D L, Yang W B, Wu J N, Liu J Z, Pan W B, Wang J J, Zhu X D, Jian Y K, Liu J Y, Zhang Y Y, Deng Y W, Li Q, Lou Y G, Xie Q, He Z H. An E3 Ubiquitin ligase-BAG protein module controls plant innate immunity and broad- spectrum disease resistance., 2016, 20: 758–769.
[17] Koji K, Yaeno T, Kusumi K, Mstsumura H, Fujisawa S, Terauchi R, Iba K. Regulatory mechanisms of ROI generation are affected by rice spl mutations., 2006, 47: 1035–1044.
[18] 王小虎. 水稻类病变早衰基因和的克隆与功能研究. 扬州大学博士学位论文, 江苏扬州, 2018. Wang X H. Map-based Cloning and Function Analysis of Two Lesion Mimic and Early Senescence Geneandin Rice. PhD Dissertation of Yangzhou University, Yangzhou, Jiangsu, China, 2018 (in Chinese with English abstract).
[19] Jiang J, Yang G Z, Xin Y F, Wang Z G, Yan W, Chen Z F, Tang X Y, Xia J X. Overexpression of OsMed16 inhibits the growth of rice and causes spontaneous cell death., 2021, 12: 656.
[20] Cui Y J, Peng Y L, Zhang Q, Xia S S, Ruan B P, Xu Q K, Yu X Q, Zhou T T, Liu H, Zeng D, Zhang G H, Gao Z Y, Hu J, Zhu L, Shen L, Guo L B, Qian Q, Ren D Y. Disruption of EARLY LESION LEAF 1, encoding a cytochrome P450 monooxygenase, induces ROS accumulation and cell death in rice., 2021, 105: 942–956.
[21] Ma J, Wang Y F, Ma X D, Meng L Z, Jing R N, Wang F, Wang S, Cheng Z J, Zhang X, Jiang L, Wang J L, Wang J, Zhao Z C, Guo X P, Lin Q B, Wu F Q, Zhu S S, Wu C Y, Ren Y L, Lei C L, Zhai H Q, Wan J M. Disruption of gene SPL35, encoding a novel CUE domain-containing protein, leads to cell death and enhanced disease response in rice., 2019, 17: 1679–1693.
[22] Hu H T, Ren D Y, Hu J, Jiang H Z, Chen P, Zeng D L, Qian Q, Guo L B. WHITE AND LESION-MIMIC LEAF1, encoding a lumazine synthase, affects reactive oxygen species balance and chloroplast development in rice., 2021, 108: 1690–1703.
[23] Chen X F, Hao L, Pan J W, Zheng X X, Jiang G H, Jin Y, Gu Z M, Qian Q, Zhai W X, Ma B J. SPL5, a cell death and defense- related gene, encodes a putative splicing factor 3b subunit 3 (SF3b3) in rice., 2012, 30: 939–949.
[24] 刘林, 张迎信, 李枝, 刘群恩, 余宁, 孙滨, 杨正福, 周全, 程式华, 曹立勇. 水稻类病变突变体的鉴定和基因定位. 中国水稻科学, 2014, 28: 465–472.Liu L, Zhang Y X, Li Z, Liu Q E, Yu N, Sun B, Yang Z F, Zhou Q, Cheng S H, Cao L Y. Characterization and gene mapping of a lesion mimic mutantin rice., 2014, 28: 465–472 (in Chinese with English abstract).
[25] Kumar D, Yusuf M A, Singh P, Sardar M, Sarin N B. Histochemical detection of superoxide and H2O2accumulation inseedlings., 2014, 4: e11108.
[26] Christensen T H, Zhang Z G, Wei Y D, Collonge D B. Subcellular localization of H2O2in plants. H2O2accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction., 1997, 11: 1187–1194.
[27] Kauffman H E, Reddy A, Hsieh S, Merca S D. Improved technique for evaluating resistance of rice varieties to., 1973, 57: 537–541.
[28] 陈析丰, 刘亚萍, 马伯军. 图位克隆技术新型遗传学实验教学项目的设计与实践. 植物学报, 2019, 54: 797–803. Chen X F, Liu Y P, Ma B J. Design and practice of a new teaching project of the map-based cloning., 2019, 54: 797–803 (in Chinese with English abstract).
[29] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4325.
[30] International Rice Genome Sequencing Project. The map-based sequence of the rice genome., 200, 436: 793–800.
[31] Kumar S, Stecher G, Tamura K. MEGA 7: molecular evolutionary genetics analysis version 7.0 for bigger datasets., 2016, 33: 1870–1874.
[32] Smith P K, Krohn R I, Hermanson G T, Mallia A K, Gartner F H, Provenzano M D, Fujimoto E K, Goeke N M, Olson B J, Klenk D C. Measurement of protein using bicinchoninic acid., 1985, 150: 76–85.
[33] Urrutia M, Blein-Nicolas M, Prigent S, Deborde C, Balliau T, Maucourt M, Jacob D, Ballias P, Benard C, Sellier H, Gibon Y, Giauffret C, Zivy M, Moing A. Maize metabolome and proteome responses to controlled cold stress partly mimic early sowing effects in the field and differ from those of., 2021, 44: 1504–1521.
[34] Sun J, Song W, Chang Y, Wang Y, Lu T, Zhang Z. OsLMP1, encoding a deubiquitinate, regulates the immune response in rice., 2022, 12: 814465.
[35] 张长波, 孙红霞, 巩中军, 祝增荣. 植物萜类化合物的天然合成途径及其相关合酶. 植物生理学通讯, 2007, 43: 779–786. Zhang C B, Sun H X, Gong Z J, Zhu Z R. Plant terpenoid natural metabolism pathways and their synthases., 2007, 43: 779–786 (in Chinese with English abstract).
[36] Umate P. Genome-wide analysis of thioredoxin fold superfamily peroxiredoxins inand rice., 2010, 5: 1543–1546.
[37] Addlesee H A, Hunter C N.possesses a variant of thegene, encoding geranylgeranyl-bacteriopheophytin reductase., 2002, 184: 1578–1586.
[38] Zhang C, Zhang W, Ren G, Li D, Cahoon R E, Chen M, Zhou Y, Yu B, Cahoon E B. Chlorophyll synthase under epigenetic surveillance is critical for vitamin E synthesis, and altered expression affects tocopherol levels in., 2015, 168: 1503–1511.
[39] Marla S S, Singh V K. LOX genes in blast fungus () resistance in rice., 2012, 12: 265–275.
[40] 何晓玲, 刘鹏程, 马伯军, 陈析丰. 基于CRISPR/Cas9的基因编辑技术研究进展及其在植物中的应用. 植物学报, 2022, 57: 208–531.He X L, Liu P C, Ma B J, Chen X F. Advance in gene-editing technology based on CRISPR/Cas9 and its application in plants., 2022, 57: 508–531 (in Chinese with English abstract).
[41] Li Z, Ding B, Zhou X, Wang G L. The rice dynamin-related protein osdrp1e negatively regulates programmed cell death by controlling the release of cytochrome C from mitochondria., 2017,13: e1006157.
[42] Zheng Y, Zhu Y, Mao X, Jiang M, Wei Y, Lian L, Xu H, Chen L, Xie H, Lu G, Zhang J. SDR7-6, a short-chain alcohol dehydrogenase/reductase family protein, regulates light-dependent cell death and defence responses in rice., 2022, 23: 78–91.
[43] Rao Y C, Jiao R, Wang S, Wu X M, Ye H F, Pan C Y, Li S F, Xin D D, Zhou W Y, Dai G X, Hu J, Ren D Y, Wang Y X. SPL36 encodes a receptor-like protein kinase that regulates programmed cell death and defense responses in rice., 2021, 14: 34.
[44] Lee D, Lee G, Kim B, Jang S, Lee Y, Yu Y, Seo J, Kim S, Lee Y H, Lee J, Kim S, Koh H J. Identification of agene involved in early senescence and defense response in rice., 2018, 9: 1274.
[45] Huang K, Wang D, Duan P, Zhang B, Xu R, Li N, Li Y. WIDE AND THICK GRAIN 1, which encodes an otubain-like protease with deubiquitination activity, influences grain size and shape in rice., 2017, 91: 849–860.
[46] Shi C, Ren Y, Liu L, Wang F, Zhang H, Tian P, Pan T, Wang Y, Jing R, Liu T, Wu F, Lin Q, Lei C, Zhang X, Zhu S, Guo X, Wang J, Zhao Z, Wang J, Zhai H, Cheng Z, Wan J. Ubiquitin specific protease 15 has an important role in regulating grain width and size in rice., 2019, 180: 381–391.
[47] Chen Y, Yan Y, Wu T T, Zhang G L, Yin H, Chen W, Wang S, Chang F, Gou J Y. Cloning of wheatreveals a role of jasmonic acid in grain weight determination., 2020, 11: 6266.
Phenotypic identification and disease resistance mechanism analysis of rice lesion mutant
YU Yao1, WANG Zi-Yao1, ZHOU Si-Rui1, LIU Peng-Cheng1, YE Ya-Feng2, MA Bo-Jun1, LIU Bin-Mei2,*, and CHEN Xi-Feng1,*
1College of Life Science, Zhejiang Normal University, Jinhua 321004, Zhejiang, China;2Hefei Institutes of Physical Science, Chinese Academy of Science, Hefei 230031, Anhui, China
Lesion mimic mutants are important genetic materials for studying molecular mechanisms of plant cell death and disease resistance. Through radiation mutagenesis of arice cultivar ‘Wuyunjing 7’, a rare lesion mimic and disease-susceptible mutantwas obtained. Compared to the wild type, the leaves of this mutant spontaneously appeared reddish-brown spots, and its plant height, panicle length, number of grains per panicle, and yield per plant decreased, but the weight of 1000-grain increased. In addition, the resistance ofto rice bacterial blight decreased significantly, and tissue staining showed significant cell death and excessive accumulation of reactive oxygen species in the mutant leaves. Genetic analysis showed that the phenotype of themutant was controlled by a single recessive nuclear gene, and thegene was finely located between two molecular markers, Indel7 and Indel8, on chromosome 9 of rice with a physical distance of 62 kb. PCR amplification and sequencing of candidate genes in the localization interval showed that a 654 bp sequence was inserted into the first exon of the() gene, which encodes a ubiquitin carboxyl-terminal hydrolase, resulting in premature termination of protein translation. The protein compositions ofmutants and WT controls were analyzed by a proteomics technology, which identified a total of 19 differentially accumulated proteins (7 upregulated and 12 down-regulated), mainly involved in redox, chlorophyll synthesis, photosynthesis, and other metabolic pathways. The above results provide a reference for further research on the function of thegene and its molecular mechanism of regulating programmed cell death and disease resistance.
rice; lesion mimic;; gene mapping; proteomic analysis
10.3724/SP.J.1006.2024.32010
本研究由国家自然科学基金项目(32071987, 32101697)和浙江省自然科学基金项目(LQ22C130005, LZ23C130004)资助。
This study was supported by the National Natural Science Foundation of China (32071987, 32101697) and the Natural Science Foundation of Zhejiang Province (LQ22C130005, LZ23C130004).
刘斌美, E-mail: liubm@ipp.ac.cnl; 陈析丰, E-mail: xfchen@zjnu.cn;
E-mail: 2315318441@qq.com
2023-03-27;
2023-10-23;
2023-11-23.
URL: https://link.cnki.net/urlid/11.1809.S.20231122.1419.002
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

