乌头碱调节C-C基序趋化因子配体2/C-C基序趋化因子受体2信号通路对膀胱癌细胞抗肿瘤活性及其作用机制研究
任慧云,冯一伟,许培英
作者单位:上海中医药大学附属龙华医院药学部,上海200032
膀胱癌预后不理想,严重威胁病人身心健康[1-3]。C-C基序趋化因子配体2(CCL2)/C-C基序趋化因子受体2(CCR2)是调控小胶质细胞、巨噬细胞等细胞极化的重要信号,与癌细胞生长及转移关系密切,在各种癌症类型中高表达,抑制CCL2/CCR2信号具有很好的抗肿瘤功效,并可增强抗PD-1治疗效果[4],可通过减轻小胶质细胞M2极化而抑制胶质母细胞瘤生长,进而提高胶质母细胞瘤病人的放疗疗效[5],还可通过抑制肿瘤相关巨噬细胞M2极化而减轻膀胱癌细胞的侵袭转移[6],因而CCL2/CCR2可作为治疗膀胱癌的潜在靶点。乌头碱是一种有剧毒的双酯类生物碱,可消炎镇痛、减轻癌痛,能呈浓度及时间依赖性地抑制胃腺癌细胞存活及克隆形成[7],提高小细胞肺癌对顺铂的敏感性[8],还可明显抑制前列腺癌细胞增殖、侵袭并诱导其凋亡[9],但乌头碱是否可通过下调CCL2/CCR2信号通路对膀胱癌细胞发挥抗肿瘤活性,目前并不清楚,2021年12月至2022年10月进行本研究,以不同剂量乌头碱处理体外培养的人膀胱癌细胞系5637,对此课题进行探究。
1 材料与方法
1.1 试剂与仪器 人膀胱癌细胞系5637(货号ZQ0114)、RPMI-1640完全培养基(含10%胎牛血清、1%双抗,货号A0611)、RPMI-1640基础培养基(货号ZQ-200)购自上海中乔新舟生物科技有限公司;空载质粒、CCL2过表达质粒购自苏州吉玛生物科技有限公司;乌头碱(纯度>98%,货号ZQ-201)购自北京北纳创联生物技术研究院;结晶紫染色液(货号G1062)购自北京索莱宝科技有限公司;细胞计数试剂盒(CCK-8,货号ab228554)、Hoechst 33258染色溶液(货号ab228550)、辣根过氧化物酶(HRP)标记驴抗兔IgG二抗(货号ab6802)、兔抗人锌指E盒结合同源盒1(ZEB1)一抗(货号ab203829)购自美国Abcam公司;一步法反转录实时荧光定量PCR(qRT-PCR)试剂盒(货号D7277M)、兔抗人紧密连接蛋白1(ZO-1)一抗(货号AF8394)、5-乙炔基-2'-脱氧尿苷(5-Ethynyl-2'- deoxyuridine,Edu)-488细胞增殖检测试剂盒(货号C0071S)、兔抗人上皮钙黏素(E-cadherin)一抗(货号AF6759)、兔抗人CCR2一抗(货号AF2359)、兔源抗人神经钙黏素(N-cadherin)一抗(货号AF0243)、兔抗人CCL2一抗(货号AF7437)、兔抗人甘油醛-3-磷酸脱氢酶(GAPDH)一抗(货号AF1186)、小鼠抗人Anti-BCL2相关X蛋白(Bax)抗体(货号AF0054)、兔抗人Anti-B淋巴细胞瘤-2(Bcl-2)抗体(货号AF6285)、免疫荧光染色试剂盒-抗小鼠荧光素异硫氰酸酯(FITC)(货号P0196)、免疫荧光染色试剂盒-抗兔Cy3(货号P0183)均购自上海碧云天生物技术有限公司等。
全自动酶标仪(型号Varioskan LUX)、生物光学显微镜(型号Nicolet™ iN™ 5 FTIR)、倒置荧光显微镜(型号EVOS™ M7000)均购自赛默飞世尔科技中国有限公司;蛋白湿式转膜仪(型号为E-Blotter)、双稳定时通用型高电流电泳仪电源(型号ELITE HC 2.0)、垂直蛋白电泳仪(型号为V-GES)均购自北京好亿科技发展有限公司等。
1.2 方法
1.2.1 筛选合适的乌头碱作用浓度 将人膀胱癌细胞系5637快速解冻复苏后以RPMI-1640完全培养基进行培养,细胞长满瓶底后胰酶消化,传代后以每孔1×104个细胞的密度接种在96孔板中培养,36 h后分别以0、2.5、5.0、10.0、20.0、30.0 µmol/L乌头碱处理[9],以0 µmol/L乌头碱处理细胞做对照组,未接种细胞的培养孔做空白对照组,采用CCK-8试剂盒按照其说明书中方法测出各组细胞吸光度后算出其细胞存活率,公式为:细胞存活率(%)=[药物处理组D(λ)-空白对照组D(λ)]/[对照组D(λ)-空白对照组D(λ)]×100%,根据各乌头碱处理后的细胞存活率来筛选出其合适的作用浓度。
1.2.2 分组处理5637细胞后收集标本 将5637细胞传代后以每孔2×105个细胞的密度接种在24孔板中培养36 h后,分为对照组、乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组、乌头碱高剂量+CCL2过表达组,对照组细胞不处理,乌头碱低剂量组、乌头碱高剂量组细胞分别以10.0、20.0 µmol/L乌头碱处理,乌头碱高剂量+空载组以20.0 µmol/L乌头碱处理同时采用脂质体2000转染空载质粒,乌头碱高剂量+CCL2过表达组以20.0 µmol/L乌头碱处理同时采用脂质体2000转染CCL2过表达质粒,各组均处理24 h后收集其细胞沉淀,重复6次,得到6份样品。
1.2.3 蛋白质印迹法检测各组5637细胞CCL2/CCR2 信号通路相关蛋白表达 取出“1.2.2”中的各组细胞与高效RIPA裂解液混匀,于冰水浴中裂解后离心,采用BCA法测出上清中总蛋白浓度后,煮沸变性蛋白后每组取出15 µg,跑电泳后做全湿电转,以3%牛血清白蛋白封闭膜上蛋白后将其中CCL2、CCR2、GAPDH截下,分别孵育相对应一抗、二抗后洗膜,化学发光法对各组目的蛋白显色后摄片,采用Image Pro Plus软件分析所得图片并定量各组CCL2、CCR2蛋白条带灰度值,最终得到其相对表达。
1.2.4 CCK-8法、Edu染色法及Hoechst 33258染色分别检测各组5637细胞存活率、增殖率、凋亡率CCK-8法:将5637细胞传代后以每孔1×104个细胞的密度接种在96孔板中培养,36 h后按照“1.2.2”中方法分组处理24 h,采用CCK-8试剂盒测出各组细胞存活率,具体见“1.2.1”。
Edu染色法:将5637细胞传代后以每孔2×105个细胞的密度接种在24孔板中培养,36 h后按照“1.2.2”中方法分组处理24 h,加入Edu试剂孵育3 h后PBS漂洗、4%多聚甲醛固定后采用荧光显微镜观察各组细胞形态并摄片,增殖细胞为Edu阳性细胞呈明亮绿色,采用Image Pro Plus软件分析所得图片并定量各组增殖细胞及总细胞数目,算出各组细胞增殖率,公式为:增殖率=增殖细胞数目/总细胞数目×100%。
Hoechst 33258染色:将5637细胞传代后以每孔2×105个细胞的密度接种在24孔板中培养,36 h后按照“1.2.2”中方法分组处理24 h,PBS漂洗、4%多聚甲醛固定、Hoechst 33258染色溶液染色、PBS漂洗后采用荧光显微镜观察各组细胞形态并摄片,凋亡细胞呈明亮蓝色且细胞核固缩破碎,正常细胞呈微弱蓝色且细胞核圆润,采用Image Pro Plus软件分析所得图片并定量各组凋亡细胞及总细胞数目,算出各组细胞凋亡率,公式为:凋亡率=凋亡细胞数目/总细胞数目×100%。
1.2.5 Transwell实验及划痕实验分别检测各组5637细胞侵袭数、迁移率 Transwell实验:将5637细胞传代后以每孔2×105个细胞的密度接种在经基底胶包被过的24孔Transwell培养板上室中,以不含胎牛血清的RPMI-1640基础培养基培养,36 h后按照“1.2.2”中方法分组处理24 h后于下室内加入含胎牛血清的RPMI-1640完全培养基,继续培养24 h后将上室细胞擦除,PBS漂洗、4%多聚甲醛固定、结晶紫染色液染色、PBS漂洗下室细胞后采用荧光显微镜观察各组细胞并摄片,采用Image Pro Plus软件分析所得图片并定量各组细胞数目作为细胞侵袭数。
划痕实验:将5637细胞传代后以每孔2×105个细胞的密度接种在24孔板中培养,36 h后按照“1.2.2”中方法分组处理24 h,使用1 mL枪头在每个细胞培养孔中央划一直线,以PBS将划痕内细胞洗去,于生物光学显微镜下观察各组细胞并摄片,采用Image Pro Plus软件分析所得图片并定量各组细胞划痕宽度(记为L0h),继续培养24 h后再次观察各组细胞并摄片、定量各组细胞划痕宽度(记为L24h),算出各组细胞迁移率,公式为:迁移率=(L0h-L24h)/L0h×100%。
1.2.6 免疫荧光染色检测各组细胞凋亡相关蛋白Bax和Bcl-2表达比值(Bax/Bcl-2) 取传代5637细胞接种在24孔培养板中培养,每个培养孔约含1×105个细胞,2 d后依照“1.2.2”中步骤分组并进行转染,24 h后吸出培养基后漂洗、固定、5%牛血清白蛋白封闭、小鼠抗人Anti-Bax抗体和兔抗人Anti-Bcl-2抗体孵育、漂洗、Alexa Fluor 488偶联抗小鼠二抗及Alexa Fluor 555偶联抗兔二抗孵育、漂洗细胞,依照免疫荧光染色试剂盒说明书指导步骤做DAPI染色后漂洗,使用研究级正置荧光显微镜观察各组Bax(绿色荧光)和Bcl-2表达(红色荧光)情况并摄取图像,通过Image J软件定量各组细胞红色、绿色平均荧光强度后算出Bax/Bcl-2,公式为:Bax/Bcl-2=绿色平均荧光强度/红色平均荧光强度。
1.2.7 免疫印迹法检测各组5637细胞上皮间质转化标志蛋白(N-cadherin、ZEB1、ZO-1、E-cadherin)表达 取出“1.2.3”中剩余的各组细胞蛋白样品液,采用免疫印迹法检测其中各组N-cadherin、ZEB1、ZO-1、E-cadherin相对表达,具体方法见“1.2.3”。
1.3 统计学方法 本研究数据以统计SPSS 26.0软件进行统计学分析,并作为计量资料以进行描述,且符合正态分布。采用单因素方差分析进行多组间差异比较,组间两两进一步差异比较进行SNK-q检验,P<0.05表示差异有统计学意义。
2 结果
2.1 不同浓度乌头碱对5637细胞存活率的影响0、2.5、5.0、10.0、20.0、30.0 µmol/L浓度的乌头碱处理时5637细胞存活率分别为(100.00±0.00)%、(85.01±10.26)%、(71.87±8.85)%、(59.22±7.12)%、(39.54±5.69)%、(35.85±5.52)%。2.5、5.0、10.0、20.0、30.0µmol/L浓度的乌头碱均可降低5637细胞存活率(P分别为0.010,<0.001,<0.001,<0.001,<0.001),且其降低作用随乌头碱浓度的升高而增强,选择IC50值附近的10.0、20.0 µmol/L的乌头碱进行后续实验。
2.2 各组5637细胞CCL2/CCR2信号通路相关蛋白表达检测结果 与对照组相比,乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组细胞CCL2、CCR2蛋白表达均降低(均P<0.001),乌头碱高剂量组、乌头碱高剂量+空载组细胞CCL2、CCR2蛋白表达相比乌头碱低剂量组进一步降低(均P<0.001);与乌头碱高剂量组相比,乌头碱高剂量+CCL2过表达组细胞CCL2、CCR2蛋白表达升高(均P<0.001),乌头碱高剂量+空载组细胞CCL2、CCR2蛋白表达差异无统计学意义(均P>0.999)。见图1,表1。
表1 各组5637细胞CCL2、CCR2蛋白相对表达水平/
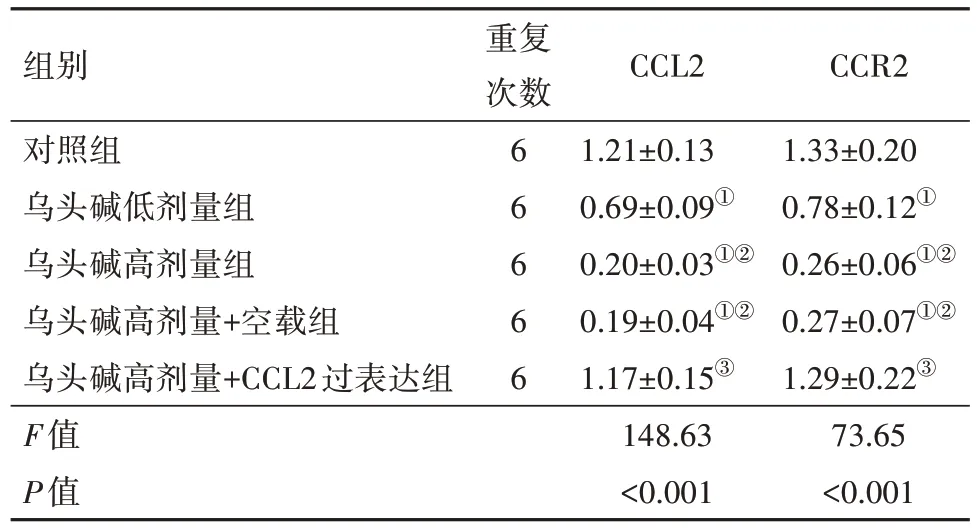
表1 各组5637细胞CCL2、CCR2蛋白相对表达水平/
注:CCL2为C-C基序趋化因子配体2,CCR2为C-C基序趋化因子受体2。①与对照组相比,P<0.05。②与乌头碱低剂量组相比,P<0.001。③与乌头碱高剂量组相比,P<0.05。
CCR2 1.33±0.20 0.78±0.12①0.26±0.06①②0.27±0.07①②1.29±0.22③73.65<0.001组别对照组乌头碱低剂量组乌头碱高剂量组乌头碱高剂量+空载组乌头碱高剂量+CCL2过表达组F值P值重复次数6 6 6 6 6 CCL2 1.21±0.13 0.69±0.09①0.20±0.03①②0.19±0.04①②1.17±0.15③148.63<0.001

图1 免疫印迹法检测各组5637细胞CCL2/CCR2信号通路相关蛋白表达
2.3 各组5637细胞增殖、凋亡检测结果 与对照组相比,乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组细胞存活率、增殖率均降低(均P<0.001),凋亡率均升高(均P<0.001);乌头碱高剂量组、乌头碱高剂量+空载组细胞存活率、增殖率相比乌头碱低剂量组进一步降低(均P<0.001),凋亡率进一步升高(均P<0.001)。与乌头碱高剂量组相比,乌头碱高剂量+CCL2过表达组细胞存活率、增殖率升高(均P<0.001),凋亡率降低(P<0.001);乌头碱高剂量+空载组细胞存活率、增殖率与凋亡率差异无统计学意义(存活率、凋亡率:P>0.999;增殖率:P=0.997)。见图2,3;表2。
表2 各组5637细胞存活率、增殖率与凋亡率/(%,)
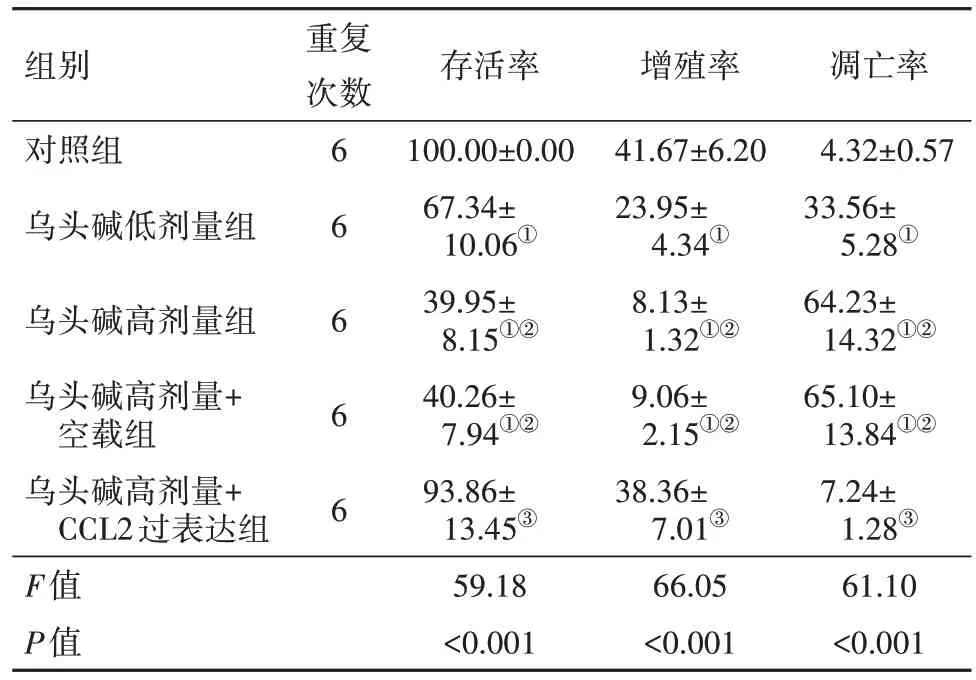
表2 各组5637细胞存活率、增殖率与凋亡率/(%,)
注:CCL2为C-C基序趋化因子配体2。①与对照组相比,P<0.05。②与乌头碱低剂量组相比,P<0.001。③与乌头碱高剂量组相比,P<0.05。
凋亡率4.32±0.57 33.56±5.28①64.23±14.32①②65.10±13.84①②7.24±1.28③61.10<0.001组别对照组乌头碱低剂量组重复次数乌头碱高剂量组乌头碱高剂量+空载组乌头碱高剂量+CCL2过表达组F值P值6 6 6 6 6存活率100.00±0.00 67.34±10.06①39.95±8.15①②40.26±7.94①②93.86±13.45③59.18<0.001增殖率41.67±6.20 23.95±4.34①8.13±1.32①②9.06±2.15①②38.36±7.01③66.05<0.001

图2 Edu染色检测各组5637细胞增殖(×200)

图3 Hoechst 33258染色检测各组5637细胞凋亡(×400)
2.4 各组5637细胞侵袭、迁移检测结果 与对照组相比,乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组细胞侵袭数、迁移率均降低(均P<0.001),乌头碱高剂量组、乌头碱高剂量+空载组细胞侵袭数、迁移率相比乌头碱低剂量组进一步降低(均P<0.001);与乌头碱高剂量组相比,乌头碱高剂量+CCL2过表达组细胞侵袭数、迁移率升高(均P<0.001),乌头碱高剂量+空载组细胞侵袭数、迁移率差异无统计学意义(均P>0.999)。见图4,5;表3。
表3 各组5637细胞侵袭数、迁移率/
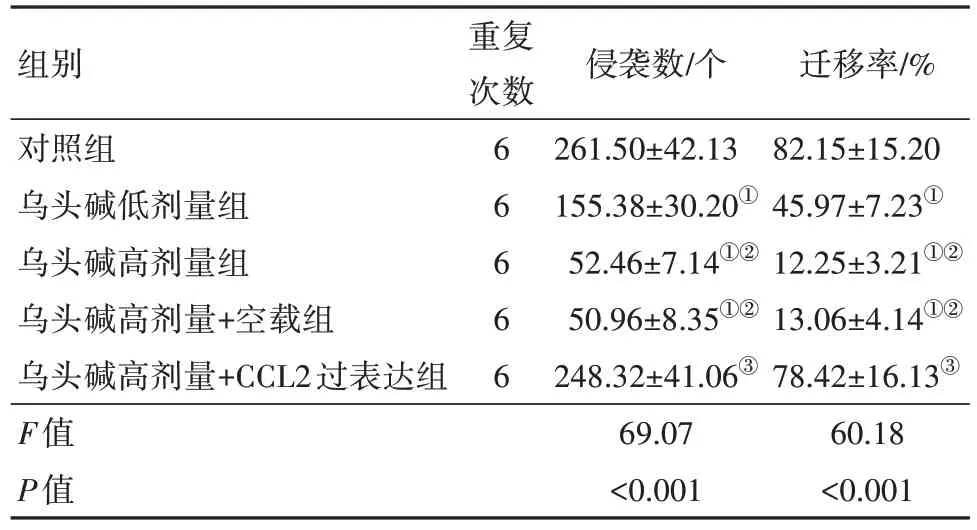
表3 各组5637细胞侵袭数、迁移率/
注:CCL2为C-C基序趋化因子配体2。①与对照组相比,P<0.05。②与乌头碱低剂量组相比,P<0.05。③与乌头碱高剂量组相比,P<0.05。
重复次数组别对照组乌头碱低剂量组乌头碱高剂量组乌头碱高剂量+空载组乌头碱高剂量+CCL2过表达组F值P值6 6 6 6 6侵袭数/个261.50±42.13 155.38±30.20①52.46±7.14①②50.96±8.35①②248.32±41.06③69.07<0.001迁移率/%82.15±15.20 45.97±7.23①12.25±3.21①②13.06±4.14①②78.42±16.13③60.18<0.001
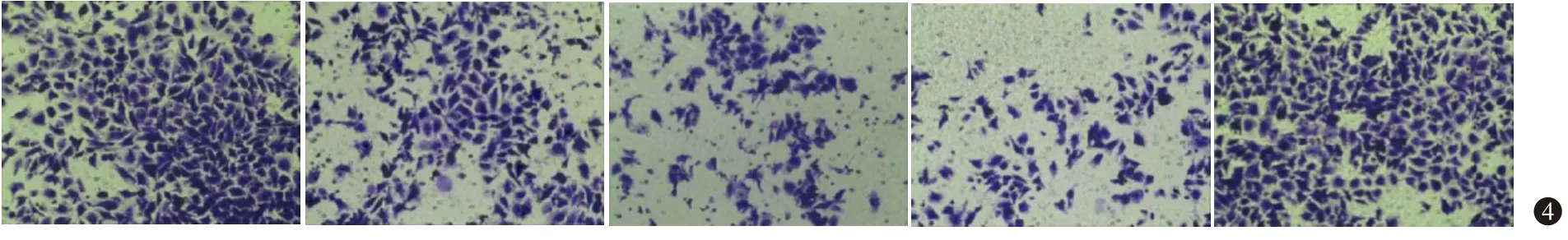
图4 Transwell实验检测各组5637细胞侵袭(×200)

图5 划痕实验检测各组5637细胞迁移(×200)
2.5 各组5637细胞凋亡相关蛋白表达检测结果对照组、乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组、乌头碱高剂量+CCL2过表达组Bax/Bcl-2分别为0.16±0.02、0.51±0.06、0.87±0.10、0.86±0.07、0.19±0.04,组间差异有统计学意义(F=174.40,P<0.001)。与对照组相比,乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组细胞Bax/Bcl-2均升高(均P<0.001),乌头碱高剂量组、乌头碱高剂量+空载组细胞Bax/Bcl-2相比乌头碱低剂量组进一步升高(均P<0.001);与乌头碱高剂量组相比,乌头碱高剂量+CCL2过表达组细胞Bax/Bcl-2降低(P<0.001),乌头碱高剂量+空载组细胞Bax/Bcl-2差异无统计学意义(P=0.999)。见图6。

图6 免疫荧光染色检测各组5637细胞Bcl-2 相关X蛋白(Bax,绿色)和B淋巴细胞瘤-2(Bcl-2,红色)表达(×200)
2.6 各组5637细胞上皮-间质转化标志蛋白表达检测结果 与对照组相比,乌头碱低剂量组、乌头碱高剂量组、乌头碱高剂量+空载组细胞N-cadherin、ZEB1蛋白表达均降低(均P<0.001),ZO-1、E-cadherin蛋白表达均升高(均P<0.001);乌头碱高剂量组、乌头碱高剂量+空载组细胞N-cadherin、ZEB1蛋白表达相比乌头碱低剂量组进一步降低(均P<0.001),ZO-1、E-cadherin蛋白表达进一步升高(均P<0.001)。与乌头碱高剂量组相比,乌头碱高剂量+CCL2过表达组细胞N-cadherin、ZEB1蛋白表达升高(N-cadherin:P<0.001;ZEB1:P=0.006),ZO-1、E-cadherin蛋白表达降低(均P<0.001);乌头碱高剂量+空载组细胞N-cadherin、ZEB1、ZO-1、E-cadherin蛋白表达差异无统计学意义(N-cadherin、ZEB1、ZO-1均P>0.999;E-cadherin:P=0.996)。见图7,表4。
表4 各组5637细胞上皮-间质转化标志蛋白相对表达水平/
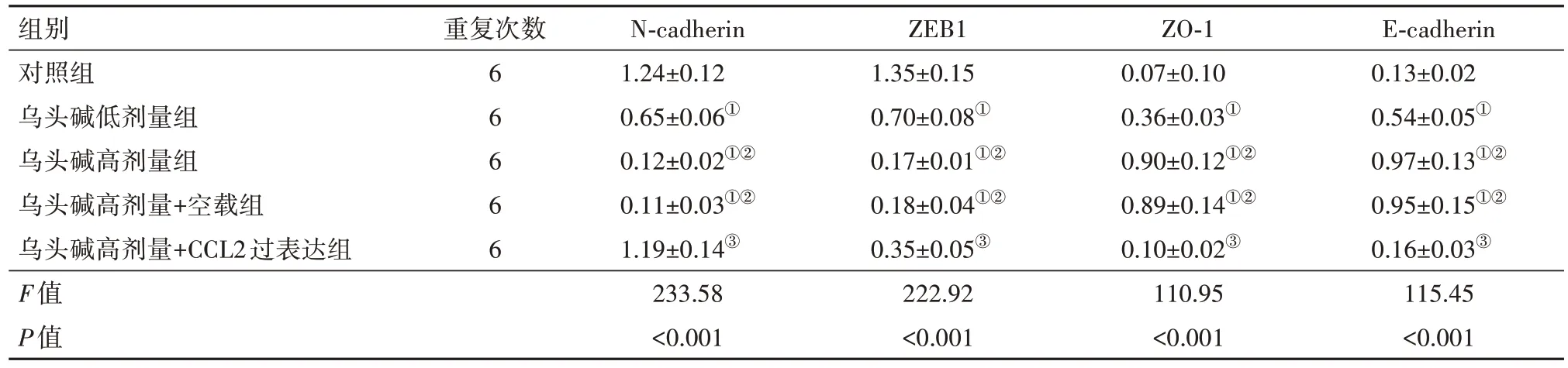
表4 各组5637细胞上皮-间质转化标志蛋白相对表达水平/
注:CCL2为C-C基序趋化因子配体2,N-cadherin为神经钙黏素,ZEB1为锌指E盒结合同源盒1,ZO-1为紧密连接蛋白1,E-cadherin为上皮钙黏素。①与对照组相比,P<0.05。②与乌头碱低剂量组相比,P<0.05。③与乌头碱高剂量组相比,P<0.05。
组别对照组乌头碱低剂量组乌头碱高剂量组乌头碱高剂量+空载组乌头碱高剂量+CCL2过表达组F值P值E-cadherin 0.13±0.02 0.54±0.05①0.97±0.13①②0.95±0.15①②0.16±0.03③115.45<0.001重复次数6 6 6 6 6 N-cadherin 1.24±0.12 0.65±0.06①0.12±0.02①②0.11±0.03①②1.19±0.14③233.58<0.001 ZEB1 1.35±0.15 0.70±0.08①0.17±0.01①②0.18±0.04①②0.35±0.05③222.92<0.001 ZO-1 0.07±0.10 0.36±0.03①0.90±0.12①②0.89±0.14①②0.10±0.02③110.95<0.001

图7 蛋白质印迹法检测各组5637细胞上皮-间质转化标志蛋白表达
3 讨论
膀胱癌的临床治疗以手术去除肿瘤组织为主,并辅以膀胱灌注、放疗、化疗等手段,可有效缓解膀胱癌进展,但对于发展到晚期及发生转移的病人疗效并不理想,因此寻找开发更有效的抗癌药物对于改善膀胱癌病人预后具有重大价值[10-11]。乌头碱是提取自中药乌头中的一种天然生物碱,可通过调控多条信号通路而发挥抗卵巢癌作用[12],能通过促进活性氧而增强骨肉瘤细胞凋亡[13],还可显著抑制食管癌细胞增殖、克隆形成、侵袭及促进其凋亡[14],具有明显的抗肿瘤作用。本研究以不同剂量乌头碱处理5637细胞,均可降低其存活率、增殖率并升高Bax/Bcl-2,表明乌头碱可增强促凋亡蛋白表达,抑制膀胱癌存活、增殖并诱导其凋亡;上皮-间质转化是癌细胞发生转移侵袭的关键生理过程,与膀胱癌恶性进展密切相关[15],ZO-1、E-cadherin是上皮标志物,N-cadherin、ZEB1和Vimentin是间充质标志物,在癌细胞的上皮-间质转化过程中起到重要调控作用[16-17]。
CCL2作为一种CC趋化因子家族的小分子量细胞因子,可招募调控单核细胞、记忆性T细胞和树突状细胞功能,在不同类型的癌症中起着关键作用,下调CCL2及其受体CCR2表达可通过减轻糖酵解而促进替莫唑胺诱导的胶质瘤细胞凋亡[18],减轻HER2阳性细胞的迁移[19],并可抑制免疫抑制巨噬细胞和髓源性抑制细胞募集到胰腺中,进而通过改善免疫抑制肿瘤微环境来阻止胰腺上皮内瘤变向胰腺导管腺癌的进展[20],最终起到明显抗肿瘤作用。本研究结果显示,以不同剂量乌头碱处理5637细胞,均可降低其CCL2、CCR2蛋白表达;以乌头碱处理5637细胞同时转染CCL2过表达质粒,相比乌头碱单独处理,可升高细胞CCL2、CCR2、N-cadherin与ZEB1蛋白表达、存活率、增殖率、侵袭数、迁移率,降低细胞Bax/Bcl-2、ZO-1与E-cadherin蛋白表达,揭示乌头碱抑制膀胱癌细胞增殖、迁移侵袭并促使其凋亡是通过下调CCL2实现的。
综上所述,乌头碱可通过降低CCL2及CCR2表达而抑制膀胱癌细胞上皮-间质转化,从而降低细胞增殖、迁移侵袭能力并促使其大量凋亡;最终起到显著抗肿瘤功效,抑制CCL2/CCR2 信号激活可能是其药理机制之一。本研究提供了乌头碱这一新型的膀胱癌治疗候选药物,有助于其临床开发应用及膀胱癌病人预后的改善。

