高活性天然酵母发酵剂的优化
赵佳佳 顾 尧 李 言 钱海峰 王 立
面包是世界范围内食用最广泛的主食之一[1]。诸多新型健康天然产品中,天然酵母有3 000多年的历史,其通常被定义为面粉、水和内源性微生物的发酵混合物[2]。乳酸菌和酵母菌是天然酵母微生物的两种主要类型,二者比例通常为100∶1[3]。用天然酵母制备的面包具有降低血糖指数[4],提高矿物质生物利用度[5]和降低麸质含量等作用。与普通面包相比,天然酵母面包含有更少的可发酵低聚糖、双糖、单糖和多元醇(FODMAP)[6],且含有更多的生物活性化合物,如γ-氨基丁酸和多酚类化合物[7]。
根据微生物发酵活性,天然酵母的应用形式可分为I型、II型和III型三大类。I型天然酵母是通过传统方法培养,主要为室温环境下的连续继代培养(间隔时间一般为8~24 h)。这种发酵方式可以保证内源微生物始终处于较活跃状态。同时,其微生物来源主要为环境、原料和水,这种发酵过程能够保持自身菌群处于较稳定的状态[8]。近年来,对微生物基因等方面的高通量研究方法愈发完善,使得对复杂菌群的研究更加深入,天然酵母就是其中一例,其样本通常同时含有1~2种酵母菌和数种乳酸菌。I型天然酵母在面包制备中有很好的产气效果(一般不额外添加商用即发酵母),且能够改善面包组织、增添风味和延长保质期。然而,天然酵母的微生物多样性使其品质差异巨大。I型天然酵母在使用中存在的主要问题为规模小、操作复杂、易污染、难以标准化等。生产中存在的不利因素促进了II型和III型天然酵母的产生[9]。
II型天然酵母是通过大型发酵装置实现大批量一次发酵,来实现更合理的批次化面包生产,其流程通常是持续发酵15~20 h或者发酵8 h后再投料扩大发酵一次,完成发酵后贮藏于相应容器中,再投入生产。因其一般维持一个较长的发酵阶段,内部微生物群通常处于代谢中后期,因此II型天然酵母一般表现出较高的酸度,在面包生产中更多地扮演酸化剂和风味添加剂的角色。为达到使用时仍有较好发酵活性的效果,II型天然酵母的菌种一般具有较好的耐酸性能,常见的酵母菌有酿酒酵母(Saccharomycescerevisiae),乳酸菌有:短乳杆菌(Levilactobacillusbrevis)、发酵乳杆菌(Limosilactobacillusfermentum)、植物乳杆菌(Lactiplantibacillusplantarum)、罗伊氏乳杆菌(Limosilactobacillusreuteri)和旧金山乳杆菌(Fructilactobacillussanfranciscensis)等[10]。由于II型天然酵母的酸度较强(一般pH低于3.5),生产过程中会影响最终产品的食用品质。同时,在批次化生产中,尽管II型天然酵母在同一批次的产品中效果较均一,但经过长时间使用后其批次间差异仍较为显著[11]。
为达到长时间的品质均一,研究者对稳定化的天然酵母发酵剂进行了相关研究,III型天然酵母就是其中最主要的产品形式。III型天然酵母是将培养完成的天然酵母通过不同的干燥手段制备成的粉末状发酵剂[12]。这种方式保留了天然酵母的风味特性,批次间生产的稳定性也得到提升。然而,因干燥工艺和菌种保护的缺陷导致发酵剂的发酵活性较差,生产中通常需要极大的投料量(超过面粉质量10%)。因此,根据发酵微生物的发酵活性、风味物质产出和温度敏感性选择合适的菌种是制备III型天然酵母的关键因素。其中异型发酵的短乳杆菌(L.brevis)、兼性异型发酵的戊糖片球菌(Pediococcuspentosaceus)和兼性异型发酵的植物乳杆菌(L.plantarum)具有较好的相应属性[13]。同时,针对在干燥过程中缺少适合的保护剂等问题,需进一步研究以优化天然酵母发酵剂,使其品质稳定、贮藏活性好、干燥存活率高。
研究拟对天然酵母进行分离鉴定,采用不同方案进行不同干燥工艺处理,分析保护剂对其存活率的影响,并进一步对存活率高的方案进行贮藏试验,以探究其实际应用价值,旨在为天然酵母面包产业化发展提供理论和技术指导。
1 材料与方法
1.1 材料、试剂与仪器
高筋小麦粉:益海嘉里金龙鱼粮油食品股份有限公司;
起酥油:艾迪科食品有限公司;
即发干酵母:乐斯福(明光)有限公司;
乳酸杆菌琼脂培养基(MRS):杭州百思生物技术有限公司;
水果、食用盐、蔗糖、海藻糖(HRE)、麦芽糊精(MD)、脱脂乳粉(SM)、乳清蛋白(WHEY):市售;
酵母浸出粉胨葡萄糖培养基(YPD)、片状NaOH、酚酞:国药集团药业股份有限公司;
酵母基因组DNA提取试剂盒、细菌基因组DNA提取试剂盒:上海碧云天生物技术有限公司;
引物:苏州金唯智生物科技有限公司;
真空冷冻干燥机:LGJ-10E型,四环福瑞科技有限公司;
喷雾干燥机:BUCHIB-290型,步崎实验室设备贸易有限公司;
电烤箱:WTNS36型,联合纬创机械有限公司;
醒发箱:JW-LD18SP型,联合纬创机械有限公司;
PCR仪:XP型,博日科技有限公司;
物性分析仪:TA.XTC-18型,保圣实业有限公司;
pH计:FE20型,梅特勒—托利多精密仪器有限公司;
霉菌培养箱:BMJ-400C型,博讯医疗生物有限公司。
1.2 试验方法
1.2.1 天然酵母及其面包制备
(1) 天然酵母的培养:参考虞桠芳[14]的方法并修改。将百香果、葡萄、橙子、梨洗净,擦干,切成2 cm×3 cm×3 cm块状。取400 g水果于玻璃发酵罐中,加入400 mL灭菌水,40 g蔗糖,保鲜膜封口后关闭罐口,室温下避光培养7 d。发酵完成后得到百香果天然酵母发酵液(pfs)、葡萄天然酵母发酵液(gs)、橙子天然酵母发酵液(os)和梨天然酵母发酵液(ps)。将发酵液和高筋面粉按质量比1∶1混匀,28 ℃发酵24 h,按相同比例添加等质量的灭菌水和面粉,再发酵24 h,并重复添加和发酵两次,最终得到天然酵母,分别命名为PFS、GS、OS和PS。
(2) 面包制作:将面包面团所需物料按表1配制好,向搅拌机内投入物料搅打成团。加入起酥油,搅打至表面光滑,获得面包面团。将面团正反两面于室温各静置醒发30 min,分割成150 g的面团并搓圆。静置松弛20 min,用擀面杖将面团擀整成型,放入模具中醒发,醒发温度为38 ℃,85%湿度,醒发时间50 min。放入烤箱烘烤,上火180 ℃,下火200 ℃,时间25 min。为控制发酵菌数量,进行了发酵剂添加量的平衡,即发干酵母一般的活菌数为1010CFU/g,天然酵母稳定后的总活菌数一般不超过5×108CFU/g,因此在配方上对其添加的发酵剂数量进行了控制。各天然酵母制备的面包分别命名为PFSB、GSB、OSB和PSB,空白面包样命名为CB。面包于室温静置6 h后取样测定或冻干备用。
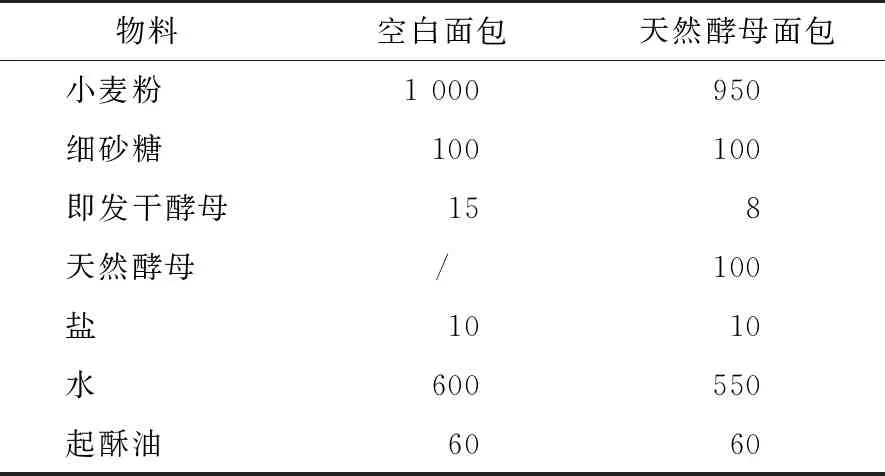
表1 面包配方†
1.2.2 菌群分离与鉴定 取部分天然酵母进行10倍梯度稀释至10-8。于适当的稀释梯度(通常为10-5,10-6,10-7)下取10 μL样品涂布于YPD和MRS平板进行培养。在菌落数量较合适的平板上挑取全部单菌落,放入相应液体培养基中进行扩大培养,取部分菌液按体积比1∶1加入60%甘油,混匀,于-80 ℃贮藏。
采用16s和ITS高通量基因测序对分离得到的菌种进行鉴定。用细菌基因组DNA提取试剂盒提取乳酸菌DNA,用酵母基因组DNA提取试剂盒提取酵母菌DNA,对比其吸光度值,并判断其纯度。进行PCR扩增试验,反应体系为50 μL,包括上游引物2 μL、下游引物2 μL、DNA模板2 μL、PCR扩增预混液25 μL和ddH2O 19 μL,其中PCR预混液包括DNA聚合酶、脱氧核苷酸、Mg2+等。扩增条件:95 ℃保持5 min,开始循环95 ℃保持20 s,55 ℃保持30 s,72 ℃保持1 min,重复33次,循环结束后72 ℃保持5 min,于4 ℃贮藏。乳酸菌所使用的上游扩增引物为27F:(5′-AGAGTTTGATCCTGGCTCAG-3′),下游扩增引物为1492R:(5′-CTACGGCTACCTTGTTACGA-3′),酵母菌所使用的上游扩增引物为ITS1:(5′-TCCGTAGGTGAACCTGCGG-3′),下游扩增引物为ITS4:(5′-TCCTCCGCTTATTGATATGC-3′)。取2.5 μL PCR产物进行1%的琼脂糖凝胶电泳,并使用化学凝胶成像系统进行成像拍照。将PCR产物寄送检测公司进行测序,并与已知菌种序列进行同源性对比。
1.2.3 发酵剂制备 将分离鉴定出的优势菌种进行扩大培养,按菌种分布比例混合后命名为天然酵母优势菌菌液,并加入保护剂,若不加保护剂则加入5%的小麦面粉作为载体。将天然酵母整体加入保护剂或不加保护剂作为干燥底料。两种干燥方式的菌落数控制在酵母菌107CFU/mL,乳酸菌109CFU/mL。冷冻干燥条件:底料混匀后于-80 ℃冷冻4~6 h,真空冷冻干燥,-20 ℃真空处理2~3 d。喷雾干燥工艺条件:干燥底料于40 ℃水浴10 min后进料,进出口温度135/75 ℃、进料速度1 mL/s。得到干燥后的发酵剂于4 ℃贮藏(不控制空气),按干燥后和贮藏时间取样进行活菌量测定。将天然酵母整体和优势菌菌液分别进行喷雾干燥和冷冻干燥处理,喷雾干燥天然酵母整体命名为SD-D,冷冻干燥天然酵母整体命名为FD-D,喷雾干燥优势菌菌液命名为SD-S,冷冻干燥优势菌菌液命名为FD-S。
保护剂试验中,经筛选得到麦芽糊精(MD)、海藻糖(TRE)、脱脂乳粉(SM)和分离乳清蛋白(WHEY)作为保护剂。在得到单保护剂最佳浓度后,排除分离乳清蛋白后,进行三因素三水平的正交试验分析最佳的复配保护剂。
1.2.4 pH值测定 采用pH计。
1.2.5 存活率测定 待测样品使用灭菌水进行10倍梯度稀释至10-8。选择3个较恰当的浓度梯度(通常为10-4,10-5,10-6),取10 μL稀释液进行平板涂布(MRS琼脂平板和YPD琼脂平板),分别倒置于37,28 ℃培养48 h,进行菌落计数。每组样品重复测定3次。
1.2.6 比容测定 参照AACC10-05标准测试方法并修改。使用小米替代油菜籽测定体积,使用电子秤称重后计算比容。每组样品重复测定3次。
1.2.7 孔隙度测定 将面包放凉后切薄片,使用扫描仪扫描面包截面,用ImageJ软件分析面包截面孔隙属性。每组样品重复测定6次。
1.2.8 质构测定 参照AACC74-09测试方法并修改。面包放凉后3 h,将其切为均匀薄片(16~18 mm),取3片进行TPA测试。探头为P36R,下压速率2 mm/s、测定速率1.5 mm/s、应变力0.005 N,形变程度50%,两次压缩间隔4 s。
1.2.9 数据统计与分析 采用Excel 2019和SPSS 20软件进行统计分析和显著性分析,显著性水平为0.05。数据可视化由Origin 2022软件完成。
2 结果与讨论
2.1 天然酵母发酵过程
由图1 (a)可知,os和pfs在培养初期的pH值显著低于ps和gs的,其中os的pH值最低为5.03。其主要原因为不同天然酵母选用的发酵底物自身酸度不同[15]。发酵第3~5天,4种天然酵母的pH值均快速下降至3.5~4.0,与Fang等[16]的研究结果类似。其主要原因为天然酵母在培养过程中经过前期的菌群竞争出现了有显著生存优势的菌种,并且在中期优势菌群进行快速生长产生了大量的有机酸代谢物使得整体pH值快速下降。发酵末期,4种天然酵母的pH值变化基本稳定,gs和ps的pH值仍显著高于os和pfs的,但绝对差距缩小了近50%。发酵后期酸度差异主要来源于发酵底物的酸度不同和优势菌群代谢差异[15]。
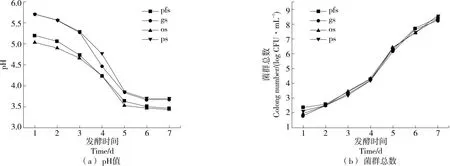
图1 不同天然酵母发酵过程的pH值和菌群数量变化
由图1(b)可知,菌落总数在整个发酵期间持续增长,在发酵前2 d和第7天的增速较为缓慢,在发酵中期的增速最快,与刘若诗[17]的研究结果类似,与天然酵母发酵期间pH值的变化结果相符合。发酵后期,不同天然酵母的菌落数均>108CFU/mL且无显著差异,主要原因是获得竞争优势的主要菌种为植物乳杆菌,其生长活性差异较小且环境给予的营养物质总量固定。
不同的天然酵母发酵过程中的pH值均呈先缓慢下降后快速下降再趋于稳定的趋势,表明天然酵母培养存在前期菌群水平高、杂菌多的情况,这是天然酵母优势菌群不稳定的主要原因。中期优势菌群迅速生长繁殖,代谢产物快速增多;后期菌群达到动态稳定,在环境营养物质不足等因素影响下,整体代谢活性降低。
2.2 天然酵母的品质
由表2可知,GSB的比容显著大于其他面包的,CB、PFSB和OSB的次之且无显著差异,PSB的比容显著小于其他面包的。不同的天然酵母制备的面包因其优势菌不同,其品质也有一定差异,主要是不同菌株的代谢产物有差异,包括胞外多糖、有机酸种类和产量等[18]。5种面包的平均孔隙无显著差异,但PSB和PFSB的孔隙相对较大。孔隙大小能在一定程度上反映面包的组织品质,细密的空隙能包裹更多的气体,更利于品质提升[19]。

表2 天然酵母面包烘焙属性†
GSB和PSB的硬度小于其他面包的,同时GSB的品质略优于PSB。OSB的硬度显著小于PFSB和CB的。Yu等[15]研究表明,添加天然酵母可以改善面包的质构特性,尤其是硬度及其相关属性,其主要原因是有机酸和其他有益代谢物改善了面包的组织结构。在弹性方面,PSB、OSB和PFSB的弹性相对优于其他面包,但其绝对差距较小。综上,GSB的品质相对更好,并以此为基础进行发酵剂的开发。
2.3 菌种鉴定
由表3可知,酿酒酵母和植物乳杆菌是4组天然酵母中丰度相对较高的菌种。酿酒酵母是活性相对较强的菌种,一般可以耐受较低的pH值和高渗透压,比较适合天然酵母和面包生产的体系。植物乳杆菌作为主要的细菌菌种,在多个方面起到有益作用,包括肠道和抗氧化方面,而其对多种碳水化合物的消化能力是使其在该体系中较为常见的主要原因[20]。

表3 天然酵母微生物分离鉴定
2.4 干燥工艺分析
由图2可知,经FD-S和SD-D处理后的活菌数显著高于其他组别,经SD-S和FD-D处理后的活菌数较少(<5%)。酵母菌的存活能力较强,在干燥处理后存活率要高于细菌。FD-S 的活菌数始终保持最高,但在无保护剂环境下,活菌数呈指数级下降。同时,经SD-S处理后的活菌数和贮藏活菌数均显著低于其他组别。FD-S采用冻干优势菌株菌液的方案处理,其活菌数和贮藏效果较好,可能是因为菌株菌液更适应冻干的处理方式,且在后续贮藏中微胶囊能较好地延续微生物的低新陈代谢状态[21]。SD-D采用整体喷雾干燥天然酵母的方案处理,保留了大部分固体作为载体,其初始活菌数较高但贮藏效果较差,主要原因可能是在缺少保护剂的情况下,尽管进行了温度等条件的调整,但活菌的细胞壁仍会受到热损伤。在干燥初始的情况下可以进行繁殖,但在低新陈代谢的情况下菌株难以长期存活[22]。因此,选择纯菌液冻干和天然酵母整体喷干两种方式进行保护剂添加处理,可以弥补其缺点提高存活率并延长贮藏期限。

图2 无保护剂干燥处理的乳酸菌存活情况
2.5 干燥保护剂优化
由图3可知,SM保护剂对两种干燥方案的保护效果显著高于其他保护剂,使用MD和TRE保护剂进行冻干处理的存活率约为40%,且贮藏保护效果较好,第30天时仍有约30%的存活率。所有喷雾干燥组均存在贮藏过程中存活率下降较快的问题,可能是单保护剂的使用量和保护效果对降低热处理造成的损伤作用不强[23]。使用WHEY作为冻干保护剂时,初始存活率较低,其保护效果不佳。干燥过程中糖类保护剂的羟基会与蛋白质表面的极性基团形成氢键,取代表面的水分子,形成一层膜防止菌体表面直接暴露从而提高菌活性[24]。使用MD和TRE作为保护剂进行干燥的初始存活率为40%~60%,保护效果相对较好。同时,糖类保护剂在冻干时会转变为玻璃态,具有较高的黏度和较低的扩散性,会包裹在物质表面维持整体结构,这可能是糖类保护剂在冻干处理时贮藏效果较好的主要原因[23]。蛋白保护剂通常能够自发吸附在菌体表面,对大多数菌的干燥处理都有保护作用,SM为常见且有效的保护剂。WHEY在两种处理方式中效果均相对较差,其主要原因可能是乳清蛋白对菌体的包裹性不好,同时WHEY自身的热稳定能力在其原本的工艺流程中结构已经被破坏。因此,选用SM、MD和TRE进行后续复配研究。
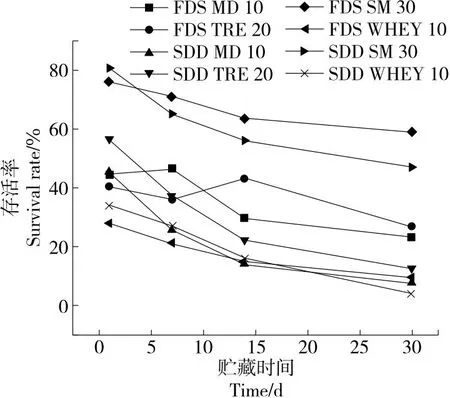
FDS MD 10为添加10%麦芽糊精冻干优势菌菌液;FDS TRE 20为添加20%海藻糖冻干优势菌菌液;SDD MD 10为添加10%麦芽糊精喷干天然酵母整体;SDD TRE 20为添加20%海藻糖喷干天然酵母整体;FDS SM 30为添加30%脱脂乳粉冻干优势菌菌液;FDS WHEY 10为添加10%乳清蛋白冻干优势菌菌液;SDD SM 30为添加30%脱脂乳粉喷干天然酵母整体;SDD WHEY 10为添加10%乳清蛋白喷干天然酵母整体
在前期试验基础上,以MD添加量、TRE添加量和SM添加量为试验因素,以菌种存活率为考察指标进行三因素三水平正交试验优化最佳的复配保护剂配比。试验因素水平见表4,试验设计及结果见表5。

表4 试验因素水平表
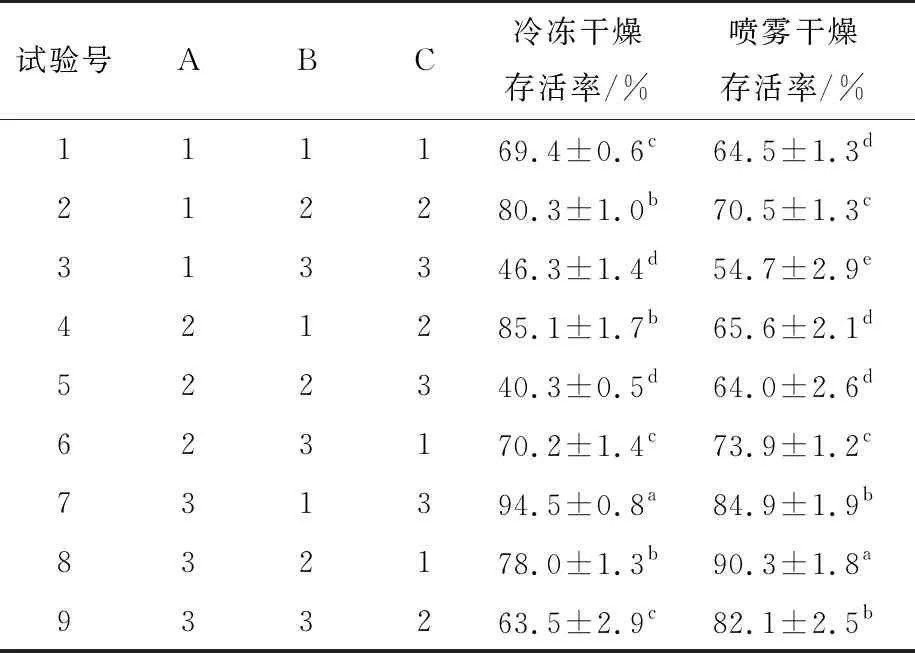
表5 试验设计及结果†
由表5可知,试验7的冷冻干燥初始存活率显著高于其他组,试验3和试验5的冷冻干燥初始存活率最低,其他组的冷冻干燥存活率为65%~85%。试验1、试验4和试验7的冷冻干燥存活率相对较高,试验3、试验6和试验9的冷冻干燥存活率相对较低,其主要原因可能是MD添加量较低时,SM和TRE能发挥较好的保护作用,MD添加量较高时,同等含量的SM和TRE的保护作用明显减弱。这可能是MD对蛋白结合位点的抢夺能力强于其他物质,且MD自身的保护能力较弱,导致高含量时整体的保护效果减弱[25]。SM的保护效果随其添加量的增加而增强,但容易受到其他物质的干扰,说明其结合能力相对较弱,但保护效果很好。综上,冷冻干燥保护剂的最佳配方为SM 35%、MD 7.5%和 TRE 25%。
试验8的喷雾干燥存活率最高,其次为试验7和试验9的,试验3的最低。试验3的保护效果最差可能是因为MD添加量太高在喷干过程中黏性过强,因而在有面粉等碳水化合物的环境中无法包裹菌体形成较好的微胶囊[25]。试验7、试验8和试验9的喷雾干燥存活率相对较高,可能是因为SM添加量较高,在有面粉等基础物质的环境中需要一定含量才能完成蛋白质的包裹。相对更高的试验8中糖类保护剂更少,可能是糖类保护剂的黏性太强会影响SM的包裹。最佳喷雾干燥复配保护剂配方为SM 35%、MD 10%和 TRE 15%。
2.6 贮藏稳定性
由图4(a)可知,冷冻干燥组在贮藏第1周存活率快速下降,之后进入稳定期,存活率下降缓慢,贮藏2个月时仍有约75%的存活率,与Stefanello等[26]的研究结果类似。冻干保护剂与菌体表面通过羟基等连接形成膜,既可以降低冰晶对菌体的伤害,又可以包裹菌体在贮藏期间维持菌体的低新陈代谢状态。由图4(b)可知,喷雾干燥组在贮藏6周内一直保持较快的失活速率,其主要原因可能是喷雾干燥的热处理不可避免地会导致菌体失活,即使在低新陈代谢下,蛋白受损、变性等因素会影响菌体的存活率[27]。贮藏6周后菌体的存活率较为稳定,且贮藏2个月内活性仍保持>65%,能够满足作为发酵剂使用的活性要求。总体而言,冷冻干燥天然酵母优势菌菌液具有相对更好的存活率和贮藏品质。

图4 最优存活率复配保护剂的贮藏效果
3 结论
通过对比多种水果天然酵母的应用品质,得到较好的一种,并将其制备成具有较好贮藏活性的天然酵母发酵剂。结果表明,天然酵母的最终优势菌群在发酵第3天获得竞争优势,在后续快速生长繁殖,并在发酵5 d后进入稳定期。其中,葡萄天然酵母具有最佳的应用品质,其主要优势酵母菌株为酿酒酵母Y117、TU11 XZFM15F1,乳酸菌菌株为融合魏斯氏乳杆菌3052、植物乳杆菌2194、植物乳杆菌2329、植物乳杆菌N-1和植物乳杆菌2877。
通过研究干燥方式和复配保护剂对天然发酵剂的存活率和贮藏活性影响,最佳的复配保护剂配方为:① 冷冻干燥优势菌种菌液(FDS),脱脂乳粉35%、麦芽糊精7.5%和海藻糖25%;② 天然酵母整体喷雾干燥(SDD),脱脂乳粉35%、麦芽糊精10%和海藻糖15%。两种天然酵母发酵剂在贮藏2个月时仍有较高的活性,但喷雾干燥的发酵剂贮藏活性相对冷冻干燥下降得更快。研究对标准化天然酵母发酵剂进行了系列试验,开发了稳定化高活性的天然酵母发酵剂,但其中关于发酵剂应用效果评价与其贮藏活性延长还需要进一步研究。其应用效果评价应从组织质构、风味属性和保质期等多方面进行评估;其贮藏活性延长可从保护新工艺开发等方面入手。

