柠檬明串珠菌KM20中D-乳酸脱氢酶的特性
文宇萍 刘金熙 金 清 崔虎山
柠檬明串珠菌(Leuconostoccitreum)是异型发酵乳酸菌的一种,因其非病原性、对人体无害被列为GRAS (generally recognized as safe),主要存在于蔬菜、牛乳、水果、传统发酵泡菜、乳制品等食品中[1-2]。柠檬明串珠菌能通过代谢产生CO2、风味化合物、特殊活性物质、细菌素及其他抑菌成分,具有潜在的益生效果,可作为食品发酵剂广泛应用于发酵食品中从而改善其风味、功能性、组织状态与贮存期,或作为生产功能性物质的细胞工厂,直接应用于食品工业与医药保健等领域[2]。
乳酸脱氢酶(lactate hehydrogenase, LDH)是乳酸菌催化丙酮酸产生乳酸的关键酶,根据催化产物不同,可将其分为D-乳酸脱氢酶(D-LDH)与L-乳酸脱氢酶(L-LDH)两种,并分别催化丙酮酸生成互为镜像的D-乳酸与L-乳酸[3]。乳酸的合成构型由D-/L-乳酸脱氢酶基因的表达水平决定,因此目前的研究重点主要集中在乳酸菌的乳酸脱氢酶的编码基因上[4]。柠檬明串珠菌作为泡菜等发酵的优势菌种,被认为只含D-LDH,在发酵过程中生成的乳酸以D-型为主[1,5-6],由于人体缺乏D-乳酸的特异性代谢酶,过量食用会导致D-乳酸堆积,从而引起酸中毒等代谢障碍,危害人体健康[7-8]。
D-乳酸作为多种手性化合物合成的前体,在提高聚乳酸材料热稳定性等方面具有重要作用,高光学纯度的D-乳酸能够提高聚乳酸材料的性能,具有良好的生物降解性,可在微生物的分解作用下完全降解为二氧化碳和水,因此D-乳酸对环境保护具有重要意义[9-13]。此外,LDH也是乳酸菌催化苯丙酮酸生成苯乳酸(phenyllactic acid, PLA)的关键酶,与催化丙酮酸情况类似,L-LDH催化苯丙酮酸生成L-苯乳酸,D-LDH则催化苯丙酮酸生成D-苯乳酸[14]。与L-苯乳酸相比,D-苯乳酸具有更高的抗菌活性,在食品、饲料等领域作为一种新型的生物防腐剂具有较大潜力[15- 16]。综上,D-乳酸、D-苯乳酸在制药、化妆品、化学与食品工业等领域受到了广泛青睐[17]。柠檬明串珠菌也可作为生产高纯度D-乳酸、D-苯乳酸的优良菌种,具有广阔的应用前景。
柠檬明串珠菌基因组测序的完成为当下研究提供了丰富的信息资源[18-19],但其功能注释大多为初步推测,因此在功能研究方面或是利用基因工程技术对该菌株进行改造方面发展较为缓慢[20]。前期试验发现,柠檬明串珠菌KM20通过丙酮酸还原途径生成D-乳酸,且LCK_00389为D-乳酸合成的关键基因编码酶;LCK_00027与LCK_00222基因同样在丙酮酸代谢通路中编码D-乳酸脱氢酶的合成并参与D-乳酸的生成;LCK_00027与LCK_00222拥有极为相近的转录本丰度TPM (transcripts per million)值,由于不同基因编码LDH的性质可能会有较大差异,因此有必要对两种酶进行特性研究。研究拟以柠檬明串珠菌KM20为研究对象,通过基因工程手段对D-乳酸生成相关基因进行基因重组、克隆,并在大肠杆菌中进行异源表达,经纯化后测定酶活,并对酶的最适pH值、最适温度、底物特异性、潜在抑制性和动力学常数等进行分析,以期为提高发酵食品安全性、生产高光学纯度乳酸与苯乳酸提供依据。
1 材料与方法
1.1 材料与试剂
柠檬明串珠菌KM20:延边大学食品与生物科学系食品科学实验室;
TOP 10、EscherichiacoliBL21(DE3)、质粒pET-21a(+)、质粒pET-15b:德国Novagen公司;
DNA提取试剂盒:美国Omega公司;
聚合酶链式反应(PCR)试剂盒,限制性内切酶EcoR I、Hind III、Nde I和Xho I:日本TaKaRa公司;
BCA试剂盒:美国Pierce Biotechnology公司;
聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒:北京索来宝生物科技有限公司;
异丙基-β-D-硫代半乳糖苷(IPTG)、丙酮酸、D-/L-乳酸、还原态烟酰胺腺嘌呤二核苷酸(NADH)、烟酰胺腺嘌呤二核苷酸(NAD+)、苯丙酮酸钠:美国Sigma公司。
1.2 仪器与设备
PCR仪:PTC-225型,美国MJ Research公司;
Ni2+-NTA柱:17531901型,瑞典GE Healthcare公司;
SDS-PAGE电泳仪:1658001型,美国Bio-Rad公司;
超声波细胞破碎仪:UCS-650型,杭州米欧仪器有限公司;
多功能荧光酶标仪:SP-max3500FL型,上海闪谱生物科技有限公司。
1.3 方法
1.3.1 重组质粒的构建与鉴定 根据NCBI数据库提供的信息(http://www.ncbi.nlm.nih.gov),以柠檬明串珠菌KM20基因组为模板 (https://www.ncbi.nlm.nih.gov/nuccore/NC_010471.1),分别以LCK_00027-F (5′-GA CACGAATTCATGAAGATCATCATGTACAACAC-3′)、LCK_00027-R (5′-GTGTCAAGCTTTTAGCGCAGAAT TTCGTTTTCGG-3′)、LCK_00222-F (5′-GCAGCCAT ATGACCAAAATCCTGATGACCAGTGTGCGCAGTGAT-3′)与LCK_00222-R (5′-GGATCCTCGAGTTAA ATTTCATTAACTGCCTGATGACCGCTAAT-3′)为引物进行PCR扩增,经琼脂糖凝胶电泳鉴定其分子量,切胶回收后将纯化的LCK_00027基因产物插入至pET-28a(+)质粒(5 369 bp)的EcoR I和Hind III酶切位点上,获得重组质粒pETldhD-1(6 346 bp);纯化的LCK_00222基因产物插入至pET-15b质粒(5 708 bp)的Nde I和Xho I酶切位点上,获得重组质粒pETldhD-2(6 701 bp)。分别将重组质粒pETldhD-1、pETldhD-2转化至TOP 10感受态细胞中,并从含卡那霉素(30 μg/mL)与氨苄青霉素(50 μg/mL)的LB培养基中筛选重组体。
1.3.2 重组菌的蛋白表达及纯化 将筛选得到阳性克隆质粒pETldhD-1、pETldhD-2分别转化至E.coliBL21(DE3)感受态细胞中,42 ℃热激后分别涂布至含卡那霉素(30 μg/mL)与氨苄青霉素(50 μg/mL)的LB平板上,37 ℃培养24 h,挑取单克隆菌落至对应的LB肉汤中,37 ℃培养至OD值为0.6时,分别添加0.5 mmol/L的异丙基硫代半乳糖苷 (IPTG),并于20 ℃诱导培养16 h,4 000 r/min离心10 min,弃上清,收集菌体,加入PBS缓冲液重悬,用超声波细胞破碎仪破碎菌体细胞,破碎时间为15 min (开5 s,关5 s)。将破碎后的菌液于4 ℃、12 000 r/min离心5 min,得到上清液为粗蛋白。根据重组蛋白为多聚组氨酸标签这一性质,选用Ni2+-NTA柱亲和层析的方法进行纯化。首先通过洗杂液(30,50 mmol/L咪唑,500 mmol/L NaCl,20 mmol/L Na2HPO4-NaH2PO4缓冲液;pH 7.4)进行两步洗杂,再用洗脱液(500 mmol/L咪唑,500 mmol/L NaCl,20 mmol/L Na2HPO4-NaH2PO4缓冲液;pH 7.4)缓慢洗脱,收集洗脱液作为纯酶液,4 ℃保存备用。通过变性聚丙烯酰胺凝胶电泳(SDS-PAGE)分析蛋白样品的表达与纯化水平。
1.3.3D-LDH-1和D-LDH-2酶活力测定 分别通过丙酮酸还原与D-乳酸氧化两种反应测定酶活性。丙酮酸还原反应:向0.3 mL底物溶液(0.5 mmol/L NADH,10 mmol/L丙酮酸,0.1 mol/L Tris-HCl缓冲液;pH 8.0)中加入0.01 mL纯酶液进行反应;D-乳酸氧化反应:向0.3 mL底物溶液(5 mmol/L NAD+,75 mmol/LD-乳酸,0.1 mol/L甘氨酸—氢氧化钠缓冲液;pH 11.0)中加入0.01 mL纯酶液进行反应。两种反应混合物均在指定温度和时间下孵育,并于340 nm处测定吸光度。定义每分钟氧化1 μmol NADH或每分钟还原1 μmol NAD+所需酶量为一个酶活力单位(U);每毫克酶蛋白所含的酶活单位数(U/mg)为比活力。使用BCA蛋白检测试剂盒测定蛋白浓度。
1.3.4 酶反应产物测定 以D-乳酸为底物,在酶的作用下进行充分氧化反应,将反应后的酶解液稀释,并经0.22 μm水系滤膜过滤,进行高效液相色谱检测。检测条件[21]:色谱柱为Hypersil GOLD Amino (250 mm×4.6 mm, 5 μm);柱温30 ℃;流动相为乙腈—0.02 mol/L磷酸二氢钾(V乙腈∶V磷酸二氢钾为30∶70);流速1.0 mL/min;进样体积20 μL;紫外检测器;检测波长210 nm。
1.3.5 pH和温度对D-LDH-1和D-LDH-2酶活力的影响 分别测定不同pH值缓冲液 (100 mmol/L磷酸盐缓,pH 6.0~7.0、100 mmol/L Tris-HCl缓冲液,pH 8.0~10.0、100 mmol/L甘氨酸—氢氧化钠缓冲液,pH 11.0~13.0)对D-LDH-1和D-LDH-2酶活性的影响,探索酶最适pH值。在最适pH条件下,于10~50 ℃范围内测定温度对D-LDH-1和D-LDH-2酶活性的影响,探索酶的最适反应温度。
1.3.6D-LDH-1和D-LDH-2的底物特异性和酶抑制剂测定 以与丙酮酸结构相似的乙酰丙酸、苯丙酮酸钠、α-酮丁酸、草酰乙酸、2-酮戊二酸和与D-乳酸结构相似的苹果酸为底物,在最适温度与最适pH条件下,测定D-LDH-1与D-LDH-2的底物特异性,并以丙酮酸与D-乳酸作为底物反应时的酶活性定义为100%。
为确定抑制剂对酶活性的影响,将D-LDH-1和D-LDH-2分别与浓度为0.1,1.0 mmol/L的金属离子 (Ca2+、Co2+、Cu2+、Mg2+、Mn2+、Zn2+、Na+)、SDS与尿素孵育,以未添加抑制剂对照组中酶的丙酮酸还原活性为100%。
1.3.7D-LDH-1和D-LDH-2动力学参数测定 在0.5 mmol/L NADH下分别测定不同丙酮酸浓度(1,2,3,4,5 mmol/L)下的酶活性;在10 mmol/L丙酮酸下测定不同浓度NADH (0.1,0.2,0.3,0.4,0.5 mmol/L)的酶活性。在5 mmol/L NAD+下分别测定不同D-乳酸浓度(10,20,30,40,50 mmol/L)的酶活性;在50 mmol/L乳酸浓度下测定不同浓度NAD+(1,2,3,4,5 mmol/L)的酶活性,并采用Lineweaver-Burk作图法进行数据分析。
1.4 数据处理
各试验重复3次,使用SPSS 20软件进行数据分析,通过Origin 2018软件进行图表绘制。
2 结果与分析
2.1 重组基因的诱导表达分析
利用设计的引物进行PCR扩增,将提纯后得到的目的基因分别插入到相应质粒的酶切位点上获得重组质粒,并分别对其进行双酶切鉴定。在1%琼脂糖凝胶上进行电泳验证,所得目的基因与基因测序结果一致,表明基因克隆成功,获得重组载体。将重组质粒转化至E.coliBL21 (DE3)感受态细胞,经IPTG诱导表达和纯化后进行丙烯酰胺凝胶电泳(SDS-PAGE),检测结果(图1)表明,E.coliBL21 (DE3)/pETldhD-1与E.coliBL21 (DE3)/pETldhD-2分别在40.0,38.5 kDa处有单一蛋白条带,无杂蛋白,表明重组蛋白表达纯化成功。

M. 蛋白Marker 1. E. coli BL21 (DE3)/pETldhD-1粗酶液 2. E. coli BL21 (DE3)/pETldhD-1纯酶液 3. E. coli BL21 (DE3)/pETldhD-2粗酶液 4. E. coli BL21 (DE3)/pETldhD-2纯酶液
2.2 D-LDH-1和D-LDH-2酶活力分析
由表1可知,D-LDH-1粗酶液对丙酮酸的比活力为0.95 U/mg,纯化后比活力达2.18 U/mg,提高约2.29倍;D-LDH-2粗酶液对丙酮酸的比活力为8.97 U/mg,纯化后比活力达153.10 U/mg,提高约17.07倍。两种酶经纯化后,以L-乳酸为底物时显示并无活力。虽然两种酶的编码基因来自同一菌株,但活性差异较大,可能是因为其核苷酸、氨基酸序列不同。D-LDH-1酶活力较低,但略高于肠膜明串珠菌NCDO的D-LDH比活力(0.6,0.9 U/mg)[22];D-LDH-2酶活力较高,且高于植物乳杆菌LY-78的(65.35,0.41 U/mg)[23],但仍低于肠膜明串珠菌ATCC8293的D-LDH比活力(4 450 U/mg)[24]。D-LDH-1的回收率为19.65%,符合多数情况下酶的回收率<100%的情况;D-LDH-2的回收率为162.25%,可能是因为粗酶液中某物质抑制了该D-乳酸脱氢酶的活性。

表1 D-LDH-1和D-LDH-2纯化前后的酶活力
2.3 酶反应产物分析
由图2可知,50 mg/L丙酮酸标准品在7.567 min时检测到明显峰值。两种酶以D-乳酸为底物进行氧化反应,反应产物均在丙酮酸保留时间处检测到明显峰值,证明两种酶是将D-乳酸氧化为丙酮酸的D-LDH。而以L-乳酸为底物进行反应所得产物在丙酮酸保留时间处并未检出峰值,与酶活力测定结果相符。
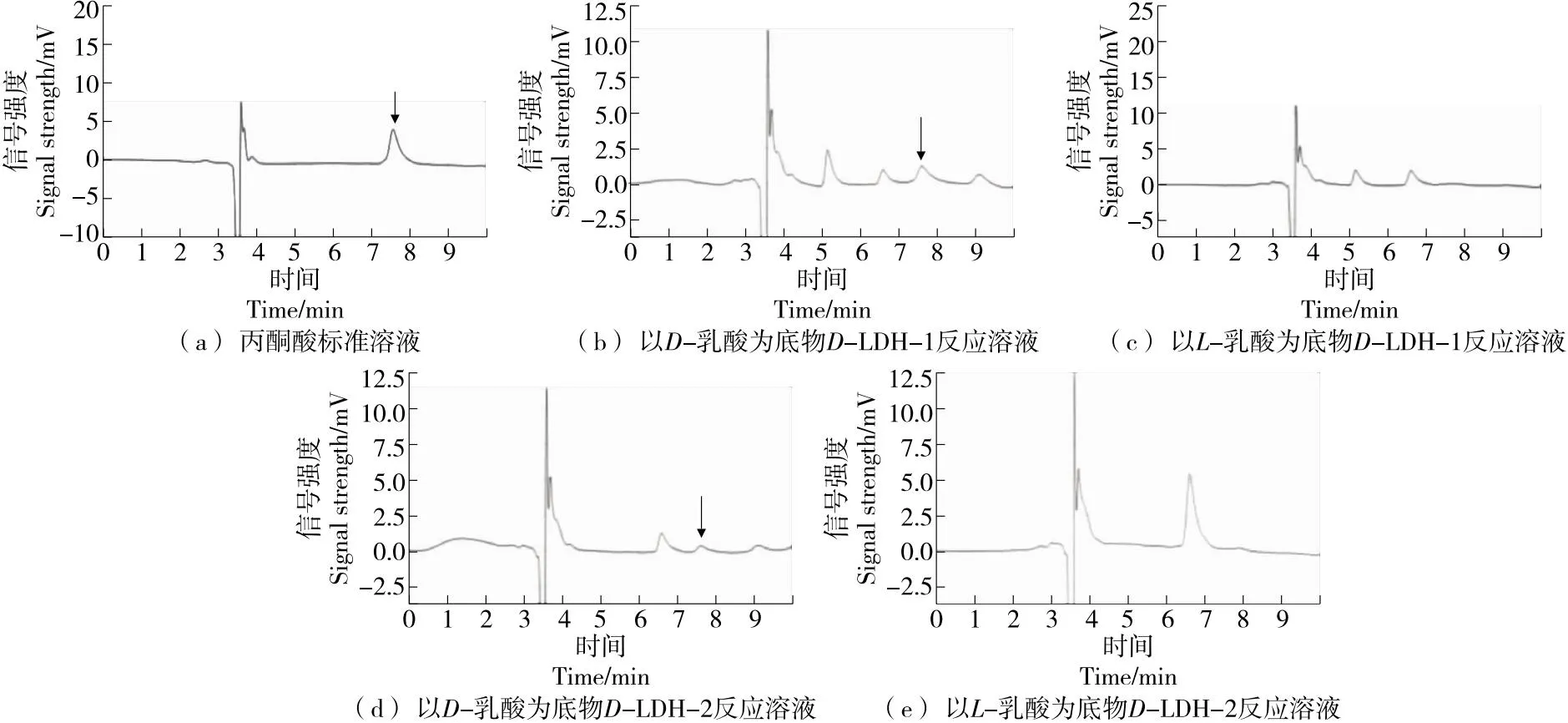
图2 HPLC检测D-LDH氧化反应生成丙酮酸
2.4 pH和温度对D-LDH-1和D-LDH-2酶活力的影响
由图3可知,D-LDH-1和D-LDH-2还原丙酮酸时的最佳pH均为8.0;当pH>10时,酶活力大幅下降,D-LDH-1和D-LDH-2的相对酶活力分别为16.79%,21.87%。两种酶还原丙酮酸时的最佳pH值符合乳酸菌最适生长的pH范围,与多聚组氨酸标签纯化系统的最适pH环境相近,利于简化纯化过程[25]。在乳酸氧化过程中,由于D-LDH-1酶活力过小,未进一步进行表征;而D-LDH-2在乳酸氧化时的最佳pH为12.0,当pH为13时,其酶活力仍能保持在66.68%。当pH为8.0~13.0时,D-LDH-2中均能被检测到乳酸氧化的酶活性,表明该酶对碱性条件具有较强的抵抗力,与肠膜明串菌中D-LDH相似[24]。两种酶对pH均较为敏感,相对酶活力变化显著(P<0.05)。

图3 pH对D-LDH-1和D-LDH-2酶活力的影响
由图4可知,D-LDH-1和D-LDH-2在丙酮酸还原时的最适温度均为40 ℃;当温度<20 ℃或>50 ℃时,D-LDH-1的相对酶活力均<50%,与文献[26-27]的结果相符;当温度为50 ℃时,D-LDH-2的相对酶活力仍保持在76.38%,说明D-LDH-2比D-LDH-1更耐高温。在乳酸氧化过程中,D-LDH-2的最适温度为30 ℃,与Hofvendahl等[28]的结论接近。两种酶对温度均较为敏感,相对酶活力变化显著(P<0.05)。

图4 温度对D-LDH-1和D-LDH-2酶活力的影响
2.5 D-LDH-1和D-LDH-2底物特异性和酶抑制剂分析
由表2可知,两种酶对不同底物展现了相似的底物偏好,其底物催化偏好为丙酮酸>草酰乙酸>苯丙酮酸钠>2-酮戊二酸。与肠膜明串珠菌ATCC8293和发酵乳杆菌JN248的D-LDH相比,柠檬明串珠菌的D-LDH-1和D-LDH-2底物范围并不广泛,但相对特异性更高[29-30]。
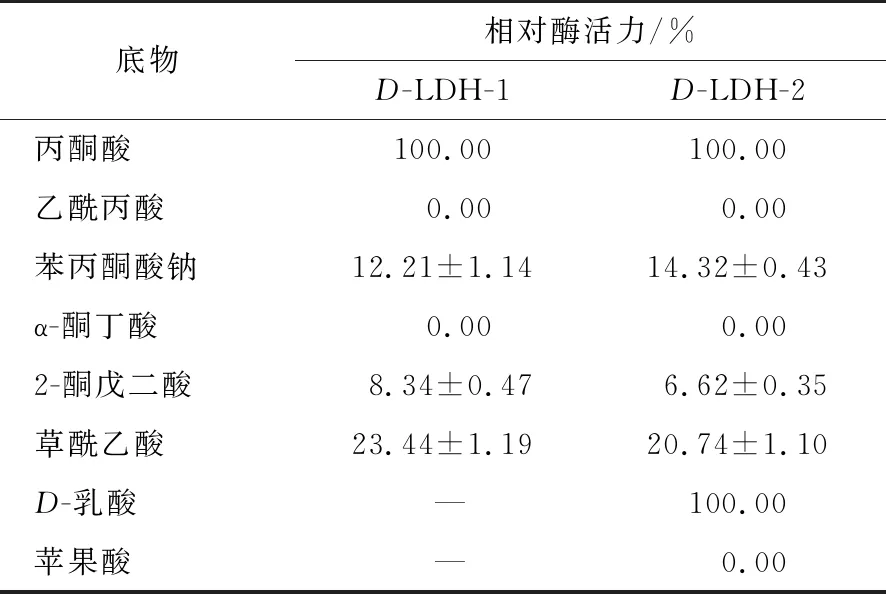
表2 D-LDH-1和D-LDH-2对不同底物的相对酶活力
由图5可知,Ca2+、Cu2+和Na+对两种酶活性均有促进作用,浓度为1 mmol/L的Cu2+使D-LDH-1的相对酶活力达到150.05%,D-LDH-2的相对酶活力高达162.46%;Mg2+、Co2+、Mn2+、Zn2+、尿素和SDS对两种酶的活性均有抑制作用,尤其是浓度为1 mmol/L的Zn2+和SDS对两种酶的相对酶活力抑制率高达100%,与文献[24,31]的结论相同。两种酶对SDS均比较敏感,推测是SDS使两种酶的构象发生变化,显著降低了其催化能力,与文献[32]的报道相符。

图5 抑制剂对D-LDH-1和D-LDH-2酶活力的影响
2.6 D-LDH-1和D-LDH-2动力学参数分析
由表3可知,D-LDH-1对丙酮酸和NADH的Km值分别为2.98,0.32 mmol/L;D-LDH-2对丙酮酸和NADH的Km值分别为6.11,0.32 mmol/L。D-LDH-2对D-乳酸和NAD+的Km值分别为44.30,4.32 mmol/L。两种酶对D-乳酸和NAD+的Km值均大于丙酮酸和NADH的,表明两种酶对丙酮酸和NADH的亲和力均高于乳酸和NAD+,更利于D-乳酸或D-苯乳酸的生成。此外,两种酶对丙酮酸的Kcat/Km值分别为6.0×102,2.2×104L/(mol·s);D-LDH-2对D-乳酸的Kcat/Km值为65.0 L/(mol·s)。D-LDH-2对丙酮酸的Kcat值比D-LDH-1的大,且催化效率(Kcat/Km)也更高,表明D-LDH-2更适合D-乳酸或D-苯乳酸的生成。

表3 D-LDH-1和D-LDH-2的动力学参数
3 结论
研究以柠檬明串珠菌KM20基因组为模板,通过对两个编码D-乳酸脱氢酶的基因构建质粒并克隆至表达载体,并在E.coliBL21(DE3)中进行异源表达后,分别对其酶学性质进行了分析。结果表明,柠檬明串珠菌的两个D-乳酸脱氢酶比其他一些乳酸菌的D-乳酸脱氢酶具有较高的比活力;两种酶均对碱性环境具有较强的抵抗力;Ca2+、Cu2+和Na+对两种酶活力均有促进作用,Zn2+和SDS则对两种酶活力高度抑制。后续可比较纯酶与原始菌株的转化效率,还可根据其酶学特性研究D-乳酸脱氢酶在发酵食品安全方面的应用。

