神经轴突导向因子3E与颅内动脉瘤介入栓塞术后1个月不良预后的关系*
谢昌纪 杨辰龙 周志宇 胡瑞婷 黄俊萍 谭 呼 韦馨娴 王 涛 杨 军**
(广西壮族自治区民族医院神经外科,南宁 530001)
颅内动脉瘤是颅内动脉壁的局限性、病理性扩张,通常发生于动脉的分叉部,具有破裂倾向。根据形态学特征,动脉瘤主要分为囊状、梭形、夹层3种,囊状动脉瘤约占90%[1]。一般人群中颅内动脉瘤发生率为1%~7%[2]。大多数颅内动脉瘤无临床症状,动脉瘤破裂可导致蛛网膜下腔出血(subarachnoid hemorrhage,SAH)。颅内动脉瘤的手术方式主要包括开颅手术夹闭和血管内介入动脉瘤栓塞。影响颅内动脉瘤预后的因素较多,除了年龄、动脉瘤大小和位置、破裂次数、Hunt-Hess分级及手术时机、基础疾病等常见因素外[3],近来研究显示脑脊液与血清白细胞介素6(IL-6)比值、动脉血乳酸水平以及血清髓鞘碱性蛋白(MBP)、神经元特异性烯醇化酶(NSE)和S100B蛋白水平均是颅内动脉瘤的独立预后因素[4]。神经轴突导向因子3E(semaphorin 3E,Sema3E)是semaphorin信号素家族的一员,作为膜相关性的分泌性蛋白,对于维持神经系统和血管系统的正常结构具有重要作用,近年来得到越来越多的关注。Sema3E可调控血管内皮细胞在体外和体内的迁移,而且可与Plexin-D1受体形成复合物,调节神经细胞生长、血管生成以及炎症反应。Sema3E与颅内动脉瘤的关系尚不明确。本研究通过测定颅内动脉瘤患者血清Sema3E的水平,分析Sema3E与颅内动脉瘤介入治疗个1月不良预后(包括严重残疾、植物状态生存或死亡)的关系,为优化颅内动脉瘤的临床诊疗提供依据。
1 对象与方法
1.1 研究对象
本研究为前瞻性单中心队列研究,连续纳入2020年6月~2022年1月于广西壮族自治区民族医院神经外科住院行介入手术治疗的颅内动脉瘤患者102例。入组标准:①年龄≥18岁,男女不限;②初次手术治疗的颅内动脉瘤;③充分告知患者或授权人介入手术与开颅手术的潜在收益与风险,患者或授权人选择介入栓塞治疗;④签署知情同意书,同意参加本研究。排除标准:①有开颅手术史;②动脉瘤介入栓塞后行开颅血肿清除术;③失访;④合并恶性肿瘤;⑤合并明确感染;⑥过敏体质,或合并艾滋病、红斑狼疮、类风湿等全身系统性疾病;⑦孕产期妇女。
最终共纳入91例,未入组11例包括:2例经介入治疗后行开颅血肿清除术,1例合并胶质母细胞瘤,1例合并结直肠癌,1例合并红斑狼疮,6例失访。入组病例均有完整的临床、影像及实验室检查资料。
本组91例,男32例,女59例。年龄28~84岁,(59.9±11.0)岁。BMI 18.00~31.17,22.94±2.55。入院时格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)4~15分,(12.4±3.5)分,其中<8分15例,≥8分76例。Hunt-Hess分级:0级未破裂动脉瘤14例(15.4%),Ⅰ级6例(6.6%),Ⅱ级28例(30.8%),Ⅲ级21例(23.1%),Ⅳ级22例(24.2%)。均经CTA或DSA确诊为颅内动脉瘤。发生部位:前交通动脉22例,后交通动脉29例,大脑中动脉13例,基底动脉15例,颈内动脉12例。形态学:宽颈58例,窄颈33例;25例动脉瘤含子囊。小型动脉瘤40例,中型动脉瘤44例,大型动脉瘤7例。24例(26.4%)有吸烟史,21例(23.1%)有饮酒史(男性每天乙醇摄入量≥40 g、女性≥20 g,或近2周内大量饮酒,每天乙醇摄入量≥80 g)。合并Ⅱ型糖尿病13例(14.3%),高血压23例(25.3%),冠心病13例(14.3%)。
1.2 研究方法与数据收集
本研究设计方案提交广西壮族自治区民族医院伦理委员会审查,经批准予以开展研究(伦理批件号:2020-23)。遵循自愿、保密、公平、有益无害原则。在收集资料及进行血清Sema3E检测前征得患者同意,并对患者资料妥善保管,研究过程中按照操作规程,避免对患者造成伤害。研究对象或授权监护人均已签署知情同意书。
由研究人员收集患者的人口学资料、既往病史、临床信息、影像学数据,并由专人完成1个月后功能随访。
人口学资料和临床数据包括一般资料(年龄、性别、BMI、吸烟史、饮酒史)及合并症(糖尿病、高血压、冠心病)。临床昏迷程度评定采用GCS评分[5],SAH严重程度评定采用Hunt-Hess分级标准[6]。
影像学数据:收集血管造影(CTA或DSA)的原始Dicom图像数据,分析动脉瘤的大小与形态特征,包括动脉瘤部位(载瘤动脉)、瘤体最大径、瘤颈分型及是否含子囊。颅内动脉瘤根据瘤体最大径分为小型动脉瘤(瘤体最大径<5 mm)、中型动脉瘤(5 mm≤瘤体最大径<15 mm)、大型动脉瘤(瘤体最大径≥15 mm)。宽颈动脉瘤的诊断标准[7]:动脉瘤绝对直径>4 mm,或动脉瘤瘤体与瘤颈比<2。影像判读由2名5年以上影像诊断经验医师独立完成,如分析结果有异议,经会商后确定。
血清Sema3E水平:介入手术开始前抽取3 ml外周静脉血,于4 ℃放置自然凝固后以3000 rpm离心5 min,将分离所得血清置于-80 ℃冰箱保存。同批测定时,将所有标本置于37 ℃恒温水槽中复融,应用酶联免疫吸附测定法(ELISA)商品化试剂盒(购自无锡市东林科技发展有限责任公司,DL-SEMA3E-Hu)检测血清Sema3E水平。
介入治疗方式:均采取血管内介入方案栓塞颅内动脉瘤,其中55例采用单纯弹簧圈栓塞,36例动脉瘤因瘤颈较宽,为稳定弹簧圈采用支架辅助弹簧圈栓塞(采用LVIS支架30例,Pipeline支架2例,Solitaire支架4例)。
1.3 结局定义与研究分组
观察结局为介入手术治疗1个月的预后,评估方法采用格拉斯哥结局评分(Glasgow Outcome Scale,GOS):死亡为1分;长期持续植物状态生存为2分;严重残疾,日常生活不能自理为3分;中度残疾,可自理生活为4分;痊愈,恢复正常生活,或遗留有轻微残疾为5分。根据GOS评分,4~5分定义为预后良好,1~3分定义为预后不良(即严重残疾、植物状态生存或死亡)[5]。据此标准,将纳入患者分为预后良好组与预后不良组。
变量包括年龄、性别、BMI、吸烟史、饮酒史、糖尿病史、高血压史、冠心病史、GCS评分、Hunt-Hess分级、动脉瘤部位、瘤体最大径、是否宽颈、是否含子囊、介入治疗方式及血清Sema3E水平。
1.4 统计学分析
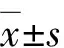
1.5 研究数据的质量控制
纳入研究对象后,及时完成数据收集及录入,确保研究数据的准确性。EpiData录入数据时限定数值范围,进行计算机逻辑检错。数据录入完成后,由前期未参与数据收集的独立研究者抽取30%录入数据与原始数据进行比对,核查数据准确性。所有研究资料保存在中心数据库,并由质控人员进行全程管理及质量控制。
2 结果
颅内动脉瘤介入栓塞术后1个月,GOS 1分2例(分别在术后第5天和第9天因呼吸循环衰竭死亡),2分13例,3分6例,4分12例,5分58例。预后良好组70例(76.9%),预后不良组21例(23.1%)。
预后不良组与预后良好组的比较见表1,预后不良组术前GCS评分低,Hunt-Hess分级和血清Sema3E水平高(均P=0.000),2组性别、年龄、BMI、动脉瘤部位、动脉瘤最大径、是否宽颈、是否含子囊、是否支架辅助弹簧圈栓塞、吸烟史、饮酒史、糖尿病史、高血压史、冠心病史方面差异均无统计学意义(P>0.05)。
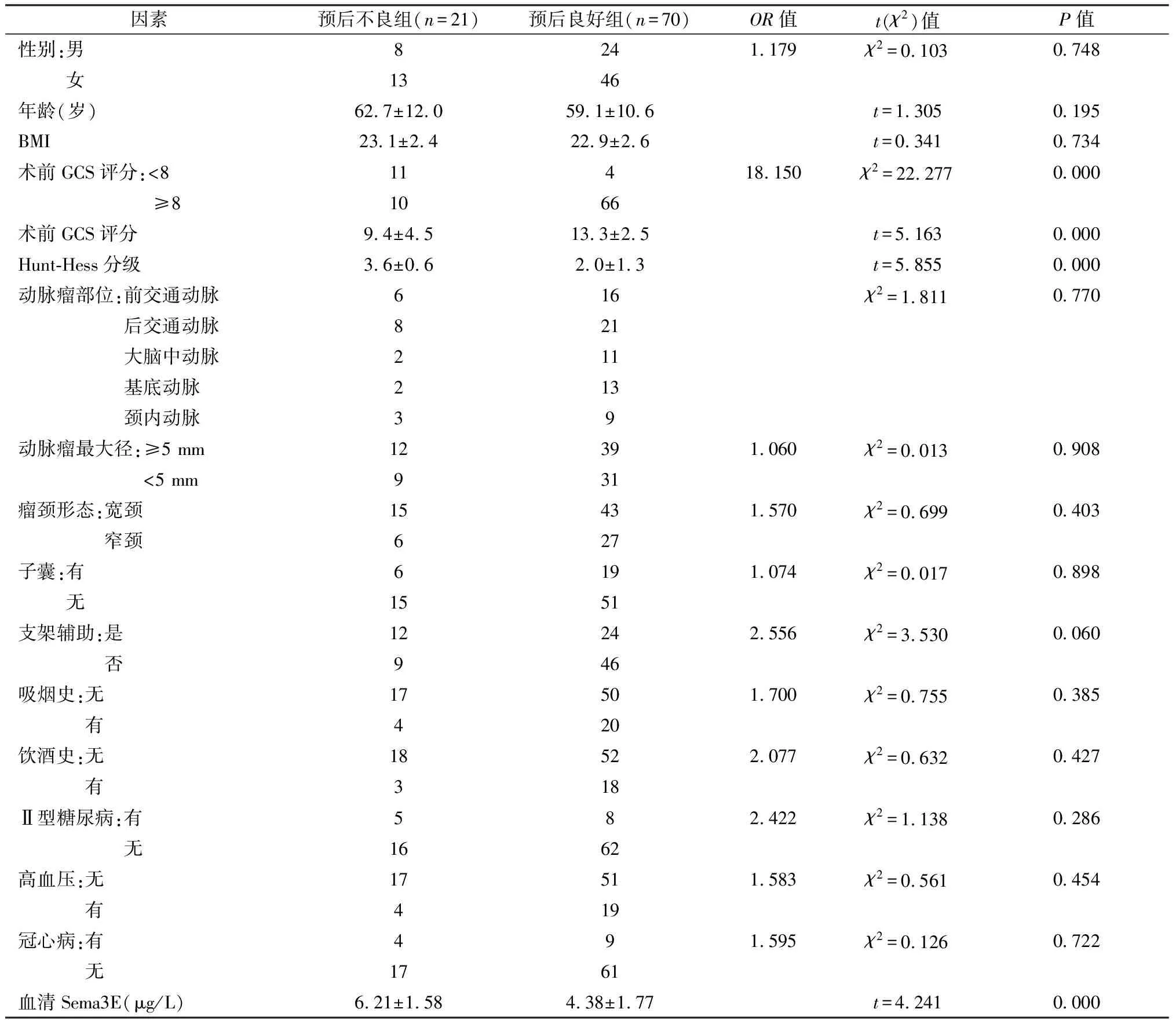
表1 动脉瘤预后不良组与预后良好组的单因素分析
将预后不良的潜在影响因素(术前GCS评分、Hunt-Hess分级、是否支架辅助弹簧圈栓塞、血清Sema3E水平)(P<0.1)纳入logistic回归分析,见表2,结果显示Hunt-Hess分级(OR=7.150,95%CI:1.963~26.044,P=0.003)、采用支架辅助弹簧圈栓塞(OR=15.777,95%CI:1.961~126.953,P=0.010)、血清Sema3E水平(OR=1.756,95%CI:1.067~2.890,P=0.027)是颅内动脉瘤介入治疗后不良预后的独立影响因素。将上述因素带入方程可得Logit(P)=-13.408+1.967×Hunt-Hess分级+2.759×是否支架辅助弹簧圈栓塞(是1;否0)+0.563×血清Sema3E水平。
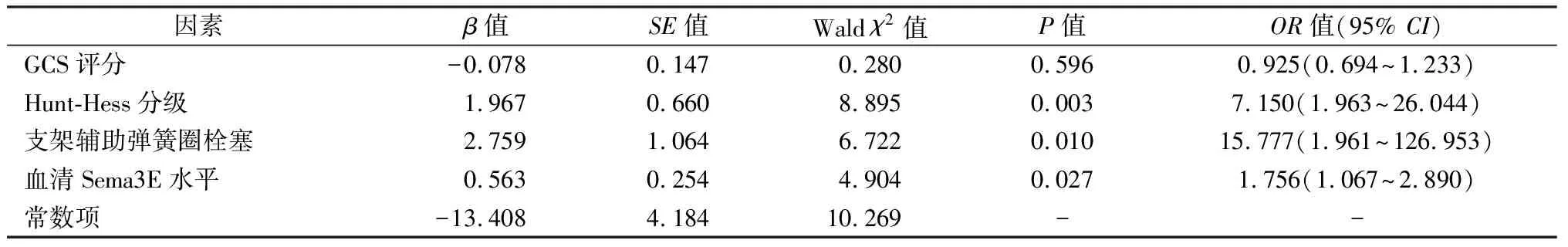
表2 颅内动脉瘤介入治疗后1个月不良预后的logistic回归分析
3 讨论
既往关于颅内动脉瘤预后因素的研究普遍认为Hunt-Hess分级是独立预后因素,年龄、高血压史、瘤颈宽度、手术方式及BMI对预后的影响存在较大争议[8]。本研究中,单因素分析及logistic回归分析提示Hunt-Hess分级、是否采用支架辅助弹簧圈栓塞及血清Sema3E水平是颅内动脉瘤不良预后的独立影响因素,初步证实血清高Sema3E水平可作为预测动脉瘤介入治疗后1个月不良预后的生物标记物。Hunt-Hess分级越高,患者入院病情越重,介入手术对于挽救生命及保留神经功能的收益越小。在本研究的单因素分析中,术前GCS评分与动脉瘤预后显著相关(P=0.000),而在logistic回归分析中并未呈现出独立预后因素特征,这可能与GCS评分系统中分数所代表病情严重程度的非线性有关。关于BMI是否是动脉瘤性SAH的预后保护因素,文献中结论不一,多个研究表明高BMI可以降低动脉瘤性SAH预后不良的风险[9,10],尤其对于接受介入治疗者[11],然而Rautalin等[5]2022年的系统评价显示BMI与动脉瘤性SAH的预后并无显著相关性。本研究也未显示BMI与颅内动脉瘤介入治疗后1个月预后相关。
本研究显示血清高Sema3E水平与颅内动脉瘤短期预后不良的相关性,我们推测其机制可能与炎症反应有关。颅内动脉瘤是动脉血管的管壁结构异常,主要影响血管分叉部位,病理学特征主要包括动脉壁退行性改变、内弹力层薄弱或消失、中层肌纤维变性和炎症细胞浸润等[12]。炎症反应是颅内动脉瘤发生发展及动脉瘤破裂后SAH的主要病理生理机制,因此Etminan等[13]提出动脉瘤实则是由炎症反应调控的炎症性疾病。炎症反应的基本病理特征是炎症细胞渗出,尤其是巨噬细胞介导的炎症反应在颅内动脉瘤发生发展机制中的作用一直是研究热点[14,15]。Shimizu等[16]观察到动脉瘤中浸润的巨噬细胞数量与动脉瘤的增大或破裂呈正相关,且编码单核细胞趋化蛋白1(巨噬细胞的主要趋化因子)的基因缺失或功能抑制可抑制颅内动脉瘤进展;特异性剥夺巨噬细胞中前列腺素E2受体2(PTGER2)或特异性抑制NF-κB核转位可显著抑制颅内动脉瘤发展。Mohammed等[17]2020年观察到Sema3E参与调控巨噬细胞对脂多糖诱导的全身炎症反应,这从不同角度对本研究结果相互佐证。本研究显示颅内动脉瘤预后不良的患者血清Sema3E水平显著升高,结合上述研究结果,考虑与动脉瘤或其破裂后SAH所伴随的炎症反应过度激活有关,从而影响颅内动脉瘤的进展与转归。值得注意的是,虽然既往研究证据提示该炎症反应可能是由巨噬细胞介导的,但由于本研究缺乏进一步的组织病理学研究,其具体病理生理机制尚不明确,在今后研究中应深入探讨巨噬细胞介导的炎症反应是动脉瘤破裂及血清Sema3E水平升高的原因,抑或这些因素均是动脉瘤破裂后SAH诱导的继发性改变。
颅内动脉瘤患者血清Sema3E水平升高的原因及继发性病理生理变化仍需深入研究,尤其具体的上下游调控机制及影响因素对于揭示动脉瘤的发生发展机制具有重要意义。炎症反应的另一个特点是伴随免疫细胞介导的免疫应答,尤其是来自活化CD4+细胞的辅助性T细胞(helper T cell,Th细胞)的特定亚组Th1细胞和Th17细胞。这两种细胞成分也称为促炎性T细胞,分别通过分泌γ干扰素和IL-17因子介导免疫反应[18]。CD4+细胞分化为Th1细胞和Th17细胞的过程是由NF-κB信号通路所介导的,而Sema3E的主要作用靶点之一也是NF-κB核转录因子。Kermarrec等[19]2019年报道Sema3E可以通过调节CD11C+和CD4+T细胞的通讯来减轻炎症反应,同时指出Sema3E可能是炎症性疾病的潜在治疗靶点。虽然上述研究所采用的是溃疡性结肠炎实验模型,但其揭示的病理生理机制与颅内动脉瘤具有高度一致性。据此我们推测,在病情较为严重的病例中,动脉瘤破裂后诱导的炎症反应及免疫应答较重,作为机体的适应性反馈,血清Sema3E水平升高以缓解炎症反应并调控免疫应答。
本研究显示血清Sema3E水平与颅内动脉瘤预后的关系,提示Sema3E可能是潜在的治疗靶点。既往多认为信号素家族与神经细胞的生长发育关系密切,而近来越来越多研究开始关注其对血管内皮细胞功能的影响,该领域将是未来血管性疾病的重要研究热点。Avouac等[20]通过高通量测序观察到内皮细胞中信号素的Sema3和Sema4亚型存在显著差异性表达,尤其在类风湿关节炎的内皮细胞、滑膜血管和血清中均过表达,提出Sema3E是炎症反应和血管生成的重要标志物,可能是调控炎症反应和促血管生成的有效靶点。该靶点与动脉瘤的研究尚未得到学术界关注,本研究结果为改善动脉瘤预后提供了新思路。
本研究样本量较小,未对logistic预后预测模型的敏感性及特异性进行验证,这将是我们下一步研究工作的重点。
综上,本研究结果显示颅内动脉瘤患者血清Sema3E水平与病情严重程度关系密切,血清Sema3E水平是颅内动脉瘤介入术后的独立预后因素,而且高Sema3E水平可作为预测动脉瘤介入治疗后不良结局的生物标记物。该结果提示Sema3E所介导的炎症反应或免疫应答在颅内动脉瘤的发生发展中发挥重要作用,信号素家族将是血管性疾病机制研究的重要靶点。

