柱撑壳聚糖的氢键密堆积结构制备生物安全的高性能保润材料
高 楠,郑 悦,李欢欢,臧婉辰,元 野,杨亚杰,金 哲
(东北师范大学化学学院,多酸与网格材料化学教育部重点实验室, 长春 130024)
保润剂又称水结合剂,在化妆品、 医疗保健、 食品和药品等领域发挥着重要作用[1~6]. 例如,保润剂可通过模拟皮肤保润系统,促进水分的吸收. 一方面,保润剂结合并保留环境中的水分,增加皮肤表面水分浓度,让水分向皮肤深层扩散; 另一方面,保润剂形成疏水屏障,减少皮肤表面水分流失,促进水分向皮肤深层扩散. 这类保润剂主要包括多元醇、 糖类及盐类等[7~12],在使用过程中会覆盖在基质的表面或掺杂在基质的内部[13~16]. 自开发以来,保润剂得到了快速发展,并广泛应用于各个领域[17~22].然而,传统保润剂也存在一些问题,例如: 多元醇(如丙二醇和丙二醇)的沸点较低,容易挥发和逸散;高沸点糖类和盐类具有紧密堆积结构,严重降低了水分子的保润性能[23~26].
多糖是由醛糖或酮糖通过糖苷键形成的一类天然高分子聚合物,具有来源丰富及分布广泛的特点,是构成生物体的四大基本物质之一. 现代研究表明,多糖不但具有调节免疫、 血糖、 血脂及抗癌、抗辐射、 抗菌、 抗病毒等多种药理活性,而且具有毒性低、 来源天然及安全性高等优点,在食品、 药品和化妆品开发等方面具有广阔的应用前景. 壳聚糖是天然多糖甲壳素部分乙酰化的产物,具有生物降解和生物相容性及无毒、 抗菌、 抗癌、 降血脂及增强免疫等多种生理功能[27~29]. 基于上述优点,壳聚糖及其衍生物被广泛应用于食品添加剂、 纺织品、 化妆品、 抗菌剂、 药物缓释、 基因转移载体等生物医药及日用化工领域. 研究表明,壳聚糖衍生物的吸水率约为典型保润剂透明质酸的两倍. 然而,壳聚糖分子链内部含有多重氢键,进而促使柔性链之间紧密堆积,这种氢键密堆积结构严重影响了保润剂的吸水和储水能力(羟基使用率小于20%)[30~33].
1969 年,Davankov 等[34]首次报道了以低密度、 刚性、 无定形、 微孔结构为特征的超交联聚合物(HCP). 随后,Lee等[35]以线型聚苯乙烯为前体,采用二乙烯基苯、 对苯二甲酰二氯和氯甲基甲醚等不同交联剂,通过Friedel-Crafts烷基化反应合成了一系列具有共价桥(苯环)的HCP材料[35]. 随着HCP材料成为研究热点,研究人员进行了大量相关材料的研究[35~41]. 超交联聚合物的最大比表面积可达2090 m2/g,能够很好地保持多孔结构,用于吸附和储存能量分子[42~45]. 受HCP固体的启发,壳聚糖结构单元中的—NH2基团很容易与酸反应形成多孔结构. 本文以苯甲酸为支柱,通过羧酸酐共聚反应制备了壳聚糖基多孔保润剂,疏水性苯环的存在能够将壳聚糖的氢键密堆积结构柱撑开来(Scheme 1). 氮气吸附实验表明,壳聚糖基多孔保润剂的比表面积比原来的壳聚糖增加了9倍多. 由于本文充分利用了分子内部的羟基基团,壳聚糖基多孔保润剂能够吸附大量水气,吸附量增加了3倍多,使用壳聚糖基多孔保润剂的试纸的失水率比使用商用丙二醇的试纸低20%以上.
1 实验部分
1.1 试剂与仪器
苯甲酸,纯度98%,北京J&K百灵威试剂公司; 壳聚糖,纯度98%,美国Fluka有限公司; 对甲基苯磺酸,纯度99%,上海Macklin有限公司; Hela细胞,武汉Procell生命科技有限公司; 胎牛血清的Iscove改良杜尔贝科培养基(IMMM,Gibco BRL),美国Sigma-Aldrich 公司; 噻唑蓝(MTT)检测试剂盒(Promega),上海酶联生物科技有限公司; 小鼠(雌性,42~56 d,体重18~23 g),河北亿思生物科技有限公司.
Nicolet Impact 410型傅里叶变换红外光谱仪(FTIR),美国Nicolet公司; Bruker D8 QUEST型X射线衍射仪(XRD),德国布鲁克公司; Netzch Sta 449c 型热重分析仪(TGA),德国耐驰Netzsch 公司; JEOS JSM 6700 型扫描电子显微镜(SEM)和JEM-2100 型透射电子显微镜(TEM),日本JEOL 电子株式会社;Quantachrome Autosorb-IQ型气体吸附分析仪,美国康塔仪器公司.
1.2 实验过程
1.2.1 壳聚糖基多孔保润剂的合成 在200 mL 反应釜中加入29.57 g 苯甲酸、 59.14 g 壳聚糖和1500 mL 甲苯. 搅拌30 min 后,将15.00 g对甲基苯磺酸(催化剂)缓慢加入上述混合物中[30~32]. 然后对溶液体系进行程序加热: 先在50 ℃下反应6 h,然后加热到90 ℃反应12 h. 加水回流10 h后,停止反应并过滤除去盐分,得到壳聚糖基多孔保润剂.
1.2.2 壳聚糖基多孔保润剂的负载 将250 mg 壳聚糖基多孔保润剂分散在5 mL 水中. 搅拌30 min后,将上述溶液均匀喷洒在50 g试纸上,然后将试纸置于恒温恒湿培养箱中培养48 h,使多孔保润剂与试纸充分渗透. 即得到壳聚糖基多孔保润剂负载的试纸.
1.2.3 细胞毒性试验 将Hela细胞在添加了5%(质量分数)胎牛血清的Iscove改良杜尔贝科培养基中培养,培养条件为37 ℃,5%(体积分数)CO2的空气. 在90 µL新鲜培养基中,以每孔10000个细胞的密度培养于96孔板上. 使用改良的MTT 检测试剂盒(Promega)检测细胞毒性. 用自动平板阅读器在490 nm波长下测定甲状腺素的吸附值.
1.2.4 小鼠毒性试验 所有小鼠均分组饲养(6 只/笼); 光-暗循环,温度(24±2) ℃,湿度(60±5)%,随机提供食物和水. 所有动物护理和实验程序均符合国际标准. 通过双抗体夹心酶联免疫吸附试验(ELISA)测定血清中IL-6和TNF-a的水平.
小鼠按体重口服10 mg/kg的壳聚糖基多孔保润剂12 h后,迅速取出主要器官组织(心、 肝、 脾、 肺和肾),放入液氮中冷却. 随后,在超低温下对上述样本进行切片,用苏木精-伊红(HE)染色法进行荧光染色.
2 结果与讨论
2.1 样品的结构和形貌表征
将壳聚糖分子于甲苯溶液中浸泡30 min,然后向上述体系中缓慢加入苯甲酸和对甲基苯磺酸. 将混合物加热至50 ℃反应6 h,再于90 ℃回流12 h,得到壳聚糖基多孔保润剂. 由图1(A)可以看出,所制备的保润剂在1557 和804 cm-1处出现了C=C 伸缩振动和苯环C—H 平面外弯曲振动的特征峰; 同时,位于3422 cm-1处—NH2的伸缩振动峰强度与壳聚糖相比明显降低,而位于1520 cm-1处的源于苯甲酸羧基的—C=O伸缩振动带明显增强. 上述特征峰的变化清楚地表明酸和氨基发生了中和反应,成功制备了壳聚糖基多孔保润剂.
通过X射线衍射分析对壳聚糖基多孔保润剂的结晶特性进行了表征. 参照壳聚糖基多孔保润剂的制备条件对壳聚糖分子进行了处理,将其浸入甲苯溶液中30 min,然后将混合物加热至50 ℃反应6 h,再于90 ℃回流12 h. 由图1(B)可见,壳聚糖基多孔保润剂粉末没有出现明显的衍射峰. TGA 结果表明,随着温度的升高,壳聚糖基多孔保润剂有两个失重过程. 第一阶段失重范围在200~400 ℃,对应低聚物成分的逸出; 第二阶段失重范围在400~550 ℃,归因于多孔保润材料的骨架分解. 以上结果表明,壳聚糖基多孔保润剂的结构稳定温度应该低于200 ℃,因此后期的掺杂和应用实验中,将操作温度控制在200 ℃以内.

Fig.1 FTIR spectra(A) and XRD patterns(B) of chitosan(a) and chitosan-based porous humectant(b)
SEM照片[图2(A)]显示,壳聚糖基多孔保润剂是由粒径为250~500 nm的小尺寸纳米粒子团聚而成的,可以均匀地分散在试纸表面. TEM照片[图2(B)]显示出壳聚糖基多孔保润剂具有无定形结构.

Fig.2 SEM image(A) and TEM image(B) of the chitosan-based porous humectant
2.2 样品的气体分子吸附性能
由图3(A)结果计算得出,壳聚糖粉末的Brunauer-Emmett-Teller(BET)比表面积(SBET)仅为2.7 m2/g,这是因为壳聚糖链之间通过氢键形成了紧密的堆积结构. 经苯甲酸填充后,壳聚糖基多孔保润剂的SBET超过了28.5 m2/g. 此外,壳聚糖基多孔保润剂的孔体积从0.01 cm3/g增加到约0.065 cm3/g.这些变化归因于壳聚糖基多孔保润剂中的刚性结构单元苯甲酸削弱了壳聚糖链的层间氢键相互作用,从而有利于客体分子的吸附和储存. 同时,利用密度泛函理论(DFT)方法计算了壳聚糖基多孔保润剂样品的孔径. 壳聚糖基多孔保润剂的孔径分布在8.2 nm左右,与壳聚糖(平均孔径2.6 nm)相比明显增大[图3(B)]. 孔体积和孔径的增大有力地证明了苯环片段能有效地将壳聚糖分子链柱撑开,从而形成较大的孔体积和较宽的孔径.
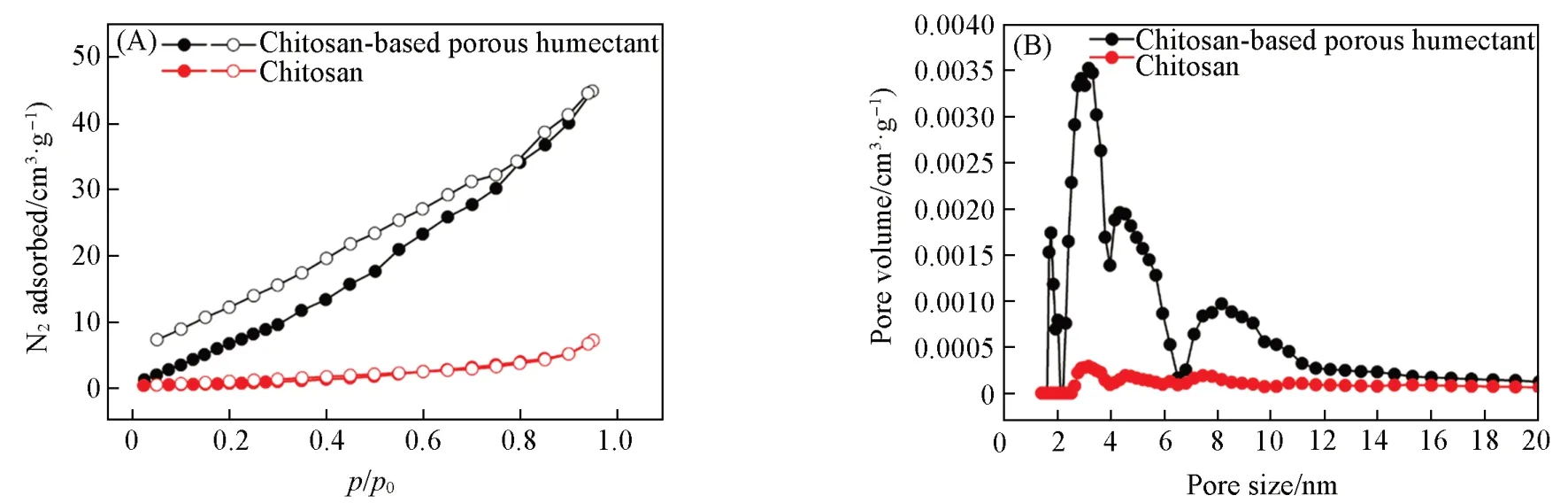
Fig.3 N2 adsorption-desorption isotherms(A) and pore size distribution(B) of Chitosan and chitosan-based porous humectant
由图4可见,壳聚糖样品的水蒸气吸附容量仅为5.0 cm3/g,而壳聚糖基多孔保润剂的吸附容量提高到21.6 cm3/g. 壳聚糖基多孔保润剂水蒸气容量对比壳聚糖样品提升3 倍多,这一提升能力远超过甘油、 1-丁基-3-甲基咪唑六氟磷酸盐以及胶体粒子网络保润剂材料[46~48]. 上述发现进一步证实,由于苯甲酸的柱撑作用,壳聚糖链之间的紧密堆积结构被破坏. 此外,壳聚糖基多孔保润剂的吸附和解吸等温线之间存在明显的滞后环,证明壳聚糖基多孔保润剂与水分子的相互作用能力很强.

Fig.4 Water adsorption-desorption isotherms of chitosan and chitosan-based porous humectant
2.3 样品的安全性分析
对于应用于人体的材料,需要预先考虑和严格证明其毒性在安全使用的范围. 因此,在进行进一步的保润应用之前,采用MTT法检测壳聚糖基多孔保润剂及其组合物的潜在生物毒性. 图5(A) 结果表明,与Hela细胞共同培养后,壳聚糖、 苯甲酸、 丙二醇和壳聚糖基多孔保润剂都没有明显的细胞毒性. 浓度差实验表明,壳聚糖基多孔保润剂在浓度高达20 mg/mL 时仍然没有明显的细胞毒性[图5(B)].
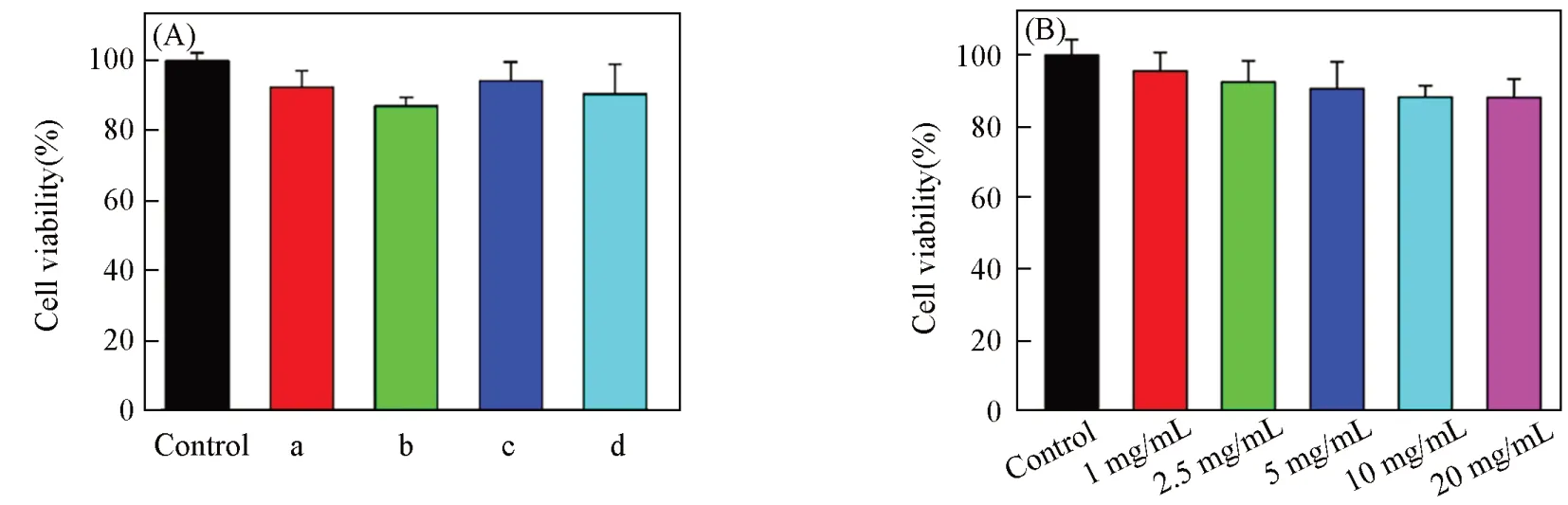
Fig.5 Results of MTT assays using Hela cell(A) Humectant: a. Chitosan; b. benzoic acid; c. propyl glycol; d. chitosan-based porous humectant.(B) Chitosan-based porous humectant of deifferent concentrations. Control: no humectant.
此外,给小鼠口服10 mg/kg的壳聚糖基多孔保润剂12 h后,制作主要器官组织(心、 肝、 脾、 肺和肾)的组织切片,并用苏木精-伊红(HE)染色. 结果表明,所有器官组织均未发现明显的器官损伤(图6),进一步证实了壳聚糖基多孔保润剂没有生物毒性.
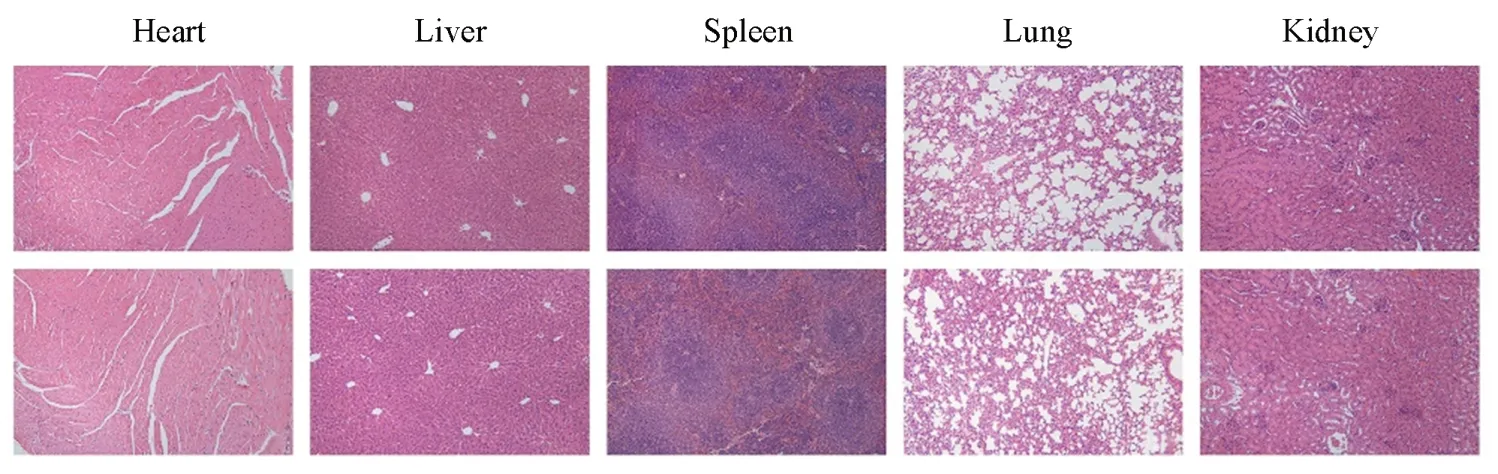
Fig.6 Tissue sections of the major organ tissues(heart, liver, spleen, lung and kidney) of the mice without(up) and with(down) chitosan-based porous humectant oral administration 10 mg/kgThe sections were stained with hematoxylin-eosin(HE). scale bar: 200 µm.
2.4 样品的保润性能
采用恒温水蒸气脱附法对壳聚糖基多孔保润剂的保润性能进行了系统测试. 将壳聚糖基多孔保润剂粉末按照1∶200的质量比添加到空白试纸中. 同时,选择空白试纸和添加了传统保润剂丙二醇的试纸作为参照物. 在恒温25 ℃和不同湿度条件下,对试纸的含水量进行了测试. 由表1可见,在相对湿度(RH)为30%和80%时,单纯试纸的含水量变化率分别为70.25%和66.26%; 加入传统保润剂丙二醇后,含水量的变化率变化不大,分别为69.21%和76.96%; 当将壳聚糖基多孔保润剂喷洒在试纸上时,含水量的变化率明显降低,分别为56.33%和60.87%.

Table 1 Comparison of the water adsorption-desorption behavior of the chitosan-based porous humectant
与丙二醇相比,壳聚糖基多孔保润剂在30%和80%相对湿度条件下的保水能力分别提高了18.61%和20.91%,这一结果表明,壳聚糖基多孔保润剂对试纸基材具有显著的保湿性能,与市场上广泛使用的丙二醇相比,其保润性能明显提高. 在已报道的常用保润剂(包括丙三醇、 丙二醇、 木糖醇、 甘油、 山梨糖醇、 糖类和其它化学物质等)中达到最高水平[49,50].
3 结 论
通过简单的中和反应合成了一种新型壳聚糖基多孔保润剂. 疏水性的苯环之间可以通过π-π作用形成疏水性区域,进而改变壳聚糖链之间的排列模式,破坏原始的氢键密堆积结构,形成大尺寸的空穴. 与原始壳聚糖相比,壳聚糖基多孔保润剂的比表面积增加了近10倍. 并且,细胞安全性实验和小鼠安全性测试表明,壳聚糖基多孔保润剂没有明显的细胞毒性,且小鼠口服之后,蛋白质水平均无明显变化,证实了壳聚糖基多孔保润剂没有生物毒性. 负载壳聚糖基多孔保润剂的试纸的失水率与商用丙二醇负载的试纸相比降低了20%以上. 本文展示了一种制备壳聚糖基保润剂的简单方法,可为今后设计高性能多孔吸附剂提供了参考.

