基于化学发光免疫技术检测念珠菌IgG抗体方法的建立与性能评估
李静静 王雪琦 孙娅顺 赵思琪 刘春龙 钟成 (.天津科技大学生物工程学院,天津 300457;.天津市侵袭性真菌病精准诊断技术企业重点实验室,天津300467)
近年来,侵袭性真菌病的发病致死率不断升高,调查数据显示,其中80%的感染由侵袭性念珠菌病引起[1]。此外,血源性感染是医院中最易发生的感染状况,其中念珠菌是主要致病菌,血源性感染引起的致死率在使用抗真菌相关的治疗手段后仍高居40%[2]。念珠菌是典型的条件致病菌,在人体肠道、口腔、阴道黏膜等常与其他微生物共存,当机体免疫力降低或外界环境对其进行给药活动时可能发展为致病菌,在情况严重时,念珠菌病会侵染到机体各组织及器官,最终导致生命受到威胁,在已发现的念珠菌种类中有超过15种会引发机体感染,而大多数念珠菌感染均由白色念珠菌、光滑念珠菌及热带念珠菌引起[3]。侵袭性念珠菌病的易感因素包括念珠菌定植、接受广谱抗菌药治疗、使用中央静脉导管、住院时间延长、入住ICU、烧伤、早产、中性粒细胞减少、全身应用糖皮质激素、HIV感染及糖尿病等[4]。目前,关于念珠菌抗原与抗体检测的相关研究逐渐增多,欧洲临床微生物与感染性疾病学会于2012年提出:β-D葡聚糖(Beta-D-glycan,BDG)与甘露聚糖均可作为念珠菌病临床相关的辅助诊断标志物[5]。BDG主要存在于大部分致病真菌细胞壁中,在检测念珠菌时的特异度和灵敏度均为75%左右,但在念珠菌病的早期诊断中假阳性检出率仍较高[6-7];甘露聚糖则存在于常见念珠菌属的细胞壁外侧,当人体受念珠菌侵染后,甘露聚糖具备的强抗原性激发人体免疫系统识别甘露聚糖产生抗甘露聚糖抗体,抗甘露聚糖抗体应用于念珠菌病的检测时其特异度可达到90%以上[8-9]。因此,建立一种高效的方法检测念珠菌甘露聚糖抗体对诊断念珠菌病在临床上具有重要意义。
目前,侵袭性念珠菌病的检测方法主要有真菌培养、组织病理学检查、酶联免疫吸附实验、PCR技术、G试验以及影像学检查,但微生物培养技术仍旧存在培养周期较长、灵敏度低等缺陷;PCR技术虽然能特异性检测出样本中的真菌核酸成分并有效区分所感染菌属种类,但该技术由于仪器昂贵、检验过程缺乏标准化及敏感性过高易产生假阳性等缺点而在临床早期诊断方面受限;ELISA检测方法对实验操作人员的技术要求较高,并且检测耗费时间过长(通常>2 h);G试验检测仅能判定是否为真菌感染,对念珠菌特定甘露聚糖抗体的敏感特异度较低;影像学检查费用昂贵,并不能作为对念珠菌病的早期快速诊断技术而普及[10-12]。近年来,化学发光技术不断发展,在体外诊断领域中由于其检测灵敏度高、线性范围宽、光信号持续时间长、检测结果稳定、实验误差小以及安全性能高等优势而被广泛应用[13-14]。相较传统检测手段而言,化学发光免疫分析技术能够在短时间内完成对样本中特定物质的检测,实验操作相对较简单,不需要对样本进行预处理,有效避免了检测过程中人为引起的误差[15]。
基于以上背景,本研究建立了一种快速检测血清样本中念珠菌甘露聚糖IgG抗体的条式化学发光技术。相对于裸磁珠体系,链霉亲和素-磁微粒能够与生物素-念珠菌甘露聚糖相结合并放大发光信号值;此外,该检测体系联合使用间接法与“两步两清洗”检测有效避免了免疫检测时易发生的钩状效应(HOOK效应)。建立该检测体系后对相关性能指标进行评价,为临床上侵袭性念珠菌病的早期诊断提供一种更加快速高效的辅助检测手段。
1 材料与方法
1.1 材料 本研究所用念珠菌甘露聚糖抗原、羊抗人IgG抗体、念珠菌IgG抗体检测试剂盒(酶联免疫吸附法)、样本稀释液、发光底物及试剂条等均由丹娜(天津)生物科技股份有限公司提供;链霉亲和素-磁微粒、N-羟基丁二酰亚胺(N-Hydroxy succinimide, NHS)活化生物素和碱性磷酸酶购自赛默飞世尔科技公司;血红蛋白、胆红素、三酰甘油及其他盐类试剂购自国药集团化学试剂有限公司。本研究所用样本收集于四川大学华西医院。本研究经四川大学华西医院临床试验伦理审查委员会批准,[2021年临床试验(器械)审(41)号],采集时间为2022年,对采集样本进行编号后置于-20 ℃保存备用。
全自动化学发光免疫分析仪(成都宜乐芯生物科技有限公司,lumilite8);全自动酶标仪(TECAN迪肯酶标仪,Infinite M200)。
1.2 方法
1.2.1 检测方法的建立 生物素标记念珠菌甘露聚糖抗原:使用0.02 mol/L pH=7.4的磷酸盐缓冲液(PBS)将念珠菌甘露聚糖抗原稀释至1 mg/ml,以摩尔比1∶40加入相应的NHS活化生物素,振荡混匀后避光置于室温反应2 h。反应结束后用0.02 mol/L pH=7.4 PBS透析纯化反应产物,4 ℃保存备用。
碱性磷酸酶标记羊抗人IgG抗体:将碱性磷酸酶以10 mg/ml浓度溶于0.1 mol/L pH=6.8的PBS中,加入戊二醛使得终浓度为1.25%,室温过夜反应后透析以除去过量戊二醛;将羊抗人IgG抗体以10 mg/ml浓度溶于0.5 mol/L pH=9.5的碳酸盐缓冲液(CBS)中,将活化的酶溶液以(每4 mg酶加入1 mg抗体比例)加入上述抗体溶液,4 ℃过夜反应;采用0.2 mol/L赖氨酸- CBS溶液(0.5 mol/L pH=9.5)加入反应体系,4 ℃反应1 h终止反应,反应产物用0.02 mol/L pH=7.4 PBS透析纯化后加入50%甘油,-20 ℃保存备用。
使用标记完成的生物素-念珠菌甘露聚糖抗原(bCA)与链霉亲和素-磁微粒混合反应,加入碱性磷酸酶标记的抗人IgG抗体(AP-IgG)后检测不同阴阳性样本以验证生物素与念珠菌甘露聚糖是否成功标记,进而确定本研究方法最适的bCA与AP-IgG反应浓度[选取bCA不同浓度(0.5、1.0、1.5、2.0 μg/ml)与AP-IgG不同浓度(0.5、1.0、1.5、2.0 μg/ml)进行正交试验],最终建立一种检测血清样本中念珠菌甘露聚糖IgG抗体的方法。
1.2.2 分析灵敏度 依据参考指南Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures;Approved Guideline-Second Edition(EP17-A02)对检测体系的分析灵敏度进行评估验证。
空白限(limit of blank, LoB)评估方法:选取5例空白样本,同时使用2台全自动化学发光免疫分析仪持续测试3 d,其中每个空白样本每天均进行3次平行试验,测试完成后评估检测方法的LoB。检出限(limit of detection,LoD)评估方法:确定LoB,选取5例低浓度样本(1~1.5 LoB),同时使用2台全自动化学发光免疫分析仪,持续测试3 d,每天每个样本均需进行3次重复试验,测试完成后评估检测方法的LoD。
1.2.3 精密度与重复性 使用双因子嵌套方差分析方法对本研究方法重复性及精密度进行评价。选取5个不同浓度样本以及2个质控品持续测试10 d,使用2批次试剂每天对每个样本进行6次生物学重复试验,最终使用标准差SD值与变异系数%CV值表示精密度及重复性。
1.2.4 分析特异性 随机选取高、中、低浓度曲霉IgG抗体(GM-IgG)、结核分枝杆菌IgG抗体(TBIgG)、肺炎支原体IgG抗体(MP-IgG)以及肺炎衣原体IgG抗体(CP-IgG)阳性样本数例,使用本研究所建立方法进行检测判定体系是否存在交叉反应。
选取高、低浓度阳性样本与阴性样本,分别加入不同剂量血红蛋白、三酰甘油和胆红素进行测试,将加入不同干扰因子后的测试浓度与加入前浓度进行对比,计算相对偏差(RD)对本研究建立体系的特异性进行评价。
1.2.5 方法学对比 使用念珠菌IgG抗体检测试剂盒(酶联免疫吸附法)与本研究建立方法分别对150例临床样本进行检验分析,参照CLSI EP12-A2指南推荐方法、回归分析与偏差分析对两种方法以及一致性程度的95%置信区间进行评价;并计算Kappa值以描述两种方法一致性强度(一致性强度分区为极强:0.81<Kappa值<1.00,较强:0.41<Kappa值<0.80,弱:0.21<Kappa值<0.40,较弱:0<Kappa值<0.20,极弱:0<Kappa值[16-17])。
1.3 统计学处理 本研究数据处理均使用Med-Calc、Minitab 18和Excel 2019软件进行分析。检测方法所使用标准曲线由最小二乘法进行线性拟合得到。样本浓度均使用全自动化学发光免疫分析仪中四参数Logisitic拟合曲线进行计算。
2 结果
2.1 检测体系建立 使不同浓度的bCA与AP-IgG进行正交试验,并记录阴阳性样本信号值比值(P/N值)如图1所示,生物素与念珠菌甘露聚糖成功标记产生有效光信号值,在图1中表明不同浓度bCA与AP-IgG反应时P/N值会随之变化;经验证确定bCA与AP-IgG浓度均为1 μg/ml时,样本P/N值呈现较高峰值(P/N=25.06)。在最优条件下,使用浓度为10、25、50、100、250、500 ng/ml的标准品建立该检测体系标准曲线如图2所示,念珠菌甘露聚糖IgG抗体检测体系线性回归方程为y=1.74×107-1.74×107/[1+(x/199 71.03)],线性相关系数R2为0.998 7,符合临床应用技术标准。

图1 不同浓度bCA与AP-IgG对样本P/N值的影响Fig.1 Effect of different concentrations of bCA and APIgG on P/N values of samples
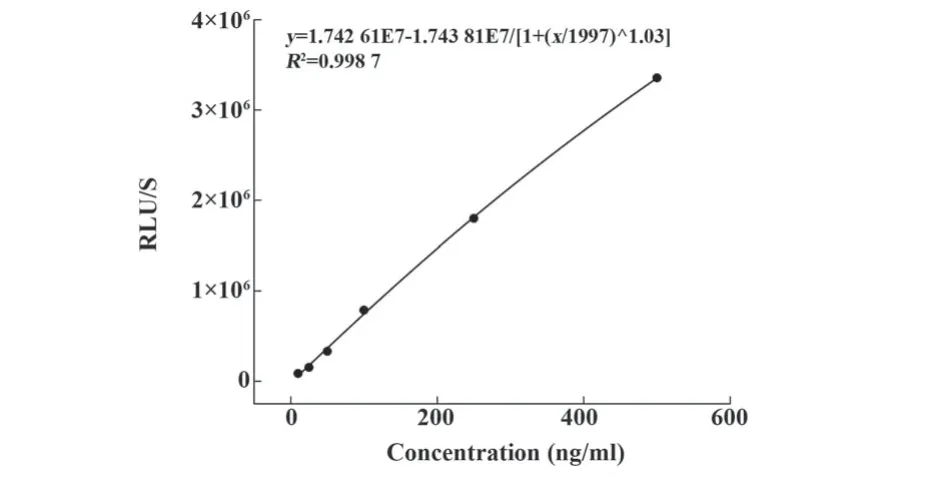
图2 检测体系标准曲线Fig.2 Standard curve for testing system
因此,本研究方法所使用生物素与多糖类标记方法可行,基于化学发光免疫技术检测样本中念珠菌甘露聚糖IgG抗体的方法初步建立。
2.2 灵敏度分析 根据EP17-A2指南所述方法计算并验证检测体系LoB与LoD,确定本研究建立体系LoB为5.20 AU/ml,LoD为5.50 AU/ml。
2.3 精密度与重复性 使用双因子嵌套方差分析方法,评价本研究建立体系精密度与重复性,结果如表1所示,以SD值与CV值表示的重复性评价中,CV值均<10%,证明在外界因素尽可能相同的情况下,使用本研究所建立体系检测同一样本时具有较高一致性。另一方面,室内精密度与批间精密度评估结果CV值同样均<10%,表明所建立体系在实验室内进行时不同批次间存在的变异性较小。因此,关于精密度与重复性的分析结果表明本研究方法能够满足临床相关辅助诊断技术的要求;同时,该分析方法也可以应用于相关检测仪器的故障排除工作中,从而进一步提高相关辅助诊断技术的临床准确性。
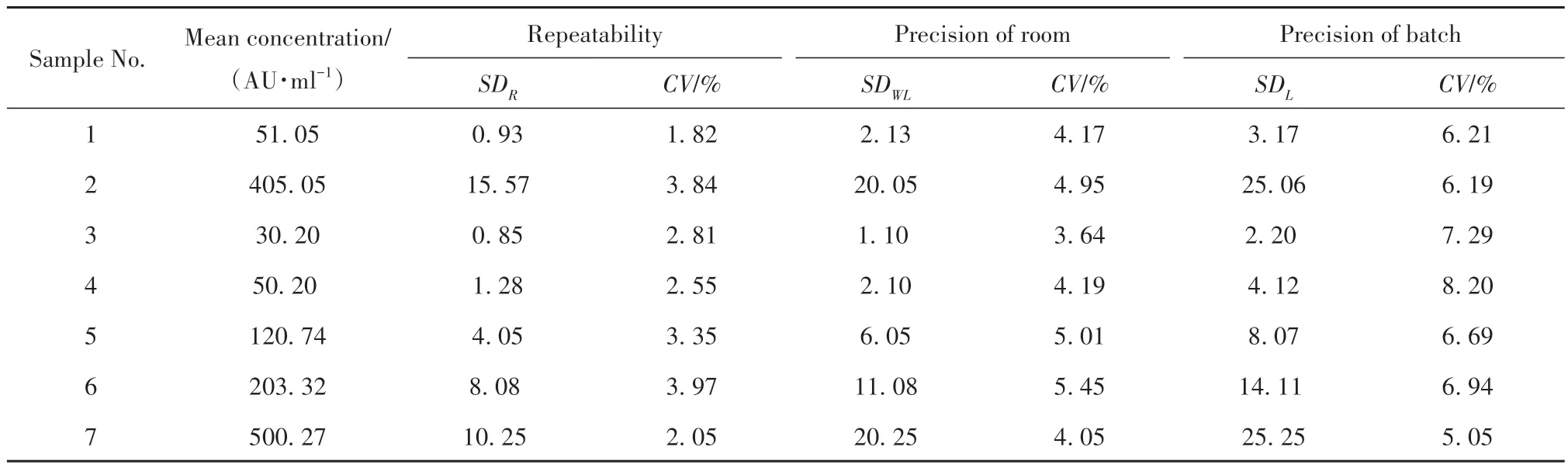
表1 精密度与重复性检测结果Tab.1 Precision and repeatability test results
2.4 分析特异性
2.4.1 交叉反应 对临床诊断过程中易发生交叉反应的特异性病原体样本进行检测,检测结果证明(图3)使用本研究建立体系所测含有不同特异性抗体阳性样本浓度值基本与念珠菌IgG抗体阴性(CAIgG)样本检测结果一致。因此,常见特异性抗体对本研究方法不存在交叉影响。
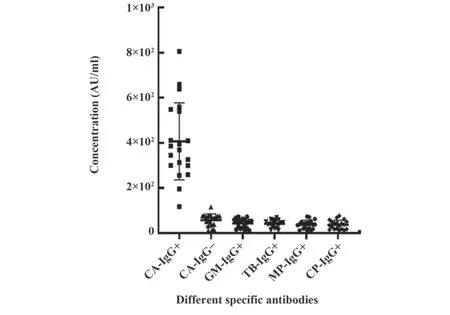
图3 本研究体系检测可能存在交叉反应特异性抗体结果Fig.3 Testing system detects possible cross-reactive specific antibody results
2.4.2 干扰因素 临床诊断时样本会出现病理性溶血或技术性溶血,进而导致样本检测结果受到干扰,见表2。当血红蛋白浓度<0.5 mg/ml时会出现肉眼不可见的非显性溶血现象;当浓度>5 mg/ml时则会出现重度溶血现象。实验结果表明,在不同浓度样本中添加血红蛋白含量高达7 mg/ml时对检测结果仍无显著干扰。正常人血清样本中三酰甘油最高可达1.7 mmol/L,本研究结果证明,在不同浓度样本中添加三酰甘油含量高达7.5 mmol/L时,检测结果的相对偏差均<10%。因此,样本中添加三酰甘油对本研究所建立体系的检测结果并无干扰。临床检验时血清样本中总胆红素正常含量范围为2.98~10.00 mg/L,重度黄疸患者总胆红素含量范围为200~300 mg/L。检测结果表明,当各浓度样本中胆红素含量达到300 mg/L时,检测结果RD仍低于10%。因此,样本中胆红素含量<300 mg/L时对本研究体系检测结果无影响。
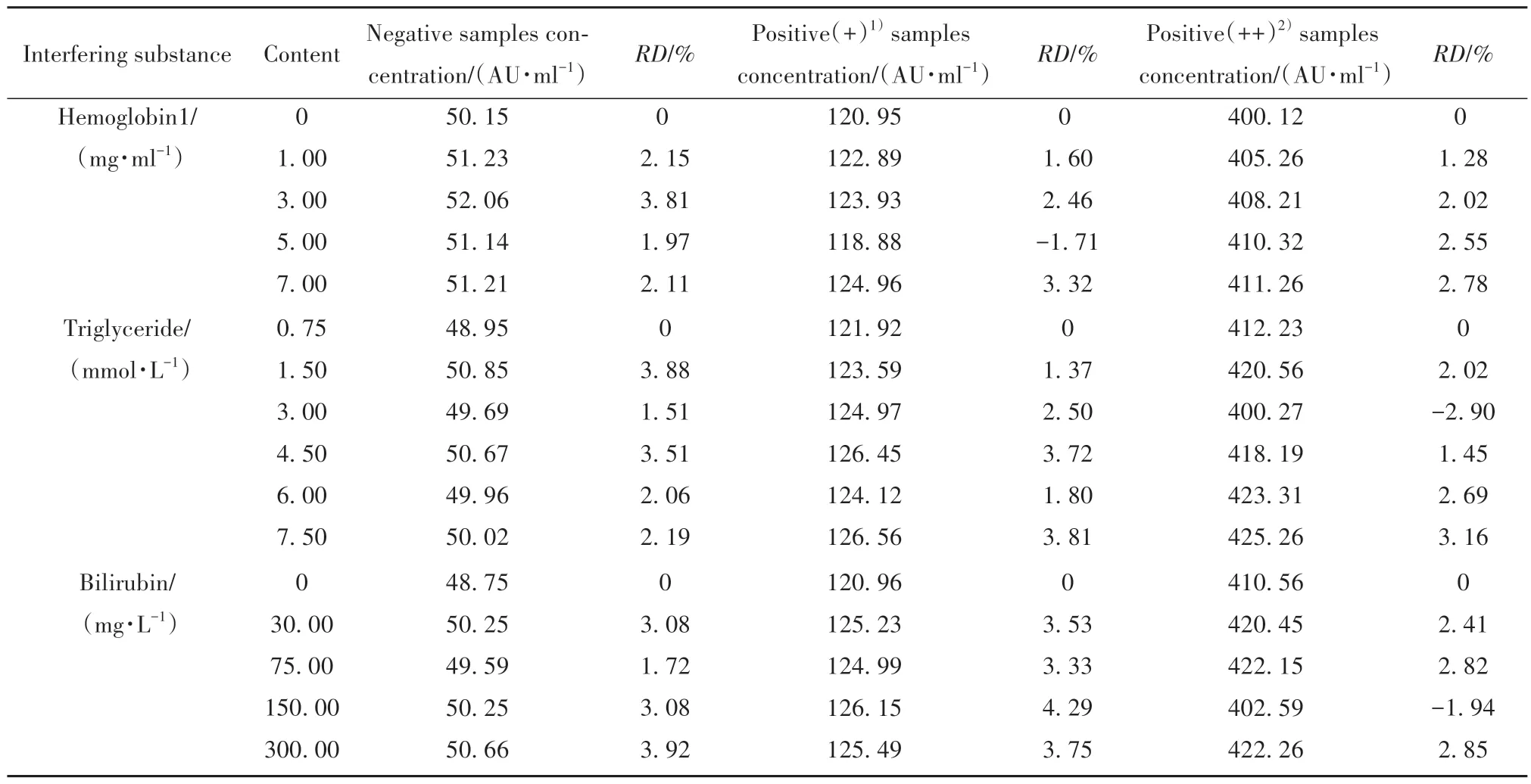
表2 添加不同含量常见干扰物质后对本研究方法检测结果的影响Tab.2 Effects of adding different contents of common interfering substances on detection results of this research method
2.5 方法学对比 参照指南分别使用ELISA法与本研究方法对临床来源样本进行检测并对结果进行回归分析与偏差分析。两种方法的回归分析表明二者相关程度较高(R2=0.989 8,图4),初步证明两种检测体系一致性较好。此外,如图5,在检测结果偏差分析中设定95%置信区间为检测上下限,结果表明96%的本研究方法与ELISA法在一致性范围内,即两方法的最大差异性在临床检测可允许发生范围内。
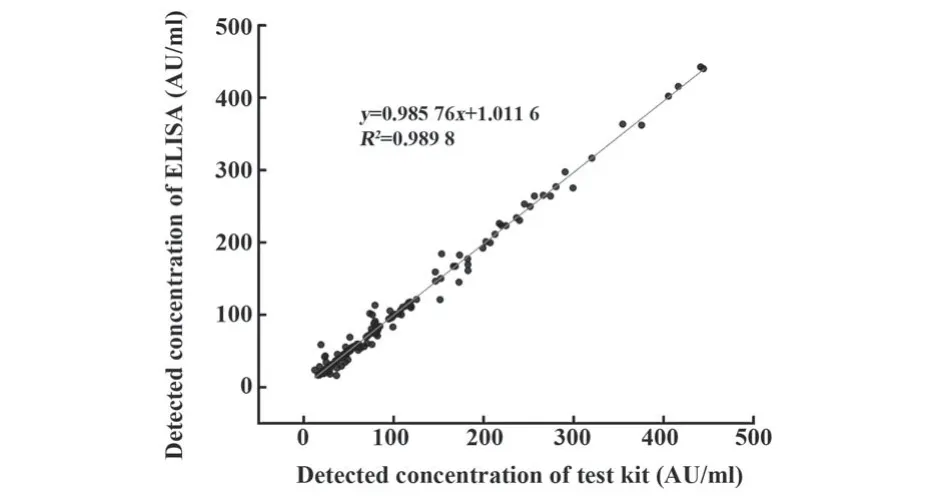
图4 两种方法学回归分析(n=150)Fig.4 Two methods of regression analysis (n=150)
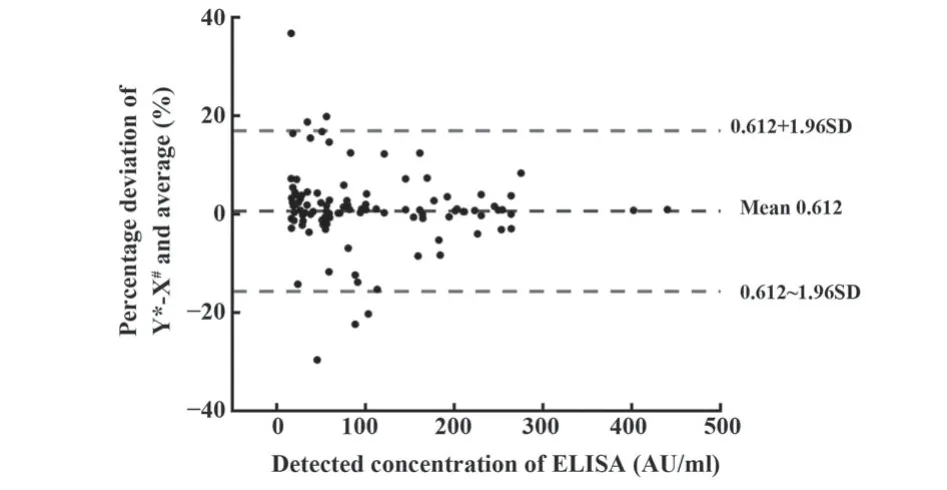
图5 检测结果偏差分析Fig.5 Deviation analysis of detection results
使用2×2列联表与Kappa值对两种方法检测的一致性强度进行评估,检测结果如表3所示,两种检测方法的阳性符合率为87.5%,阴性符合率为90.8%,总体符合率为90%;根据Kappa值公式计算出两方法的Kappa值为0.80,即二者具有较强的一致性强度。综上所述,本研究建立检测体系与现有检测方法具有较好一致性,可以将本研究方法应用于念珠菌病的临床辅助诊断。
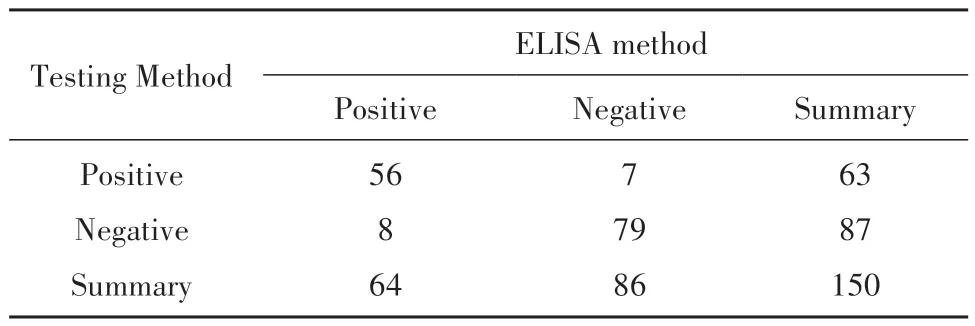
表3 本研究方法与ELISA法检测150例临床样本结果Tab.3 This method and ELISA were used to detect results of 150 clinical samples
3 讨论
目前,关于念珠菌病的检测试剂盒主流市场多为ELISA法与PCR检测方法,其中ELISA法的应用虽具有较高认可度,但在检测过程中也存在不可避免的劣势:①检测过程中对操作人员技术要求较高,易出现人为因素引起的误差;②检测时平行性与时效性较差。而PCR检测手段则存在技术要求高且试验仪器较昂贵等弊端。因此,较于现有检测技术,本研究建立一种基于化学发光免疫技术的念珠菌甘露聚糖IgG抗体检测方法,其具备灵敏度高、信号值持续时间长、分析方法便捷、检测结果稳定且误差小以及安全性高等优点。近年来,传统化学发光平台多使用裸磁珠体系与大型全自动发光设备,但因其设备较大、管路清洗复杂导致检测重复性差等缺陷在使用上存在限制性。
综合考虑上述问题,本研究选用小型化学发光平台与独立条式样品架以解决设备占用面积大、管路清洗复杂而干扰实验结果等问题;在此基础上选用链霉亲和素-磁微粒为载体,生物素标记抗原与其多位点结合进一步增强发光信号值。对本研究所建立检测方法进行系列性能评估,经分析评价确定检测方法LoB为5.20 AU/ml,LoD为5.50 AU/ml,较现有ELISA检测技术(分析灵敏度为17.50 AU/ml)有所提高;精密度与重复性方面,CV值均<10%表明检测方法可行性的同时实验误差较小;对于所建立检测方法的分析特异度方面,常见干扰物质与易发生交叉反应的特异性抗体对其均无显著性影响。此外,对确诊临床样本使用本研究所建立方法进行检测发现,使用所建立检测方法检测时阴、阳性样本符合率均>85%;在方法学一致性分析方面,本研究体系与ELISA法具有较强的一致性强度,且本研究方法与ELISA法的检测差值符合95%置信区间浮动的要求,回归分析中二者相关系数R2=0.989 8>0.975 0也证明两种方法具有较高一致性,均满足临床检测需求。
因此,根据相关性能评价与分析,以链霉亲和素-磁微粒为载体,与生物素标记念珠菌甘露聚糖相结合,在碱性磷酸酶偶联羊抗人IgG抗体作为发光标志物与发光底物进行检测的方法成功建立。同时,该检测方法相关性能指标均符合临床诊断技术的要求,与现有产品一致性强度较高,为未来念珠菌病的临床诊断提供了一种更加高效且便捷的检测技术。

