人SLC15A3基因及蛋白质的生物信息学分析
钟璐璐 周峰 彭佳欣 谭洋 裴刚
(1.湖南中医药大学药学院,长沙 410208;2.湖南省普通高等学校中药现代化研究重点实验室,长沙 410208)
溶质载体15A3(solute carrier 15A3,SLC15A3,又称PhT2)是质子偶联寡肽转运体(proton-coupled oligopeptide transporters,POTs)家族成员,负责某些二肽及组氨酸跨生物膜转运[1]。研究显示SLC15A3基因参与调控固有免疫应答和炎症反应,其表达上调可能是炎症进展的原因[2]。
炎症是固有免疫系统对病原体或损伤的一种反应,通过模式识别受体识别相关病原分子启动下游信号通路,这些受体包括Toll样受体(Toll-like receptors,TLRs)和核苷酸结合寡聚结构域(nucleotidebinding oligomerization domain,NOD)样受体(NLRs)[3]。巨噬细胞是炎症反应的主要效应细胞,SLC15A3被发现在脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞中高表达[4-5]。LPS与细胞膜上的TLR4受体特异性结合,激活NF-κB,上调SLC15A3表达,此作用可被NF-κB抑制剂逆转,表明SLC15A3表达受NF-κB信号调控[2]。此外,TLR2、TLR7及TLR9激活也能上调SLC15A3基因表达[2]。SLC15A3基因通过将NOD的2个配体胞壁酰二肽(muramyl dipeptide,MDP)和胞壁酰三肽(L-Ala-γ-D-Glu-meso-diaminopimelic acid,tri-DAP)转运至胞质受体,触发NOD依赖性免疫应答[6]。MDP刺激SLC15A3沉默的树突状细胞后,IL-6和IL-1β的产生与野生型细胞相比显著减少[7];相反,过表达SLC15A3细胞受MDP刺激时,炎症因子产生增多,细胞免疫应答增强[8]。研究SLC15A3表达调控机制对进一步研究其在炎症疾病发生、发展中的作用具有重要意义。为了系统分析SLC15A3基因及编码蛋白的性质和功能,本研究利用生物信息学方法进行预测,期望有助于人SLC15A3基因表达调控机制研究的开展。
1 资料与方法
1.1 资料 人SLC15A3基因Gene ID:51296,mRNA登录号:NM_016582.3。人、大鼠、小鼠、猫和牛SLC15A3蛋白UniProtKB分别为:Q8IY34、Q924V4、Q8BPX9、M3WJ98和F1MYU7。
1.2 方法 在NCBI网站中以“SLC15A3”为关键词,获得人SLC15A3基因上游-2 000 bp~-1 bp序列,作为SLC15A3基因可能的启动子序列。使用TSSW和Neural Network Promoter Prediction启动子软件对人SLC15A3基因启动子序列进行分析。将人SLC15A3基因启动子序列输入JASPAR、PROMO和AliBaba 2.1网站对启动子区域转录因子结合位点进行预测。利用EMBOSS、MethPrimer和CpG finder网站预测人SLC15A3基因2 000 bp启动子区域甲基化CpG岛。使用SNP Function Prediction对人SLC15A3基因启动子单核苷酸多态性(single nucleotide polymorphism,SNP)位点进行预测。从Uniprot数据库中获取SLC15A3蛋白基本信息,分别使用ProtParam和ProtScale在线工具分析人SLC15A3蛋白理化性质和亲疏水性。采用DNAMAN对不同物种来源SLC15A3蛋白进行同源性分析,并使用MEGA-x构建系统进化树。使用SOPMA和SWISS-MODEL在线工具预测蛋白二级结构和三级结构。利用STRING数据库对蛋白相互作用关系进行分析。所用数据库及网址见表1。

表1 本研究所用数据库及网址Tab.1 Databases and websites used in this study
2 结果
2.1 人基因SLC15A3基本信息 SLC15A3基因在Genebank中的登录号为NC_000011.10,位于人11号染色体长臂1区2带2亚带(11q12.2),基因全长15 093 bp(60 937 084~60 952 176 bp),由9个外显子和8个内含子组成。常表达于肺、脾、骨髓及肠等组织。
2.2 人基因SLC15A3启动子预测 TSSW预测到该基因有1个启动子,位于551 bp;Neural Network Promoter Prediction数据库未发现该基因启动子。
2.3 人SLC15A3基因转录因子及其结合位点分析 利用JASPSR软件对人SLC15A3基因启动子区转录因子结合位点进行预测,Relative profile score threshold分别选择80%、85%、90%、95%及100%时,获得正负链转录因子结合位点数依次为1 702个、352个、165个、53个和2个,Relative profile score threshold为95%时转录因子结合位点部分预测结果见表2。
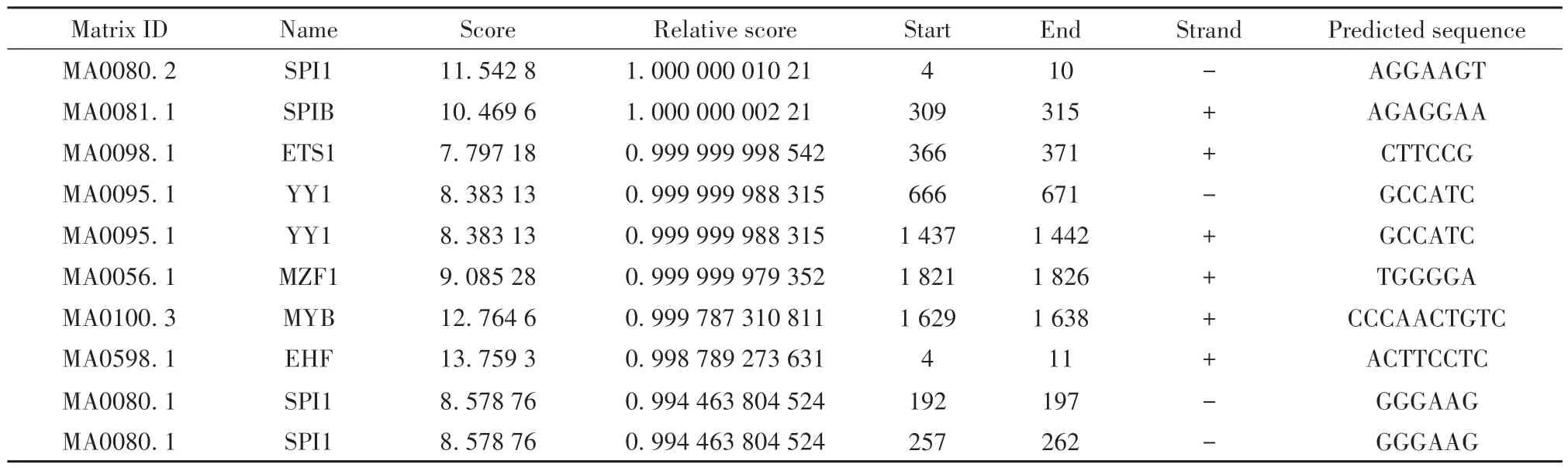
表2 JASPAR软件预测人SLC15A3基因启动子区转录因子结合位点部分结果Tab.2 Analysis part results of transcription factor binding sites in promoter region of human SLC15A3 gene predicted by JASPAR
使用PROMO数据库对人SLC15A3基因启动子区转录因子结合位点进行预测,共获得62个转录因子结合位点(图1),涉及YY1、XBP-1、GR-alpha、TFⅡ-Ⅰ、C/EBPbeta、AP-2alphaA和NF-1等。AliBaba 2.1联结TRANSFAC 4.0数据库,获得人SLC15A3基因255个转录因子结合位点(图2),主要包括Oct-1、Sp1、ETF、NF-1和RAR-alpha等,两种软件预测得到结合位点位置相同的转录因子共16个,包括YY1、C/EBPbeta、NF-1、RXR-alpha、c-Jun、ETF、Sp1、NFκB、PU.1、C/EBPalpha、GR、AP-1、c-Fos、RAR-beta、GATA-1和WT1。

图1 PROMO 预测人SLC15A3基因启动子区域转录因子结合位点结果Fig.1 Results of transcription factor binding sites in promoter region of human SLC15A3 gene predicted by PROMO

图2 AliBaba2.1预测人SLC15A3基因转录因子结合位点部分结果Fig.2 Part results of transcription factor binding sites in promoter region of human SLC15A3 gene predicted by AliBaba2.1
2.4 人SLC15A3基因启动子区CpG 岛及SNP预测分析 利用EMBOSS、CpG Finder和MethePrimer分析人SLC15A3基因上游2 000 bp,结果显示无CpG岛。运用SNP Function Prediction进行功能预测和种族特异性等位基因频率查询,结果显示rs11230691、rs11230693、rs11423328、rs11600411、rs11606608、rs17156016、rs17704641、rs34883413、rs35043745、rs35958610、rs7930736和rs896830保守性极低,其中rs17156016、rs17704641和rs896830等位基因具有人种差异,北欧西欧血统美国犹他州人(CEU)、中国北京汉族人(CHB)、日本东京人(JPT)和尼日利亚约鲁巴人(YRI) 4个种族中等位基因频率存在差异,CHB和JPT两个种族等位基因频率基本一致(表3)。进一步分析人SLC15A3基因启动子区等位基因和非同义SNP等信息,结果见表4。
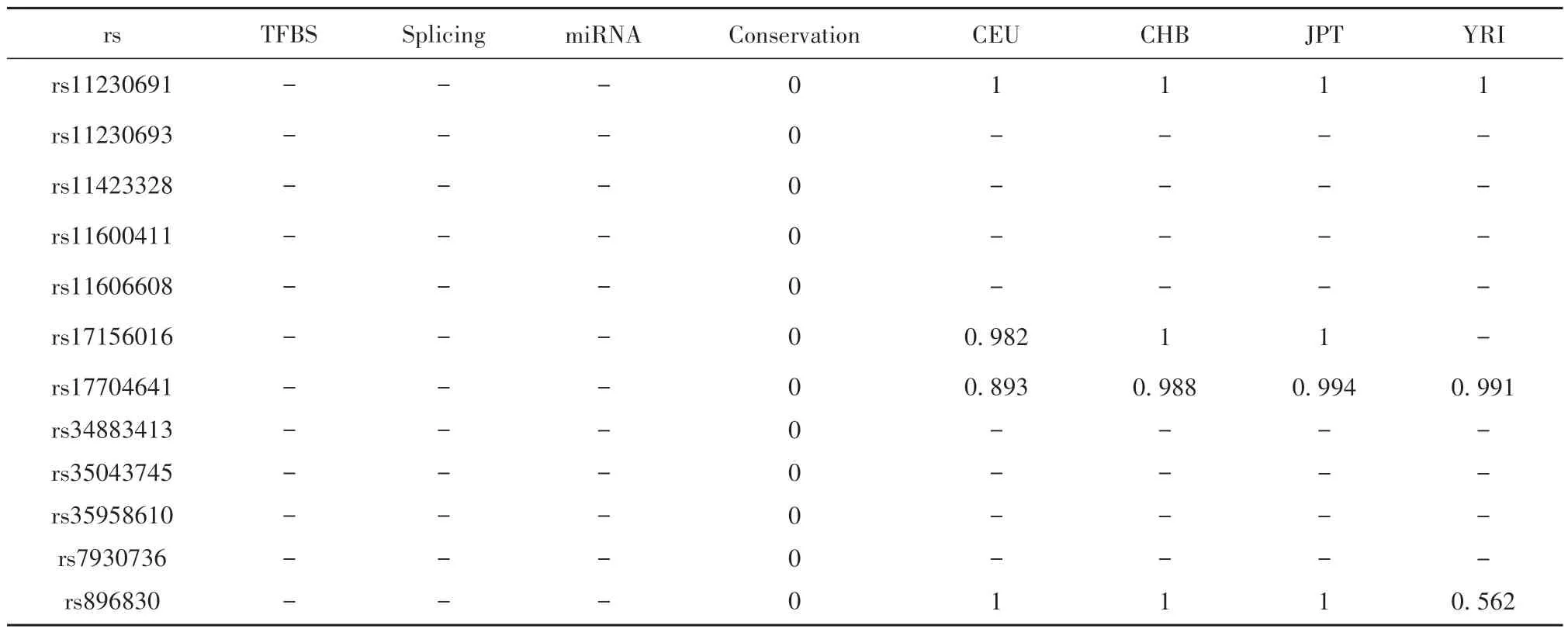
表3 人SLC15A3基因启动子区SNP功能信息和种族特异等位基因频率预测Tab.3 Prediction of functional information and race specific allele frequency of SNP in promoter region of human SLC15A3 gene
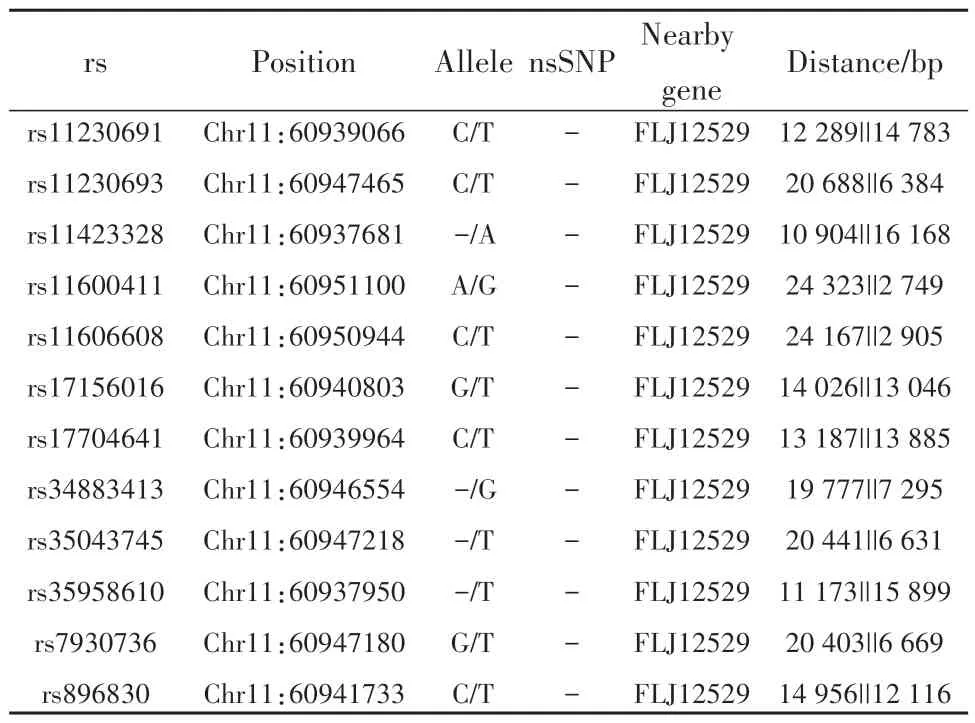
表4 人SLC15A3基因启动子区 SNP 预测Tab.4 SNP prediction of promoter region of human SLC15A3 gene
2.5 人SLC15A3蛋白的理化性质 SLC15A3蛋白总分子式为C2929H4543N769O767S27,含581个氨基酸残基,相对分子量为63 559.50,原子总数为9 026个,理论等电点为9.27。581个氨基酸残基中碱性氨基酸残基(Arg+Lys)总数为43,酸性氨基酸残基(Asp+Glu)总数为30。不稳定系数为47.70,属于不稳定蛋白。体内半衰期30 h,脂肪系数为106.99,亲水值为0.409,表明该蛋白为疏水性蛋白。进一步应用ProtScale在线亲/疏水性软件获得 SLC15A3蛋白亲/疏水性序列分析图谱(图3)。第282位丙氨基酸(A)分值为-2.911;疏水性最强位点是位于第384位的亮氨基酸(L),分值为3.500。581个氨基酸(5~581)中有365个(63.37%)分布于score>0区,表明SLC15A3蛋白存在大量疏水域,属于疏水性蛋白。预测结果与理化性质中的疏水性结果一致。

图3 人SLC15A3蛋白质的亲(疏)水性分析Fig.3 Hydrophilicity/hydrophobicity analysis of human SLC15A3 protein
2.6 SLC15A3蛋白序列比对和同源性分析 蛋白序列比对结果(图4)显示,人、大鼠、小鼠、猫和牛的SLC15A3蛋白氨基酸序列同源性高达87.91%,说明哺乳动物中SLC15A3具有高度同源性,蛋白序列保守性较高,推测其在其他物种中的生理功能可能与在人体中的生理功能相同。基于最低Bayesian Information Criterion分数值、模型更合适的原则,选择JTT模型,选择Neighbor Joining 建树方法构建系统进化树(图5)。结果显示人、大鼠和小鼠进化距离极小,说明SLC15A3蛋白在人、大鼠和小鼠中具有高度保守性。
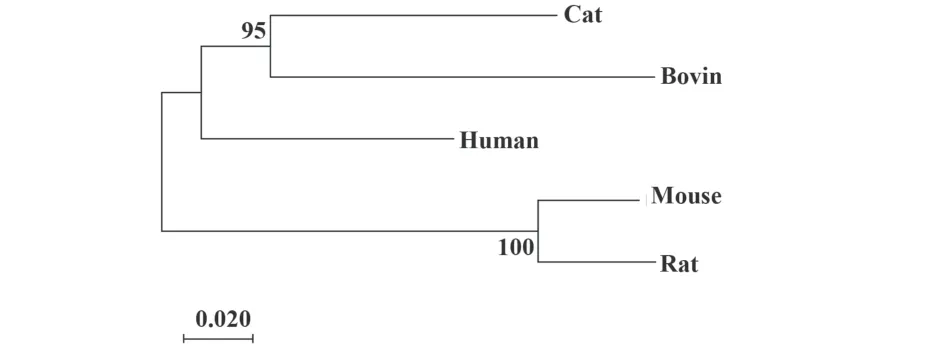
图5 人SLC15A3蛋白系统进化树Fig.5 Phylogenetic tree of human SLC15A3 protein
2.7 SLC15A3蛋白二级、三级结构预测 SLC15A3蛋白二级结构预测如图6所示。α-螺旋(Hh)270个(46.47%),无规卷曲(Cc)227个(39.07%),延伸链(Ee)67个(11.53%)及β-转角(Tt)17个(2.93%)。说明该蛋白结构主要元件为α-螺旋和无规卷曲,延伸链和β-转角仅在局部出现。将人SLC15A3氨基酸序列上传SWISS-MODEL采用同源建模法得到4个三级结构预测信息(图7)。图片展示了4种模型蛋白三级结构和同源蛋白质相似性波形图。4个模型中A模型GMQE值为0.53,同源性为26.71%,序列相似性为0.34,相似性波形图预测值较高且稳定,覆盖率为0.86,说明模型A更可信。使用The Structure Analysis and Verification Server进行拉曼图分析,进一步分析结构可信度,拉曼图中区域由白到红,颜色越深表明该区域二面角越合理。拉曼图(图8)中,392个氨基酸处于拉曼图的核心容许区(红色),占84.5%,57个氨基酸处于额外容许区(黄色),占12.3%。容许区氨基酸数比例超过90%,表明该模型A预测结构形成的二面角稳定可靠。
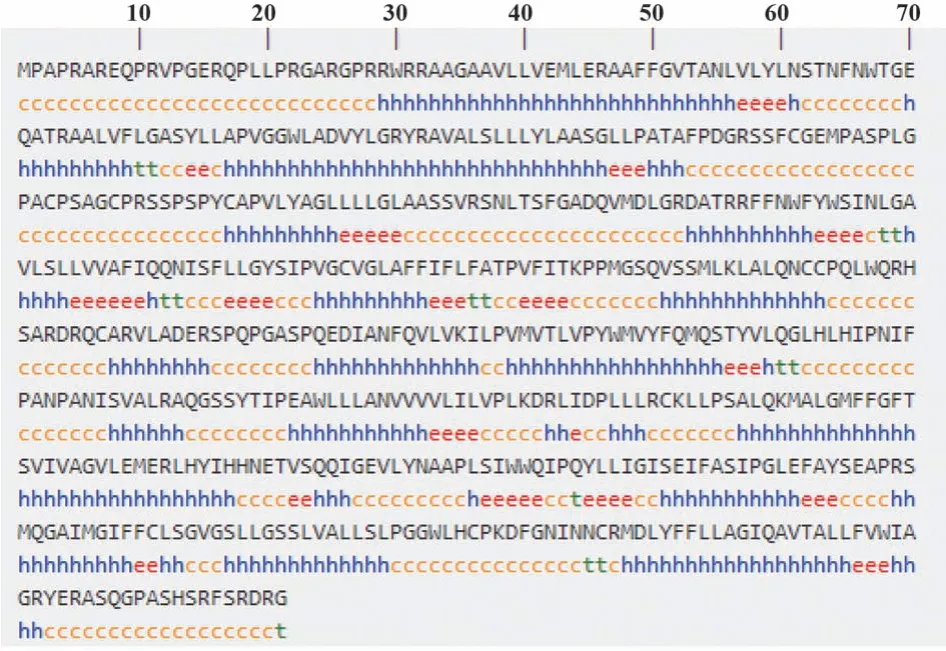
图6 人SLC15A3蛋白二级结构预测Fig.6 Secondary structure prediction of human SLC15A3 protein

图7 人SLC15A3蛋白三级结构预测Fig.7 Tertiary structure prediction of human SLC15A3 protein

图8 人SLC15A3蛋白三级结构拉曼图分析Fig.8 Ramachandran plot of tertiary structure of hunan SLC15A3 protein
2.8 人SLC15A3蛋白相互作用网络 蛋白互作网络如图9所示,CD6、TYROBP、CD5、NOD2、SLC37A2、IFI30、CSF1R、PTCHD3、LILRB2、CD14与SLC15A3相互作用,其中CD6得分最高,说明其与SLC15A3蛋白相互作用最紧密(表5)。
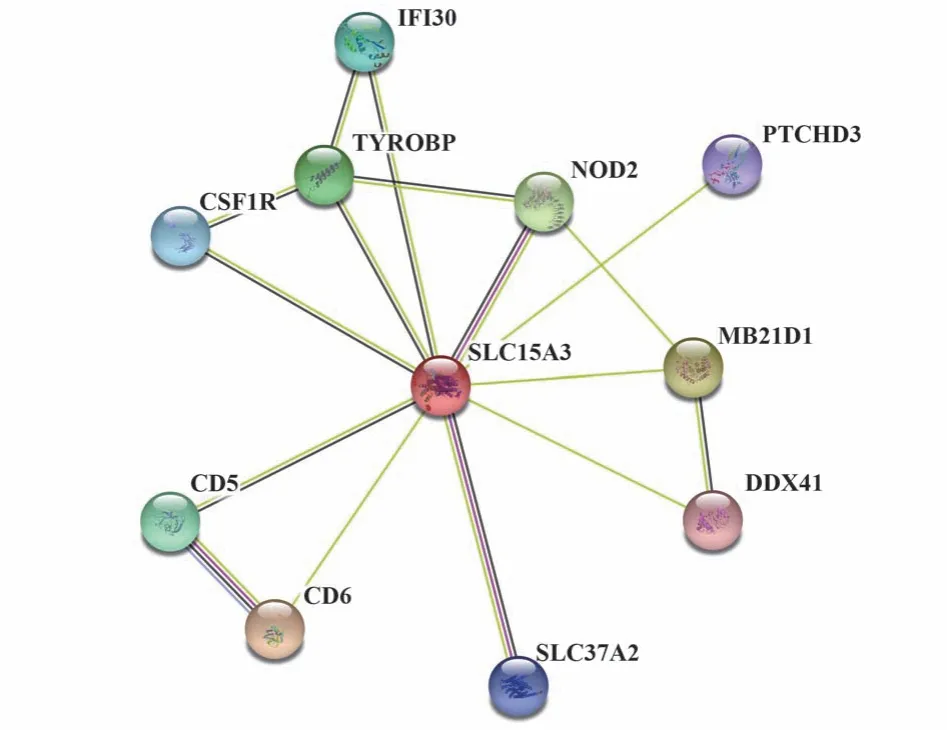
图9 人SLC15A3蛋白互作网络Fig.9 Network of proteins interacted with human SLC15A3
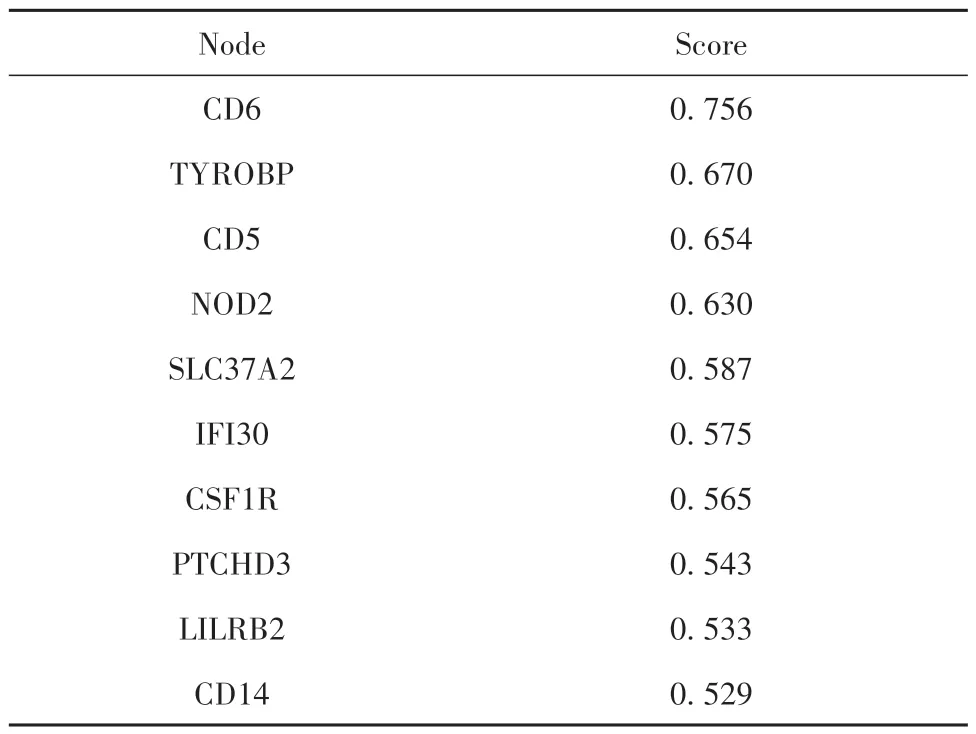
表5 与人SLC15A3蛋白相互作用可能性较大的10种蛋白Tab.5 Ten proteins with high possibility of interaction with human SLC15A3
3 讨论
POTs家族由SLC15A1~SLC15A5组成,SLC15A3的功能主要是将组氨酸和二肽从溶酶体内运输到胞质[9]。研究表明SLC15A3表达对LPS诱导的细胞炎症反应具有调节作用,将其基因沉默会减少TLR4依赖的IL-6和TNF-α等促炎因子产生;另一方面,将其基因过表达会增加TLR4依赖的炎症因子产生[2]。此外,葡聚糖硫酸钠诱导的溃疡性结肠炎小鼠结肠组织和结肠固有单核免疫细胞中可见SLC15A3表达上调,而SLC15A3上调导致更多促炎因子产生,引起更强烈的免疫应答,导致溃疡性结肠炎发展[8]。因此抑制SLC15A3表达或许能成为治疗炎症性疾病的新思路。
人SLC15A3蛋白是以α-螺旋为主的疏水性不稳定蛋白。氨基酸同源性和进化树结果显示人SLC15A3蛋白在哺乳动物中具有较高进化保守性。蛋白互作结果显示共10个蛋白与SLC15A3存在互作关系,其中NOD2与SLC15A3的关系已得到实验证实,SLC15A3基因通过将NOD2配体MDP转运至胞质受体,触发NOD依赖性免疫应答,加重炎症反应[6]。
现有文献表明SLC15A3表达受NF-κB转录因子调控[6]。SLC15A3基因表达依赖于一个复杂的调控系统,其中转录因子与目的基因启动子上的结合位点相互作用是调控基因表达的重要一环[10]。本研究经多种预测软件分析发现NF-κB、c-Jun、AP-1及c-Fos等多个转录因子在SLC15A3基因启动子序列存在结合位点。NF-κB是两种Rel家族蛋白构成的异二聚体,可以调控数百个免疫基因表达而被称为炎症反应主要调节器[11]。NF-κB接受上游信号传递后,能够磷酸化从细胞质转入细胞核,并通过结合靶基因增强子或启动子区域κB位点调控基因转录[12]。NF-κB在巨噬细胞表型转换中起转录调节作用,研究表明巨噬细胞中SLC15A3表达受NF-κB调控[4]。丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路同样参与SLC15A3表达上调[8]。激活蛋白1(activator protein-1,AP-1)是MAPK信号通路下游转录因子[13]。AP-1与NF-κB类似,AP-1接收上游信号活化后,同样通过转录参与炎症因子合成,进而导致炎症发生[14-15]。AP-1由c-Jun和c-Fos两个亚基组成[16]。c-Jun/c-Fos复合物参与激活多种促炎信号基因表达[17]。此外,c-Jun能够识别并结合增强子七聚体基序5'-TGA[CG]TCA-3',并参与c-Jun氨基末端激(c-Jun N-terminal kinase,JNK)信号通路,其被磷酸化激活有助于促炎基因表达[18]。本研究中已有转录因子结合位点参与调控SLC15A3基因表达,但还有许多是预测的潜在转录因子结合位点,需要进一步实验验证。
目前研究主要关于SLC15A3在炎症反应过程中的表达变化,本研究系统分析了SLC15A3基因特点及其编码蛋白的理化性质、结构和进化保守性等,将对深入研究SLC15A3基因和蛋白在溃疡性结肠炎等炎症性疾病发生发展中的表达调控具有重要意义。