HBx蛋白抑制乙型肝炎病毒诱导肝细胞表达Ⅰ型干扰素的研究
潘颖 杨凯 陈谨 孙蓓蓓 田平平 张发苏 (.安徽医学高等专科学校医学技术学院,合肥 3060;.安徽医科大学第二附属医院检验科,合肥 3060)
Ⅰ型干扰素主要包括IFN-α和IFN-β,在病毒感染期间,宿主对病毒入侵的初始反应是诱导Ⅰ型干扰素产生并与其受体(interferon-α/β receptor,IFNAR)结合,激活酪氨酸蛋白激酶和信号转录与转录激活因子(Janus kinase-signal transducers and activators of transcription,JAK/STAT)信号通路,合成多种抗病毒蛋白,如:核糖核酸依赖性蛋白激酶(protein kinase RNA dependent,PKR)、2'-5'寡聚腺苷酸合成酶(2'-5'oligoadenylate synthetase,OAS)、黏病毒抗性蛋白A(myxovirus resistance protein A,MxA),直接抑制病毒复制[1-2]。除了直接的抗病毒作用外,IFN-α还可以强烈调节宿主的先天性和适应性免疫反应[3-4],如:增强NK细胞的增殖、CD8+T细胞和巨噬细胞的细胞毒性以及IFN-γ分泌等,以增强宿主对病原体的清除能力,因此,Ⅰ型干扰素信号通路激活是宿主早期重要的自然防御机制,在抑制病毒入侵方面发挥重要作用。然而,WIELAND等[5]对实验室感染HBV的黑猩猩进行体内研究表明,HBV不能诱导干扰素刺激基因(interferon-stimulated gene,ISG)的表达,所以可以在肝脏中持续复制;SUSLOV等[6]通肝脏活检发现,HBV感染患者肝组织中IFN和ISG的表达被抑制,使得病毒不能被有效清除;本课题组亦在前期研究中发现,由HBV编码的HBx蛋白可以抑制外源性Ⅰ型干扰素诱导抗病毒蛋白MxA的合成[7]。据此,本课题组推测HBV很有可能通过损伤Ⅰ型干扰素信号通路,影响机体的先天免疫应答,从而引起病毒感染的慢性化。为此,本课题组拟研究HBV对肝细胞中Ⅰ型干扰素表达的影响,并进一步探讨可能存在的机制,为揭示HBV慢性感染与宿主免疫功能紊乱的关系提供新的思路。
1 材料与方法
1.1 材料 人肝癌HepG2和HepG2.2.15细胞由安徽医学高等专科学校生化实验室保存;细胞培养基DMEM和胎牛血清购自美国Gibco公司;Lipofectamine 3000TM转染试剂盒、ECL超敏发光试剂盒购自美国Thermo公司;TRIzol购自美国Life technogies公司;氯仿、异丙醇及乙醇均为分析纯;反转录试剂盒购自大连TaKaRa公司;荧光染料购自中国Novoprotein公司;BCA试剂盒、SDS-PAGE凝胶配制试剂盒均购自碧云天试剂公司;mock-siRNA、HBxsiRNA及引物由上海生工生物合成;HBx、p-IRF3及GAPDH抗体购自美国Santa Cruz公司;pEGFP-N1和pEGFP-HBx质粒由南京大学附属鼓楼医院刘巧玉博士惠赠;荧光显微镜购自德国Leica公司;荧光定量PCR仪购自美国Thermo Scientific公司;电泳仪、电泳槽购自上海天能科技有限公司;自动曝光仪购自培清科技有限公司。
1.2 方法
1.2.1 细胞培养及转染 HepG2和HepG2.2.15细胞用含10%胎牛血清的DMEM于37 ℃、5%CO2培养箱中常规培养,取对数生长期的细胞以2×105个/ml密度接种于6孔板用于转染,待细胞融合度达到80%~90%时候,改用无胎牛血清DMEM培养,以Lipofectamine 3000TM转染试剂将mock-siRNA和HBxsiRNA转染至HepG2.2.15细胞,48 h后收集细胞沉淀检测HBx蛋白表达水平;将带绿色荧光蛋白的pEGFP-N1和pEGFP-HBx质粒转染至HepG2细胞,在荧光显微镜下观察HBx蛋白的表达。
1.2.2 荧光定量PCR检测Ⅰ型干扰素IFN-α和IFN-β mRNA含量 收集转染前后的细胞沉淀,加入1 ml TRIzol完全裂解,再加入0.2 ml氯仿振荡离心取上清,加入0.5 ml预冷的异丙醇,-20 ℃孵育30 min后离心去上清,最后加入1 ml预冷的75%乙醇,12 000 r/min离心去上清,室温干燥RNA沉淀,按照TaKaRa反转录试剂盒说明书反转录为cDNA。以cDNA为荧光定量的模板,运用SYBR Green PCR试剂盒进行扩增反应,PCR仪设置扩增程序为:95 ℃ 1 min,95 ℃ 20 s,60 ℃ 1 min,40个循环,72 ℃20 s。目的mRNA相对表达量的计算方法为2-ΔΔCt。所用引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.3 Western blot检测HBx及p-IRF3蛋白含量使用RIPA细胞裂解液细胞,并以12 000 r/min离心10 min收集上清液,即含有细胞总蛋白,BCA法检测蛋白浓度。在收集的蛋白样品中按照1∶4加入蛋白上样缓冲液,经沸水浴加热10 min以充分变性蛋白质,待样品冷却至室温后,上样至加样孔内行SDSPAGE蛋白电泳1.5 h、转膜、封闭,一抗4 ℃孵育过夜,二抗室温孵育2 h。采用ECL超敏发光试剂检测目的蛋白。
1.3 统计学分析 采用MedCalc10.4软件进行数据统计分析,两组数据比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 HBV对肝细胞中Ⅰ型干扰素表达的影响 荧光定量PCR分析显示,与HepG2细胞相比,转染HBV全基因组的HepG2.2.15细胞中IFN-α和IFN-β的mRNA水平升高,但差异不具有统计学意义(P>0.05,图1),提示HBV在体外细胞中并未充分诱导Ⅰ型干扰素的表达。

图1 Ⅰ型干扰素在HepG2和HepG2.2.15细胞中的表达Fig.1 Expression of typeⅠinterferon in HepG2 and HepG2.2.15 cells
2.2 HBx-siRNA上调细胞中IFN-α和IFN-β mRNA含量 将mock-siRNA和HBx-siRNA分别转染至HepG2.2.15细胞,结果显示,与未经处理的HepG2.2.15细胞相比,转染HBx-siRNA的细胞中HBx蛋白表达显著降低(P<0.01,图2A),而IFN-α和IFN-β mRNA含量显著升高(P<0.01或P<0.001,图2B),提示HBV可通过HBx抑制Ⅰ型干扰素信号通路激活。
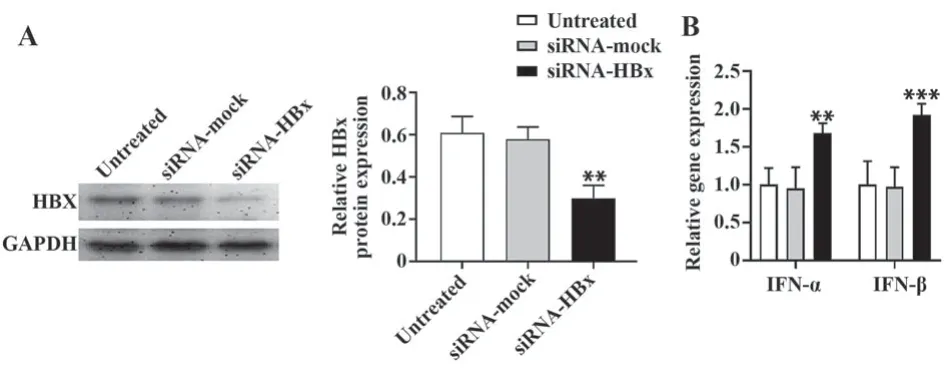
图2 HBx-siRNA对HepG2.2.15细胞内IFN-α和IFN-β表达的影响Fig.2 Effects of HBx-siRNA on expressions of IFN-α and IFN-β in HepG2.2.15 cells
2.3 pEGFP-HBx通过抑制IRF3的磷酸化影响Ⅰ型干扰素信号通路 将HepG2细胞分别转染空载体质粒pEGFP-N1和pEGFP-HBx,48 h后运用荧光显微镜观察HBx蛋白在细胞中的表达(图3A)。进一步分析各转染细胞中Ⅰ型干扰素mRNA及p-IRF3蛋白的表达,结果显示,与空载体转染的HepG2细胞相比,转染pEGFP-HBx质粒的细胞中p-IRF3蛋白含量降低,IFN-α和IFN-β mRNA水平降低,差异具有统计学意义(P<0.01,图3B、C)。

图3 HBx蛋白影响HepG2细胞p-IRF3和Ⅰ型干扰素表达Fig.3 HBx protein affects expressions of p-IRF3 and typeⅠ interferon in HepG2 cells
3 讨论
HBV是一种非细胞病变的嗜肝DNA病毒,可编码多种病毒蛋白,如:DNA多聚酶、表面抗原(HBsAg)、核心抗原(HBcAg)和HBx蛋白[8-9]。肝脏急性感染HBV后,90%~95%的患者能够清除感染并完全康复,其余5%~10%的患者发展为慢性HBV感染,并且部分逐步发展为肝硬化和肝细胞癌[10]。WHO估计全世界约有2.57亿人呈慢性HBV感染,每年有近100万人死于HBV相关并发症[11]。一般认为,HBV感染的结局取决于病毒与宿主免疫系统的相互作用,研究表明,HBV会抑制宿主的免疫系统,表现为先天和适应性免疫细胞功能障碍,而Ⅰ型干扰素在体内具有调节先天免疫反应和激活后天免疫反应的作用[12-13]。此外,尽管常规和聚乙二醇化的IFN-α蛋白已成为慢性乙型肝炎(chronic hepatitis B,CHB)患者的一线治疗药物,且Ⅰ型干扰素的抗病毒作用已明确,但在CHB患者中IFN-α治疗的病毒清除率相当低,具体机制尚未明确[14-15],因此推测HBV可能影响了Ⅰ型干扰素信号通路。为此,本实验通过对比HepG2细胞和转染HBV全基因组的HepG2.2.15细胞中IFN-α和IFN-β的基因表达量,证实HBV并不能充分诱导肝细胞表达Ⅰ型干扰素,进一步将HBx-siRNA转染至HepG2.2.15细胞发现,抑制肝细胞在病毒转录中维持共价闭合环状DNA(covalently closed circular DNA,cccDNA)微型染色体的重要调节蛋白—HBx蛋白的表达,可上调IFN-α和IFN-β的mRNA水平,提示HBx可能抑制了HBV诱导肝细胞表达Ⅰ型干扰素。
Ⅰ型干扰素的产生受到干扰素调节因子(interferon regulatory factors,IRFs)家族的调控,其中,IRF3是Ⅰ型干扰素信号通路的主要调节因子,机体感染病毒后,可通过模式识别受体对病毒病原体相关分子模式进行识别,导致下游转录因子IRF-3的激活和核转位,从而诱导IFN-α和IFN-β的表达[16-17]。而在HBV持续感染的肝细胞中,模式识别受体及IRF3呈低表达,LEE等[18]通过将IRF3小分子激活剂处理HBV感染的细胞,发现激活IRF3可诱导先天免疫作用,抑制HBV cccDNA的形成。在本研究中,将HBV编码的HBx基因表达质粒转染至HepG2细胞,检测结果显示,过表达HBx蛋白的HepG2细胞中IFN-α和IFN-β mRNA表达水平均下降,且磷酸化的IRF3蛋白含量亦降低。
综上所述,本研究通过对培养的肝细胞模型进行HBx基因过表达和沉默,揭示了HBV通过其所编码表达的HBx蛋白抑制IRF3蛋白的活化,从而抑制Ⅰ型干扰素的表达,本实验为进一步探讨HBV感染的慢性化机制以及解决临床CHB患者Ⅰ型干扰素治疗应答不佳提供了新的思路。

