利拉鲁肽调控Nrf2/ARE介导的焦亡通路减轻2型糖尿病大鼠心肌损伤的机制研究
庄天微 帅天姣 郭长秀 谢伟 王彤彤 (.牡丹江医学院附属红旗医院内分泌科,牡丹江 57000;.牡丹江医学院附属红旗医院眼科,牡丹江 57000;.黑龙江省牡丹江林业中心医院骨科,牡丹江 570)
糖尿病心肌病(diabetic cardiomyopathy,DCM)是糖尿病(diabetes mellitus,DM)的一种严重并发症,是DM患者死亡的主要原因之一,其特点为心肌结构及功能障碍,而心肌细胞死亡是DCM的基本病理特征[1]。尽管现今已有多种药物控制血糖及恢复心脏功能,但DCM的发病率和病死率仍在持续增长[2]。细胞焦亡是一种炎症相关的细胞程序性死亡,参与DCM的发生发展[3]。有效抑制细胞焦亡对DCM患者的生存至关重要,因此迫切需要寻找相应的治疗药物。核因子E2相关转录因子2(nuclear factor-E2-related factor 2,Nrf2)被证实参与调控抗氧化损伤,可与抗氧化反应原件(antioxidant response element,ARE)进一步结合,启动血红素氧化酶1(heme oxygenase-1,HO-1)表达,Nrf2/ARE对焦亡通路具有显著的负调控作用[3-4]。利拉鲁肽作为一种抗糖尿病药物,可有效抑制胰高血糖素生成,改善胰岛素分泌[5-6]。但目前关于利拉鲁肽DM心肌焦亡方面的研究还较少,因此,本研究通过构建2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠模型,探究利拉鲁肽调控Nrf2/ARE通路对DM大鼠心肌细胞焦亡的影响,以期为利拉鲁肽在DCM中的治疗机制研究提供进一步参考。
1 材料与方法
1.1 材料
1.1.1 实验动物 60只SPF级SD大鼠购自上海南方模式生物科技股份有限公司,许可证号:SCXK(沪)2017-0010,于通风良好的环境中适应性饲养1周[室温:(24±3) ℃,光照12 h/d]。
1.1.2 试剂及仪器 HE染色试剂盒、链脲佐菌素(streptozotocin,STZ)(上海联硕宝为生物科技有限公司);Nrf2抑制剂ATRA(上海陶素生化科技有限公司);利拉鲁肽(Novo Nordisk A/S,国药准字:J20160037,3 ml∶18 mg);TUNEL细胞凋亡原位检测试剂盒、BCA试剂盒(北京孚博生物科技有限公司);兔抗β-actin、HRP-IgG抗体、Nrf2抗体、HO-1抗体(Abcam);含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase 1,Caspase-1)抗体(Affinity Biosciences);凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)(AdipoGen);IL-18试剂盒(武汉菲恩生物科技有限公司);IL-1β试剂盒(上海广锐生物科技有限公司);兔抗IL-1β、IL-18抗体(Proteintech);GelSMART凝胶成像仪[大龙兴创实验仪器(北京)有限公司]。
1.2 方法
1.2.1 分组与T2DM模型构建 构建T2DM大鼠模型,采用高糖高脂饲料喂养大鼠8周后腹腔注射35 mg/kg STZ(溶于柠檬酸缓冲液),7 d后随机进行3次尾静脉取血检测,血糖水平均>11.1 mmol/L则为造模成功[7];将造模成功的SD大鼠(10只/组,共50只)随机分为T2DM组、低剂量组(35 μg/kg利拉鲁肽)、中剂量组(70 μg/kg利拉鲁肽)、高剂量组(140 μg/kg利拉鲁肽)、高剂量+Nrf2抑制组(140 μg/kg利拉鲁肽+Nrf2抑制剂ATRA 10 mg/kg)[8-9];另取10只大鼠设为对照组,全程给予基础饲料,注射等剂量柠檬酸缓冲液。低剂量组、中剂量组、高剂量组、高剂量+Nrf2抑制组大鼠分别腹腔注射相应剂量药物,对照组及T2DM组注射等量生理盐水(2次/d,12周)。
1.2.2 血糖水平检测 实验结束后,全部大鼠禁食12 h,取尾部静脉血并用血糖仪纸片法检测血糖水平。
1.2.3 ELISA检测大鼠血清中IL-1β及IL-18水平
取各组大鼠腹主动脉血,3 000 r/min离心10 min,取上清,根据IL-1β及IL-18 ELISA试剂盒操作步骤测定血清中二者水平。
1.2.4 HE染色 各组随机选取5只大鼠,取其心脏组织进行常规石蜡包埋并连续切片(4 μm),部分使用HE染色试剂盒染色后封片,显微镜观察;另一部分进行TUNEL染色。
1.2.5 TUNEL染色 取石蜡切片,经烘干、PBS清洗后,置于TUNEL反应液中孵育1 h后滴加DAB显色,苏木精复染,脱水,封片,光镜观察并拍照(棕褐色即为阳性染色细胞),Image ProPlus 6.0系统细胞计数后计算凋亡指数(apoptotic index,AI)(%)=(凋亡细胞/总细胞)×100%。
1.2.6 Western blot检测心肌中焦亡相关蛋白表达 取各组剩余的5只大鼠,心脏组织于裂解液中研磨,12 000 r/min离心10 min,取上清后BCA法测定蛋白含量,取蛋白样品并混入上样缓冲液(4∶1),变性(100 ℃),加至已配制好的分离胶中(30 μg/孔)进行SDS-PAGE凝胶电泳,转膜,5%牛血清白蛋白封闭1 h,加入一抗(兔抗β-actin、Caspase-1、ASC、Nrf2、HO-1、IL-1β、IL-18抗体,1∶1 000)孵育过夜后,于次日依次进行TBST洗涤及二抗孵育(2 h),ECL显影后,于蛋白凝胶成像仪中观察,Image J分析各条带灰度值,并计算其含量(β-actin为内参,n=5)。
1.3 统计学方法 采用SPSS24.0分析处理计量资料,并用±s描述,多组间比较行One-Way ANOVA分析,组间比较行SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血糖水平比较 相较于对照组,T2DM组大鼠空腹血糖水平显著升高(P<0.05);相较于T2DM组,低剂量组空腹血糖水平差异无统计学意义(P>0.05),中、高剂量组空腹血糖水平依次显著降低(P<0.05);相较于高剂量组,高剂量+Nrf2抑制组空腹血糖水平显著提高(P<0.05),见表1。
表1 各组大鼠血糖及炎症因子水平比较(±s,n=10)Tab.1 Comparison of blood glucose and inflammatory factors levels of rats in each group (±s,n=10)
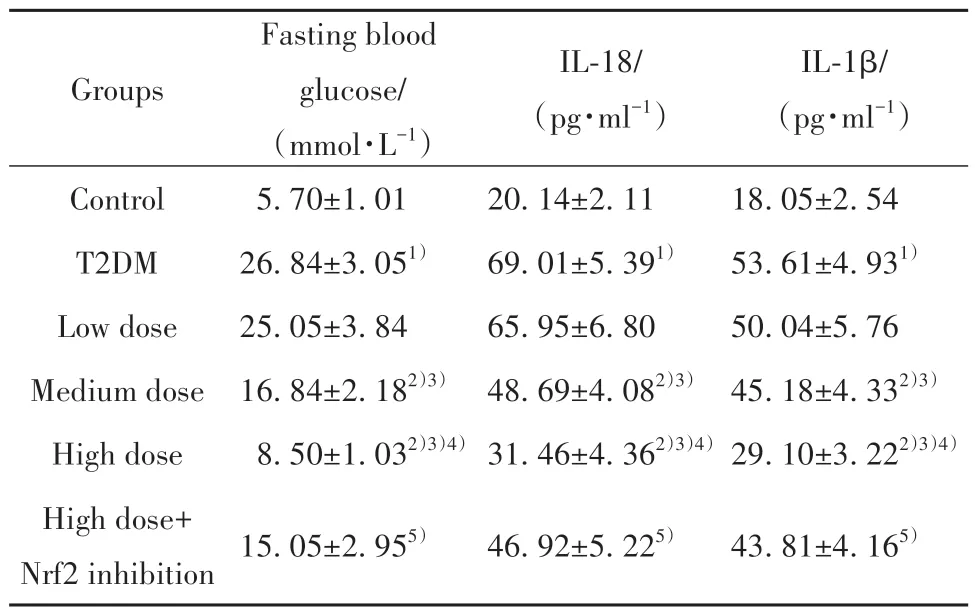
表1 各组大鼠血糖及炎症因子水平比较(±s,n=10)Tab.1 Comparison of blood glucose and inflammatory factors levels of rats in each group (±s,n=10)
Note:Compared with control group,1)P<0.05;compared with T2DM group,2)P<0.05;compared with low dose group,3)P<0.05;compared with medium dose group,4)P<0.05;compared with high dose group,5)P<0.05.
Groups Control T2DM Low dose Medium dose High dose High dose+Nrf2 inhibition Fasting blood glucose/(mmol·L-1)5.70±1.01 26.84±3.051)25.05±3.84 16.84±2.182)3)8.50±1.032)3)4)IL-18/(pg·ml-1)20.14±2.11 69.01±5.391)65.95±6.80 48.69±4.082)3)31.46±4.362)3)4)IL-1β/(pg·ml-1)18.05±2.54 53.61±4.931)50.04±5.76 45.18±4.332)3)29.10±3.222)3)4)15.05±2.955)46.92±5.225)43.81±4.165)
2.2 各组大鼠炎症因子水平比较 相较于对照组,T2DM组大鼠血清IL-18及IL-1β水平显著升高(P<0.05);相较于T2DM组,中、高剂量组IL-18及IL-1β水平依次显著降低(P<0.05);相较于高剂量组,高剂量+Nrf2抑制组IL-18及IL-1β水平显著升高(P<0.05),见表1。
2.3 大鼠心肌组织病理学情况观察 对照组大鼠心肌细胞结构清晰、完整,排列有序,未发生炎症细胞浸润现象;相较于对照组,T2DM组心肌细胞肥大、排列紊乱、肌纤维结构模糊不清,发生炎症细胞浸润现象;相较于T2DM组,低剂量、中剂量组、高剂量组心肌肥大及炎症细胞浸润现象减轻,心肌细胞结构较为完整,排列逐渐有序;相较于高剂量组,高剂量+Nrf2抑制组上述心肌损伤现象加重。见图1。
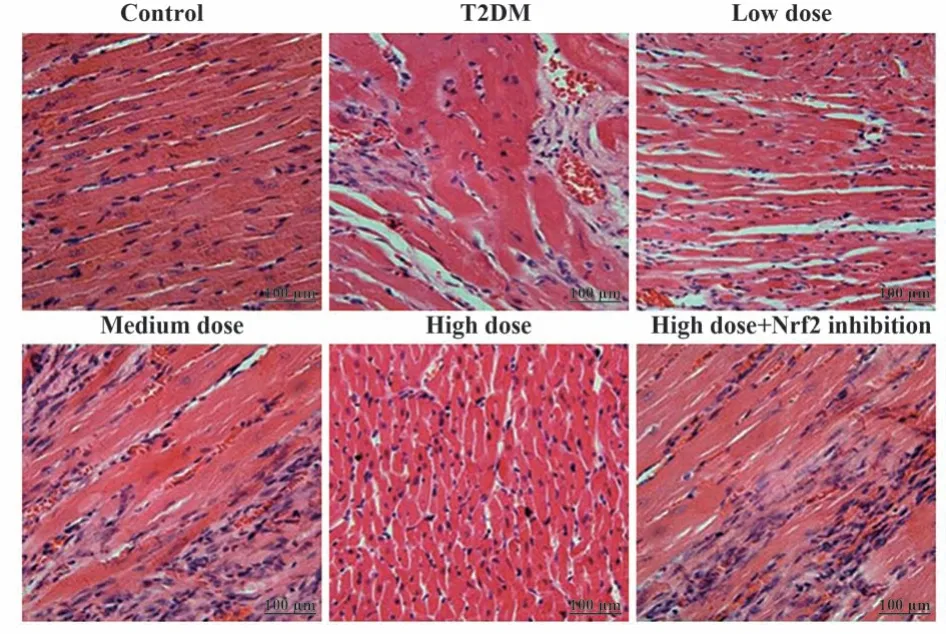
图1 心肌组织病理学情况观察(HE,×200)Fig.1 Observation of myocardial histopathology (HE,×200)
2.4 各组大鼠心肌细胞凋亡水平比较 相较于对照组,T2DM组大鼠心肌细胞凋亡水平显著升高(P<0.05);相较于T2DM组,中、高剂量组细胞凋亡水平依次显著降低(P<0.05);相较于高剂量组,高剂量+Nrf2抑制组细胞凋亡水平显著升高(P<0.05),见表2、图2。
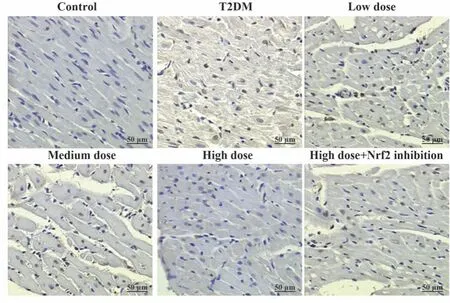
图2 各组大鼠心肌细胞凋亡水平比较(×400)Fig.2 Comparison of apoptosis levels of rat cardiomyocytes in each group (×400)
表2 各组大鼠心肌细胞凋亡水平比较(±s,n=5)Tab.2 Comparison of apoptosis levels of rat cardiomyocytes in each group (±s,n=5)
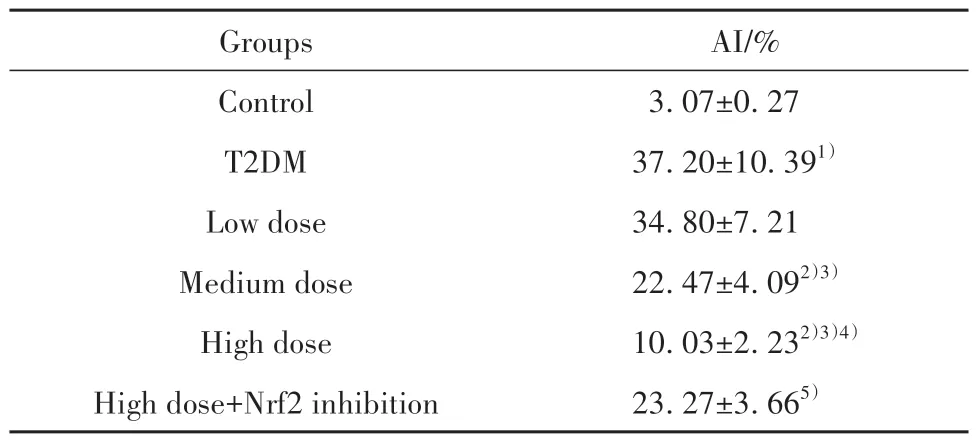
表2 各组大鼠心肌细胞凋亡水平比较(±s,n=5)Tab.2 Comparison of apoptosis levels of rat cardiomyocytes in each group (±s,n=5)
Note:Compared with control group,1)P<0.05;compared with T2DM group,2)P<0.05;compared with low dose group,3)P<0.05;compared with medium dose group,4)P<0.05;compared with high dose group,5)P<0.05.
AI/%3.07±0.27 37.20±10.391)34.80±7.21 22.47±4.092)3)10.03±2.232)3)4)23.27±3.665)Groups Control T2DM Low dose Medium dose High dose High dose+Nrf2 inhibition
2.5 各组大鼠心肌焦亡相关蛋白表达比较 相较于对照组,T2DM组大鼠心肌组织中焦亡相关蛋白Caspase-1、ASC、IL-1β、IL-18表达水平升高,Nrf2、HO-1表达水平降低(P<0.05);相较于T2DM组,中、高剂量组Caspase-1、ASC、IL-1β、IL-18表达水平降低,Nrf2、HO-1表达水平升高(P<0.05);相较于高剂量组,高剂量+Nrf2抑制组Caspase-1、ASC、IL-1β、IL-18表达水平均升高,Nrf2、HO-1表达水平降低(P<0.05),见表3、图3。
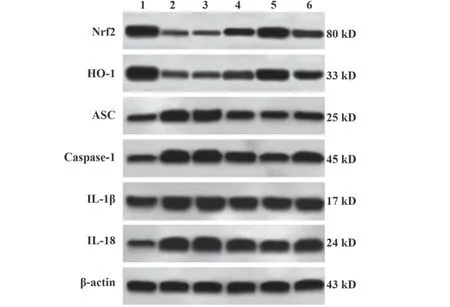
图3 各组大鼠心肌焦亡相关蛋白表达比较Fig.3 Comparison of expressions of myocardial pyroptosis-associated proteins of rats in each group
表3 各组大鼠心肌焦亡相关蛋白表达比较(±s,n=5)Tab.3 Comparison of expressions of myocardial pyroptosis-associated proteins of rats in each group (±s,n=5)
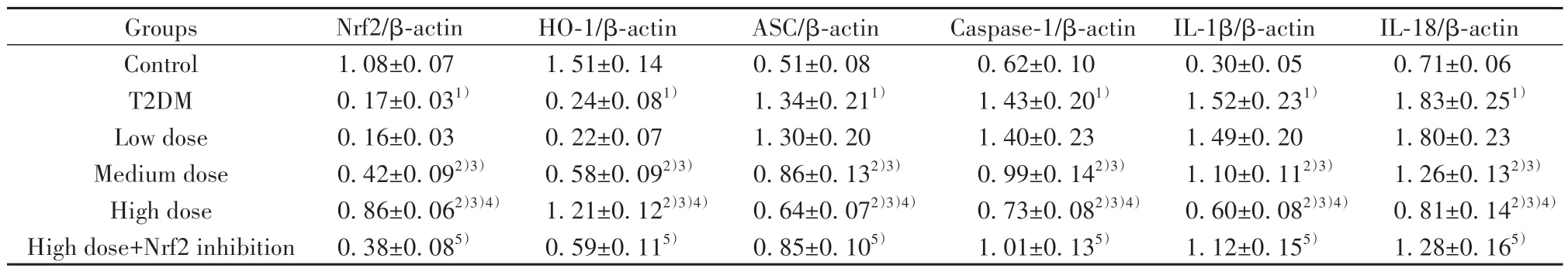
表3 各组大鼠心肌焦亡相关蛋白表达比较(±s,n=5)Tab.3 Comparison of expressions of myocardial pyroptosis-associated proteins of rats in each group (±s,n=5)
Note:Compared with control group,1)P<0.05;compared with T2DM group,2)P<0.05;compared with low dose group,3)P<0.05;compared with medium dose group,4)P<0.05;compared with high dose group,5)P<0.05.
Groups Control T2DM Low dose Medium dose High dose High dose+Nrf2 inhibition Nrf2/β-actin 1.08±0.07 0.17±0.031)0.16±0.03 0.42±0.092)3)0.86±0.062)3)4)0.38±0.085)HO-1/β-actin 1.51±0.14 0.24±0.081)0.22±0.07 0.58±0.092)3)1.21±0.122)3)4)0.59±0.115)ASC/β-actin 0.51±0.08 1.34±0.211)1.30±0.20 0.86±0.132)3)0.64±0.072)3)4)0.85±0.105)Caspase-1/β-actin IL-1β/β-actin IL-18/β-actin 0.71±0.06 1.83±0.251)1.80±0.23 1.26±0.132)3)0.81±0.142)3)4)1.28±0.165)0.62±0.10 1.43±0.201)1.40±0.23 0.99±0.142)3)0.73±0.082)3)4)1.01±0.135)0.30±0.05 1.52±0.231)1.49±0.20 1.10±0.112)3)0.60±0.082)3)4)1.12±0.155)
3 讨论
DM是一种以高血糖为主要特征的代谢性疾病,DM患者患心血管疾病的风险较正常人高2~4倍,DCM是DM的常见并发症,也是造成DM患者死亡的主要原因[10]。心肌细胞丢失导致的心功能受损是DCM的基本病理特征。细胞焦亡是有别于细胞凋亡、坏死的促炎程序性细胞死亡,越来越多的研究表明,心肌细胞焦亡会造成DCM的发生,因此,有效抑制心肌细胞焦亡对DCM的治疗极其重要[11]。
利拉鲁肽是胰高血糖素样肽-1(GLP-1)类似物,其降血糖功效已得到证实,而近几年,大量临床试验发现,其可降低不良心脏事件的发生风险[12-13]。利拉鲁肽可改善T2DM患者的血糖水平,并减轻患者体重,可用于代谢相关疾病手术后复发或持续的T2DM患者辅助治疗[14]。利拉鲁肽可控制糖尿病小鼠血糖水平,能够通过增加TGF-β1、PPARγ表达抑制心肌细胞凋亡,改善心肌损伤[15]。利拉鲁肽能够通过调控焦亡参与改善高糖高脂,降低胰岛功能损伤程度[16]。本研究发现,利拉鲁肽能够有效降低T2DM大鼠空腹血糖、心肌组织病理学程度、心肌细胞凋亡水平,与既往研究结果相似,该结果表明,利拉鲁肽具有降血糖,改善T2DM大鼠心肌损伤作用,提示利拉鲁肽有作为DCM潜在治疗药物的潜能[15]。
细胞焦亡是由炎症小体诱导的一种细胞死亡机制,可受多种调控因子影响,衔接蛋白ASC作为焦亡反应主要复合物,是NLRP3炎症体的主要组成,ASC的CARD和Caspase-1的CARD结合可形成NLRP3炎性体并激活Caspase-1,Caspase-1可促进IL-1β成熟并活化,诱导IL-18等炎症因子合成,扩大炎症反应,从而引发细胞焦亡[11,17]。大量研究发现,caspase-1活化促进DCM大鼠心肌细胞焦亡,IL-18、IL-1β、Caspase-1、ASC表达水平是评估焦亡水平的重要标志[18]。近来有研究指出,Nrf2/ARE广泛参与调控焦亡通路,抑制细胞焦亡的同时改善组织发育[19]。有研究发现,利拉鲁肽能够通过促进Nrf2/ARE通路蛋白表达,减少氧化产物生成,保护DM引发的脑缺血损伤[20]。本研究发现,中、高剂量利拉鲁肽处理均可显著降低T2DM大鼠IL-18、IL-1β、Caspase-1、ASC表达,上调Nrf2、HO-1表达水平,低剂量利拉鲁肽无显著变化,推测达到一定剂量的利拉鲁肽很可能通过调控Nrf2/ARE介导的焦亡通路发挥作用。为进一步证实该推论,本研究在利拉鲁肽处理的同时抑制Nrf2表达,发现抑制Nrf2能够显著增加大鼠IL-18、IL-1β、Caspase-1、ASC表达,降低Nrf2、HO-1表达水平,促进细胞焦亡,逆转利拉鲁肽对T2DM大鼠心肌损伤的改善作用,证实利拉鲁肽通过调控Nrf2/ARE介导的焦亡通路,减轻T2DM大鼠心肌细胞焦亡,改善心肌损伤。
综上所示,利拉鲁肽通过调控Nrf2/ARE介导的焦亡通路,促进Nrf2/ARE通路蛋白表达,抑制细胞焦亡,改善心肌损伤,利拉鲁肽可能成为DCM的有效治疗药物。本研究不仅对DCM的治疗机制研究具有重要价值,还为DCM新型治疗药物的寻找提供参考,是否有其他通路间接参与调控还需深入探讨,后续课题组将对此进行专项研究。

