脂联素通过NF-κB通路调节高糖所致内皮细胞损伤的保护作用
袁静 程杨阳 李红梅 周科技
(1.武汉理工大学医院,武汉 430070;2.中国人民解放军中部战区总医院,武汉 430070)
糖尿病肾病(diabetic nephropathy,DN)的传统特征为高血糖引起的代谢和血流动力学变化[1-2]。越来越多的证据表明,脂质代谢紊乱在DN发展和进展中起关键作用[3-5]。脂肪不仅是最大的储能器官,也是重要的内分泌器官,分泌大量具有生物活性的脂肪因子。脂联素又称脂肪细胞补体相关蛋白30(Acrp30),是一种在脂肪组织中大量存在的特异性脂肪因子,可增强机体对胰岛素的敏感性[6]。脂联素因其抗糖尿病和抗动脉粥样硬化作用引起广泛关注,有望成为糖尿病相关代谢综合征的新疗法。脂联素有利于血管内皮细胞增殖,参与血管新生调控,包括DN血管内皮细胞[7]。氧化应激相关通路或炎症相关通路是脂联素有效降低糖尿病相关血管内皮损伤的主要途径[8]。NF-κB、NLRP3炎症小体是DN的重要炎症刺激物,直接参与内皮细胞炎症过程[9]。本课题组猜测NF-κB通路可能与脂联素作用机制有关。本研究旨在探究脂联素调控高糖诱导的内皮细胞存活及氧化应激、炎症反应及线粒体功能的潜在机制及其与NF-κB通路的联系。
1 材料与方法
1.1 材料 人脐静脉内皮细胞HUVEC购自美国菌种保藏中心;重组人脂联素(球状)购自上海高创化学科技公司;DMEM培养基、胎牛血清购自Hyclonc 公司;CCK8、线粒体膜电位检测试剂盒(JC-1)购自上海碧云天;ROS检测试剂盒购自上海翌圣生物科技有限公司;Annexin V-FITC/PI双染法细胞凋亡检测试剂盒购自日本TaKaRa公司;乳酸脱氢酶(LDH)活性检测试剂盒、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒、人IL-4、IL-6、IL-1β ELISA检测试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 细胞培养 人脐静脉内皮细胞HUVEC使用含10%胎牛血清的DMEM培养于37 ℃、5%CO2、饱和湿度恒温培养,每2 d更换1次培养液。
1.2.2 细胞分组 含5 mmol/L葡萄糖培养基培养48 h的内皮细胞标记为NC组;含25 mmol/L葡萄糖培养基培养48 h的内皮细胞标记为HG组。含1、2、4 μg/ml脂联素与25 mmol/L葡萄糖共同培养48 h的内皮细胞依次标记为L组、M组、H组。PBS、LPS联合4 μg/ml脂联素处理的HUVEC细胞标记为H+PBS组、H+LPS组。
1.2.3 CCK8检测细胞增殖 收集细胞,用培养液调整密度至0.5×105个/ml,200 μl/孔接种96孔板,分别培养24 h、48 h、72 h、96 h。20 μl/孔加入CCK8反应液振荡混匀,避光孵育25 min,终止反应,检测细胞吸光度(A490)。实验重复3次,每次3个复孔。细胞存活率(%)=A490实验组/A490对照组×100%。
1.2.4 Annexin V-FITC/PI双染法检测细胞凋亡收集细胞,预冷PBS洗涤5次,500 μl结合缓冲液重悬。加入Annexin V-FITC工作液5 μl、PI工作液5 μl,室温避光孵育30 min。300目筛过滤,流式仪检测细胞凋亡。实验重复3次,每次3个复孔。细胞总凋亡率(%)=早期凋亡率(%)+晚期凋亡率(%)。
1.2.5 Western blot检测细胞Cleaved caspase-3、NLRP3、ASC、Caspase-1、p-NF-κB和p-I-κBα蛋白表达 收集待测细胞,充分裂解,提取总蛋白。BCA法测定蛋白浓度,煮沸变性。取变性蛋白上清进行SDS-PAGE蛋白电泳、转膜。0.5%脱脂奶粉37 ℃封闭1 h,洗膜3次。加入稀释后的一抗Cleaved caspase-3、NLRP3、ASC、Caspase-1、p-NF-κB和p-I-κBα(均为1 000倍稀释),4 ℃孵育过夜;洗涤3次,加入HRP标记的二抗(500倍稀释),37 ℃孵育2 h,洗涤3次。ECL显色液显影,凝胶成像系统曝光,Image J软件分析蛋白条带灰度值,以β-actin为内参计算蛋白表达。实验重复3次,每次3个复孔。
1.2.6 ELISA检测细胞上清LDH、GSH-Px、SOD、MDA、IL-4、IL-6、IL-1β浓度 收集细胞,按试剂盒说明书操作,3 000 r/min离心5 min,取上清。检测样本中LDH、GSH-Px、SOD、MDA、IL-4、IL-6、IL-1β浓度。实验重复3次,每次3个复孔。
1.2.7 免疫荧光法检测细胞ROS 收集细胞,按ROS检测试剂盒操作,暗室内用1 000倍稀释的DCFH-DA培养液孵育细胞1 h,胰酶消化,3 000 r/min离心5 min,PBS清洗。荧光显微镜下观察拍照。实验重复3次,每次3个复孔。
1.2.8 JC-1染色法检测细胞线粒体膜电位 收集细胞,冷却PBS清洗3次。按线粒体膜电位检测试剂盒(JC-1)说明书操作,5倍稀释的JC-1染色工作液染色,37 ℃孵育20 min,JC-1染色缓冲液洗涤3次,细胞培养液收集细胞,流式细胞仪分析细胞线粒体膜电位水平。实验重复3次,每次3个复孔。
1.2.9 RT-qPCR检测NLRP3表达 TRIzol液提取总RNA,使用Primescript RT试剂将总RNA反转录为cDNA。RT-qPCR试剂盒检测NLRP3水平。以β-actin为内参,2-ΔΔCt计算NLRP3相对表达。引物由primer premier 5.0和NCBI的primer BLAST设计:NLPR3 正向引物:5'-AGTGGATGGGTTTGCTGGGAT-3',反向引物:5'-TGCGTGTAGCGACTGTTGAGG-3'。β-actin正向引物:5'-GGCTGTATTCCCCTCCATCG-3',反向引物:5'-CCAGTTGGTAACAATGCCATGT-3'。实验重复3次,每次3个复孔。
1.3 统计学处理 实验数据用SPSS23.0统计分析。计量资料以±s表示。组间比较采用单因素方差分析,组内两两比较采用LSD-t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 脂联素对高糖处理的内皮细胞增殖的影响与NC组相比,HG组内皮细胞48 h、72 h、96 h增殖率均降低(P<0.05);与HG组相比,M、H组内皮细胞48 h增殖率均升高,L、M、H组内皮细胞72 h、96 h增殖率均升高(P<0.05);与L组相比,M、H组内皮细胞48 h、72 h、96 h增殖率升高(P<0.05);与M组相比,H组内皮细胞48 h、72 h、96 h增殖率升高(P<0.05,图1)。可见脂联素以浓度依赖性提升高糖处理的内皮细胞增殖率。
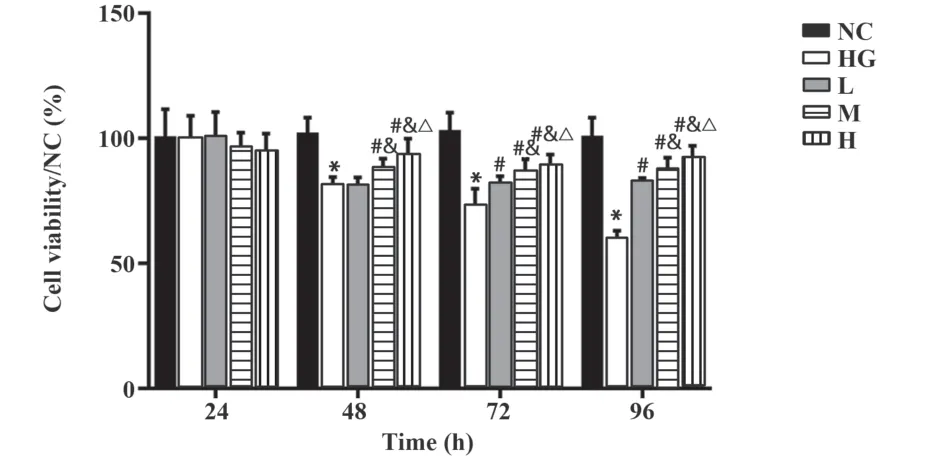
图1 不同浓度脂联素促进高糖处理的内皮细胞增殖Fig.1 Different concentrations of adiponectin promotes proliferation of endothelial cells treated with high glucose
2.2 脂联素对高糖处理的内皮细胞凋亡的影响与NC组相比,HG组内皮细胞Cleaved caspase-3蛋白表达、凋亡率均升高(P<0.05);与HG组相比,L、M、H组内皮细胞Cleaved caspase-3蛋白表达、凋亡率均降低(P<0.05,图2),且呈剂量依赖性。
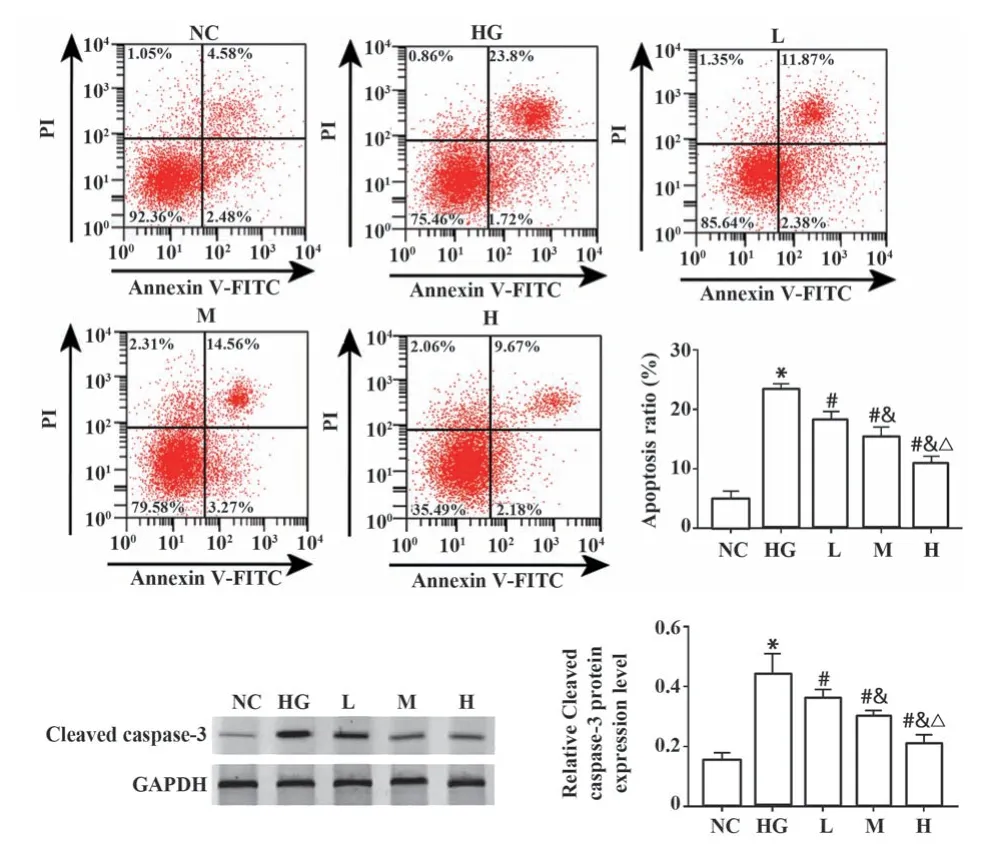
图2 内皮细胞Cleaved caspase-3表达和流式细胞术检测细胞凋亡Fig.2 Expression of Cleaved caspase-3 in endothelial cells and detection of apoptosis by flow cytometry
2.3 脂联素对高糖处理的内皮细胞氧化应激的影响 与NC组相比,HG组内皮细胞LDH、SOD和MDA浓度均升高,ROS、GSH-Px浓度均降低(P<0.05);与HG组相比,L、M、H组内皮细胞LDH、SOD和MDA浓度均降低,ROS、GSH-Px浓度均升高(P<0.05,图3),且呈剂量依赖性。
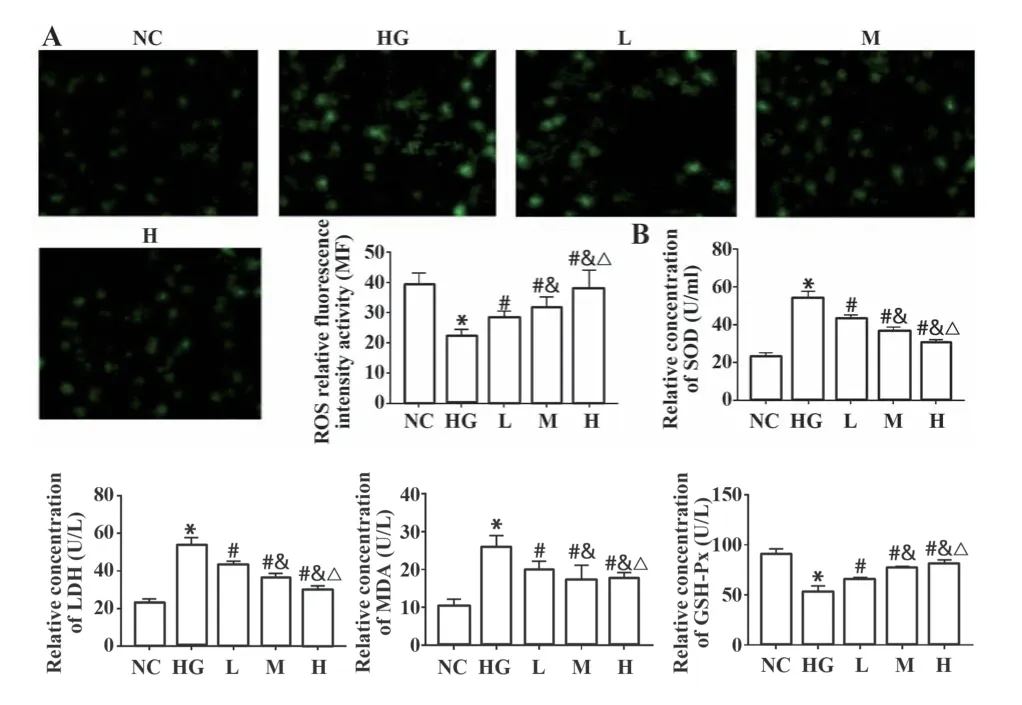
图3 脂联素对高糖处理的内皮细胞LDH、ROS、GSH-Px、SOD和MDA的影响Fig.3 Effects of adiponectin on LDH, ROS, GSH-Px, SOD and MDA in high glucose treated endothelial cells
2.4 脂联素对高糖处理的内皮细胞线粒体膜电位的影响 与NC组相比,HG组内皮细胞线粒体膜电位水平、IL-4、IL-6、IL-1β浓度均升高(P<0.05);与HG组相比,L、M、H组内皮细胞线粒体膜电位水平、IL-4、IL-6、IL-1β浓度均降低(P<0.05,图4),且呈浓度依赖性。
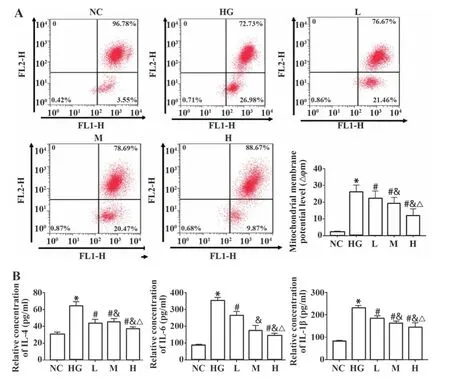
图4 脂联素对高糖处理的内皮细胞线粒体膜电位的影响Fig.4 Effect of adiponectin on mitochondrial membrane potential of high glucose treated endothelial cells
2.5 脂联素对高糖处理的内皮细胞NF-κB通路的影响 与NC组相比,HG组内皮细胞NLRP3、ASC、Cleaved caspase-3、p-NF-κB蛋白表达均升高,p-IκBα蛋白表达降低(P<0.05,图5);与HG组相比,L、M、H组内皮细胞上述指标均发生负调控,且呈浓度依赖性。
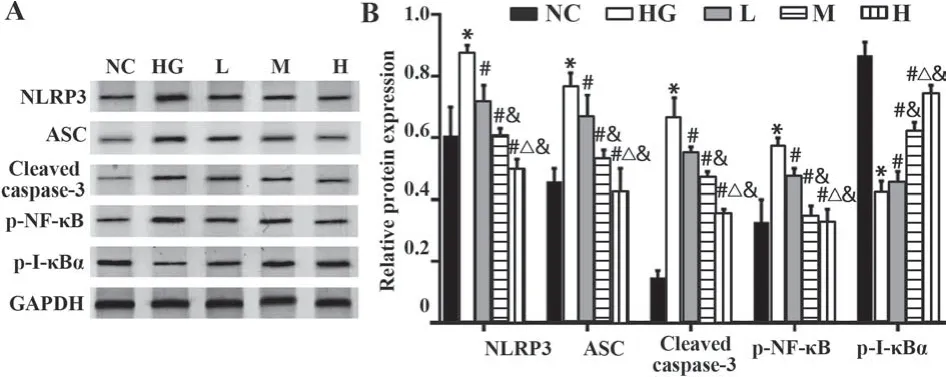
图5 脂联素对高糖处理的内皮细胞NLRP3、ASC、Cleaved caspase-3、p-NF-κB和p-I-κBα蛋白表达的影响Fig.5 Effects of adiponectin on NLRP3, ASC, Cleaved caspase-3, p-NF-κB and p-I-κBα protein expressions of endothelial cells treated with high glucose
2.6 PBS对脂联素抵抗高糖处理的内皮细胞损伤作用的调控 与H+PBS组相比,H+LPS组内皮细胞48 h、72 h、96 h活性显著降低,LDH、SOD和MDA均升高,ROS、GSH-Px均降低,细胞凋亡率、线粒体膜电位、IL-4、IL-6、IL-1β含量均升高,Cleaved caspase-3、NLRP3、ASC、Caspase-1、p-NF-κB蛋白表达均升高,p-I-κBα蛋白表达降低(P<0.05,图6)。
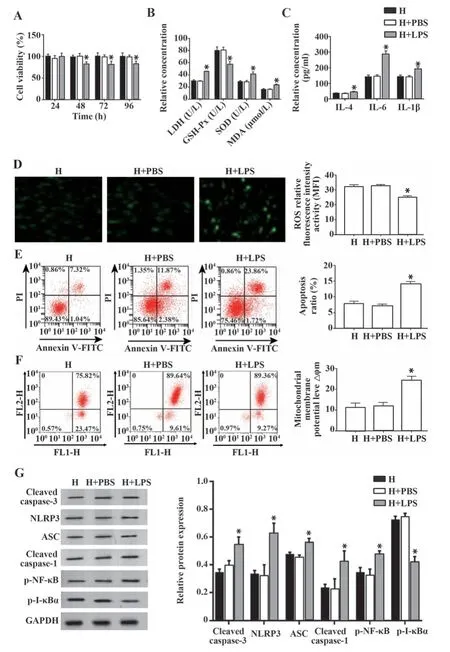
图6 PBS对脂联素调控高糖处理的内皮作用的影响Fig.6 Effect of PBS on adiponectin regulation of endothelial cells treated with high glucose
3 讨论
人和啮齿类动物代谢过程中,脂联素具有胰岛素增敏、抗动脉粥样硬化和抗炎作用,因此脂联素替代疗法可能成为治疗肥胖、胰岛素抵抗、2型糖尿病和动脉粥样硬化的潜在多功能靶点[10]。KIM等[11]研究报道,高糖处理的肾小球内皮细胞(glomerular cell,GEC)、小鼠足细胞中,脂联素提高细胞内Ca2+水平,激活CaMKKβ、Ser431LKB1磷酸化、Thr172 AMPK/PPARα通路及下游信号传导,降低高糖诱导的氧化应激和凋亡,改善内皮功能障碍,说明脂联素通过激活细胞内Ca2+/LKB1-AMPK/PPARα通路改善GEC和足细胞损伤。本研究在体外建立高糖诱导的内皮细胞损伤模型,不同浓度脂联素处理后,内皮细胞增殖能力得到恢复,凋亡率下调,LDH、SOD、MDA、IL-4、IL-6、IL-1β分泌受到抑制,ROS、GSH-Px浓度回升,线粒体膜电位水平也得到恢复,且具有浓度依赖性,充分说明脂联素在抵抗高糖对内皮细胞损害中的潜在价值。杜芸辉等[12]报道,脂联素在糖尿病血管内皮损伤中的保护作用机制与APPL1(APPL1基因编码的衔接蛋白包含PH结构域、PTB结构域以及亮氨酸拉链基序)通路、窖蛋白-1信号通路、cAMP/PKA通路活性相关。但脂联素在内皮细胞抗糖作用机制与NF-κB通路的关系有待深入研究。
NF-κB通路参与包括糖尿病在内的许多疾病炎症阶段,但该通路与脂联素的相互作用尚未清楚[13]。HU等[14]发现,晚期糖基化终产物诱导的内皮细胞损伤模型中,NF-κB/NLRP3通路激活,AMPK活性受抑制,红景天苷能够激活AMPK磷酸化,抑制NF-κB p65和NLRP3炎症小体,减轻内皮细胞炎症和氧化应激,说明红景天苷通过AMPK/NF-κB/NLRP3信号通路改善晚期糖基化终产物诱导的内皮炎症和氧化应激。YI等[15]报道,NF-κB/NLRP3信号通路参与高糖诱导的系膜细胞炎症、纤维化和增殖,linc-RNA-Gm4419特异性抑制该通路活性减轻高糖对系膜细胞的损伤。孟祥龙等[16]在糖尿病小鼠模型中发现,NF-κB/NLRP3通路异常活跃,给予生、熟地黄后该通路活性通过AMPK得到抑制,小鼠器官代谢及抗炎功能均得到改善。说明NF-κB/NLRP3通路活性增强参与糖尿病形成、发生、发展及治疗。本研究发现高糖诱导的内皮细胞中,NF-κB通路关键基因NLRP3、ASC、Cleaved caspase-3、p-NF-κB表达上升,说明该通路活性得到激活,与既往研究结果一致。进一步研究显示,脂联素呈浓度依赖性下调NLRP3、Caspase-1、p-NF-κB,上调p-I-κBα,证明脂联素抑制高糖诱导的内皮细胞NF-κB通路活性。LPS刺激NF-κB信号通路进行恢复实验显示,激活NF-κB明显降低脂联素对高糖诱导的内皮细胞的保护作用,说明NF-κB参与脂联素抵抗高糖所致细胞损伤过程。
综上,脂联素减轻高糖对内皮细胞炎症和氧化应激等损伤作用,维持内皮细胞线粒体功能,潜在机制与抑制NF-κB通路相关,为脂联素在糖尿病临床治疗中的应用奠定了理论基础。本研究结果仅在体外得到初步验证,下一步将开展动物体内研究,为脂联素用于糖尿病治疗提供更有说服力的支持。

