红色诺卡氏菌高产菌的ARTP诱变选育与发酵条件优化
陈洲琴,张祝兰,杨煌建,程 贤,严凌斌,连云阳,2*
(1.福建省微生物研究所,福建 福州 350007;2.福建省新药(微生物)筛选重点实验室,福建 福州 350007)
红色诺卡氏菌细胞壁骨架(Nocardiarubracell wall skeleton,N-CWS)是由诺卡氏菌酸、阿拉伯半乳聚糖和黏肽组成的高分子聚合物[1-2]。N-CWS具有免疫调节活性,通过增强体内巨噬细胞、T细胞和NK细胞等多种免疫细胞的活性激活机体免疫功能,诱生LAK细胞和肿瘤坏死因子,对肿瘤细胞生长有明显的抑制作用[3-6];还可以通过调节人体自身免疫系统,增强宫颈局部免疫功能,逆转低度宫颈细胞学异常,对宫颈HPV感染等临床治疗效果良好[7-10]。此外,N-CWS对促进血管生成和皮肤创面愈合效果显著,具有免疫活性高、副作用小的特点[11-13],在临床上已应用于免疫性疾病、肿瘤、体外炎症、妇科疾病、HPV感染、疱疹病毒感染的治疗,具有广阔的应用前景。常压室温等离子体(ARTP)诱变体系通过射频辉光放电产生各种高能活性离子,使细胞壁和细胞膜的通透性发生改变,损伤细胞内的DNA,引起菌株突变。与化学诱变和紫外诱变等方法相比,ARTP诱变对微生物的遗传物质损伤机制具有多样性,因而具有突变率高、技术安全性高等独特优势。目前,已有相关研究利用ARTP诱变技术进行菌种选育工作,并且取得了显著效果[14-21]。NocardiarubraFIM-PO8作为N-CWS产业化菌种,存在产量低等问题。鉴于此,作者以NocardiarubraFIM-PO8为出发菌株,采用ARTP技术进行诱变,经筛选获得遗传较稳定的Nocardiarubra高产菌株,并通过单因素实验和正交实验优化高产菌株的发酵工艺。
1 实验
1.1 材料、试剂与仪器
出发菌株:NocardiarubraFIM-PO8,保藏于福建省微生物研究所。
葡萄糖,秦皇岛骊骅;酵母粉,安琪酵母;蛋白胨,仙游三和;牛肉膏、琼脂粉,广东环凯;其它试剂均为分析纯。
ARTP-M型常压室温等离子体诱变育种仪,无锡源清天木生物科技有限公司;1360B型超净工作台,北京亚泰科隆仪器技术有限公司;MIR-253型恒温培养箱,日本三洋公司;ZQZY-CF8E型振荡培养箱,上海知楚仪器有限公司;Allegra X-15R型离心机,BECKMAN公司。
1.2 培养基
斜面培养基:蛋白胨1.0%,牛肉膏0.3%,NaCl 0.5%,琼脂2.0%,pH值7.2。
种子培养基:葡萄糖1.0%,酵母粉1.0%,纯水配制,pH值7.2。
发酵培养基:葡萄糖1.0%,酵母粉1.0%,纯水配制,pH值7.2。
1.3 培养方法
菌株活化:将甘油保存的菌种转接至斜面培养基上,置于32 ℃恒温培养箱中培养5~7 d至斜面孢子成熟,取出,4 ℃下保存。
种子液制备:将活化菌株接种至种子培养基中,于32 ℃、230 r·min-1振荡培养36~42 h,得到种子液。
发酵培养:将种子液以0.5%的接种量转接至发酵培养基中,于32 ℃、230 r·min-1振荡培养120 h,收集菌体。
菌体细胞浓度(PMV,即离心后沉淀物与发酵液的比例)的测定:取10 mL发酵液,4 000 r·min-1离心10 min,弃上清液,计算菌体细胞浓度。
1.4 生长曲线的绘制
将种子液接种至100 mL/500 mL的发酵培养基中,以未接种的发酵培养基作为空白对照;将发酵液置于恒温摇床上,于32 ℃、230 r·min-1振荡培养,每隔6 h取样测定菌体细胞浓度;以时间为横坐标、菌体细胞浓度为纵坐标,绘制NocardiarubraFIM-PO8的生长曲线。
1.5 ARTP诱变
菌悬液的制备:取NocardiarubraFIM-PO8转接至斜面培养基上,32 ℃恒温培养6~8 d,用生理盐水洗下斜面培养基上的菌体,混匀后,用擦镜纸过滤,得到菌悬液,稀释使其浓度在105~106CFU·mL-1范围内。
ARTP诱变时间的确定:取10 μL菌悬液均匀涂布于金属载片表面,用镊子将其转移至载物台上,ARTP诱变参数:以纯氦气为工作气体,电源功率为110 W,工作气流量为10 L·min-1,处理距离为2 mm,诱变时间分别为5 s、10 s、15 s、30 s、45 s、60 s、90 s、120 s、180 s。ARTP诱变处理后,将金属载片转移至装有1 mL生理盐水的离心管中,振荡洗脱,将新的菌悬液按10-1~10-6稀释度依次稀释,涂布于固体培养皿上,32 ℃培养6~7 d。培养3 d后对平板菌落进行计数,计算致死率[14]。
突变株的分离与筛选:选择致死剂量适宜的诱变时间对NocardiarubraFIM-PO8菌悬液进行ARTP诱变处理,得诱变菌悬液,按10-1~10-6稀释度依次稀释,选取10-4、10-5、10-6等3个稀释度的菌悬液,分别涂布于分离培养基上培养;将长出的单菌落转接至斜面培养基上,培养7 d后,用接种环接种至种子培养基中,于32 ℃、230 r·min-1培养32~48 h,得到种子液;将种子液以2%的接种量转接至发酵培养基中,于32 ℃、230 r·min-1培养3~5 d,收集橙红色发酵液,离心后水洗,得到赤红球菌湿细胞,比较不同单菌落培养的菌体细胞浓度。
突变株的遗传稳定性:将筛选出的突变株FIM-PO8-16斜面(F0)连续传代6次(F1~F6),经摇瓶发酵后,测定菌体细胞浓度。
1.6 发酵培养基优化
1.6.1 单因素实验
在发酵培养基中分别添加可溶性淀粉、糊精、蔗糖、葡萄糖、甘油作为碳源,其它条件不变,500 mL三角瓶中装料量为100 mL,每个三角瓶中接入0.5%的种子液,于32 ℃、230 r·min-1振荡培养72 h,测定发酵液中菌体细胞浓度,筛选发酵培养基的适宜碳源。
在发酵培养基中分别添加黄豆粉、酵母粉、花生饼粉、棉籽粉、蛋白胨作为氮源,其它条件不变,按上述方法测定发酵液中菌体细胞浓度,筛选发酵培养基的适宜氮源。
1.6.2 正交实验
根据单因素实验结果,选择酵母粉(A)、葡萄糖(B)、蛋白胨(C)、糊精(D)为考察因素,以菌体细胞浓度为评价指标,设计L9(34)正交实验优化发酵培养基组分。
1.7 发酵条件优化
将新鲜的FIM-PO8-16斜面孢子接种于优化发酵培养基中,采用单因素实验考察种子液菌龄(18 h、24 h、30 h、36 h、42 h)、初始pH值(6.0、6.4、6.8、7.2、7.6)、接种量(0.5%、1.0%、2.0%、5.0%、10.0%)、装料量(40 mL/500 mL、60 mL/500 mL、80 mL/500 mL、100 mL/500 mL、120 mL/500 mL)、转速(150 r·min-1、200 r·min-1、230 r·min-1、250 r·min-1、280 r·min-1)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)对FIM-PO8-16菌体细胞浓度的影响。
2 结果与讨论
2.1 Nocardia rubra FIM-PO8的生长曲线(图1)
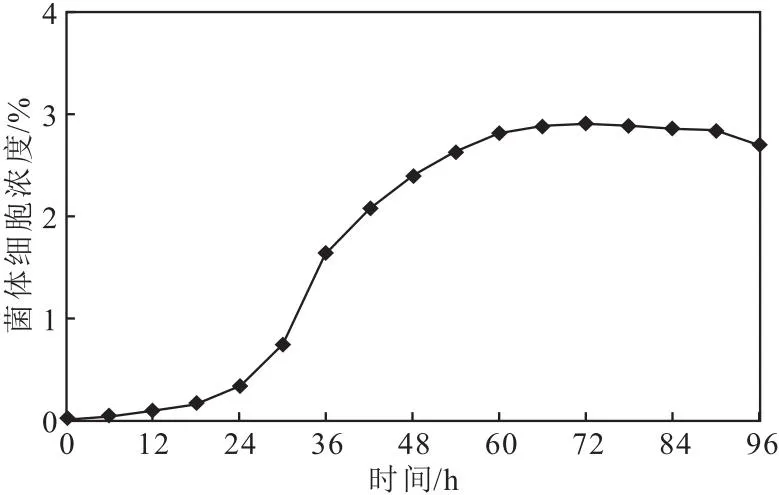
图1 Nocardia rubra FIM-PO8的生长曲线Fig.1 Growth curve of Nocardia rubra FIM-PO8
由图1可知,培养初期,菌体大量生长;24 h时菌体进入生长对数期;54~90 h时为菌体生长稳定期,菌体细胞浓度稳定;90 h后菌体进入衰亡期,由于培养基中营养成分不足以维持菌体生存,菌体细胞浓度下降。
2.2 ARTP诱变效果
2.2.1 ARTP诱变时间的选择
ARTP诱变时间对NocardiarubraFIM-PO8致死率的影响如图2所示。
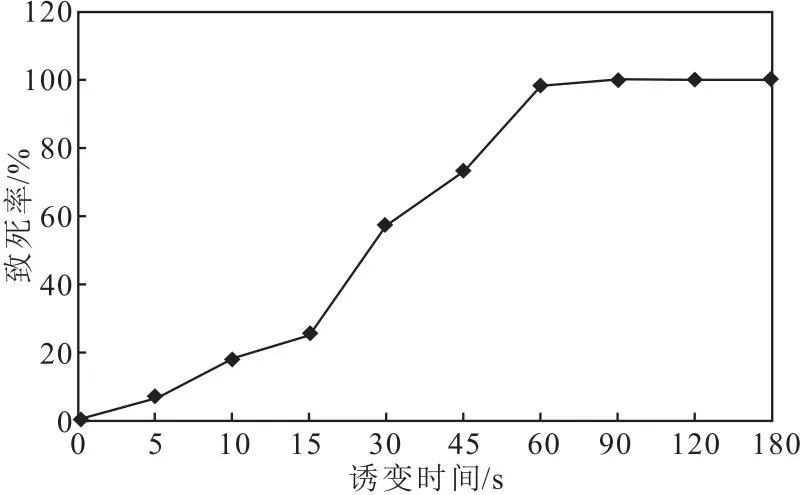
图2 ARTP诱变时间对Nocardia rubra FIM-PO8致死率的影响Fig.2 Effect of ARTP mutagenesis time on lethality of Nocardia rubra FIM-PO8
由图2可知,NocardiarubraFIM-PO8致死率与ARTP诱变时间之间存在明显的剂量效应关系,致死率随诱变时间的延长先逐渐升高而后趋于稳定,诱变45 s时其致死率为73.1%;诱变90 s后菌落完全不生长。因此,最佳ARTP诱变时间为45 s。
2.2.2 突变株的筛选
以NocardiarubraFIM-PO8为出发菌株(菌体细胞浓度为2.91%),诱变处理45 s后的菌悬液经梯度稀释涂布于分离培养基上,挑选92株单菌落进行发酵,以出发菌株的菌体细胞浓度为100%,计算突变株的相对菌体细胞浓度,结果见表1。

表1 突变株初筛结果
由表1可知,21株为正突变菌株(相对菌体细胞浓度在110%以上),其正突变率为22.83%。取初筛菌株进行二级摇瓶发酵复筛,其中FIM-PO8-16、FIM-PO8-37、FIM-PO8-69等3株突变株具有较高的菌体细胞浓度,相对菌体细胞浓度分别为175.9%、133.1%、157.3%,其中突变株FIM-PO8-16菌体细胞浓度最高,比出发菌株FIM-PO8提高了75.9%,突变效果显著。
2.2.3 高产突变株的遗传稳定性
菌种的遗传稳定性是实现工业化生产的一个重要因素。突变株在传代过程中若遗传性状不稳定,会导致筛选到的高产菌株传代培养多次后发酵产能下降[22-23]。对突变株FIM-PO8-16连续传代6次,经摇瓶发酵后测定菌体细胞浓度。以生长良好的原代菌株F0的菌体细胞浓度为100%,测得F1、F2、F3、F4、F5、F6代的相对菌体细胞浓度分别为102.1%±1.5%、101.2%±1.3%、100.5%±2.0%、100.8%±2.3%、99.4%±2.6%、93.9%±2.1%。表明突变株FIM-PO8-16传5代发酵后菌体细胞浓度无明显影响,菌体细胞浓度基本稳定,其遗传较为稳定。
2.3 发酵培养基优化
2.3.1 发酵培养基组分的筛选
碳源对菌体的生长速率和细胞浓度都有很大影响,因此,选择适宜的碳源进行菌丝体增殖培养显得尤为重要[23]。氮源更是微生物生长所必需的营养物质[15]。发酵培养基碳源和氮源对突变株FIM-PO8-16菌体细胞浓度的影响如图3所示。
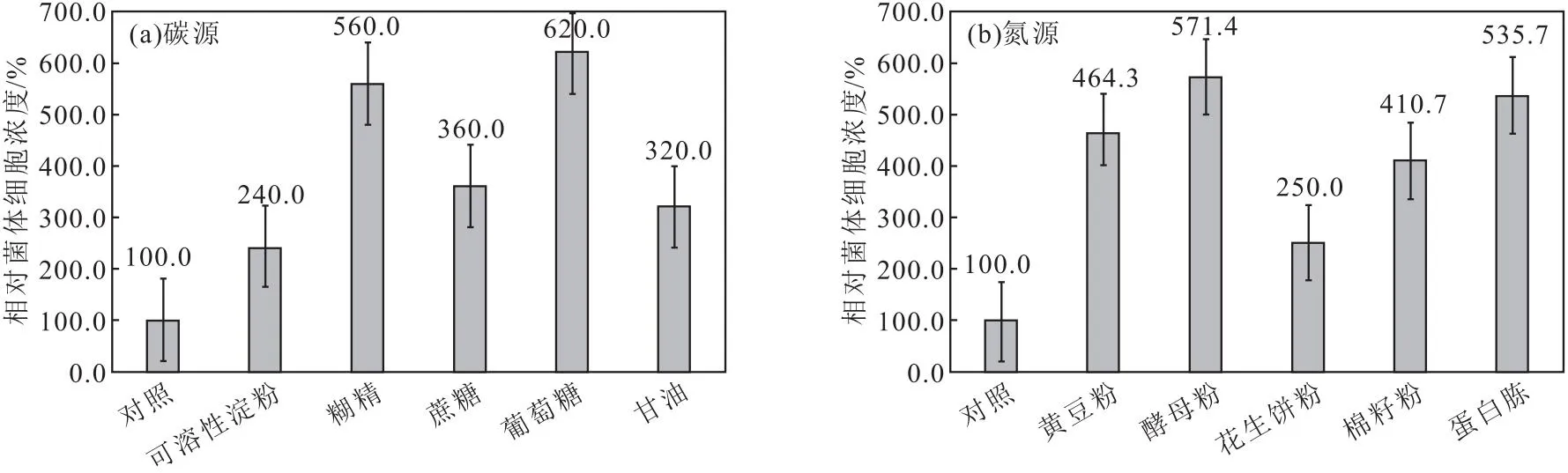
图3 发酵培养基碳源(a)和氮源(b)对突变株FIM-PO8-16菌体细胞浓度的影响Fig.3 Effects of carbon source(a) and nitrogen source(b) in fermentation medium on cell concentration of mutant strain FIM-PO8-16
由图3a可知,分别以可溶性淀粉、糊精、蔗糖、葡萄糖和甘油为碳源时均可促进菌体生长;其中以糊精、葡萄糖为碳源时,效果更显著,与对照组相比,菌体细胞浓度分别提高了460.0%和520.0%。
由图3b可知,分别以黄豆粉、酵母粉、花生饼粉、棉籽粉和蛋白胨为氮源时均可促进菌体生长;其中以酵母粉、蛋白胨为氮源时,效果更显著,与对照组相比,菌体细胞浓度分别提高了471.4%和435.7%。
2.3.2 发酵培养基组分优化
在单因素实验的基础上,设计L9(34)正交实验优化发酵培养基组分,因素与水平见表2,结果分析见表3。
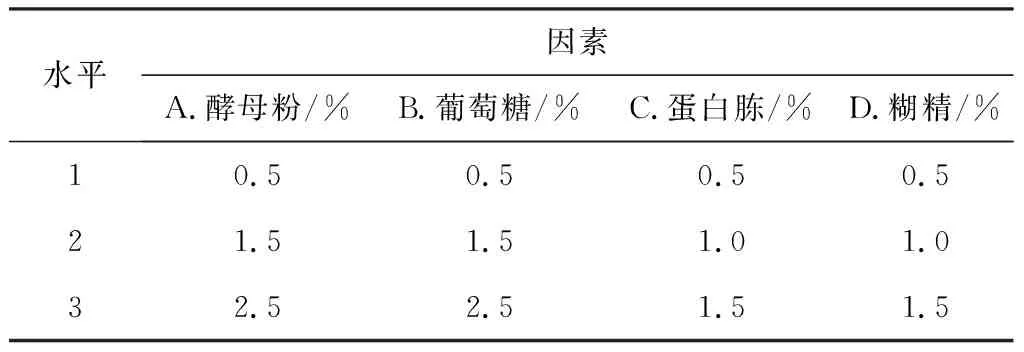
表2 正交实验的因素与水平
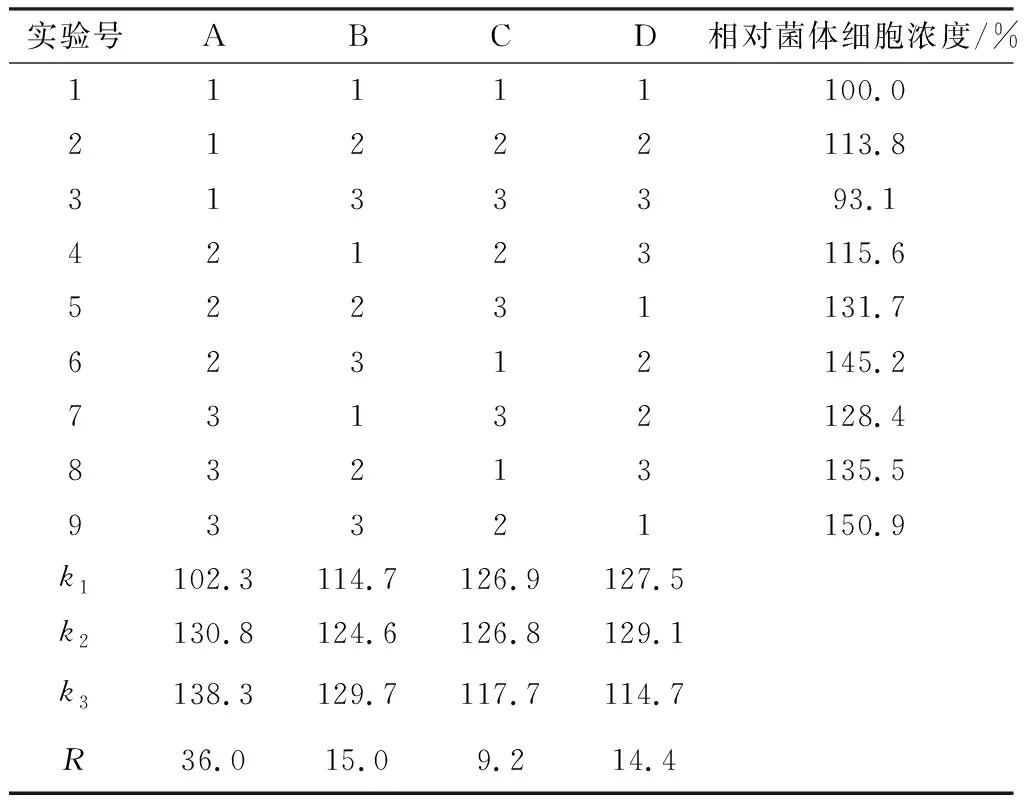
表3 正交实验结果
根据正交设计助手软件分析,按极差R值确定各因素对菌体细胞浓度影响的大小顺序为:酵母粉(A)>葡萄糖(B)>糊精(D)>蛋白胨(C),最佳发酵培养基配方组合为A3B3C1D2,即酵母粉2.5%、葡萄糖2.5%、蛋白胨0.5%、糊精1.0%。
2.4 发酵条件优化(图4)
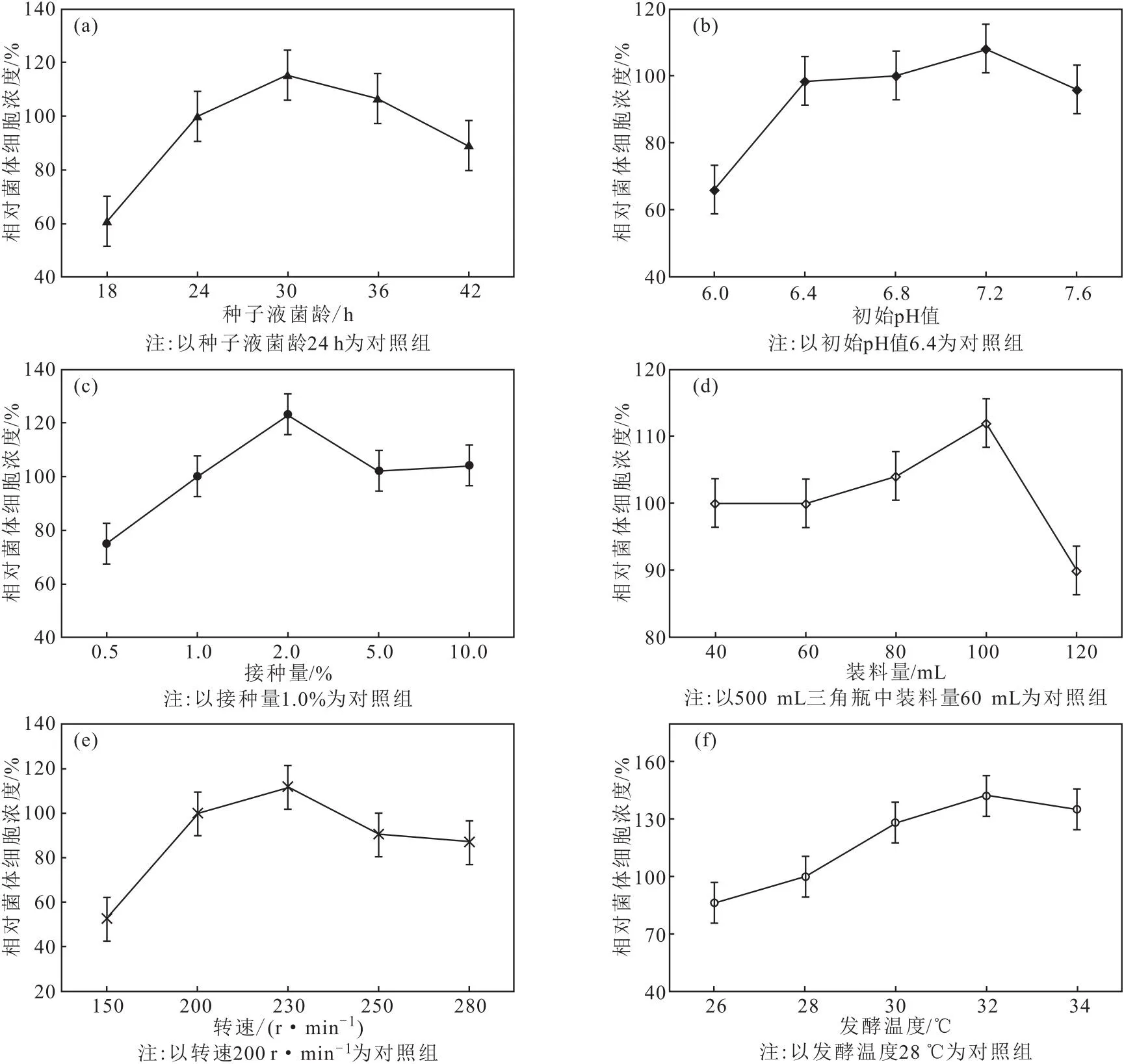
图4 种子液菌龄(a)、初始pH值(b)、接种量(c)、装料量(d)、转速(e)、发酵温度(f)对FIM-PO8-16菌体细胞浓度的影响
由图4a可知,随着种子液菌龄的增加,菌体细胞浓度逐渐升高,当种子液菌龄为30 h时,菌体细胞浓度最高;当种子液菌龄超过30 h后,菌体细胞浓度降低。因此,选择种子液菌龄为30 h。
培养基的初始pH值对菌体的生长有重要的影响,合适的pH值能缩短菌体的延滞期,使菌体较快地进入对数生长期。由图4b可知,初始pH值在6.4~7.2范围内时,菌体能较好生长,菌体细胞浓度逐渐升高;当初始pH值为7.2时,菌体细胞浓度最高;继续增大初始pH值,菌体细胞浓度降低。因此,选择初始pH值为7.2。
由图4c可知,随着接种量的增加,菌体细胞浓度逐渐升高,当接种量为2.0%时,菌体细胞浓度最高;继续增加接种量,菌体细胞浓度整体降低。综合考虑,选择接种量为2.0%。
由图4d可知,随着装料量的增加,菌体细胞浓度逐渐升高,当装料量为100 mL时,菌体细胞浓度最高;继续增加装料量,菌体细胞浓度迅速降低。因此,选择500 mL三角瓶中装料量为100 mL。
由图4e可知,随着转速的升高,菌体细胞浓度逐渐升高,当转速为230 r·min-1时,菌体细胞浓度最高;继续提高转速,菌体细胞浓度降低。因此,选择转速为230 r·min-1。
微生物只能在适宜的温度范围内生长,温度过高或过低,均不利于微生物生长和繁殖。由图4f可知,随着发酵温度的升高,菌体细胞浓度逐渐升高,当发酵温度为32 ℃时,菌体细胞浓度最高;继续升高发酵温度,菌体细胞浓度降低。因此,选择发酵温度为32 ℃。
2.5 发酵条件验证
在最优发酵条件下,对突变株FIM-PO8-16进行5次摇瓶发酵实验,以优化前发酵条件为对照,测得菌体细胞浓度平均值为8.31%,较对照组(5.12%)提高了62.30%,说明在优化发酵条件下该突变株的菌体细胞浓度显著提高,且优化发酵条件重复性良好。
3 结论
以NocardiarubraFIM-PO8为出发菌株,采用ARTP技术进行诱变,经筛选获得遗传较稳定的Nocardiarubra高产菌株FIM-PO8-16,其菌体细胞浓度比出发菌株提高了75.9%。并通过单因素实验和正交实验优化了突变株FIM-PO8-16的发酵工艺,确定最佳发酵培养基组分为:酵母粉2.5%、葡萄糖2.5%、蛋白胨0.5%、糊精1.0%;最佳发酵条件为:种子液菌龄30 h、初始pH值7.2、接种量2.0%、装料量100 mL/500 mL、转速230 r·min-1、发酵温度32 ℃。在此条件下,FIM-PO8-16菌体细胞浓度达到8.31%。该研究对N-CWS的高效制备具有重要意义。