结直肠息肉冷圈套切除术的临床疗效分析
马 艳, 武曼群, 胡建平, 马莉萍
(1.宁夏医科大学,银川 750004; 2.银川市第一人民医院消化内科,宁夏医科大学第二临床医学院,银川 750001)
结直肠癌是我国常见的胃肠道恶性肿瘤之一[1-2]。2020 年全球癌症数据统计,我国结直肠癌新发病例56 万、死亡病例29 万,其发病率和病死率在我国恶性肿瘤中分别居于第2 位和第5 位[3],多数结直肠癌系经腺瘤、腺癌路径演化所致[4]。结肠镜检查不仅可以进行结直肠癌的筛查,还可以在检查过程中进行息肉切除,进而阻止腺瘤性息肉向腺癌的进展。因此,内镜下结肠息肉切除是降低结直肠癌发病率及病死率的最有效的治疗措施。内镜下息肉切除可以减少约80%的结直肠癌的发生[2]。现阶段临床上结直肠微小息肉、小息肉切除主要选择的方式有冷活检钳夹术(cold forcepbiopsy polypectomy,CFP)、热活检钳夹术(hot forcep biopsy polypectomy,HFP)、冷圈套息肉切除术(cold snare polypectomy,CSP)、热圈套息肉切除术(hot snare polypectomy,HSP)、氩等离子体凝固术(argon plasma coagulation,APC)、内镜下黏膜切除术(endoscopic mucosal resection,EMR)[5-6]。其中CSP 是一种不需要使用电切及黏膜下注射的办法,可以避免电损伤,本研究对CFP、CSP 与EMR 在切除结直肠微小息肉和小息肉的安全性及有效性进行对照比较。
1 资料与方法
1.1 一般资料
搜集2019 年1 月至2021 年12 月在银川市第一人民医院行肠镜检查检出的直径3~10 mm的结肠息肉共694 枚。纳入标准:1)从病历系统收集行结直肠息肉切除术患者的病历资料,其息肉为单发或多发的直径3~10 mm 的结直肠息肉;2)内镜下判别为良性息肉患者。排除标准:1)正在服用抗凝/血小板药物或者停用不足7 d者;2)肠道清洁准备差者(波士顿肠道评分<5分);3)内镜资料或者临床病理学资料不完整者;4)患有息肉病、炎性肠病者。符合要求的患者中男性186 人,女性183 人;年龄28~83 岁,平均年龄(60.5±7.8)岁。按照息肉直径分成微小息肉组和小息肉组,微小息肉组CSP 术式处理205 枚息肉,CFP 术式处理有245 枚息肉;小息肉组EMR术式处理112 枚息肉,CSP 术式处理132 枚息肉。
1.2 方法
所有的内镜操作都由银川市第一人民医院4名有实践经验的内镜医生实施,切除息肉组织标本均由2 名高年资病理医师诊断,均未提前告知息肉切除方法。应用奥林巴斯(北京)销售服务有限公司提供的内镜(型号为PCF-Q260AZI、CFHQ290I)、圈套器(型号为JHY-SD-23-230-30-A1),德国爱尔博VIO200S 低频电刀,ENDO CUTIQ 形式,输出功率35~50 W。
1.3 观察指标
息肉直径、出血率、穿孔率、钛夹使用率、完全切除率(病理科医师在显微镜下评估息肉完整性,即切除息肉边缘未见息肉组织)、息肉位置及病理结果等。
1.4 统计学方法
数据采用SPSS 20.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t 检验。计数资料以率表示,组间比较采用χ2检验或Fisher 精确概率法。P≤0.05为差异有统计学意义。
2 结果
2.1 微小息肉组CSP 与CFP 术式观察指标比较
微小息肉组CSP 与CFP 相比,息肉直径差异无统计学意义(P>0.05);两种术式疗效相比较,CSP 术式完全切除率高于CFP 术(P<0.05),见表1。
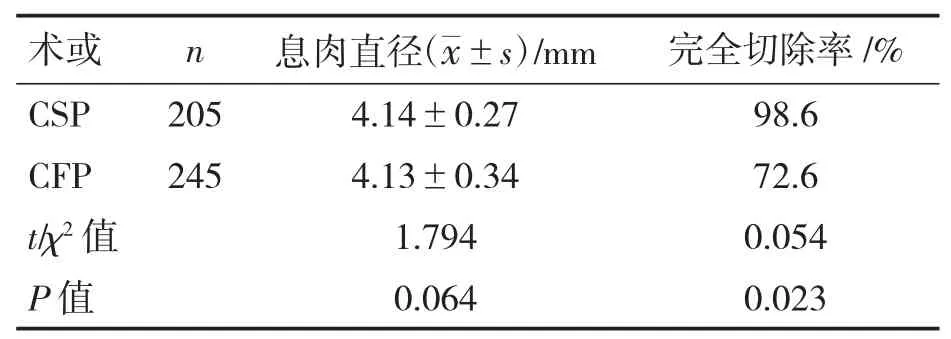
表1 微小息肉组CSP 与CFP 术式观察指标比较
2.2 小息肉组CSP 与EMR 术式观察指标比较
与CSP 术式相比,小息肉组EMR 术式处理息肉直径、完全切除率差异无统计学意义(P>0.05);钛夹使用率EMR 高于CSP(P<0.05);穿孔率和出血率CSP 均低于EMR(P 均<0.05),见表2。
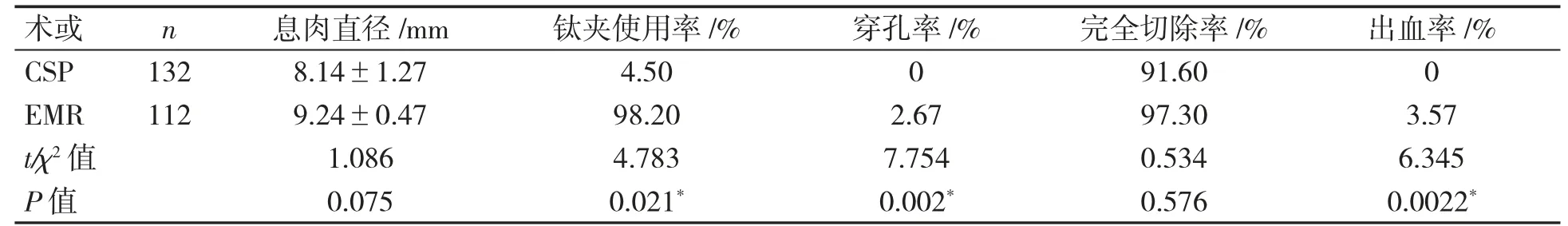
表2 小息肉组CSP 与EMR 术式观察指标比较
2.3 微小息肉组CSP 与CFP 术式息肉位置及病理结果比较
微小息肉组息肉位置及病理结果比较,CSP与CFP 在息肉位置及病理结果方面,差异均无统计学意义(P 均>0.05),见表3。

表3 微小息肉组CSP 与CFP 术式息肉位置及病理结果比较(例)
2.4 小息肉组EMR 与CSP 息肉位置及病理结果比较
小息肉组息肉位置及病理结果比较,EMR与CSP 在息肉位置及病理结果方面,差异均无统计学意义(P 均>0.05),见表4。

表4 小息肉组EMR 与CSP 息肉位置及病理结果比较(例)
3 讨论
目前研究已证实,超过90%的结直肠癌由结肠息肉转变而来,结肠息肉按大小可分为微小息肉(≤5 mm)、小息肉(6~9 mm)、大息肉(≥10 mm),现有的结肠镜检查的数据表明,所检出的息肉中,90%左右为(微)小息肉[5,7-8]。研究[5]显示,50%的被调研内镜专家选择用活检钳切除1~3 mm息肉,用电圈套器勒除装置切除7~9 mm 息肉,而对于4~6 mm 的息肉没有明确的优选办法。在欧洲,消化内镜学会推荐对于≤5 mm 的小息肉首选CSP 切除,认为出血、穿孔等并发症的发生率更低,且完全切除率更高,获得的组织标本更完整,对于6~9 mm 的无蒂息肉,也推荐采用CSP 切除,认为其安全性更高[5,9-12]。但是目前我国仍缺乏基于循证医学证据的结直肠息肉规范化诊疗指南,并且该技术在国内应用实践经验相对较少。基于此,本研究对2019 年1 月至2021年12 月行内镜下结肠息肉切除的病例开展了回顾性分析,探讨CSP 的临床疗效及安全性。
本研究对几种息肉切除术式的完全切除率、术后出血率、穿孔率等指标进行了比较。结果表明,微小息肉组CSP 的完全切除率为98.6%,CFP的完全切除率为72.6%,CSP 的完全切除率高于CFP,原因可能为:1)CFP 首次钳除之后的出血导致内镜下的评估困难,残留息肉不易观察;2)二次甚至三次钳夹无法保障创面之间的连接,会导致息肉切除不完全。小息肉组中EMR 出血率、穿孔率、钛夹利用率方面均高于CSP;在术后出血方面,CSP 迟发性出血为0,依据目前的实际操作经验,CSP 虽然术中出血多于活检钳钳除及热切除,如未出现活动性出血,则几乎不会再出现迟发性出血,研究中也未发现CSP 术后迟发性穿孔,而EMR 常采用电切电凝功能,虽然当时创面可被电凝止血,但其热损伤可能导致术后创面范围扩大而出现迟发性出血,同时,电凝后局部结肠黏膜充血水肿明显,可能出现坏死并导致穿孔,而CSP 切除由于不使用高频通电,术后出血率及穿孔率均低,因而更为安全[5-9]。同时,由于CSP 不需要高频发生装置及单极装置的电极板,无须黏膜下注射,且术后出血率低,操作中基本不需要钛夹夹闭,与EMR 相比,可以节省操作时间和成本[13]。
对于(微)小息肉,CSP 是科学合理的选择,但CSP 缺少对周围组织的电灼烧作用,仍有息肉残留的理论风险。目前我们也积累了解决此类风险的实践经验:1)术中评估可以采用白光或者内镜窄带成像技术(NBI)及NBI+放大功能辅助实时评估切缘,术后评估则需要加强标本的规范送检及与病理科医生的协作配合;2)扩大冷切除范围;3)使用专用冷切圈套器,可以对黏膜面进行充分切割,创面也更平整。
综上所述,CSP 应用于切除3~10 mm 结肠息肉可提升完全切除率,而且操作简单、技术难度不高,并发症的发生率低、所需的操作时间少,是安全性更高的微小息肉及小息肉切除方式,值得临床推广应用。

