血清ADAMTS13水平与接受ECMO治疗患者的预后关系
陈华桂 肖杰 万剑波 丁冬梅 马兰
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)通过机械循环支持,发挥暂时替代心肺的功能,已广泛应用于难治性和危重症心脏及呼吸系统疾病的治疗[1]。在过去10年中,提供ECMO 的中心数量迅速增长。但是临床实践也发现,ECMO 同时伴有高概率的并发症,主要包括严重的炎症反应、出血、血栓形成等,其中致死性的出血与血栓发生率高达10%~33%[2]。目前ECMO治疗凝血监测的常用指标主要包括部分凝血活酶时间(activated partial thromboplastin time,APTT)和活化凝血时间(activated clotting time,ACT)[3]。 然而, 包括凝血系统激活和消耗性凝血疾病等因素的诸多因素均会影响凝血监测的准确性[4]。目前国内外针对ECMO 治疗过程中出凝血方面的研究较少,尚无一套完善的、可有效监测抗凝血治疗过程的方案和指标。如何在临床ECMO 治疗过程中通过有效监测和干预,达到既可以预防血栓又能有效降低出血风险,是目前ECMO 治疗过程中的难点和关键所在。血管性血友病因子特异性裂解酶(a disintegrin-like and metalloprotease with thrombospondin type 1 motif,member 13,ADAMTS13)通过降解血管性血友病因子(von willebrand factor,VWF)来减少血栓形成,主要来源于肝星状细胞和血管内皮细胞[5]。本研究选取2020年1月—2022年6月在湖南医药学院第一附属医院接受ECMO 治疗的42 例患者,按照ECMO 撤离1 个月内患者预后分为生存组和死亡组进行探讨。通过分析接受ECMO治疗患者的血清ADAMTS13 水平,分析血清ADAMTS13与接受ECMO 治疗患者的预后关系,为调控患者出凝血平衡提供相关试验基础和新的临床治疗思路,从而为临床监控出血或血栓并发症发生的相关标准制定提供依据,尤其为ECMO 治疗凝血监测相关行业标准的制定提供试验依据。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年6月在湖南医药学院第一附属医院接受ECMO 治疗的42 例患者。纳入标准:年龄18 ~70 岁;治疗期间进行肝素抗凝治疗;患者家属签署知情同意书。排除标准:妊娠期及哺乳期妇女;ECMO 治疗前已有明确出血表现,未用肝素抗凝;治疗后24 h 内死亡;ECMO 治疗前72 h 已出现严重感染者;未经治疗的自身免疫系统疾病患者。按照ECMO 撤离1 个月内患者预后分为生存组(n=29)和死亡组(n=13)。本研究经医院伦理委员会批准。
1.2 方法
所有患者于接受ECMO 治疗前以及治疗后24 h、48 h这3 个时间点取静脉血,分别注入干燥管、3.8%枸橼酸钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)及肝素抗凝管内,3 000 r/min 离心10 min,收集血浆置于-80 ℃保存。使用酶联免疫吸附测定法(enzyme-linked immunosorbent assay,ELISA)检测ADAMTS13 活性。
1.3 观察指标
经各项检查后对比2 组年龄、性别、体表面积、左室射血分数、平均动脉压、氧合指数、急性生理与慢性健康评分(acute physiology and chronic health evaluation-Ⅱ,APACHE-Ⅱ)、ECMO 流量等临床数据。APACHE-Ⅱ评分的理论最高值为71分,APACHE-Ⅱ≥15 分归属为重症,而APACHE-Ⅱ<15分归属为非重症。比较2 组患者接受ECMO 治疗前1 h 以及治疗后24 h、48 h 的血清ADAMTS13 水平。
1.4 统计学处理
使用SPSS 23.0 统计学软件进行数据分析。计量资料以(±s)表示,组间比较采用独立样本均数t检验;计数资料以n(%)表示,采用χ2检验。用logistic 回归分析死亡的危险因素。检验水准α=0.05。
2 结果
2.1 2 组一般资料比较
生存组年龄小于死亡组,差异有统计学意义(P<0.001)。2 组性别和体表面积比较,差异无统计学意义(P>0.05)。见表1。

表1 生存组与死亡组一般资料比较
2.2 2 组体内循环数据比较
生存组平均动脉压、氧合指数均高于死亡组,APACHE-Ⅱ评分低于生存组(P<0.05)。2 组左室射血分数和ECMO 流量比较,差异无统计学意义(P>0.05)。见表2。
表2 生存组与死亡组体内循环数据比较(±s)
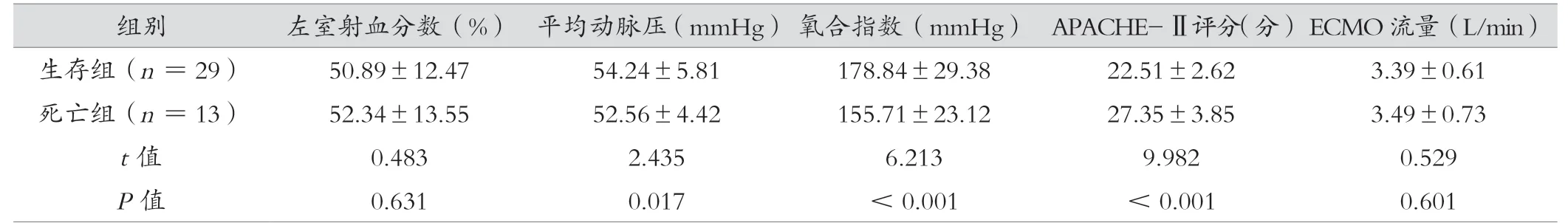
表2 生存组与死亡组体内循环数据比较(±s)
组别左室射血分数(%) 平均动脉压(mmHg) 氧合指数(mmHg) APACHE-Ⅱ评分(分)ECMO 流量(L/min)生存组(n =29)50.89±12.4754.24±5.81178.84±29.3822.51±2.623.39±0.61死亡组(n =13)52.34±13.5552.56±4.42155.71±23.1227.35±3.853.49±0.73 t 值0.4832.4356.2139.9820.529 P 值0.6310.017<0.001<0.0010.601
2.3 2 组ECMO 治疗前1 h 及治疗后24 h、48 h 血清ADAMTS13 水平比较
ECMO 治疗后,2 组血清ADAMTS13 水平升高。生存组ECMO 治疗前1 h 及治疗后24 h、48 h 血清ADAMTS13水平高于死亡组(P<0.001)。见表3。
表3 生存组与死亡组ECMO 治疗前1 h 及治疗后24 h、48 h 血清ADAMTS13 水平比较(IU/dL,±s)

表3 生存组与死亡组ECMO 治疗前1 h 及治疗后24 h、48 h 血清ADAMTS13 水平比较(IU/dL,±s)
组别ECMO 治疗前1 hECMO 治疗后24 hECMO 治疗后48 h生存组(n =29)83.31±7.7191.46±8.48106.89±12.47死亡组(n =13)72.14±8.1581.06±10.5289.73±15.07 t 值10.08912.76516.381 P 值<0.001<0.001<0.001
2.4 ECMO 辅助治疗患者死亡的危险因素分析
以ECMO 治疗48 h 后血清ADAMTS13 水平为自变量,以生存和死亡为因变量分析。结果显示,血清ADAMTS13水平为ECMO 治疗患者死亡的独立危险因素(B=0.629,SE =0.164,Waldχ2=14.800,OR=1.879,95%CI1.488 ~2.361,P<0.001)。
3 讨论
ECMO 是一种能够为心脏、肺部或两者提供短期机械支持的技术。同时,电路设计和插管技术进步的支持使ECMO的使用适应证也得到了扩大。尽管广泛采用体外生命支持技术,但ECMO 的使用仍然与发病率和死亡率相关。ECMO 期间出现的并发症是对体外循环的炎症反应。这种反应与全身炎症反应综合征有相似之处,并且与体外循环有关。患者血液暴露于ECMO 回路的非内皮化表面会导致先天免疫系统的广泛激活;如果不加以控制,可能会导致炎症和器官损伤。接触系统激活最终导致触发内在凝血途径。作为接触激活的产物形成的因子Ⅻa 激活因子Ⅺ至Ⅺa。在接下来的步骤中,因子Ⅺa 将因子Ⅸ转化为Ⅸa,进而激活因子Ⅹ。因子Ⅹ的转换是内在和外在途径之间凝血级联的第一个常见步骤。传统上认为外在途径在体外循环中的作用较小,部分原因是组织损伤的需要和随后组织因子(tissue factor,TF)的暴露。目前国内外针对ECMO治疗伴发的出血方面的研究较少,尚无一套完善的、可有效监测抗凝血治疗过程的方案和指标。如何在临床ECMO 治疗过程中通过有效监测和干预,达到既可以预防血栓又能有效降低出血风险,是目前ECMO 治疗过程中的难点和关键所在[6]。
本研究选取2020年1月—2022年6月在湖南医药学院第一附属医院接受ECMO 治疗的42 例患者。比较2 组患者接受ECMO 治疗前1 h 以及治疗后24 h、48 h 的血清ADAMTS13 水平。本研究结果表明,生存组年龄小于死亡组,差异有统计学意义(P<0.001)。2 组性别和体表面积比较,差异无统计学意义(P>0.05)。生存组平均动脉压、氧合指数均高于死亡组,APACHE-Ⅱ评分低于生存组(P<0.05)。ECMO 治疗后,2 组血清ADAMTS13 水平升高。生存组ECMO 治疗前1 h 及治疗后24 h、48 h 血清ADAMTS13 水平高于死亡组。VWF 代谢受血液流变条件的严格控制,特别是在高流体剪切力条件下,会诱导凝血和纤维蛋白溶解系统的激活,影响ADAMTS13 的活性,从而干扰VWF 活化和降解。ADAMTS13 作用于VWF 蛋白的肽键[7]。ECMO 治疗时,血液同样受到仪器高剪切力的作用[8]。此外,ECMO 不同的治疗模式,如VV-ECMO、VA-ECMO具有不同的剪切力,而这对ADAMTS13 活性及VWF 的代谢也可能存在影响[9]。本研究以接受ECMO 治疗的患者为受试对象,研究ECMO 治疗对ADAMTS13 水平的影响,评估ADAMTS13 对出血及血栓风险的预估是否存在临床意义。由于ECMO 的平流血流灌注模式,因此在治疗过程中存在一定程度的脏器血流灌注不足,易引起患者出现强烈应激反应[10]。同时,ECMO 治疗需要较长时间支持,导致人工材料和血液之间存在广泛接触,从而引起细胞因子的释放,导致炎症反应的发生[11]。不同炎症因子影响ADAMTS13 的活性[12]。但是,在接受ECMO 治疗的患者人群中,上述ADAMTS13 活性变化是否与炎症因子变化具有相关性,目前尚无清晰论述,值得进一步研究。在众多生理和病理状态中,ADAMTS13 活性存在不同程度的降低。由于ECMO患者人群基础疾病危重且复杂,其不同疾病状态可能会对ADAMTS13 活性产生不同程度的影响,因此结合相关临床资料,多因素综合分析具有至关重要的意义。
在过去的10年中,ECMO 技术有了巨大的改进。这有助于越来越多的中心接受越来越多的适应证。正在进行的抗凝和膜肺构建的研究将进一步提高ECMO 的安全性和有效性。此外,仍需进一步的研究,如临床前研究和临床研究等来评估ECMO 治疗对凝血监测的影响。这项工作将为ECMO 期间可能使用的新型抗凝疗法提供信息。目前,靶向因子Ⅻ作为一种新的抗凝手段引起了人们的极大兴趣。鉴于有可能降低或消除血栓形成的风险,而不会遇到与当前抗凝剂相关的出血风险,因此在这种情况下使用因子Ⅻ抑制剂是有应用前景的[13]。抑制F Ⅻa 的重组人抗体3 F7 已在VAECMO 的兔模型中成功测试,但在进行人体研究前,任何未来的工作都需要使用当代临床ECMO 设备在ECMO 的大型动物模型中证明因子Ⅻ抑制剂的安全性和有效性[14]。ECMO是一个存在明显并发症(包括血栓形成和出血)的复杂过程。由于使用体外循环进行心肺支持使血液暴露在非生物的、血栓形成的表面,临床ECMO 方案多推荐全身抗凝[15]。因此,对于大多数ECMO 患者来说,抗凝是必要的,从而防止回路凝血。本质上讲,抗凝剂最常见的副作用是出血[16]。由于危重患者与ECMO 回路之间的相互作用以及患者对疾病和ECMO 回路的炎症反应,都会导致患者正常止血失衡,因此ECMO 期间的抗凝更为复杂[17]。本研究初步发现接受ECMO治疗患者的血清ADAMTS13 水平降低与预后不佳相关,应通过早期检测及干预,提高患者生存率。文章中体现了《体外膜肺氧合循环支持专家共识》[18]的执行标准。
综上所述,接受ECMO 治疗患者的血清ADAMTS13 水平降低与预后不佳相关。本研究为调控患者出凝血平衡提供相关试验基础和新的临床治疗思路,从而为临床监控出血或血栓并发症发生的相关标准制定提供依据,尤其为ECMO 治疗凝血监测相关行业标准的制定提供试验依据。

