β-环糊精接枝壳聚糖对铅离子的吸附研究
李海丰,刘海江,廖绍群,万志勇,黄丽华
(1.新余市生态环境污染防治中心,江西新余,338000;2.江门生态环境监测站,广东江门,529000)
0 引言
环境中的铅主要来自工业废气、汽车尾气、某些涂料及铅包装饮品,尤其是印刷厂在铅版镀铁、镀锌过程中会产生高含量酸性铅、锌废水[1]。铅及其化合物主要是从消化道及呼吸道进入人体,随血液循环流至全身。铅中毒会直接损伤人和动物的甲状腺功能,并引起头痛、慢性肌肉痛[2]、高血压[3]等,如果是急性铅中毒,还会导致腹绞痛、贫血、中毒性肝炎[4]。此外,铅还能通过母体胎盘侵入胎儿脑组织。
本研究仿文献[5-7]方法, 将β-环糊精(β-Cyclodextrin, 简写β-CD) 接枝到壳聚糖(Chitosan,简写CS),以合成β-环糊精接枝壳聚糖(CS-CD)吸附剂,利用CS-CD 上的氨基[8]与Pb2+发生配位反应形成螯合物,从而将其去除。文章主要从吸附影响因素、动力学、热力学、吸附机理的XPS 分析等几个方面出发对CS-CD 吸附Pb2+的性能进行初步分析。
1 试剂与仪器
壳聚糖(脱乙酰度90%以上,国药集团化学药剂有限公司)[9];CS-CD;硝酸铅(分析纯,国药集团化学药剂有限公司)。
原子吸收分光光度计(WFX-120 型,尤尼柯上海仪器有限公司);pH/电导计(990 型,上海雷磁仪器厂);电子天平(JA1003 型,上海精密科学仪器有限公司天平仪器厂)。
2 实验方法
2.1 吸附影响因素实验
本研究仿文献[8]的方法,称取一定量的CS-CD加入Pb2+溶液中,在不同初始浓度、pH、投加量的条件下进行Pb2+的吸附试验,运用原子吸收分光光度法在283.3nm 处测定吸附平衡时滤液中离子的浓度,其吸附量Q(mg/g)的计算公式为:
其中C0,Pb2+的初始浓度,mg/L;Ce,吸附平衡浓度,mg/L;V,溶液总体积,L;m,吸附剂质量,g。
2.2 吸附动力学测定
本研究仿文献[8]的方法,在一系列150mL 具塞锥形瓶中分别加入一等量的 CS-CD 和25mL 浓度为20mg/L 的Pb2+溶液,旋紧盖子,置于恒温振荡器上。在不同温度(30℃、40℃、50℃)和150r/min 的条件下振荡,在不同时间取出过滤。用原子吸收分光光度法测定滤液中的 Pb2+残留量,根据工作曲线求出Pb2+的浓度。
2.3 吸附等温线测定
本研究仿文献[8]的方法,在一系列150mL 具塞锥形瓶中分别加入一定量的 CS-CD 和25mL 不同浓度的Pb2+溶液,旋紧盖子,置于恒温振荡器上。在不同温度(20 ℃ 、30℃、40 ℃、50 ℃)和150r/min 的条件下振荡至吸附平衡,求出平衡浓度,根据公式1 计算平衡吸附量,并绘出吸附等温线。
3 结果与讨论
3.1 pH 对CS-CD 吸附效果的影响
在16mg/L 的Pb2+溶液中加入一定量的 CS-CD,在温度为30℃,反应时间为1 h 的情况下研究不同pH 条件下CS-CD 对Pb2+的吸附影响。因Pb2+在碱性溶液中会发生沉淀生成Pb(OH)2,所以本实验选择实验范围为pH 值介于2~6 之间。 不同pH 对吸附的影响结果如图1所示。
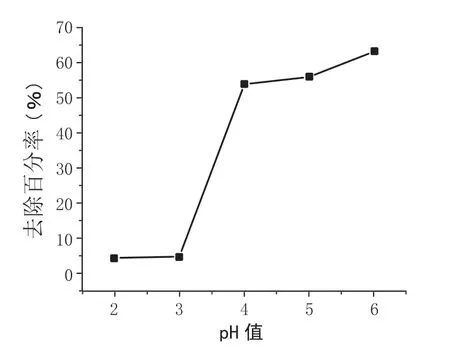
图1 不同pH 值对CS-CD 吸附Pb2 +的影响
由图1 可以看出,溶液在接近中性偏酸性的情况下,CS-CD 对Pb2+的吸附效果最好,而当pH 值下降时,其吸附量明显下降。究其原因,当pH 值较低时,H+浓度上升,带正电的-NH3+也增加了,对Pb2+的吸附效果就变差了。
3.2 CS-CD 投加量对吸附效果的影响
在pH =6,Pb2+的浓度为28mg/L,温度为30℃的条件下,研究不同CS-CD 的投加量对吸附的影响,结果如图2 所示。
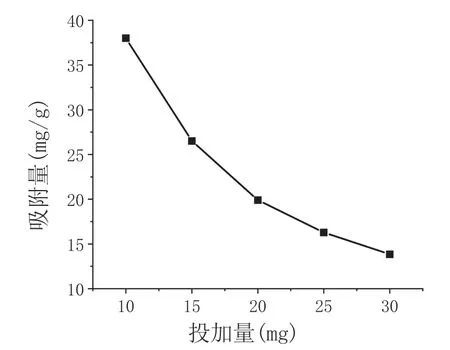
图2 投加量对CS-CD 吸附Pb2 +影响
从图2 可以看出,随着投加量的逐渐增多,其吸附量反而减少,这是因为在一定的溶液浓度条件下,随着吸附剂投加量的增大,单位每g 的CS-CD 与溶液接触的比表面积反而减少了,因此其单位吸附量也减少了。
3.3 初始浓度对CS-CD 吸附效果的影响
在CS-CD 投加量为10mg,温度为30℃,pH =6的条件下,研究不同Pb2+初始浓度对CS-CD 吸附效果的影响,结果如图3 所示。由图3 可知,当Pb2+浓度增大时,CS-CD 对Pb2+的吸附量也逐渐增大,这是因为增加反应物的量有利于反应的进行。
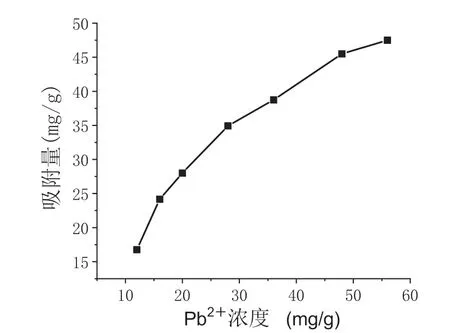
图3 溶液初始浓度对CS-CD 吸附Pb2 +的影响
3.4 吸附动力学
在pH=6 的条件下,分别向30 ℃、40 ℃、50 ℃的25 mL 浓度为20mg/L 的Pb2+溶液中加入10mg CSCD, Pb2+的吸附动力学曲线如图4 所示。图4 表明,CS-CD 对水溶液中Pb2+的吸附量在一定的温度范围内上升,升高温度有利于吸附的进行。
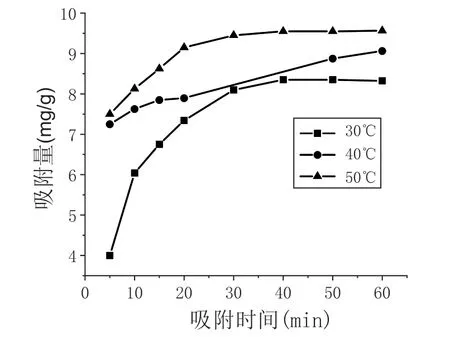
图4 Pb2 +的吸附动力学曲线
针对吸附动力学特性的研究可用准一级动力学和准二级动力学方程对不同时间的吸附量进行拟合,以寻求最优方程,通过模型线性化的相关性系数R2大小来判断模型优劣[10]。
准一级动力学方程:
准二级动力学方程:
其中,qe、qt分别为吸附平衡和时间t时刻CS-CD对Pb2+的吸附量(mg/g),t为反应时间,k1为准一级动力学吸附速率常数(1/min),k2为准二级动力学吸附速率常数〔g/(mg·min)〕。
基于以上两个方程式,以ln(qe-qt)为纵坐标,时间t为横坐标;以t/qt为纵坐标,时间t为横坐标,得到的动力学拟合曲线见图5。通过曲线的斜率和截距计算得到的动力学模拟参数列于表1。
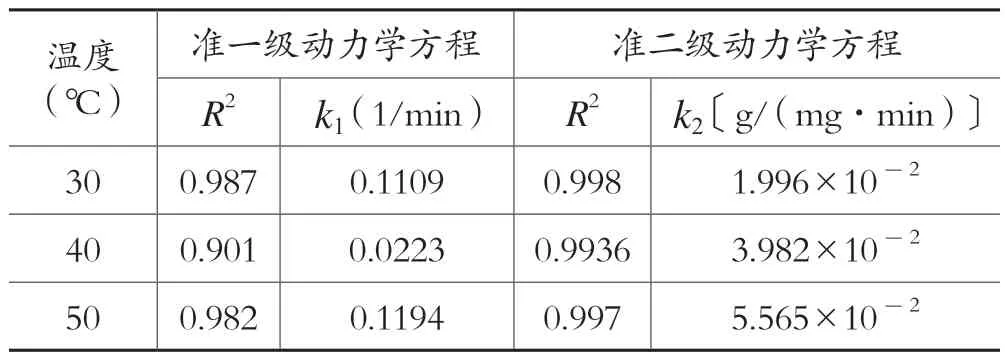
表1 不同温度条件下CS-CD 对Pb2 +的吸附动力学模拟参数
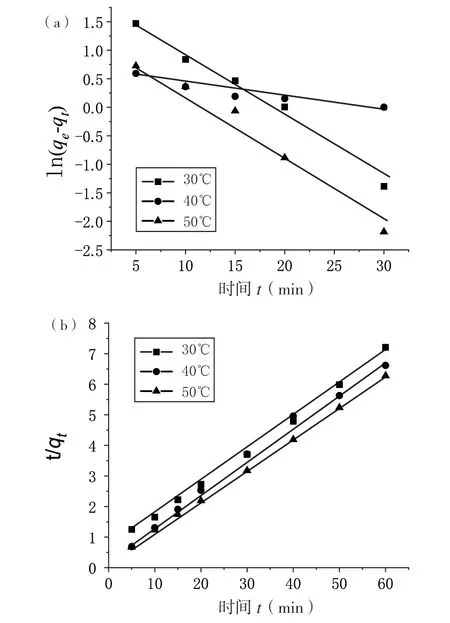
(a)准一级动力学;(b)准二级动力学图5 Pb2 +的准一级动力学曲线(a)及准二级动力学曲线(b)
通过两种动力学拟合后相关性系数的对比,在30℃、40℃、50℃条件下,CS-CD 对Pb2+的吸附更符合准二级动力学模型,其相关系数R2均大于0.99,k2为动力学反应速率常数,其反应速率随着温度升高而增大。
已知反应温度和准二级动力学速率常数k2,阿仑尼乌斯(Arhenius)公式常用于表观活化能的求解,其线性表达式为:lnk=lnA-Ea / R·T,式中,k为反应速率常数;T为绝对温度(K);A为指前因子;Ea为经验活化能(J/mol);R为理想气体常数〔J/(mol·K)〕,以lnk2对1/T作图可得一条直线,根据直线的斜率可求得CS-CD 对Pb2+的表观活化能Ea为41.846 kJ/mol>25.1kJ/mol,这说明该吸附的主要方式为化学吸附。
3.5 吸附等温线
吸附等温线采用Freundlich 和Langmuir 方程对不同温度下(20℃ 、30℃、40℃、50℃)的吸附等温线实验数据进行线性拟合处理。Freundlich 等温吸附方程的线性化形式为lgqe=lgK+1/nlgCe,qe为平衡时的吸附量(mg/g);Ce为吸附平衡时溶液中Pb2+浓度(mg/L),以lgqe为纵坐标,以lgCe为横坐标,作图6(a)。Langmuir等温吸附方程的线性化形式为Ce/ qe=1/(qm·K)+Ce/qm,以Ce / qe为纵坐标,以Ce为横坐标,作图6(b)。
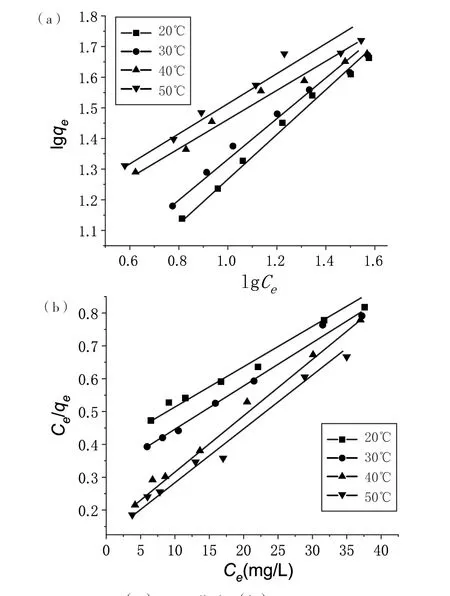
(a)Freundlich;(b)Langmuir图6 Freundlich(a)和Langmuir(b)吸附等温线
通过表2 中Langmuir 和Freundlich 等温模型相关性系数的比较,可以得出用Langmuir 等温模型来拟合CS-CD 对Pb2+的吸附更优。同时,利用Langmuir 等温吸附方程的线性化形式拟合实验数据,根据拟合的斜率和截距可以分别计算出CS-CD 对Pb2+的最大吸附量qmax及吸附平衡常数K,结果列于表3。
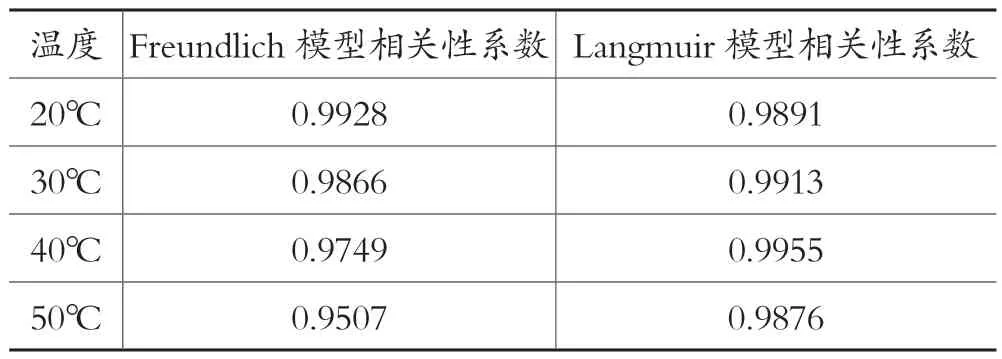
表2 Freundlich 和Langmuir 两种吸附模型的相关性系数对比
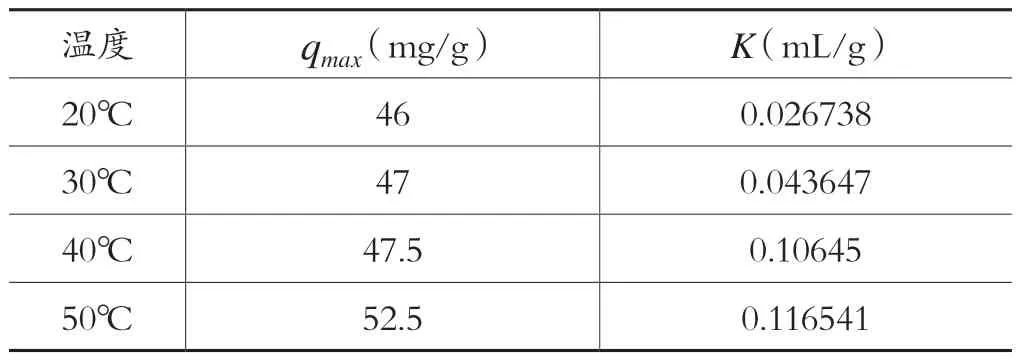
表3 CS-CD 吸附Pb2 +的Langmuir 吸附模型参数
从表3 中可以得出,在不同温度下,CS-CD 对Pb2+的最大吸附量及吸附平衡常数K随温度升高而增大,这说明在一定的温度范围内温度升高有利于吸附过程的进行。
3.6 吸附热力学
吸附热常数包括吉布斯自由能变ΔG(kJ/mol)、焓变ΔH(kJ/mol)和熵变ΔS〔kJ/(mol·K)〕等,它们之间的关系可以根据下列公式来确定:
根据公式4,由不同温度下的吸附平衡常数K可以计算出吉布斯自由能变ΔG的数值。根据公式5,以ΔG为纵坐标,以T为横坐标作图,可得到一条直线,见图7。由线性回归方程求出标准焓变ΔH和熵变ΔS的值,结果列于表4 中。
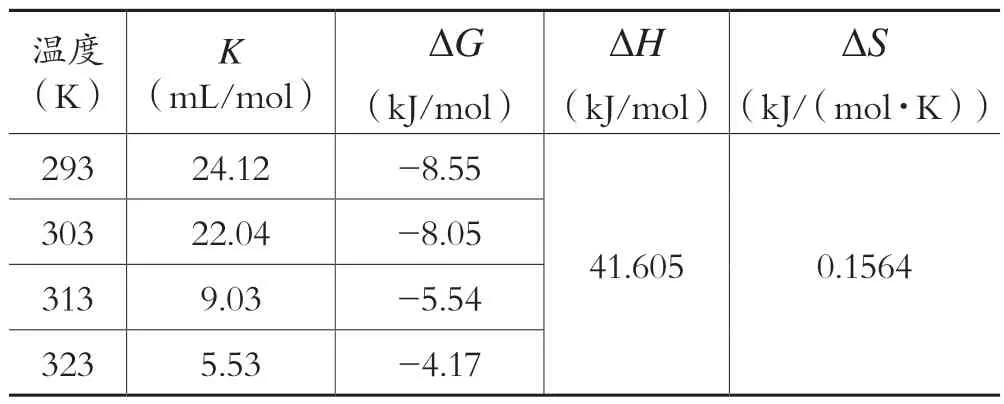
表4 Pb2 +的热力学参数
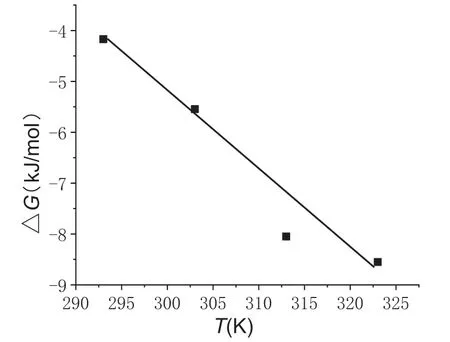
图7 Pb2 +的吸附热力学直线
表4 结果表明,在四种不同温度下,CS-CD 对Pb2+的吸附反应的自由能变ΔG都小于0,这表明该吸附反应为自发过程。ΔG随着温度的升高而降低,这说明在一定的温度范围内温度升高有利于吸附。焓变ΔH值为41.605kJ/mol>0,化学吸附的焓变绝对值一般在40~400 范围内,这说明CS-CD 对Pb2+的吸附主要以化学吸附为主,其中发生了配位基等作用力。
3.7 CS-CD 吸附Pb2 +的XPS 分析
表5 中是CS-CD 和Pb(II)与CS-CD 配合物表面元素电子结合能的数据。因为配位前后氧原子的1s 电子和氮原子的1s 电子结合能都变大,所以氧原子和氮原子被认为是参与了与Pb(II)的配位反应而导致自身化学环境发生变化。由此可以认为Pb(II)-CS-CD 配合物中的-NH2和-OH 都参与了配位。根据N 原子的1s 电子结合能变大可看出N 在配位后有失电子或孤对电子被共享的倾向。从原子结构看,N 原子外层有5 个电子,其中3 个已配对成键,剩下1 对孤对电子,失去电子的可能性较小,但容易提供孤对电子而形成配合物。同样,O 原子也有孤对电子,容易提供孤对电子进入Pb(II)的空轨道而形成配合物,使结合能变大。配合物表面Pb(Ⅱ)的4f 电子结合能为138.7 eV, 而Pb(NO3)2中Pb(II)的4f 电子结合能为139.60 eV,铅配位后结合能变小,说明在配位反应后,Pb(II)有明显地得到电子或共享到电子对的趋势[11]。

表5 CS-CD 与Pb2 +的化学结合能参数对比
综上分析, CS-CD 分子中的-NH2或-OH 对重金属离子的吸附属于化学吸附, 属于-NH2或-OH 基团与重金属离子的配位反应, CS-CD 与重金属离子之间形成了配位键。
4 小结
①CS-CD 分子中含有-OH 及大量游离-NH2,导致其可借离子键,也可借氢键形成具有类似网状结构的笼形分子,从而对金属离子产生稳定的配位作用。其对Pb2+的吸附在pH =6 时效果最好。投加量减少,增大反应物接触的比表面积,有利于吸附;初始浓度的增加相当于增加了反应物的量,有利于吸附反应的进行。
②CS-CD 对Pb2+的吸附活化能Ea值为41.85kJ/mol,以化学吸附为主。在实验的不同温度条件下,通过对相关性系数的对比,发现吸附更符合准二级动力学方程。
③CS-CD 对Pb2+的吸附等温实验数据符合Langmuir 模型;吸附反应自由能变ΔG<0,说明反应是自发进行的;标准焓变值为41.61kJ/mol>0,说明CS-CD 对Pb2+的吸附在一定温度范围内升温有利于吸附,其焓变绝对值在40~400 范围内,反应过程以化学吸附为主,XPS 分析结果进一步表明了该吸附反应属于化学吸附过程。

