不同诱导物对白地霉中高级醇脱氢酶的影响
朱 静,杨晓聪,陈亚蓝,刘海波,陈 龙,郑雪珂, ,师俊玲
(1.信阳农林学院食品科学与工程,河南信阳 464000;2.西北工业大学生命学院,陕西西安 710072)
白地霉是一种常见真菌[1],在自然界和食品加工中分布广泛[2-3],由于其形态特征介于酵母菌和霉菌之间[4],且酶系统丰富[5],生长繁殖快、适应性强[1],因此广泛用于食品发酵[6-8]、动物饲养[9]、粮食安全贮藏[10-11]、食品材料[12]、废水处理[13]、乳制品风味形成[14]等领域。高级醇广泛存在于食品原料及成品中,其含量过高会导致食品风味不良,且对人体产生毒害[15]。尤其是高级醇中的正己醇由于会对周围神经系统产生损伤,而被归为有毒物质。适当降低食品中高级醇含量,对改良食品风味和提高食品的安全性具有重要意义。前期从土壤中分离的白地霉(Galactomyces geotrichum)S12 能在酸性条件下有效降解高级醇,尤其是正己醇,转化为相应的酸类或酯类物质,其属于脱氢酶类[16-18]。研究表明,大部分真核生物的醇脱氢酶都是在缺氧或有醇存在的条件下才能诱导产生[19]。这些能够直接或间接影响基因转录表达的化学因子或物理因子,通常被称为诱导物[20]。大多数酶的底物类似物都是该酶合成的诱导物。作为诱导物,必须能到达酶在转录和表达时所涉及到的调控位点。多种诱导物能使脱氢酶的表达量增加或产生,如乙醇[21]、四氢糠醇[22]、伯醇、α,ω-二醇或烷烃[23]等。前期研究表明,白地霉中的高级醇脱氢酶也是一种受高级醇诱导才能产生的诱导酶[16]。然而,在已有文献中,高级醇由于难溶于水,而被认为很难直接进入细胞来诱导相关酶类的合成[24]。
本文以G.geotrichumS12 为材料,先把高级醇溶于吐温-80,再将其加入反应体系中,从而使高级醇发挥很好的诱导作用;用五种不同的高级醇作为诱导物,研究了高级醇的种类、剂量和诱导时间三个因素对整个菌体降解不同高级醇类的能力以及相应脱氢酶活的影响。
1 材料与方法
1.1 材料与仪器
白地霉S12(Galactomyces geotrichumCCTCC AF2012005)由本实验室分离自土壤,现保存于中国典型微生物保藏中心(武汉,中国);正丙醇、正丁醇、异丁醇、正己醇、异戊醇 色谱纯(纯度≥99%),德国Dr.Ehrenstorfer 公司;2×Native Loading buffer 大连宝生物公司;牛血清白蛋白、三羟甲基氨基甲烷、丙烯酰胺、N,N-甲叉双丙烯聚酰胺、甘氨酸、过硫酸铵、考马斯亮蓝R-250 和G-250、吩嗪硫酸甲酯、烟酰胺腺嘌呤二核苷酸磷酸(NADP+)、氯化硝基四氮唑蓝(NBT)优级纯,美国Amresco 公司;非变性高分子量蛋白标准 美国GE healthcare 公司;其他试剂均为市售分析纯。
SW-CJ-2FD 超净工作台 苏州安泰空气技术有限公司;CMQ.J 型立式灭菌器 山东新华医疗器械股份有限公司;SPX-300B-Ⅱ生化培养箱 上海跃进医疗器械厂;ZHWY-2102 型恒温培养振荡器 上海智诚分析仪器制造公司;AUY220 电子精密天平 日本Shimadzu 公司;HC-3018R 冷冻离心机 安徽中科中佳科学仪器有限公司;GC-17A/FID 气相色谱分析仪 日本Shimadzu 公司;YCZ-24DN 型迷你双垂直电泳仪(槽)北京市六一仪器厂;UVmini-1240 岛津紫外可见分光光度计 日本Shimadzu公司。
1.2 实验方法
1.2.1 菌体的活化与培养 将保存在PDA 斜面上的菌体接种于PDB 培养基中进行活化培养,在28 ℃、160 r/min 条件下培养18 h 后,按2.0%的接种量转入PDB 培养基中进行扩大培养,条件为28 ℃、160 r/min、培养时间38 h。所得培养物在5000 r/min、4 ℃下离心10 min,收集菌体,并用无菌水重新悬浮和离心,重复5 次,以除去粘附在菌体表面的培养液。最后一次在8000 r/min,4 ℃下离心10 min,收集湿菌体,存于-20 ℃备用[17]。
1.2.2 高级醇对菌体高级醇脱氢酶的诱导作用 将1.2.1 中制备的菌体20 g,加入100 mL、含1.0 g/L正丙醇、正丁醇、异丁醇、正己醇和异戊醇的MSM培养基中,在28 ℃、160 r/min 下培养6 h,将全部培养液在5000 r/min、4 ℃下离心10 min,收集菌体,用无菌水重新悬浮和离心,清洗5 次,最后在8000 r/min、4 ℃下离心10 min,收集菌体备用,即诱导后的菌体。
取上述制备好的菌体0.3 g,加入20 mL 含20 mmol/L 不同高级醇的柠檬酸缓冲溶液(pH4.0、0.1 mol/L)中,在28 ℃下恒温反应1 h,用气相色谱测定缓冲液中高级醇的剩余量。计算菌体降解活性,表示为每小时的高级醇降解量(mmol/L)。
1.2.3 高级醇诱导时间对高级醇脱氢酶合成的影响
培养时间对菌体生长量的影响:同1.2.2 的处理方法,培养时间分别为0、3、6、9、12 h,测定其在600 nm 处的吸光值(OD600),考察菌体浓度变化;培养时间对菌体降解活性的影响:取10 mL 诱导后培养物,在5000 r/min 下离心10 min,收集菌体,用无菌水清洗3 次后,获得菌体,同1.2.2 方法测定其对正丙醇、正丁醇、异丁醇、正己醇和异戊醇的降解能力;培养时间对酶活力的影响:取10 mL 培养液中收集所得全部菌体,测定酶活力。取等量上述菌体,液氮充分研磨,1 mL pH5.8 的柠檬酸缓冲溶液(0.1 mol/L)浸提30 min,在8000 r/min下离心10 min,收集上清液,即为粗酶液,分别分析其蛋白浓度、Native-PAGE 电泳条带、高级醇脱氢酶活性,对照为在相同条件下保温处理的不加菌体的柠檬酸缓冲液体系。酶活单位(U)定义为每小时的高级醇降解量。酶活力表示为每小时每毫克蛋白降解高级醇的量(U/mg protein)。
1.2.4 高级醇诱导剂量对高级醇脱氢酶合成的影响
按照1.2.3 中的方法,取制备好的菌体加入含不同浓度的正丙醇、正丁醇、异丁醇、正己醇和异戊醇(0.5、1.0、1.5、2.0 和2.5 g/L)的MSM 培养基中,测定指标同1.2.3。
1.2.5 不同高级醇诱导产生的相应高级醇脱氢酶的对比 为了考察不同高级醇诱导产生的相应高级醇脱氢酶是否为同一种酶,将分别在五种不同高级醇的最佳诱导条件下诱导产生的菌体制备成胞内酶粗提液,再将它们同时进行Native-PAGE 电泳分析。取同批次电泳的两块胶板,取一块胶用于考马斯亮蓝R-250 染色,另一块分割为5 列,分别以五种与菌体诱导时相同的高级醇做底物进行脱氢酶活性染色,然后,再将它们拼接在一起,用凝胶成像照相,分析不同高级醇诱导时所得蛋白条带的异同。所用各种高级醇的详细诱导剂量和时间分别为:正丙醇,1.5 g/L,6 h;正丁醇,1.0 g/L,6 h;异丁醇,0.5 g/L,6 h;正己醇,1.5 g/L,6 h;异戊醇,1.0 g/L,12 h。
1.2.6 正己醇诱导菌体S12 降解高级醇的产物分析
以气质联用仪(GC-MS)分析最适诱导物(正己醇)诱导菌体在柠檬酸缓冲液中的降解产物。将1.2.1中的菌体按照1.2.2 中诱导方法进行诱导,处理条件:诱导剂量1.5 g/L 正己醇,诱导时间6 h。处理好的菌体分别催化含有20 mmol/L 五种不同高级醇、pH4.0 的0.1 mol/L 的柠檬酸缓冲溶液,按照1.2.3的反应条件进行反应。反应结束后,用GC-MS 进行测定,分别分析正己醇诱导后G.geotrichumS12 催化五种高级醇生成的降解产物。
1.2.7 指标测定
1.2.7.1 高级醇的气相色谱分析 样品处理[17]:检测时取2 mL 待测样放入5 mL 顶空瓶中,每毫升样品中加入20 μL 内标(50 g/L 4-甲基-2-戊醇的丙酮溶液)终浓度为9.8 mmol/L,在60 ℃下保温处理30 min,使气液平衡,然后用500 μL 微量进样器在距液面0.3 mm 处吸取300 μL 顶空瓶上层气体,注入气相色谱仪中,检测五种高级醇的残留量。
色谱条件:色谱柱为弹性石英毛细管柱DBWAX-10(30 m×0.53 mm,0.30 μm),载气N2,进样量300 μL;采取程序升温,设初始温度为55 ℃,在55 ℃下保持3 min;然后15 ℃/min 升至200 ℃,在200 ℃保持3 min。
高级醇降解量的计算方法:对照内标浓度和峰面积,计算对照样品和处理样品中高级醇浓度,按照式(3)和式(4)计算高级醇降解量。
式中:9.8 为内标的终浓度(mmol/L);A样为处理样品中的高级醇峰面积;A内为内标的峰面积;A0为对照样品中的高级醇浓度;A1为处理样品中的高级醇浓度。
1.2.7.2 细胞光密度(OD600)测定 将分光光度计波长调整到λ=600 nm,预热30 min。以无菌水作为空白对照,测定菌悬液(稀释10 倍)的吸光值,记为OD600。重复试验3 次,按照式(5)计算其平均值,用以表示菌体浓度[25]。
1.2.7.3 非变性聚丙烯酰胺凝胶电泳(Native-PAGE)
参照Stroh 等[26]和Almeida 等[27]方法进行。所用凝胶条件为:5%浓缩胶,10%分离胶;电泳条件为:电压80 V,样品到分离胶后改为120 V,60 min 左右。整个电泳过程在4 ℃下进行,电泳结束后分别用考马斯亮蓝R-250 和脱氢酶活性染色剂染色,该染色剂中底物与诱导用高级醇一致。采用非变性高分子量蛋白标准,分子量范围为66~669 kDa。
Native-PAGE 电泳分析是将20 μL 粗酶液与2×Native Loading buffer 进行等比例混合,同时在两块电泳凝胶上进行电泳分析[27]。电泳结束后,一块用考马斯亮蓝R-250 染色,另一块用含正丙醇等的脱氢酶活性染色剂染色。用Quantity One 4.6.7 软件分析凝胶照片上的条带光密度,用其表示脱氢酶的浓度与活性。
1.2.7.4 蛋白含量的测定 蛋白含量的测定按照Bradford[28]的方法进行。
1.3 数据处理
试验数据使用SPSS Statistics 20.0 进行单因素ANOVA 分析和Duncan 检验,P<0.05 表示显著性差异,使用Excel 2019 整合试验数据,Origin 9.1 软件对试验数据进行统计分析与制图,全文试验设置3 次平行。
2 结果与分析
2.1 高级醇对菌体高级醇脱氢酶的诱导作用
根据Zhang 等[16]的研究结果,正己醇是G.geotrichumS12 合成降解正己醇脱氢酶的诱导剂。为了考察正丙醇、正丁醇、异丁醇、正己醇和异戊醇是否也能诱导该菌合成高级醇脱氢酶,用1.0 g/L 正丙醇对菌体进行诱导处理了6 h,结果如图1 所示,五种高级醇能诱导该菌株产生可同时作用于多种高级醇的降解活性,但所得菌株对不同高级醇的降解活性有所差异。正丙醇诱导后菌株对不同高级醇降解能力依次为:正丁醇>正己醇和异戊醇>正丙醇>异丁醇;正丁醇为诱导剂时降解能力依次为:正丙醇>正丁醇>正己醇>异戊醇和异丁醇;以异丁醇为诱导剂时,诱导后菌体对各种高级醇的降解能力都有显著提高(P<0.05),均高于以正丙醇和正丁醇为诱导剂时所得菌体的降解能力,降解能力依次为:异戊醇>异丁醇>正己醇>正丙醇>正丁醇。以正己醇为诱导剂时,降解能力依次为:正己醇>正丁醇>异丁醇>正丙醇>异戊醇,诱导作用与以异丁醇为诱导剂时的结果接近,对五种高级醇的降解能力均高于以正丙醇和正丁醇为诱导剂时所得菌体的降解能力;而且,其对正己醇和正丁醇的降解能力均高于以异丁醇为诱导剂时所得菌体;但是,对正丙醇、异丁醇和异戊醇的降解能力低于以异丁醇为诱导剂时所得菌体的活性;经过异戊醇诱导的菌体降解活性依次为:正丁醇>正丙醇>异丁醇>异戊醇>正己醇。正己醇和异丁醇对酶的启动作用则可能是由于有机物介入酶分子的内部,通过改变介质的介电常数和酶的空间构象来影响酶的催化活性,这种变化可能使酶活性中心的柔性增强,有利于酶功能的发挥;正丙醇诱导产生的脱氢酶活力低的原因可能是正丙醇的亲水性较强,可有效夺取酶周围的水化层,致使直接或间接由水参与形成的氢键、疏水键及范德华力等受到破坏,引起酶构象的改变,使酶活下降[29]。
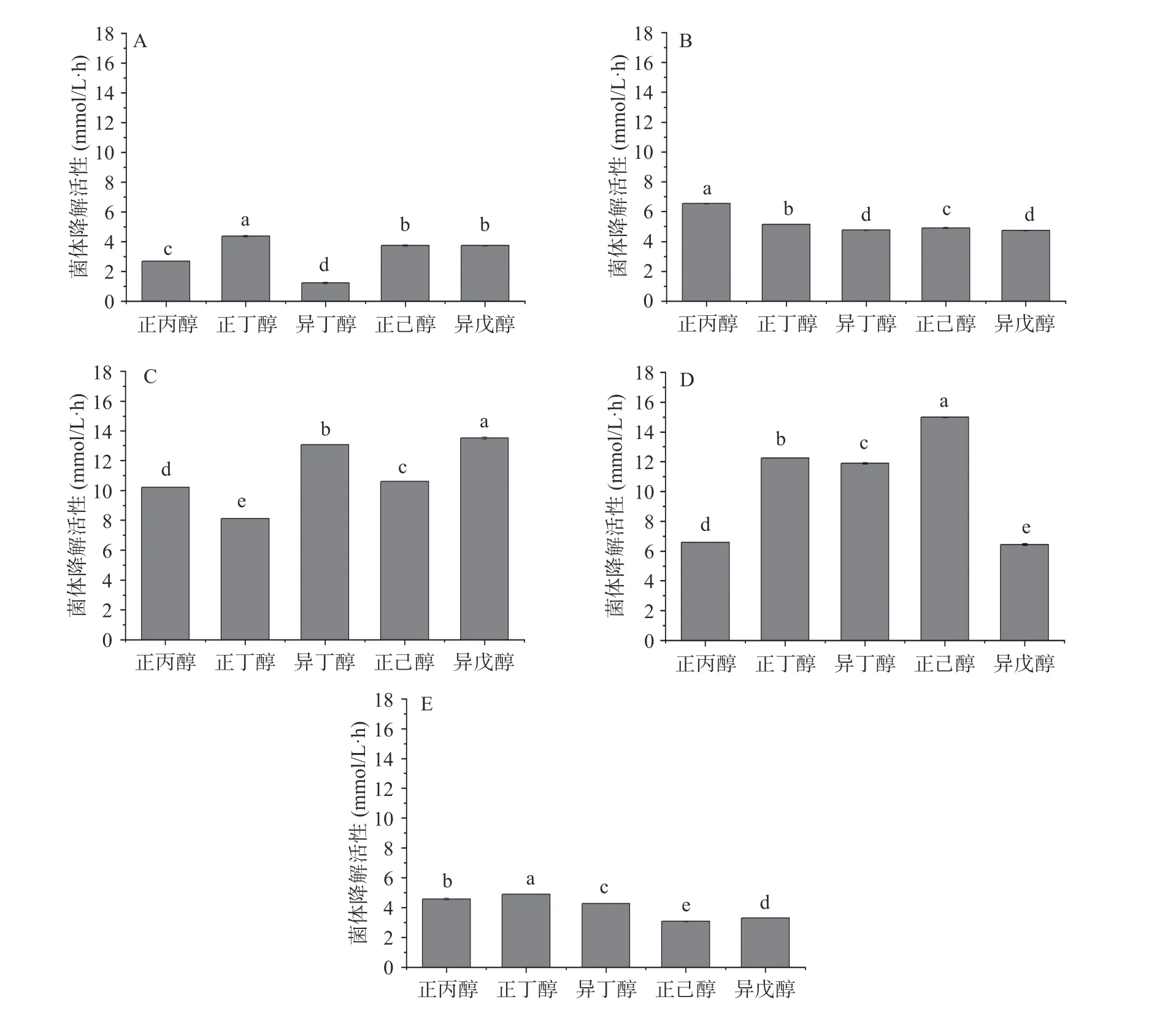
图1 高级醇诱导对菌体S12 高级醇降解能力的影响Fig.1 Effect of higher alcohol induction on the capability of strain S12 to degrade different higher alcohols
2.2 高级醇诱导时间对高级醇脱氢酶合成的影响
2.2.1 正丙醇诱导时间对高级醇脱氢酶合成的影响
以1.0 g/L 正丙醇为诱导剂,诱导不同时间后所得菌体降解活性及胞内酶活力结果如图2 所示。在整个诱导时间内,反应体系中的OD600随着诱导时间延长而增大,但在诱导6 h 后,OD600值有所下降。这说明,菌体可利用底物进行生长,当6 h 后,因正丙醇被消耗,这种促进能力减少,菌体量有所下降。

图2 正丙醇诱导时间对菌体和胞内酶的正丙醇降解活性的影响Fig.2 Effects of induction time on 1-propanol degrading activity of the strain and enzymes formed by strain S12 with 1-propanol as the inducer
在不同诱导时期所得菌体降解活性和酶活力均表现为:随着诱导时间的延长,呈先升后降的趋势。以正丙醇为底物时,诱导6 h 所得酶活力最强,与菌体量的增加时间相吻合;而诱导9 h 菌体降解活性大,滞后于胞内酶。这可能是因为胞内酶从产生到分泌还需要一定的时间[30]。
从正丙醇诱导产生胞内酶的Native-PAGE 电泳结果可看出(图3),以正丙醇为诱导剂,且以正丙醇为底物进行脱氢酶特异性染色,所得酶类活性的分析结果与图2 中的胞内酶活力检测结果完全吻合,即6 h 时的蛋白条带的光密度最大。而且,此时的两条脱氢酶电泳条带变粗,几乎合并在一起,说明其产生酶量大、活性高。
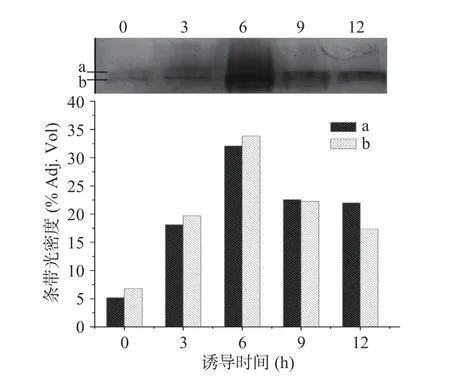
图3 正丙醇不同诱导时间所得胞内酶的Native-PAGE 电泳结果及其光密度分析Fig.3 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with 1-propanol at different induction time
2.2.2 正丁醇诱导时间对高级醇脱氢酶合成的影响
以1.0 g/L 正丁醇为诱导剂,诱导不同时间后所得菌体降解活性及胞内酶活力分析结果如图4 所示。随着诱导时间的改变,反应体系中的OD600值显著下降(P<0.05),说明菌体量在减少,意味着菌体发生了自溶和损失(图4)。
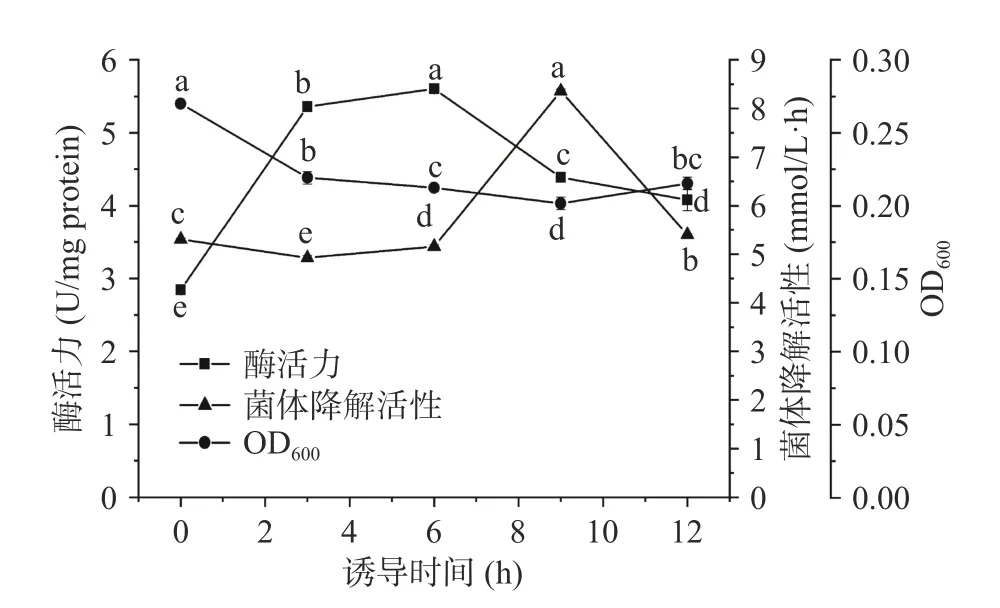
图4 正丁醇诱导时间对菌体和胞内酶的正丁醇降解活性的影响Fig.4 Effects of induction time on n-butanol degrading activity of the strain and enzymes formed by strain S12 with n-butanol as the inducer
随着诱导时间的延长,菌体降解活性开始时略有下降,到9 h 时突然增大,之后又迅速下降;而酶活力则呈先升后降的趋势,在3~6 h 时达到相对稳定的较高值(图4)。可能的原因是在诱导开始的时间里,能降解正丁醇的脱氢酶在胞内有所积累(图5),胞内酶活力升高;正丁醇作为一种有机溶剂,会渗透入细胞膜,增加膜的流动性,且具有一定的细胞毒性,会干扰细胞的正常功能[31]。
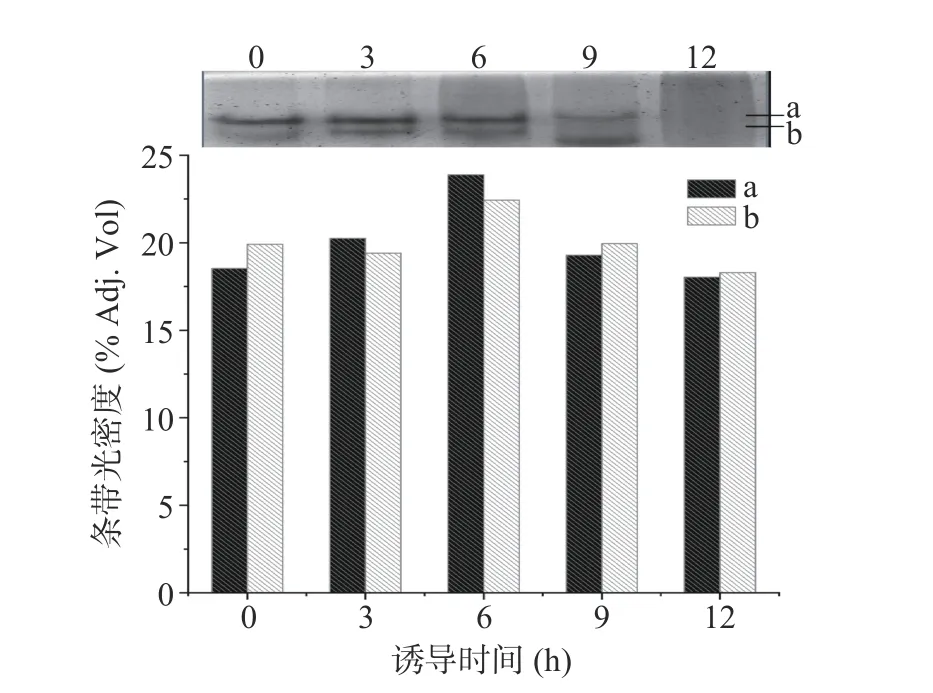
图5 正丁醇不同诱导时间所得胞内酶的Native-PAGE 及其光密度分析Fig.5 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with n-butanol at different induction time
胞内酶的Native-PAGE 电泳及其条带光密度分析结果表现出与胞内酶活力相同的变化趋势(图5)。诱导9 h 时,原条带(b)分子量降低,可能是出现酶的降解,此时酶活力也急速下降,但还具有脱氢酶活力,因此脱氢酶电泳能够染色,到12 h 时,已没有明显的脱氢酶条带存在,酶活力也降至最低,说明能降解正丁醇的脱氢酶条带主要为(b)。
2.2.3 异丁醇诱导时间对高级醇脱氢酶合成的影响
以1.0 g/L 的异丁醇为诱导剂,分别收集不同诱导时间内所得菌体,分别分析菌体降解活性和胞内酶活力,结果如图6 所示。由图可看出,OD600随着诱导时间的延长而下降,说明菌体在异丁醇中受到损伤。
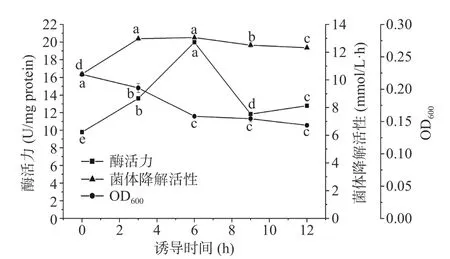
图6 异丁醇诱导时间对菌体和胞内酶的异丁醇降解活性的影响Fig.6 Effects of induction time on isobutanol degrading activity of the strain and enzymes formed by strain S12 with isobutanol as the inducer
除诱导时间6 h 外,不同诱导时间所得菌体降解活性均高于胞内酶活力,表现出了与前面三种高级醇不同的作用规律,且表现出随着诱导时间的增加而呈先升后降的趋势,在3~6 h 处表现为相对较高值。这可能是因为菌体对异丁醇的亲和性较高,而菌体相对密闭的微环境保护了胞内酶的活性。不同诱导时间所得胞内酶活力表现为先上升后下降的趋势,在6 h时达到最大,之后迅速下降。这可能是因为诱导后期产生异丁醇诱导酶的活性较低(图7)。

图7 异丁醇不同诱导时间所得胞内酶的Native-PAGE 及其光密度分析Fig.7 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with isobutanol at different induction time
胞内酶的Native-PAGE 电泳及其条带光密度分析结果(图7)与胞内酶活力曲线一致,诱导6 h 时的活性条带颜色最深,表明此时该酶的合成量最大。由电泳结果可看出,用异丁醇诱导9 h 和12 h 时,a、b 两条带的光均有所变淡,说明此时的酶发生了降解,与其异丁醇降解能力的下降完全吻合。
2.2.4 正己醇诱导时间对高级醇脱氢酶合成的影响
以1.0 g/L 正己醇为诱导剂,诱导处理不同时间,收集菌体,分别检测菌体降解活性和胞内酶活力,结果如图8 所示。随着诱导时间的延长,所得菌体的OD600呈现先小幅度上升之后趋于不变的趋势,说明以正己醇为诱导剂时,在诱导过程中对菌体没有损伤作用。

图8 正己醇诱导时间对菌体和胞内酶的正己醇降解活性的影响Fig.8 Effects of induction time on hexanol degrading activity of the strain and enzymes formed by strain S12 with hexanol as the inducer
同时,随着诱导时间的增加,所得菌体降解活性在前6 h 时迅速增大,之后趋于平稳,和菌体OD600的变化趋势一致;而胞内酶活力则呈先升后降的趋势,在6 h 时达到最大值(图8)。
胞内酶的Native-PAGE 电泳及其条带光密度分析结果(图9)与胞内酶活力相符。正己醇为诱导剂时,其酶含量在3 h 后达到一个稳定的状态,原条带(a)在12 h 略有增加,其变化和菌体降解活性曲线一致,但酶活力在12 h 下降很快,可能是作用正己醇的脱氢酶不是(a)条带。
2.2.5 异戊醇诱导时间对高级醇脱氢酶合成的影响
以1.0 g/L 异戊醇为诱导剂,诱导不同时间时所得菌体及其胞内酶的异戊醇降解活性如图10 所示,OD600在诱导过程中随着时间的增加而有所下降,说明菌体在诱导过程中有所损伤。

图10 异戊醇诱导时间对菌体和胞内酶的异戊醇降解活性的影响Fig.10 Effects of induction time on isoamyl alcohol activity of the strain and enzymes formed by strain S12 with isoamyl alcohol as the inducer
诱导时间越长,所得菌体降解活性越强,其中在诱导时间为3~6 h 时所得菌体降解活性增加幅度较大。此后,再继续延长诱导时间对菌体降解活性增加幅度较小,诱导时间为9 h 时,所得菌体降解活性最高。随着诱导时间的延长,所得胞内酶活力呈先升后降再升的趋势。其中,诱导处理6 h 时所得胞内酶活力较强;诱导时间9 h 时胞内酶活力最弱;而当诱导时间延长至12 h 时,所得菌体胞内酶活力突然增强。总体来看,菌体降解活性显著高于胞内酶,说明异戊醇诱导产生的高级醇脱氢酶的稳定性较差,需借助于细菌菌体的完整性,才能较好地发挥其降解作用(图10)。
胞内酶的Native-PAGE 电泳及其条带光密度分析结果如图11,基本与胞内酶活力检测结果相吻合。由图11 还可看出,诱导时间为6 h 时所得酶活力较高,可能是因为条带(a)的光密度加深引起的;而诱导时间为12 h 时所得酶活力突然增大,可能是因为条带(b)的光密度加深所致。由此说明,以异戊醇为诱导剂时,产生的(b)条带具有更高的异戊醇降解活性。
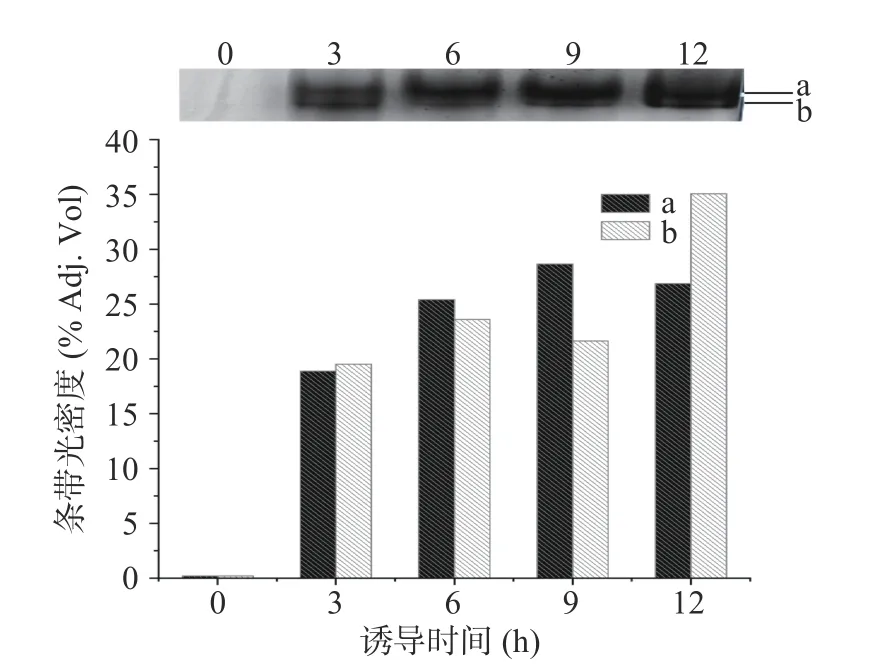
图11 不同异戊醇诱导时间所得胞内酶的Native-PAGE及其光密度分析Fig.11 Analysis of band intensity in Native-PAGE of endoenzyme induced by isoamyl alcohol at different induction time
2.3 高级醇诱导剂量对高级醇脱氢酶合成的影响
2.3.1 正丙醇诱导剂量对高级醇脱氢酶合成的影响
图12 显示了以不同浓度的正丙醇为诱导剂,诱导6 h 后的菌体降解活性和酶活力及菌体OD600的变化。由图12 可知,在诱导过程中,反应体系中的OD600值随着诱导剂(正丙醇)浓度的增加而趋于稳定。这说明,不同浓度的正丙醇对菌体S12 的生长无显著影响。
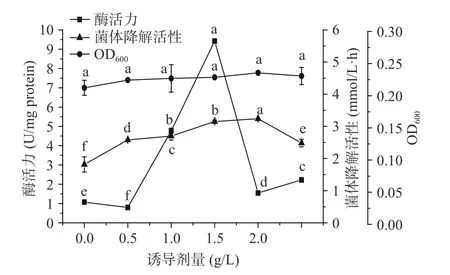
图12 正丙醇诱导剂量对菌体和胞内酶的正丙醇降解活性的影响Fig.12 Effects of 1-propanol concentration on 1-propanol degrading activity of the strain and enzymes formed by strain S12 with1-propanol as the inducer
随着诱导所用正丙醇浓度的增大,所得菌体降解活性和胞内酶活力均呈先升后降的趋势,并分别在正丙醇浓度为2.0 和1.5 g/L 时达到最大值。同时,胞内酶的Native-PAGE 电泳及其条带光密度分析结果(图13),表现出与胞内酶活力结果完全一致的变化趋势。因此,适当增大诱导用正丙醇的浓度,能在一定程度上提高菌体中高级醇脱氢酶的合成量。
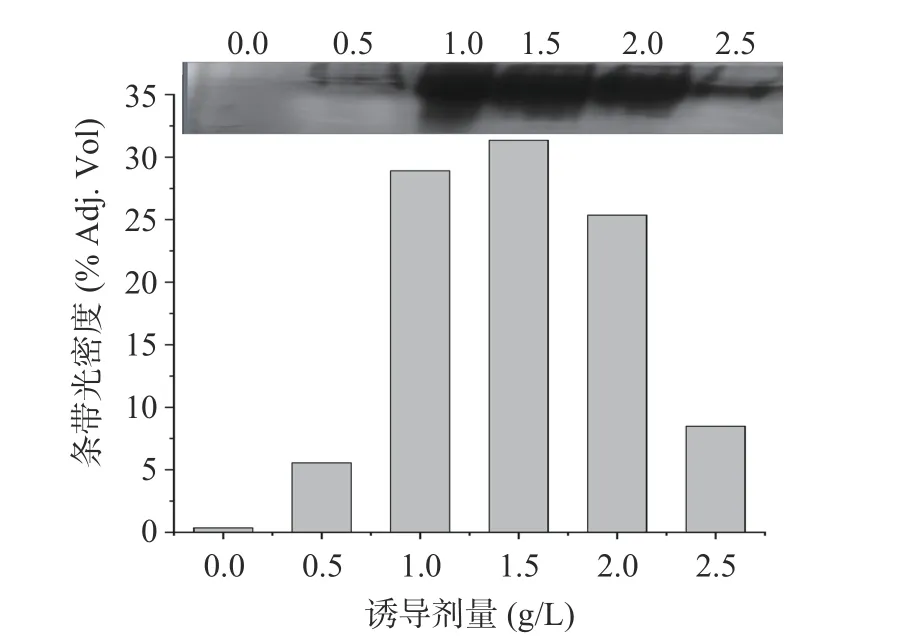
图13 不同正丙醇诱导剂量所得胞内酶的Native-PAGE电泳结果及其光密度分析Fig.13 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with different 1-propanol concentration
综合分析,正丙醇对菌株S12 合成高级醇脱氢酶的最佳诱导剂量和诱导时间分别为1.5 g/L、6 h。
2.3.2 正丁醇诱导剂量对高级醇脱氢酶合成的影响
图14 显示了以不同浓度的正丁醇为诱导剂,诱导6 h 后所得菌体降解活性和胞内酶活力。随着正丁醇浓度的增大,OD600值趋于稳定,说明不同浓度的正丁醇对菌体生长无显著影响。

图14 正丁醇诱导剂量对菌体和胞内酶的正丁醇降解活性的影响Fig.14 Effects of n-butanol concentration on n-butanol degrading activity of the strain and enzymes formed by strain S12 with n-butanol as the inducer
菌体降解活性呈现持续下降趋势,说明菌体对高浓度正丁醇降解能力较弱;而胞内酶活力则随着诱导用正丁醇浓度的增大而呈先升后降的趋势,在1.0 g/L 处达到最大值(5.60 U/mg protein)。说明一定剂量的正丁醇能诱导菌体产生正丁醇降解酶,但该酶主要存在于细胞内部;高剂量的正丁醇对菌体有杀伤作用,会导致菌体不能合成正丁醇降解酶。
由胞内酶的Native-PAGE 电泳及其条带光密度分析(图15)可知,正丁醇为诱导剂时,在浓度为0.5及1.0 g/L 时,蛋白表达量较大,且均为两条带,说明能降解正丁醇的脱氢酶除了和能降解正丙醇位置一样的脱氢酶之外,还存在另一种脱氢酶,这和诱导时间的结果及胞内酶活性曲线的变化一致。

图15 不同正丁醇诱导剂量所得胞内酶的Native-PAGE电泳结果及其光密度分析Fig.15 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with different n-butanol concentration
综合分析,正丁醇对菌株S12 合成高级醇脱氢酶的最佳诱导剂量和诱导时间分别为1.0 g/L、6 h。
2.3.3 异丁醇诱导剂量对高级醇脱氢酶合成的影响
图16 显示了以不同浓度的异丁醇为诱导剂,诱导6 h 时后所得菌体降解活性及其胞内酶活力。由图可知,随着诱导用异丁醇浓度的增大,所得菌体浓度略微下降,说明异丁醇对菌体生长有损伤作用。
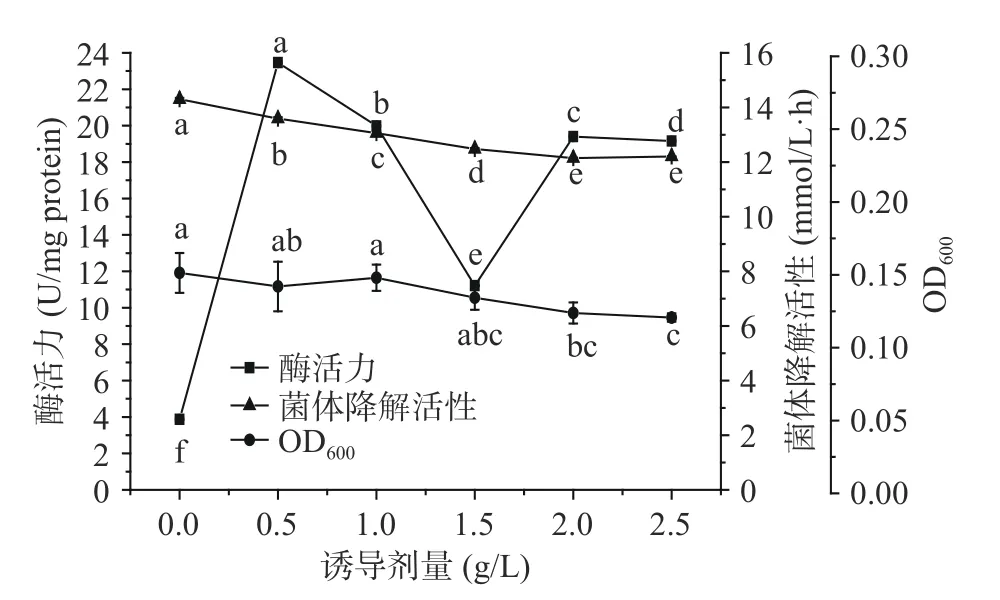
图16 异丁醇诱导剂量对菌体和胞内酶的异丁醇降解活性的影响Fig.16 Effects of isobutanol concentration on isobutanol degrading activity of the strain and enzymes formed by strain S12 with isobutanol as the inducer
由图16 还可看出,随着诱导剂异丁醇浓度的增大,所得菌体降解活性呈现持续下降趋势,和菌体OD600的变化趋势一致。因此,异丁醇的浓度越大,所得菌体降解活性越弱。当异丁醇的浓度为0.5 g/L时,所得菌体的胞内酶活力达到最高值,但其他异丁醇浓度诱导所得胞内酶活力均比较低。
胞内酶的Native-PAGE 电泳及其条带光密度分析结果(图17)与胞内酶活力分析结果相同。综合分析,异丁醇诱导菌株S12 合成高级醇脱氢酶的最佳诱导剂量和诱导时间分别为0.5 g/L、6 h。
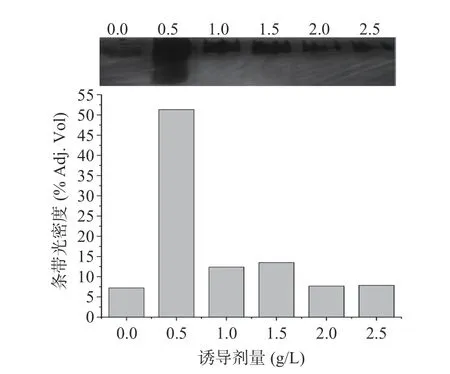
图17 不同异丁醇诱导剂量所得胞内酶的Native-PAGE及其光密度分析Fig.17 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with different isobutanol concentration
2.3.4 正己醇诱导剂量对高级醇脱氢酶合成的影响
由图18 可看出,以不同浓度的正己醇为诱导剂,诱导6 h 后所得菌体OD600值呈现平稳趋势。

图18 正己醇诱导剂量对菌体和胞内酶的正己醇降解活性的影响Fig.18 Effect of hexanol concentration on hexanol degrading activity of the strain and enzymes formed by strain S12 with hexanol as the inducer
所得菌体降解活性在诱导用正己醇浓度为1.0 g/L 时达到最大值,而在其他的诱导剂量时均相对较低;所得胞内酶活力呈先降后升再下降再升的波动趋势,在正己醇诱导剂量为1.5 g/L 时达到最大值。同时,正己醇的诱导剂量小于1.5 g/L 时,菌体降解活性高于胞内酶;诱导剂量大于等于1.5 g/L 时,菌体降解活性小于胞内酶(图18)。
胞内酶的Native-PAGE 电泳及其条带光密度分析(图19)与胞内酶的活性分析结果相一致。综合分析,正己醇诱导产生高级醇脱氢酶的最适条件为1.5 g/L、6 h。
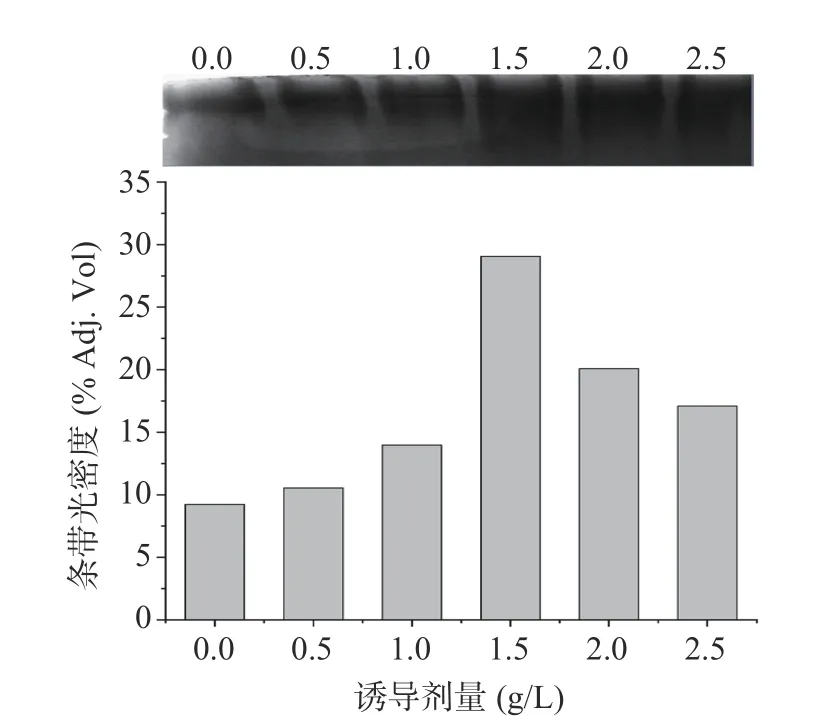
图19 不同正己醇诱导剂量所得胞内酶的Native-PAGE及其光密度分析Fig.19 Band intensity analysis of Native-PAGE of endoenzymes produced by strain S12 under induction with different hexanol concentration
2.3.5 异戊醇诱导剂量对高级醇脱氢酶合成的影响
图20 显示了以不同浓度的异戊醇为诱导剂时,所得菌体降解活性及其胞内酶活力。从图20 中可看出,异戊醇浓度的增加对OD600几乎没有影响,说明增加诱导剂异戊醇浓度对菌体生长没有显著影响。

图20 异戊醇诱导剂量对菌体和胞内酶的异戊醇降解活性的影响Fig.20 Effects of isoamyl alcohol concentration on isoamyl alcohol degrading activity of the strain and enzymes formed by strain S12 with isoamyl alcohol as the inducer
诱导剂异戊醇浓度低于1.5 g/L 时,所得菌体降解活性变化很小;而当异戊醇浓度高于1.5 g/L 时,菌体降解活性则随着异戊醇浓度的加大而显著下降(P<0.05)。胞内酶活力则随着异戊醇浓度的增大,表现出先增后减再增的波动趋势。当诱导剂浓度为2.5 g/L 时,菌体降解活性很小,而胞内酶活力却很强,说明此时的菌体外围可能受到了某种损伤,导致其不能作用于异戊醇,而胞内的酶类则仍然具有较高的异戊醇降解能力。总体来讲,当异戊醇诱导剂量小于2.0 g/L 时,菌体降解活性大于胞内酶;而当异戊醇诱导剂量为2.5 g/L 时,胞内酶活力则大于完整的菌体(图20)。
胞内酶的Native-PAGE 电泳及其条带光密度分析结果(图21)与胞内酶活力检测结果相一致。与未诱导的菌体胞内酶条带比,除了0 g/L 和2.0 g/L 异戊醇诱导以外,其他诱导剂量下的诱导后菌体中胞内酶增加了一条涂抹带。结合胞内酶的异戊醇降解活力可推测,这条涂抹带是由于异戊醇诱导产生的,也是导致胞内酶异戊醇降解活性增加的主要原因。综合分析,异戊醇诱导产生高级醇脱氢酶的最适条件为2.5 g/L、12 h。

图21 不同异戊醇诱导剂量所得胞内酶的Native-PAGE及其光密度分析Fig.21 Analysis of band intensity of Native-PAGE of endoenzymes produced by strain S12 under induction with different isoamyl alcohol concentration
2.4 不同高级醇诱导产生的相应高级醇脱氢酶的对比
表1 显示不同高级醇诱导G.geotrichumS12后,再作用五种高级醇(正丙醇、正丁醇、异丁醇、正己醇和异戊醇)的降解结果。当正己醇和异丁醇作诱导剂时,菌体S12 降解高级醇的能力较强。正丙醇作诱导剂时菌体降解能力最弱。当诱导剂为正己醇时,对正己醇和正丁醇的催化活性较强;正丙醇、异丁醇和异戊醇的降解活性较强时的诱导剂为异丁醇,但对正己醇和正丁醇降解活性低,且异丁醇为诱导剂时对菌体及酶有损伤作用。
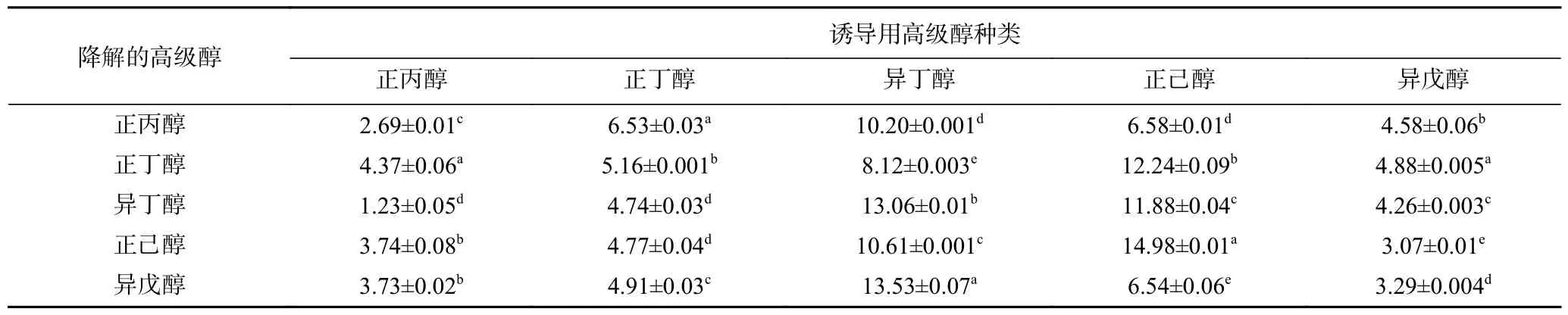
表1 不同高级醇诱导后的菌株S12 的高级醇降解活性(mmol/L)Table 1 Degrading of higher alcohols by stain S12 induced with different higher alcohols (mmol/L)
不同高级醇诱导产生的相应高级醇脱氢酶的电泳结果如图22 所示。从图22 中可以看出,在活性染色胶上(图22a),用五种不同的高级醇均可诱导产生最上方一条粗的条带;当以正己醇和异戊醇为诱导剂时,该条带明显变粗。对照考马斯亮蓝染色(图22b)可以看出,该条件的分子量约为232 kDa。而且,五种高级醇均可诱导该条带活性增加。通过计算,该条带的分子量分布在223 kDa 左右。

图22 同高级醇诱导所产胞内酶的Native-PAGE 电泳图Fig.22 Native-PAGE of endoenzymes produced by strain S12 under induction with different higher alcohols
2.5 正己醇诱导菌体降解高级醇的产物
以菌体作为酶源应用,具有完整的酶系、不需添加辅酶和无需纯化等优点,且白地霉是一种可添入食品的安全菌。将菌体作为酶源进行应用之前,首先要了解菌体代谢高级醇的产物。因此,以最适诱导剂正己醇诱导获得的菌体分别催化高级醇,采用GCMS 来分析正己醇诱导后菌体催化高级醇(pH4.0、0.1 mol/L 的柠檬酸缓冲溶液)的产物。由图23 和表2 可看出,正己醇诱导后的G.geotrichumS12 催化五种高级醇的反应过程分别为:正丙醇转化为正丙酸;正丁醇转化为丁酸丁酯;异丁醇转化为异丁酸;正己醇转化为正己酸和己酸己酯;异戊醇转化为异戊酸、异戊酸异戊酯和3-甲基-2-丁烯酸-异戊醇酯。因此,在柠檬酸缓冲液中,菌体催化高级醇形成的产物为其相应的酸和酯。

表2 菌体S12 在柠檬酸缓冲溶液中降解高级醇生成的产物Table 2 Products formed by strain S12 when it was cultivated in citrate buffer with higher alcohols


图23 高级醇转化产物的GC-MS 分析结果Fig.23 Results of GC-MS analysis of the product of higher alcohols
3 讨论与结论
高级醇作为诱导剂处理白地霉S12,会影响菌体降解活性和酶活力。与相关研究结果类似,葡萄糖、蔗糖、麦芽糖、黎芦醇等作为诱导剂能提高漆酶活性[32-33];甲醇、乙醇、正丁醇作为诱导物能促进裂殖壶菌积累油脂、角烯鲨、类胡萝卜素和虾青素,主要是因为醇类诱导物可以影响菌体代谢途径[31-33]。
不同高级醇的最适诱导剂量不同,同时Native-PAGE 电泳结果说明,高级醇诱导脱氢酶活性提高与脱氢酶的表达有一定的关系。和相关报道一致,6 g/L 的丁醇使裂殖壶菌体DNA 降低了40%,角烯鲨含量增加了31 倍,积累了更多的类胡萝卜素,8 g/L丁醇处理后,虾青素含量增加了245 倍,说明同一诱导物不同诱导浓度对菌体代谢影响不同[33]。一定浓度范围内Ca2+对纤维素酶的分泌具有诱导作用,但当超过一定浓度时会对纤维素酶的合成产生不利影响。较高Ca2+浓度易引起渗透胁迫,对微生物细胞造成毒害[34]。在5 mmol/L Ca2+激活作用最显著,纤维素酶FPase(4.20 IU/g)和羧甲基纤维素酶CMCase(18.60 IU/g)酶活水平最高,是对照组的1.3~1.61倍。此条件对应的胞外蛋白含量达到13.77 mg/g,半纤维素、纤维素、木质素降解率为32.39%、41.23%、22.73%。同时,Ca2+诱导条件下纤维素酶合成相关基因qPCR 检测结果表明,Ca2+处理能上调这些基因的表达倍数,但随着Ca2+浓度进一步升高,抑制了FPase 的合成,FPase、β-葡萄糖苷酶和CMCase 分别为2.03、4.05 和14.30 IU/g[34]。β-酪醇大于60 mg/L时诱导肝癌细胞Ⅱ相脱毒酶NAD(P)H:醌氧化还原酶,有明显的剂量效应关系,同时mRNA表达量增加,其抑制细胞增殖能力随着浓度的增加而增加[35]。白藜芦醇可诱导猪卵巢颗粒细胞中去乙酰化酶SIRT1 的表达,加速猪卵巢颗粒细胞凋亡,SIRT1表达与猪卵巢颗粒细胞凋亡存在一定相关性。当甲醇浓度达到3.2%时虾青素开始积累,在5.6%时达到峰值,比对照增加了2000 倍。而在5.6%甲醇浓度下,生物量、脂质、角鲨烯和总甾醇均有不同程度的下降。转录组学分析探讨了不同甲醇浓度(0%、3.2%和5.6%)对B4D1 表达谱的影响。在甲醇培养条件下,发现了三个关键的信号通路在调节细胞生长和代谢中起重要作用。五个中心碳代谢相关基因在5.6%甲醇的作用下显著下调,因此预计会导致用于细胞生长和合成的ATP 和NADPH 减少。高甲醇条件下,参与脂肪酸和角鲨烯/甾醇前体生物合成的3 个基因显著下调,而参与虾青素合成的香叶二磷酸合成酶、番茄红素环化酶和-胡萝卜素3-羟化酶显著上调,导致前体水平升高,最终虾青素产量增加。此外,三个应激反应基因的转录水平上调[36]。
本文采用五种高级醇(正丙醇、正丁醇、异丁醇、正己醇和异戊醇)诱导白地霉S12 结果为:当正己醇和异丁醇分别作为诱导剂时,白地霉S12 产生的高级醇脱氢酶活性较高,且正己醇为诱导剂时,诱导后菌体及其胞内酶的正己醇和正丁醇降解活性高于其他高级醇类。此外,高级醇种类对脱氢酶诱导时间和剂量有所影响。正丙醇、正丁醇、异丁醇和正己醇作为诱导剂时,最适诱导时间均为6 h;而以异戊醇为诱导剂时,最佳诱导时间为12 h。以正丙醇和正己醇为诱导剂时,最适的诱导浓度为1.5 g/L;以正丁醇、异丁醇和异戊醇为诱导剂时,最适诱导浓度分别为1.0、0.5 和2.5 g/L。Native-PAGE 电泳结果说明,高级醇诱导脱氢酶活性提高与脱氢酶的表达有一定的关系。本文从蛋白表达水平、菌体细胞和胞外酶活进行不同高级醇诱导特性分析,但缺少转录水平的机理探究,后续还需要从此方面进行研究。

