紫苏籽壳提取物纳米银颗粒的制备及性能表征
韩婉毓,李会珍, ,张志军,郭誉嵘,张红玉,王 丹
(1.中北大学化学与化工学院,山西太原 030051;2.中北大学晋中产业技术创新研究院,山西晋中 030600)
紫苏(Perilla frutescensL.)是一种药食两用植物,广泛分布于日本、中国、韩国和越南等东亚国家[1]。研究表明,紫苏具有抗氧化[2-3]、抗癌[4]、抗菌[5]、抗炎[6]及抗过敏[7]等多种生物活性。紫苏全身是宝,茎叶含有丰富的蛋白质、类胡萝卜素、黄酮和多酚类物质[8-10],籽粒含有脂肪、多糖、蛋白质等,紫苏籽油中α-亚麻酸含量高达60%以上[11]。为加强紫苏蛋白资源的利用,目前紫苏籽粒加工普遍采用脱壳液压冷轧工艺。紫苏籽壳占籽粒总质量27%左右,含有丰富的黄酮等多酚类物质,具有良好的抗氧化性、抗菌性和抗癌活性[12],但通常作为肥料或废弃物被处理,造成资源的浪费。
纳米颗粒尺寸通常小于100 nm[13],且比表面积大、温度变化小,孔径可调、颗粒间扩散距离短、吸附位点多,可作为良好的吸附剂和催化剂[14]。与普通银相比,纳米银颗粒具有更强的抗菌性能,非耐药性和抗生物膜活性等[15-17],已被用于物理、化学、生物和制药领域[18]。纳米银的合成方法包括物理、化学和生物合成法[19],物理法能耗大且需要相对较长的合成时间和复杂的设备[20-21];化学法需另外加入保护剂和分散剂避免纳米银颗粒团聚,该方法中使用的有毒化学品限制了纳米银在临床和医学领域的应用[22];生物合成法绿色环保、成本低、产量高、抗菌效率高,具有良好的生物相容性和环境友好性[23-25],其中植物提取物还原法是指利用植物提取物中的天然抗氧化剂,在制作过程中充当还原剂和保护剂合成纳米银的一种方法,该方法更加快速、简便,避免了微生物法维持细胞培养的复杂过程,该法合成的纳米银颗粒不仅和普通纳米银一样具有广谱杀菌性,还具有良好的生物相容性,因此可被应用于医学领域作为抗菌剂、抗病毒、癌症治疗等[26]。
紫苏籽壳提取物富含还原性官能团,可作为纳米银的还原剂与保护剂。以紫苏籽壳为原料,增加了对资源的充分利用,减少了对环境的污染。本研究以超声波辅助与植物提取物还原法相结合制备纳米银颗粒,探究紫苏籽壳提取物(PSHE)制备纳米银颗粒的最优工艺,并对最优工艺下所制得的紫苏籽壳提取物纳米银颗粒(PSHE@AgNPs)进行结构与性能表征。通过本研究工艺合成的纳米银颗粒经济、环保且不涉及有毒化学物质,有望在生物材料和临床医学领域得到应用。
1 材料与方法
1.1 材料与仪器
紫苏籽壳 中北大学晋中产业技术创新研究院提供;硝酸 AR,成都市科隆化学品有限公司;硝酸银 99.8%,天津市风船化学试剂科技有限公司;硫酸铁铵十二水合物 AR,上海源叶生物科技有限公司;硫氰酸铵标准溶液(AR)、考马斯亮蓝G250(AR)、纳米银粉末(纯度99.5%)上海麦克林生化科技有限公司;福林酚试剂 BR,国药集团化学试剂有限公司;苯酚,亚硝酸钠、硝酸铝 AR,天津市天力化学试剂有限公司;芦丁(纯度95%)、没食子酸(99%)上海阿拉丁生化科技股份有限公司。
SB-5200DTDN 数显超声仪 宁波新芝生物科技股份有限公司;P4 紫外-可见光分光光度计 上海美谱达仪器有限公司;FAl204B 分析天平 上海精科天美科学仪器有限公司;CTL550 低速离心机 湖南湘立仪器有限公司;TGL-16.5M 台式高速冷冻离心机 上海卢湘仪离心机仪器有限公司;GZX-9146MBE 电热鼓风干燥箱 上海博迅实业有限公司;ZYCGF-III-20T 超纯水制备系统 四川卓越水处理设备有限公司;GZX-9146MBE 电热鼓风干燥箱 上海博迅实业有限公司;PB-10 酸度计 上海美普达仪器有限公司;X 射线衍射仪 荷兰Panalytical Empyrean;Nicolet iS20 傅里叶红外光谱仪 美国Thermo Scientific;TG 209 F3 热重仪 德国Netzsch;JEM 2800 透射电子显微镜 日本JEOL。
1.2 实验方法
1.2.1 紫苏籽壳提取液的制备 称取10 g 紫苏籽壳粉,加去离子水100 mL,在超声波功率600 W,温度50 ℃条件下超声2 h,5000 r/min 离心10 min,取上清液,即可得到PSHE。
1.2.2 PSHE 组成成分分析
1.2.2.1 pH 对PSHE 组成成分进行测定,pH 采用PB-10 酸度计测定。
1.2.2.2 蛋白质含量 蛋白质含量采用考马斯亮蓝法测定[27],用牛血清蛋白配制标准蛋白质溶液,600 μL 各不同浓度蛋白质溶液与3 mL 考马斯亮蓝溶液混匀静置2 min,以去离子水作为空白对照,测量595 nm 处吸光度,以蛋白质含量(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,取600 μL PSHE 按上述方法测定595 nm 处的吸光度,以标准曲线回归方程计算蛋白质含量。
1.2.2.3 多糖含量 多糖含量采用苯酚-硫酸比色法测定,参考赵滢等[28]方法,并稍做修改,1 mL 各不同浓度葡萄糖标准溶液与1 mL 5%苯酚溶液和5 mL浓硫酸混匀后,于室温下避光放置30 min,以去离子水为空白对照,测量490 nm 处吸光度,以多糖含量(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,取1 mL PSHE 按上述方法测定490 nm 处的吸光度,以标准曲线回归方程计算多糖含量。
1.2.2.4 总黄酮含量 总黄酮含量采用亚硝酸钠-硝酸铝比色法测定,参考吴现芳等[29]方法,并稍做修改,5 mL 各不同浓度芦丁标准溶液与0.4 mL 5%亚硝酸钠溶液混匀放置6 min 后,加入0.4 mL 10%硝酸铝溶液,混匀放置6 min,然后再加入4 mL 5%氢氧化钠溶液,混匀后放置15 min,以标准空白管为对照,测量510 nm 处吸光度,以总黄酮含量(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,取5 mL PSHE 按上述方法测定510 nm 处的吸光度,以标准曲线回归方程计算总黄酮含量。
1.2.2.5 多酚含量 多酚含量采用福林酚比色法测定,参考游见明等[30]试验方法,并稍做修改,1 mL 各不同浓度的标准没食子酸溶液与6 mL 去离子水和0.5 mL 福林酚试剂混匀后置于暗处5 min,再加入1.5 mL 7%碳酸钠溶液和1 mL 去离子水,充分混匀后室温下暗处静置60 min,以标准空白管为对照,测量760 nm 处吸光度,以多酚含量(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,取1 mL PSHE 按上述方法测定760 nm 处的吸光度,以标准曲线回归方程计算多酚含量。
1.2.3 紫苏籽壳提取物纳米银的制备 采用超声波辅助法制备PSHE@AgNPs。将一定量的硝酸银溶液和PSHE 混合,在设定温度和功率下超声一定时间即可得到PSHE@AgNPs 溶胶。
1.2.4 单因素实验 分别探究不同硝酸银浓度、紫苏籽壳提取液浓度、超声波功率、超声温度和超声时间对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响。
1.2.4.1 硝酸银浓度 将不同浓度的硝酸银溶液(5、10、15、20、25 mmol/L)和同体积0.1 g/mL 的紫苏籽壳提取液充分混匀后,置于480 W,50 ℃超声数显仪中4 h 得到紫苏籽壳提取物纳米银溶胶,探究不同硝酸银浓度对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响
1.2.4.2 紫苏籽壳提取液浓度 将15 mmol/L 硝酸银溶液与同体积不同浓度的紫苏籽壳提取液(0.1、0.2、0.3、0.4、0.5 g/mL)充分混匀后,置于480 W,50 ℃超声数显仪中4 h 得到紫苏籽壳提取物纳米银溶胶,探究不同提取液浓度对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响。
1.2.4.3 超声波功率 将同等体积15 mmol/L 硝酸银溶液和0.4 g/mL 紫苏籽壳提取液充分混匀后,置于50 ℃不同超声功率(360、420、480、540、600 W)超声数显仪4 h 得到紫苏籽壳提取物纳米银溶胶,探究不同超声波功率对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响。
1.2.4.4 超声温度 将同等体积15 mmol/L 硝酸银溶液和0.4 g/mL 紫苏籽壳提取液充分混匀后,置于480 W,不同超声温度(50、60、70、80、90 ℃)超声数显仪4 h 得到紫苏籽壳提取物纳米银溶胶,探究不同超声温度对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响。
1.2.4.5 超声时间 将同等体积15 mmol/L 硝酸银溶液和0.4 g/mL 紫苏籽壳提取液充分混匀后,置于480 W,50 ℃超声数显仪中,超声不同时间(4、5、6、7、8 h)得到紫苏籽壳提取物纳米银溶胶,探究不同超声时间对PSHE@AgNPs 的紫外-可见光谱和银离子还原率的影响。
1.2.5 银离子还原率的计算 将得到的紫苏籽壳提取物纳米银溶胶,经过12000 r/min,20 min 的高速离心后,得到的沉淀即为PSHE@AgNPs,取上清液,以硫酸铁铵溶液作为指示剂,利用沉淀滴定法测定上清液中的剩余银离子浓度,即可得到银离子还原率(Y)。
其中:a 为用于滴定的紫苏籽壳提取物纳米银溶液的体积,L;b 为滴定所用硫氰酸铵指示剂的体积,L;CNH4SCN为滴定所用硫氰酸铵指示剂的浓度,mol/L;CAg+为得到的紫苏籽壳提取物纳米银溶液的浓度,mol/L。
其中:V1为加入硝酸银溶液的体积,L;V2为制备反应的总体积,L;CAgNO3为加入硝酸银溶液的浓度,mol/L;Y为银离子还原率,%。
1.2.6 响应面法优化试验 在单因素实验的基础上,采用Design-Expert 软件,以硝酸银浓度(A)、提取液浓度(B)和超声时间(C)为影响因子,以银离子还原率为响应值,进行3 因素3 水平响应面试验,见表1。

表1 响应面试验设计因素及水平Table 1 Factors and levels of response surface test design
1.2.7 紫苏籽壳提取物纳米银的表征
1.2.7.1 紫外-可见光谱分析 通过测量所制得的PSHE@AgNPs 溶胶(20 倍稀释)和市售纳米银(AgNPs)的紫外-可见光谱来监测溶液中纳米银的生物合成。在紫外-可见光分光光度计上以1 nm 的分辨率记录300~800 nm 的紫外-可见光谱,蒸馏水作空白对照。
1.2.7.2 X 射线衍射分析 将PSHE@AgNPs 溶胶高速离心,多次洗涤沉淀,烘干,研磨至粉末,将PSHE@AgNPs 和AgNPs 粉末压片后进行XRD 测试。辐射源CuKα射线、电流30 mA、电压40 kV,扫描范围10°~80°,扫描速度为2°/min[31]。
1.2.7.3 傅里叶变换红外光谱分析 将烘干至恒重的纯溴化钾(KBr)粉末与PSHE、PSHE@AgNPs 和AgNPs 粉末进行研磨,压成半透明薄片。背景材料为光谱纯KBr 粉末,波长范围设置为4000~400 cm-1,分辨率为4 cm-1[32]。
1.2.7.4 热重分析 通过热重分析对PSHE@AgNPs和AgNPs 的热稳定性进行评估。PSHE@AgNPs和AgNPs 粉末在氮气氛围下,从30 ℃升温至700 ℃,升温速度为10 ℃/min[33]。
1.2.7.5 透射电子显微镜分析 使用透射电子显微镜(TEM)对PSHE@AgNPs 和AgNPs 的尺寸分布和形貌进行表征。取微量PSHE@AgNPs 和AgNPs粉末溶于乙醇中,超声15 min 使其分散均匀,将重悬好的PSHE@AgNPs 滴定在100 目的超薄碳膜铜网上,放置于无尘干燥环境中,自然干燥后在300 kV 下使用TEM 对样品粒径大小与形貌进行观察[34]。
1.3 数据处理
本文所有定量数据均测定3 次,所测数据采用单因素方差分析,结果以平均值±标准偏差表示,采用SPSS Statistics 26、Microsoft Excel 2019 进行统计学分析处理,P<0.05 被认为显著。采用Design-Expert.V8.0.6.1 进行响应面试验。采用Origin 2021进行绘图。
2 结果与分析
2.1 紫苏籽壳提取液各参数测定结果
对PSHE 组成成分进行测定,通过PB-10 酸度计测得PSHE 的pH 为6.16;得到蛋白质标准曲线为y=0.0004x+0.0240,R2=0.9980,PSHE 的蛋白质含量为238.25 μg/mL;多糖标准曲线为y=0.0102x+0.0078,R2=0.9998,PSHE 的多糖含量为98.04 μg/mL;总黄酮标准曲线为y=0.0139x-0.0144,R2=0.9999,PSHE 的总黄酮含量为17.68 μg/mL;多酚标准曲线为y=15.584x+0.0366,R2=0.9993,PSHE 的多酚含量为14.57 μg/mL。
各参数的测定结果表明紫苏籽壳提取液中含有丰富的蛋白质、多糖、黄酮和酚类物质,表明紫苏籽壳提取液在制备纳米银的过程中既可以充当还原剂,也可以作为保护剂,一方面能有效将银离子还原成银单质,另一方面可以将生成的银单质保护起来以得到纳米银颗粒。
2.2 紫苏籽壳提取物纳米银的制备工艺
2.2.1 单因素实验结果
2.2.1.1 硝酸银浓度的优选 纳米银在波长400~450 nm 的范围内有典型的特征峰[35-36],由图1a 可知在波长450 nm 附近有明显的吸收峰,证实了纳米银的存在。当硝酸银浓度为5 mmol/L 时未出现明显吸收峰,当浓度增大至10 mmol/L 时吸收峰较低且半峰宽较大,可能是因为反应体系中含有较多的还原剂,对纳米银的检测产生影响[34]。当浓度从15 mmol/L 增加至25 mmol/L 时,吸收峰强度随之升高,说明PSHE@AgNPs 的浓度随着硝酸银浓度的增大而增加,但吸收峰出现红移且半峰宽度增大,这表明生成的PSHE@AgNPs 粒径逐渐增大且分布不均。
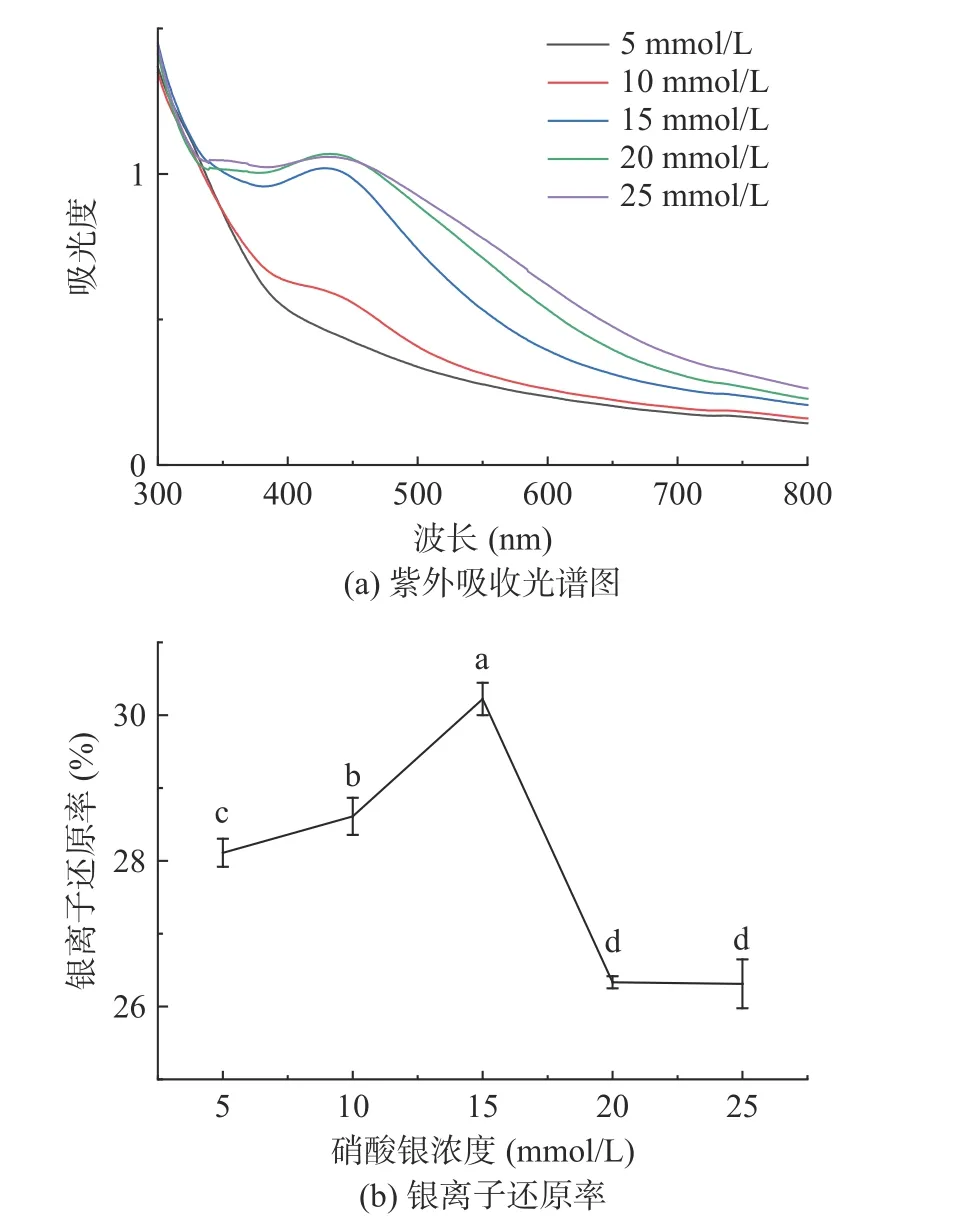
图1 硝酸银浓度对PSHE@AgNPs 的影响Fig.1 Effect of silver nitrate concentration on PSHE@AgNPs
由图1b 可知,当硝酸银浓度从5 mmol/L 增加至15 mmol/L 时,随着硝酸银浓度增大,银离子还原率也随之增加,在硝酸银浓度为15 mmol/L 时,银离子还原率达到最大值,最大值为30.22%。当硝酸银浓度继续增大时,由于PSHE 还原力的限制,导致银离子还原率下降。因此,选择15 mmol/L 为PSHE@AgNPs 制备的最佳硝酸银浓度。
2.2.1.2 紫苏籽壳提取液浓度的优选 由图2a 可知,当提取液浓度为0.1 g/mL 时,溶液中还原剂含量较低,不能完全将硝酸银中的银离子还原为PSHE@AgNPs,导致部分颗粒静电斥力小,发生聚集现象,颗粒粒径较大。当提取液浓度从0.2 g/mL 增大至0.4 g/mL 时,吸收峰也随之增强,说明PSHE@AgNPs的浓度随着提取液浓度的增大而增加。当浓度增大至0.5 g/mL 时,半峰宽度增大,说明合成PSHE@AgNPs 粒径分布均匀性变差。

图2 提取液浓度对PSHE@AgNPs 的影响Fig.2 Effect of extract concentration on PSHE@AgNPs
由图2b 可知,随着提取液浓度增大,银离子还原率也随之增加,当提取液浓度为0.4 g/mL 时,银离子还原率为40.37%。随着提取液浓度进一步增大,银离子还原率趋于稳定。因此根据经济适用原则,选择0.4 g/mL 为PSHE@AgNPs 制备的最佳提取液浓度。
2.2.1.3 超声波功率的优选 由图3a 可知,当超声波功率从360 W 增加至480 W 时,吸收峰强度随之增大,且发生轻微蓝移,说明随着超声波功率增大,PSHE@AgNPs 的浓度随之增加且粒径变小。当功率继续增大至600 W 时,吸收峰变弱,说明PSHE@AgNPs 的浓度降低。

图3 超声波功率对PSHE@AgNPs 的影响Fig.3 Effect of ultrasonic power on PSHE@AgNPs
由图3b 可知,随着超声波功率的增大,银离子还原率也随之增加,当超声波功率为480 W 时,银离子还原率达到最大值40.33%,随后下降。超声的引入有利于微小颗粒的形成,同时超声波的空化作用可以产生大量的微小气泡,并分散于纳米银颗粒表面,抑制纳米银颗粒的增长,且对团聚的纳米银颗粒也具有破碎和分散作用[37]。因此,选择480 W 为制备PSHE@AgNPs 的最佳超声波功率。
2.2.1.4 超声温度的优选 由图4a 可知,当超声温度从50 ℃升高至80 ℃时,吸收峰强度随之增大,说明PSHE@AgNPs 的浓度随着超声温度升高而增加。但当温度继续增加至90 ℃时,吸收峰出现红移且半峰宽度增大,这表明生成的PSHE@AgNPs 粒径逐渐增大且分布不均。

图4 超声温度对PSHE@AgNPs 的影响Fig.4 Effect of ultrasonic temperature on PSHE@AgNPs
由图4b 可知,随着超声温度的升高,银离子还原率也随之增加,当超声温度达到80 ℃时,银离子还原率为71.56%,随着超声温度的进一步升高,银离子还原率趋于稳定。因此选择80 ℃为PSHE@AgNPs 制备的最佳超声温度。
2.2.1.5 超声时间的优选 由图5a 可知,当超声时间从4 h 增加至8 h 时,吸收峰强度随之增大,说明PSHE@AgNPs 的浓度随着超声时间增加而增加。

图5 超声时间对PSHE@AgNPs 的影响Fig.5 Effect of ultrasonic time on PSHE@AgNPs
由图5b 可知,随着超声时间的增加,银离子还原率也随之增加,当超声时间为7 h 时,银离子还原率为92.37%,后趋于稳定。因此,选择7 h 为PSHE@AgNPs 制备的最佳超声时间。
2.2.2 响应面优化试验结果 利用Design Expert 8.0.6软件对表2 中的数据进行回归拟合分析,建立模型,得到硝酸银浓度(A)、提取液浓度(B)和超声时间(C)3 个因素的回归方程:

表2 响应面试验设计及结果Table 2 Design and results of response surface experiment
该回归方程的决定系数R2为0.9869,说明拟合性良好。校正系数R2Adj为0.9700,说明该模型可以解释97.00%实验数据的变异性。对该回归方程进行方差分析,结果见表3。硝酸银浓度和超声时间对银离子还原率的影响显著(P<0.05),而提取液浓度对银离子还原率的影响不显著,这说明硝酸银浓度和超声时间对银离子还原率的影响起主要作用。该模型的F值为58.51,P值小于0.0001,表明该模型极显著。失拟项的P值为0.1244,差异不显著(P>0.05),表明该回归方程拟合度较高,可以较好地反映响应值与各种因子变量之间的关系。

表3 二次回归方程模型方差分析结果Table 3 ANOVA results of quadratic regression model
通过分析所拟合的响应面的形状,来探究硝酸银浓度、提取液浓度和超声时间交互作用对银离子还原率的影响。从图6 可知,硝酸银浓度和提取液浓度的交互作用对银离子还原率的影响最显著,提取液浓度和超声时间的交互作用次之,硝酸银浓度和超声时间的交互作用不显著。

图6 各因素交互作用对银离子还原率影响的响应面Fig.6 Response surface of the interaction of various factors on the reduction rate of silver ions
通过响应面优化确定了PSHE@AgNPs 最佳合成条件,即硝酸银浓度14.65 mmol/L,提取液浓度0.4 g/mL,超声时间7.09 h,银离子还原率的预测值为91.63%。考虑到实际操作的便利,确定PSHE@AgNPs 制备工艺条件为硝酸银浓度15 mmol/L,提取液浓度0.4 g/mL,超声时间7 h。3 次验证实验的银离子平均还原率为92.11%±0.25%,与理论预测值相比相对误差小,说明模型拟合良好。因此,采用响应面分析方法优化得到的PSHE@AgNPs 的制备条件具有可行性。
2.3 紫苏籽壳提取物纳米银的表征
2.3.1 紫外-可见光谱图分析 无色的硝酸银溶液和浅黄色的PSHE 混合,超声后溶液颜色变为深棕色,初步证明PSHE@AgNPs 的生成。由图7 可知,PSHE@AgNPs 在463 nm 处有明显吸收峰,进一步证实了PSHE@AgNPs 的生成。AgNPs 在405 和619 nm处出现两个吸收峰,且吸收峰并不明显。

图7 PSHE@AgNPs 和AgNPs 的紫外-可见光谱Fig.7 UV-Vis spectrum of PSHE@AgNPs and AgNPs
2.3.2 X 射线衍射分析 由图8 可知,PSHE@AgNPs在38.11°、44.28°、64.47°和77.40°处有明显的衍射峰,AgNPs 在 38.07°、44.25°、64.42°和 77.37°处有明显的衍射峰,分别对应于银标准的(111)、(200)、(220)和(311)四个晶面衍射[38],结果表明,生成的PSHE@AgNPs 和AgNPs 都具有面心立方结构[39]。

图8 PSHE@AgNPs 和AgNPs 的XRD 衍射光谱Fig.8 XRD diffraction spectrum of PSHE@AgNPs and AgNPs
2.3.3 傅里叶变换红外光谱分析 如图9 所示,PSHE、PSHE@AgNPs 和AgNPs 均有特征吸收峰出现。3306.14、3263.43 和3444.07 cm-1处的吸收峰为黄酮类、酚类化合物中的-OH 特征伸缩吸收峰[40],而吸收峰的偏移说明酚类化合物参与纳米银的合成;2927.28、2855.22 和2925.30、2853.91 cm-1处的吸收峰是C-H2特征伸缩吸收峰[40];1744.78 和1744.24 cm-1处的吸收峰是酯类化合物的C=O 特征伸缩吸收峰[41];1660.17、1649.153 和1633.29 cm-1处的吸收峰则为烯烃C=C 特征振动吸收峰[42];1402.23、1378.03 和1400.27 cm-1处吸收峰是芳香族或脂肪族化合物的CH3特征振动吸收峰[41];1056.44 和1163.25 cm-1处为多糖中的C-O 特征振动吸收峰[42]。FTIR 图谱表明合成的PSHE@AgNPs 存在PSHE中的植物化学物质。

图9 PSHE、PSHE@AgNPs 和AgNPs 的傅里叶变换红外光谱Fig.9 FTIR spectroscopy of PSHE,PSHE@AgNPs and AgNPs
2.3.4 热重分析 如图10 所示,AgNPs 在30~700 ℃之间高度稳定,基本无重量损失,合成的PSHE@AgNPs 在30~700 ℃之间存在部分重量损失。由DTG 图可知在30~700 ℃之间PSHE@AgNPs 共出现两次主要的质量减轻,当实验温度低于100 ℃时,样品的重量损失主要来自于水分蒸发,可能是由于样品制备干燥不充分,含有少量的水分,发生了极小幅度的质量损失;在276.7~420.3 ℃范围内存在主要的质量减轻,质量减少46.74%,在357 ℃时达到峰值,峰值为2.75%,样品的质量损失可能是由于PSHE@AgNPs 表面的PSHE 中的植物化学物质被解吸[43]。TG 和DTG 结果表明,所制备的PSHE@AgNPs 由于表面PSHE 中植物化学物质的存在于270 ℃以上出现部分质量损失,但在200 ℃以内基本无质量损失,有良好的热稳定性。
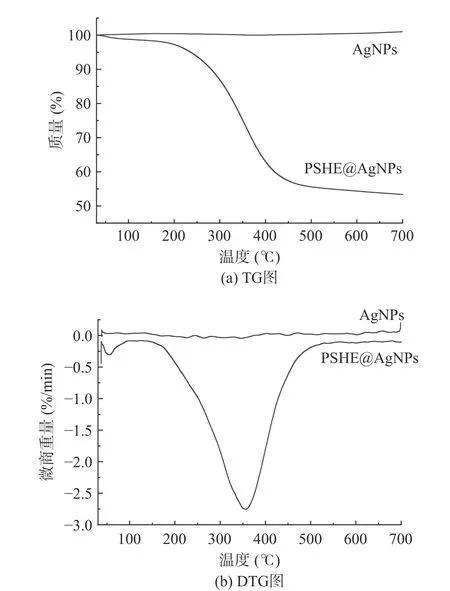
图10 PSHE@AgNPs 和AgNPs 的热重分析图谱Fig.10 TG and DTG of PSHE@AgNPs and AgNPs
2.3.5 透射电子显微镜分析 通过TEM 表征PSHE@AgNPs 和AgNPs 的形态和粒径大小,结果如图11所示。实验表明PSHE 合成的PSHE@AgNPs 显示均匀的球形,分散性好;AgNPs 也为分散性好的均匀球形颗粒。接着选取图像范围内的400 颗PSHE@AgNPs 和AgNPs 分析确定粒径大小,结果如图12所示,所合成的PSHE@AgNPs 的直径尺寸分布范围为6~53 nm,平均值为27.97 nm,标准偏差为8.88 nm,直方图中表明大多数PSHE@AgNPs 的直径尺寸在20~30 nm,对应于狭窄的均匀分布;AgNPs 的平均尺寸为30.27 nm,标准偏差为5.05 nm。正如Reddy等[44]所述,植物当中的某些物质在纳米银的合成过程中起关键的还原和稳定作用,紫苏中的酚类和类黄酮含量丰富,这些成分具有抗氧化活性,能够将银离子还原成银单质,同时,蛋白质通过对纳米银的包裹提供稳定性。
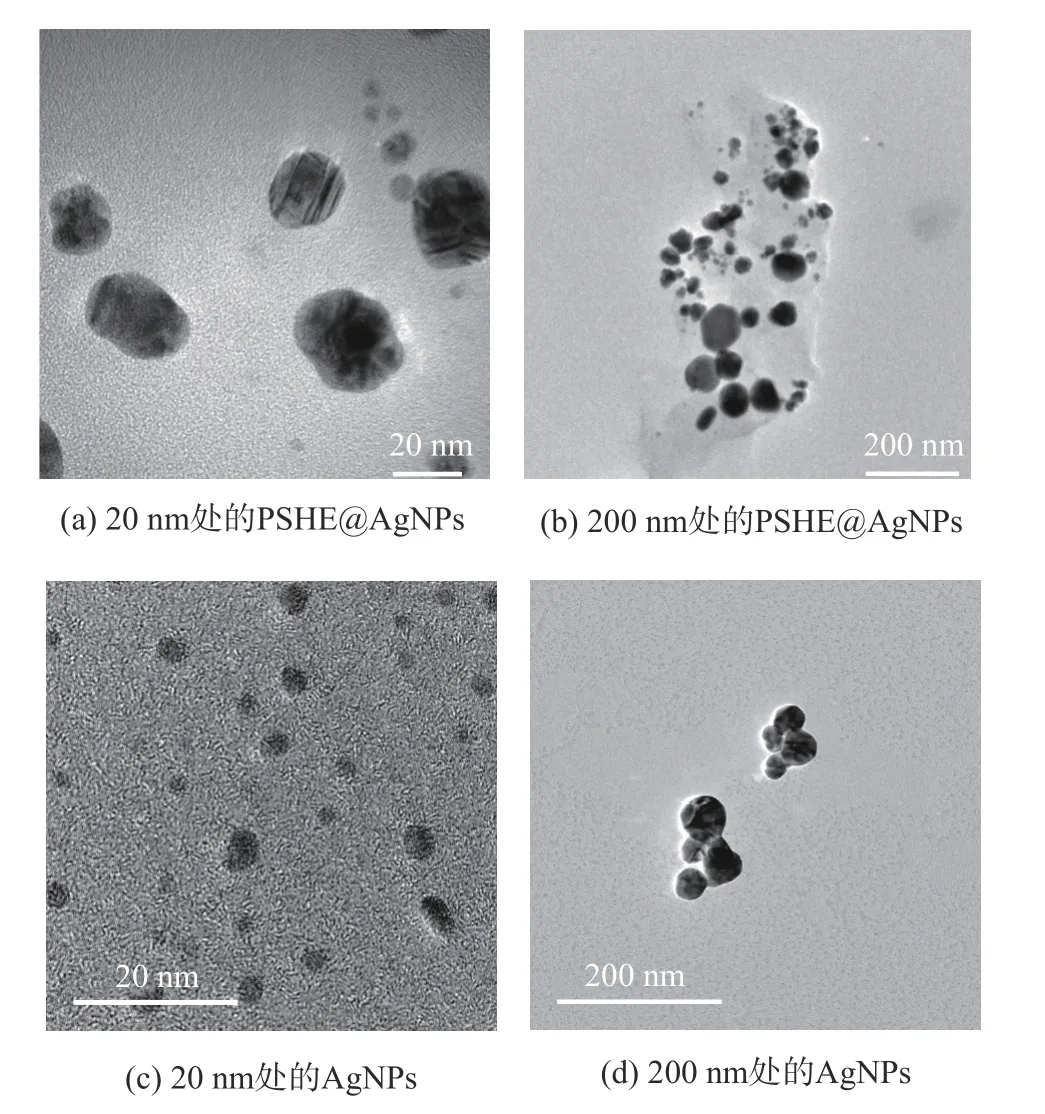
图11 PSHE@AgNPs 和AgNPs 的透射电子显微镜图像Fig.11 TEM image of PSHE@AgNPs and AgNPs
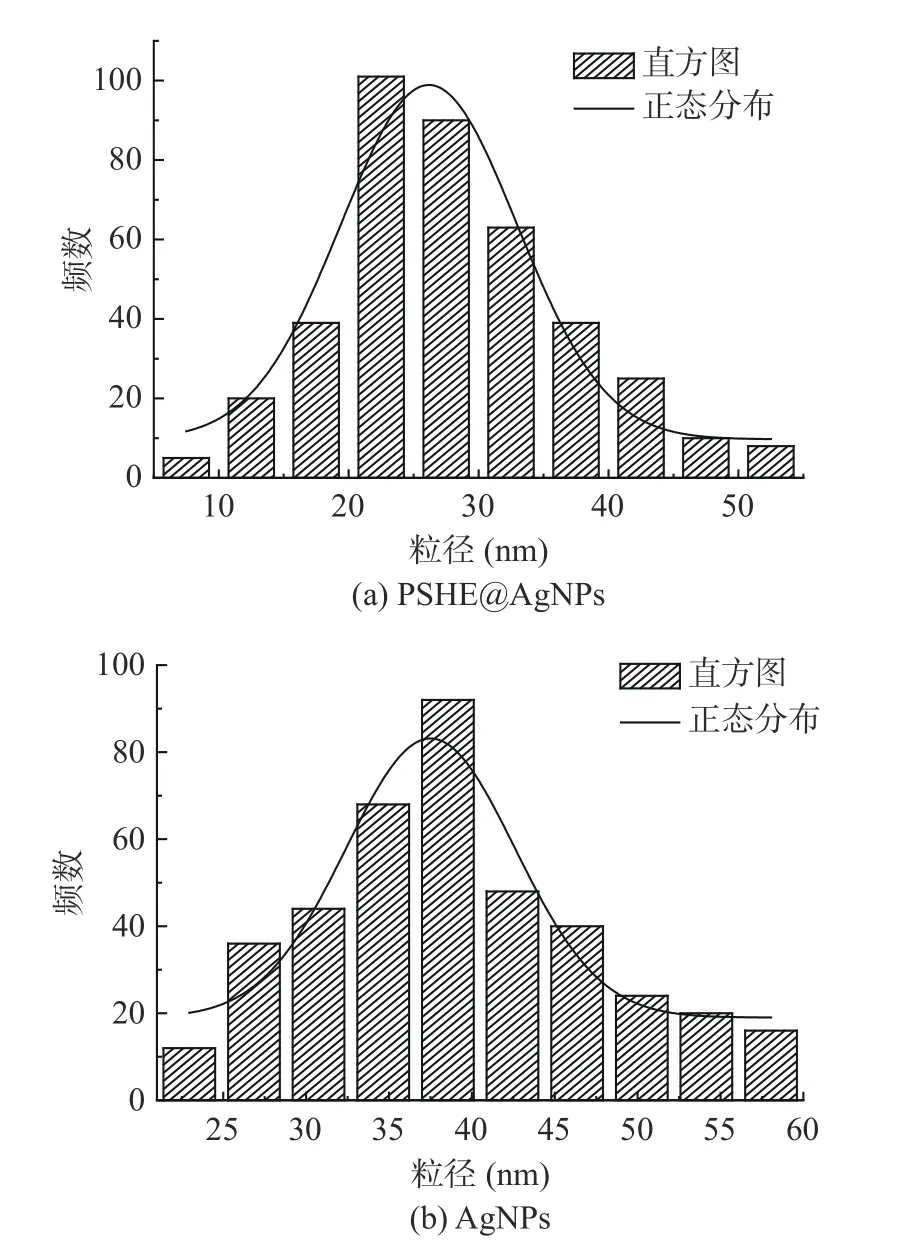
图12 PSHE@AgNPs 和AgNPs 的粒径尺寸分布直方图Fig.12 Histogram of particle size distribution of PSHE@AgNPs and AgNPs
3 结论
综上,以硝酸银为前驱体,紫苏籽壳提取液作为还原剂和保护剂,通过超声波辅助法制备PSHE@AgNPs 最佳工艺为:硝酸银浓度15 mmol/L,提取液浓度0.4 g/mL,超声波功率480 W,超声温度80 ℃,超声时间7 h,此时银离子还原率为92.11%±0.25%。XRD 表明,所制得的PSHE@AgNPs 具有面心立方结构;FTIR 图谱表明合成的PSHE@AgNPs 存在PSHE 中的植物化学物质;TG 分析证明了PSHE@AgNPs 的热稳定性;TEM 图像显示生成的PSHE@AgNPs 是高分散性、小粒径的近球形颗粒,平均尺寸为27.97 nm。研究表明,紫苏籽壳作为原料使得PSHE 中的植物化学物质覆盖在纳米银表面,增加其稳定性和分散性;超声波的引入有助于尺寸更小的纳米银颗粒的生成。本研究通过超声辅助法绿色合成的纳米银颗粒各项性能优异且经济环保,有望在生物材料和临床医学领域得到应用。

