CT45A1基因沉默抑制人前列腺癌细胞的迁移和侵袭
刘守磊,陈善苗,李耀军,罗 晓,卢红荪,王诗建,沃奇军,祁小龙
(1.桐乡市第一人民医院 泌尿外科,浙江 桐乡 314500;2.浙江省人民医院 泌尿外科,浙江 杭州 310014)
前列腺癌是一类严重危害男性健康的泌尿系统恶性肿瘤,近年来在我国的发病率呈持续增长趋势[1]。尽管得益于诊断水平的提高及手术治疗、抗雄激素治疗和免疫治疗等手段的综合运用,患者的整体生存状况已经有了一定的改善,但部分患者仍因发生转移导致死亡[2]。CT45家族是癌睾抗原(cancer/testis antigens,TAs)中的成员之一,由六个高度保守的基因组成,命名为CT45A1到CT45A6[3-4]。CT45A1在多种类型的恶性肿瘤中呈现异常高表达,并通过多种作用机制发挥着促肿瘤效应[5-7],但CT45A1在前列腺癌细胞中的表达情况及其发挥的作用尚不明确。本研究分析CT45A1在前列腺癌细胞中的表达情况及对细胞增殖、迁移和侵袭能力的影响,并从上皮-间质转化角度探索分子作用机制,希望为靶向CT45A1控制前列腺癌提供实验性支持。
1 材料与方法
1.1 细胞培养 高侵袭力人前列腺癌PC-3细胞、低侵袭力人前列腺癌LNCap细胞以及小鼠肺成纤维NIH-3T3细胞,均购自中科院上海生命科学研究院细胞资源中心。LNCap和PC-3细胞培养于含10%胎牛血清(FBS)的RPMI1640培养基,NIH-3T3细胞置于10% FBS的DMEM培养液中培养;所有细胞均放置于37 ℃、5% CO2的培养箱中培养。
1.2 主要试剂 磷酸钙转染试剂来自Promega公司,荧光定量PCR试剂盒和逆转录试剂盒购自Thermofisher公司,定量PCR引物和shRNA寡核苷酸委托上海生工公司合成。慢病毒包装载体以及shRNA慢病毒表达载体pLKO.1-puro购自Addgene公司。用于迁移实验的Transwell小室购自Corning公司,用于侵袭实验的包被基质胶的BD BioCoatTMBD MatrigelTMInvasion Chamber购自BD Biosciences公司。兔抗人CT45A1抗体购自ORIGENE公司,兔抗人β-actin、E-cadherin、Vimentin、Twist、Zeb-1抗体以及辣根过氧化物酶(HRP)标记的山羊抗兔IgG(二抗)购自Proteintech公司。
1.3 重组shRNA慢病毒表达载体构建 按照Addgene网站上提供的方法设计基因特异性shRNA序列。CT45A1 shRNA#1的寡核苷酸的序列为5’-CCGGCCAGCCAATTGGATTCTCAGACTCGAGTCTGA GAATCCAATTGGCTGGTTTTTG-3’和5’-AATTCAA AAACCAGCCAATTGGATTCTCAGACTCGAGTCTGAG AATCCAATTGGCTGG-3’;
CT45A1 shRNA#2的寡核苷酸的序列为5’-CCGGCAGCAGTTTCTCTGGAGATGACTCGAGTCATC TCCAGAGAAACTGCTGTTTT TG-3’和5’-AATTCAA AAACAGCAGTTTCTCTGGAGATGACTCGAGTCATCT CCAGAGAAACTGCTG-3’;
作为阴性对照的Scramble shRNA 的寡核苷酸序列为5’-CCGGCCTAAGGTTAAGTCGCCCTCGCT CGAGCGAGGGCGACTTAACCTTAGGCTCGAGTTTTT G- 3 ’ 和5’-AATTCA AAAACCTAAGGTTAAGTCGC CCTCGCTCGAGCGAGGGCGACTTAACCTTAGGCTCG AG-3’。
将合成的shRNA片段进行退火形成寡核苷酸对,同时使用AgeⅠ和EcoRⅠ酶切pLKO.1-puro载体并纯化回收,再利用T4DNA连接酶将寡核苷酸对与回收得到的载体进行连接,然后将连接产物转化到感受态细胞中。挑选单一克隆进行测序鉴定,鉴定正确的shRNA表达质粒分别命名为pLKO.1-puro-shCT45A1#1,pLKO.1-puro-shCT45A1#2和pLKO.1-puro-shScram。
1.4 慢病毒包装及感染 参照文献报道[8],使用磷酸钙转染试剂将shRNA表达载体与psPax2和pMD2.G病毒包装载体按 5∶4∶1 的质量比转染至293T细胞中;转染8 h后,换成新鲜培养液继续培养48 h;收集新鲜含病毒上清液过滤后用于PC-3细胞的感染。将感染后的细胞置于含嘌呤霉素的培养基中继续培养72 h,得到的细胞分别标记为shCT45A1#1,shCT45A1#2和shScram。
1.5 实时荧光定量PCR 采用TRIzol试剂提取细胞总RNA,使用反转录试剂盒获得cDNA。使用SYBR-Gree方法在Bio-Rad CFX 96 实时定量 PCR 系统上检测 CT45A1 的表达水平。CT45A1 的上游引物序列为 5’-AGGAAGCAGCAAGATGTATGAG-3’,下游引物序列为5’-CTGGAAGGCTATTTGATTCGG-3’;β-actin(看家基因)的上游引物序列为5’-AAGATCAAGATCATTGCTCCTCC-3’,下游引物序列为5’-GTCATAGTCCGCCTAGAAGCA-3’。PCR 反应条件:94 ℃ 2 min;94 ℃ 30 s、60 ℃ 30 s,共40个循环。以2-ΔΔCt值计算 CT45A1 的相对表达水平。
1.6 蛋白免疫印迹(Western blot,WB) 收集细胞提取总蛋白,BCA法对蛋白定量后依次进行SDS PAGE、转膜和脱脂奶粉封闭,分别加入不同的兔抗人多克隆抗体作为一抗,包括抗CT45A1、β-actin、E-cadherin、Zbe-1、Vimentin以及Twist,4 ℃条件下孵育过夜;再用TBST洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG作为二抗,室温孵育2 h后洗膜以及显影,使用Quantity One 软件对各种蛋白的表达丰度进行半定量分析,以β-actin作为内参。
1.7 细胞增殖实验 将细胞悬液以每孔 5×103个细胞/100 μL 的条件接种于96 孔板中,每组细胞设置3个复孔。于不同时间点(4 ~ 96 h)将10 μL 的MTT试剂加入每个孔中,在培养箱中培养4 h后小心吸净孔内培养液,每孔加入150 μL DMSO后振荡混匀15 min,至结晶物充分溶解;使用酶联免疫检测仪测量490 nm处的吸光度。
1.8 Transwell 小室法检测细胞迁移和侵袭能力
1.8.1 迁移实验 参照文献报道[8],收集细胞重悬于含0.1%BSA的无血清培养基中,按照3×104个细胞/150 μL/室加至Transwell小室的上室中,下室加入600 μL无血清条件培养的NIH-3T3细胞上清液作为趋化因子继续培养细胞12 h。用棉签抹净上层小室内的细胞,以甲醇固定后加入结晶紫溶液染色15 min,洗去多余的染料后晾干。在显微镜下观察并拍照,再切下完整的滤膜置于30%乙酸溶液内洗脱,用酶联免疫检测仪检测OD570 nm读数反映细胞迁移能力。
1.8.2 侵袭实验 参照文献报道[8],收集细胞重悬于含0.1% BSA的无血清培养基中,按照6×104个细胞/150 μL/室加至BD BioCoatTMBD MatrigelTMInvasion Chamber的上室,下室同样加入600 μL NIH-3T3细胞条件培养液,继续培养细胞18 h,后续步骤与迁移实验相同。
1.9 划痕愈合实验 将对数期生长的细胞接种于6孔板中,过夜后细胞均匀铺成单层。用200 μL移液管尖头轻轻划擦穿过孔中心的单层,然后用PBS冲洗3遍以除去漂浮的细胞,加入无血清培养基继续培养,于0 h和24 h拍照记录。用Image J软件分析并计算划痕面积(S),细胞划痕的愈合率(%)=(S0h-S24h)/S0h×100。

2 结果
2.1 CT45A1在具有不同侵袭力的前列腺癌细胞中的表达情况 荧光定量PCR和WB实验结果显示,PC-3细胞中CT45A1 mRNA的相对表达量(4.37±0.34)、CT45A1的蛋白表达水平(2.49±0.12)明显高于LNCap细胞,差异均有统计学意义(t=17.23、21.78;均P<0.0001)。见图1。因此,后续选用PC-3细胞进行CT45A1基因沉默的实验学研究。
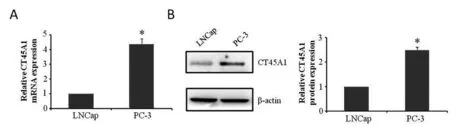
注:*与LNCap细胞比较,P<0.05。
2.2 shRNA重组慢病毒感染对细胞中CT45A1表达水平的影响 将两种靶向CT45A1的重组慢病毒包括pLKO.1-puro-shCT45A1#1和pLKO.1-puro-shCT45A1#2,以及阴性对照慢病毒pLKO.1-puro-shScram分别感染PC-3细胞。荧光定量PCR和WB实验结果表明,与shScram细胞相比,shCT45A1#1和shCT45A1#2细胞中的CT45A1 mRNA表达水平(图2A)和蛋白表达水平(图2B)均明显下调,差异均有统计学意义(P<0.05)。
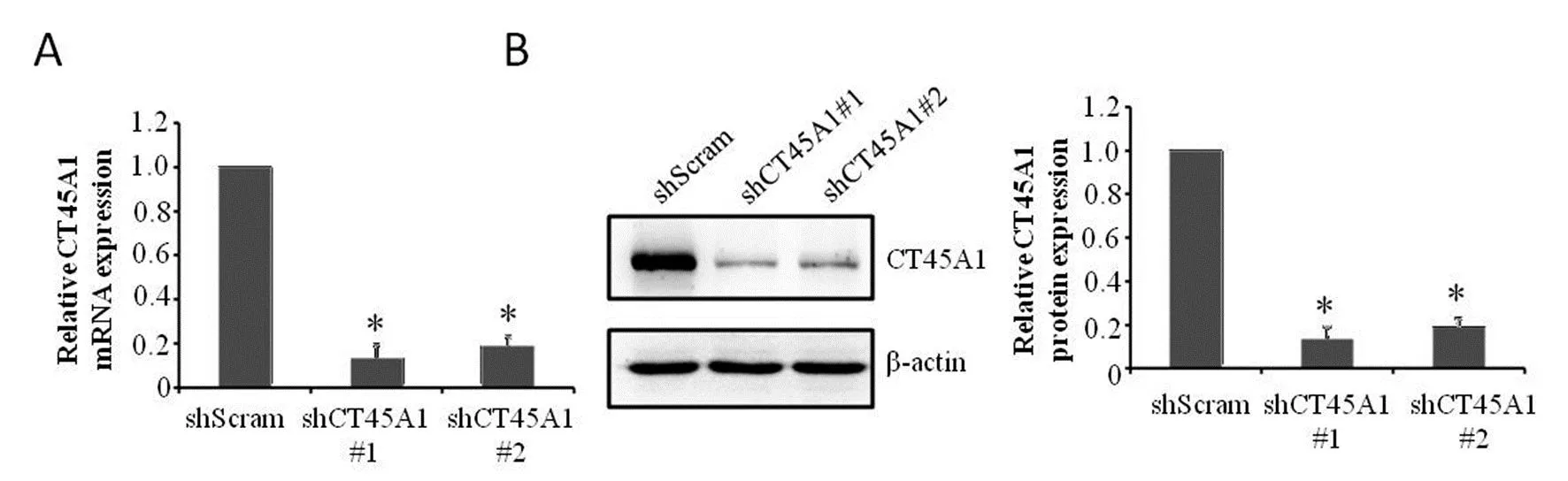
注:*与shScram细胞比较,P<0.05。
2.3 沉默CT45A1基因对细胞增殖能力的影响 采用MTT法检测shCT45A1#1,shCT45A1#2和shScram细胞的增殖情况。结果如封三图1A所示,三种细胞在培养4、24、48、72 和96 h时OD值间的差异无统计学意义(P>0.05),表明沉默CT45A1基因不影响PC-3细胞的体外增殖能力。
2.4 沉默CT45A1基因对细胞迁移和侵袭能力的影响 基于Transwell小室的迁移实验结果(封三图1B)显示,shCT45A1#1组、shCT45A1#2组的穿膜细胞数(OD值=0.24±0.07、0.31±0.07)低于shScram组(0.74±0.09);划痕愈合实验结果(封三图1C)显示,shCT45A1#1和shCT45A1#2组的细胞划痕愈合率为(57.99±1.43)%、(58.33±3.60)%,均低于shScram细胞组;侵袭小室法分别测试这三种细胞的侵袭能力,结果如封三图1D显示,shCT45A1#1组、shCT45A1#2组的穿膜细胞数(OD值=0.32±0.04、0.15±0.02)低于shScram组(0.11±0.03);差异均有统计学意义(P<0.05)。
2.5 沉默CT45A1基因对细胞上皮-间质转化(epithelial-mesenchymal transition,EMT)表型的影响 WB技术检测EMT相关的上皮细胞标志物E-cadherin和间质细胞标志物Vimentin的表达水平,结果如图3所示:与shScram组相比,shCT45A1组中E-cadherin的蛋白表达水平升高,而Vimentin的蛋白表达水平降低,差异均有统计学意义(P<0.05)。
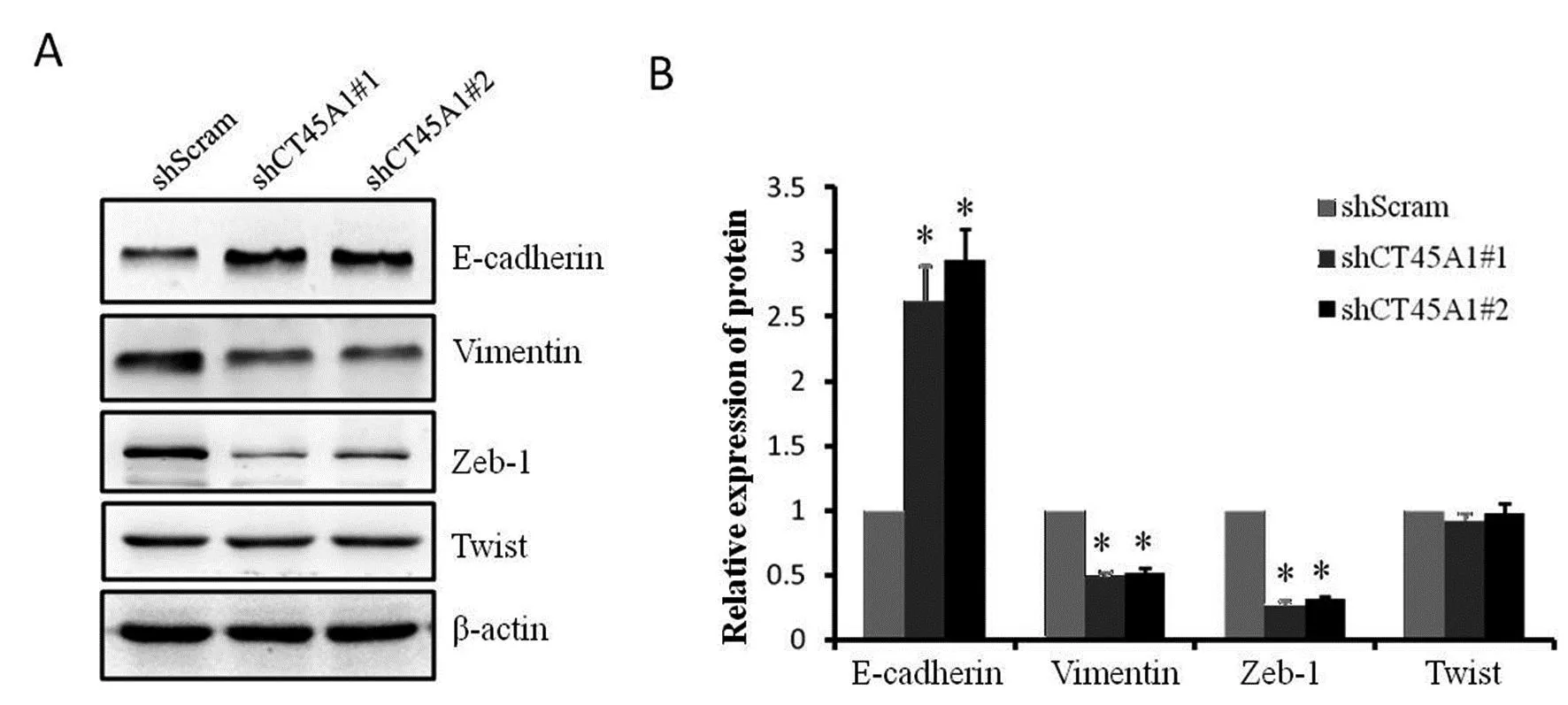
注:*与shScram组比较,P<0.05。
2.6 沉默CT45A1基因对Twist和Zeb-1蛋白表达水平的影响 WB技术检测shCT45A1#1组,shCT45A1#2组和shScram组细胞中Twist和Zeb-1蛋白的表达水平,结果如图3所示:Zeb-1蛋白在shCT45A1#1和shCT45A1#2组细胞中的表达水平明显低于其在shScram组中的表达水平,差异有统计学意义(P<0.05);而Twist蛋白在这些组别细胞中的表达水平并无显著差异(P>0.05)。
3 讨论
癌睾抗原CT45A1在多种恶性肿瘤中高度表达且发挥着提升肿瘤细胞的增殖水平、耐药性、迁移力和侵袭力的作用,表明其具有原癌基因的特性,然而其在人前列腺癌细胞中的表达情况及其功能尚无人报道。我们在两种被广泛使用的人前列腺癌细胞株LNCap和PC-3中测试了CT45A1的mRNA和蛋白的表达情况,结果发现PC-3细胞表达较高水平的CT45A1 mRNA和蛋白;鉴于PC-3细胞比LNCap细胞具有更强的侵袭能力,笔者推断CT45A1可能参与调控了PC-3细胞的侵袭能力。为了进一步明确CT45A1在PC-3细胞中所发挥的作用,本研究在利用shRNA技术抑制CT45A1基因表达后,系统性分析了PC-3细胞在增殖、迁移和侵袭能力方面的变化情况。本研究采用了2条不同的shRNA干扰片段去沉默CT45A1基因,据此获得的携带2种不同shRNA干扰片段的PC-3细胞在迁移和侵袭能力以及EMT相关基因表达水平上的变化基本一致,因而所观察到的研究结果不太可能是shRNA导致的脱靶效应。
MTT法检测结果显示,PC-3细胞的体外增殖能力在CT45A1基因被沉默后未发生明显改变,表明CT45A1蛋白的表达与PC-3 细胞的增殖能力并无直接联系。有文献报道,CT45A1在一些肿瘤细胞如肺癌细胞中具有促进增殖的效应[6],而在另一些肿瘤细胞如纤维肉瘤细胞中敲低其表达水平对细胞增殖水平并无明显影响[9],因而CT45A1对肿瘤细胞增殖的影响具有细胞背景依赖性。借助于体外迁移实验和侵袭实验,我们发现沉默CT45A1基因导致PC-3细胞的迁移和侵袭能力受损,表明CT45A1基因发挥了促进PC-3细胞迁移和侵袭的效应。肿瘤细胞可以通过一种名为EMT的表型转换来提升恶性转化能力进而发挥促进肿瘤组织局部浸润和远处转移的作用,发生EMT的细胞的典型特征性表现是上皮细胞标志物(如:E-cadherin)表达水平发生下调而间质细胞标志物(如:Vimentin)表达水平上升;与此同时肿瘤细胞的迁移和侵袭能力,以及体内转移能力明显增强[10-11]。蛋白印迹法结果显示,沉默CT45A1基因导致PC-3细胞中E-cadherin蛋白表达发生上调,同时Vimentin 蛋白表达受到抑制,提示沉默CT45A1基因可以通过削弱PC-3细胞的EMT表型来减弱PC-3细胞的迁移和侵袭能力。
Zeb-1和Twist是在生理和病理条件下调控EMT表型的关键转录因子,二者均在前列腺癌中高度表达,同时它们的高度表达与患者不良预后密切相关[12-17];沉默Zeb-1或者Twist基因均能显著抑制前列腺癌细胞的EMT表型并降低迁移和侵袭能力[15,17],提示这两种基因均可以通过诱导EMT来促进前列腺癌细胞的恶性转化。Shang等[5]报道在乳腺癌细胞中过表达CT45A1可以通过提升Twist基因的表达水平来促进EMT的发生,但本研究发现,敲低CT45A1在抑制前列腺癌细胞EMT的同时并不影响Twist的表达水平,提示我们CT45A1对Twist的调控具有细胞背景依赖性。有意思的是,本研究发现敲低CT45A1能显著降低PC-3细胞中Zeb-1蛋白的表达水平,提示CT45A1可能通过上调Zeb-1的蛋白表达来诱导EMT进而发挥促进PC-3细胞迁移和侵袭的作用。值得指出的是,CT45A1对于Zeb-1的这种调控关系目前尚未有报道,它是否特异性存在于前列腺癌细胞中,抑或也适用于其他肿瘤细胞仍需进一步的探讨。另一方面,CT45A1调控Zeb-1的具体机制也有待阐明,近期Wen等[7]报道CT45A1可以与β-catenin发生蛋白间互作而促进后者的蛋白表达,需要进一步的研究确认CT45A1是否可能通过类似的机制来调控Zeb-1蛋白的表达。
综上所述,CT45A1基因在高侵袭性前列腺癌细胞PC-3中高度表达;尽管沉默CT45A1基因不影响PC-3细胞的增殖能力,却可以显著抑制后者的迁移和侵袭,这可能是通过逆转Zeb-1介导的EMT来实现的。鉴于CT45A1能通过驱动EMT来促进前列腺癌的迁移和侵袭,靶向该分子的治疗方法有望用于治疗前列腺癌转移。我们的研究还存在一些不足之处,尤其是没有在荷瘤小鼠模型中探索Zeb-1是否介导了CT45A1对前列腺癌细胞体内转移能力的影响。

