CDK4/6抑制剂联合芳香化酶抑制剂类药物用于HR+/HER2-晚期乳腺癌一线治疗的临床综合评价
张佳雯,李琴,范国荣,程学芳*(.上海交通大学医学院附属第一人民医院临床药学科,上海 200080;2.上海市松江区新浜镇社区卫生服务中心药剂科,上海 20605)
乳腺癌是女性最常见的恶性肿瘤。据世界卫生组织GLOBOCAN[1]数据显示,全球乳腺癌年新发病例数从2018年的210万例增至2020年的226万例。在中国,2020年新发乳腺癌约41.6万例,高居女性恶性肿瘤的首位。其中,约70%的乳腺癌患者为激素受体(hormone receptor,HR)阳性和人表皮因子生长受体-2(human epidermal growth factor receptor 2,HER2)阴性(HR+/HER2-)[2-3]。
CDK4/6抑制剂可通过与CDK4和CDK6激酶的三磷酸腺苷(ATP)结合位点结合,抑制其活性,干扰网膜母细胞瘤(retinoblastoma,Rb)的磷酸化,阻断细胞周期从G1期到S期的进程,抑制肿瘤细胞增殖。此外,CDK4/6抑制剂还能抑制上游雌激素受体信号通路的表达,与内分泌治疗之间存在协同增效作用[3-4]。迄今为止,已有5种CDK4/6抑制剂获批上市,分别是哌柏西利、瑞博西利、阿贝西利、曲拉西利(预防骨髓抑制)和达尔西利(2021年底获批上市,未纳入本研究)。国内外权威指南一致推荐CDK4/6抑制剂联合芳香化酶抑制剂(aromatase inhibitor,AI)用于HR+/HER2-晚期乳腺癌一线治疗。然而,目前国内外尚无相关CDK4/6抑制剂联合AI类药物临床综合评价研究报道。
本研究选取HR+/HER2-晚期乳腺癌一线治疗药物哌柏西利、瑞博西利和阿贝西利作为研究对象,拟通过临床综合评价的方法,比较哌柏西利、瑞博西利和阿贝西利联合AI方案的临床综合价值,以期为临床用药实践提供参考。
1 研究方法
1.1 临床综合评价指标体系构建与评价方法
本研究基于《抗肿瘤药品临床综合评价技术指南(2022年版试行)》等[5-10],围绕HR+/HER2-晚期乳腺癌一线治疗的安全性、有效性、经济性、创新性、适宜性和可及性6个维度进行综合分析。通过文献查询确定各维度评价指标并构建形成CDK4/6抑制剂联合AI类药物用于HR+/HER2-晚期乳腺癌一线治疗的临床综合评价指标体系。在安全性和有效性方面,本研究采用网状meta分析进行定量分析。在经济性、创新性、适宜性和可及性方面,本研究采用国内药品价格、纳入医保情况、综合专利情况、地区药品配备量等数据进行定量分析,并结合药品说明书等相关资料进行定性分析。
1.2 文献筛选与资料提取
系统检索PubMed、Cochrane Library、中国知网和万方数据库,采用主题词加自由词组合检索,检索时限均为建库至2023年1月20日。中文检索词包括晚期乳腺癌、哌柏西利、瑞博西利/瑞博西尼/瑞博西林、阿贝西利等,英文检索词包括advanced breast cancer、palbociclib、ribociclib、abemaciclib等。纳入标准:① 目标人群是临床明确诊断为HR+/HER2-晚期乳腺癌患者;② 临床试验类型为Ⅱ期或Ⅲ期随机对照试验(randomized controlled trial,RCT);③ 干预措施是CDK4/6抑制剂联合AI对比AI;④ 结果指标为无进展生存期(progression free survival,PFS)、总生存期(overall survival,OS)及不良反应情况。排除标准:排除个案报道、综述、荟萃分析等。
由两名研究员根据纳入与排除标准独立筛选文献,如遇分歧,则咨询第三方人员协商解决。先将文献导入Endnote软件,删除重复文献,然后阅读文献标题和摘要,初步筛选文献,进一步阅读文献全文,确定最后纳入的文献。资料提取内容包括:第一作者;发表年份;研究设计类型;患者基线特征;患者例数;干预和对照措施;相关结局指标。
1.3 文献偏倚风险评价
由两名研究员根据Cochrane偏倚风险评估工具独立评估所纳入文献质量,如遇分歧,则咨询第三方人员协商解决。
1.4 统计学处理
通过 R4.2.2和R studio12.0 软件实现安全性和有效性的贝叶斯网状meta分析。根据I2指数或Q检验判断各研究间异质性,若异质性较小(I2≤50%,P≥0.05),选用固定效应模型进行网状meta分析;若异质性较大(I2>50%,P<0.05),在排除异质性后,进行网状meta分析;若无法确定异质性来源,仅做描述性分析。根据误差信息准则(deviance information criterion,DIC)判断一致性,若DIC差值小于5,表明一致性较好。Brooks-Gelman-Rubin诊断图判断模型收敛程度。二分类资料(总体/3级以上不良反应发生率)采用比值比(odds ratio,OR)及95%CI表示,并使用累计概率排序图下面积(SUCRA)进行综合排序,其数值越大不良事件发生可能性越大。生存相关的时间-事件资料(PFS和OS),采用风险比(hazard ratio,HR)及95%CI表示,并使用P分数(P-score)[11]比较不同治疗方案的优势程度,其数值越大优势程度越大。
2 结果
2.1 临床综合评价指标体系构建
本研究指标体系包括安全性、有效性、经济性、创新性、适宜性和可及性6个维度。其中,安全性包括总体不良反应/事件、3级以上不良反应/事件和不良反应发生类型;有效性包括临床疗效即PFS和OS;经济性包括单疗程治疗药品费用;创新性包括用药方案、作用靶点、专利价值和技术国产化;适宜性包括药品说明书适应证和医保目录、药品使用与储存条件、药品剂型选择的优先性;可及性包括可获得性和可负担性,共15个指标。
2.2 临床综合评价
2.2.1 安全性 纳入文献的基本特征见表1。对纳入文献进行 Cochrane风险评估,结果显示整体文献质量较高。异质性检验提示存在部分异质性,怀疑异质性可能来源于PALOMA-4试验,剔除该试验后,提示无明显异质性(I2=0%),选择固定效应模型进行分析。一致性检验表明一致性好(DIC差值<5);Brooks-Gelman-Rubin诊断显示收敛程度满意。各CDK4/6抑制剂联合AI总体不良反应发生率相似,接近100%,见表1。

表1 纳入安全性评价研究的基本特征Tab 1 Basic characteristics of included studies on safety evaluation
3级以上不良反应率的网状meta分析结果显示:相对于阿贝西利联合AI,哌柏西利联合AI(OR=2.3,95%CI:1.4~3.7)和瑞博西利联合AI(OR=2,95%CI:1.2~3.3)可增加3级以上不良反应发生风险,差异具有统计学意义(P<0.05)。哌柏西利联合AI和瑞博西利联合AI的3级以上不良反应发生率差异无统计学意义(P>0.05),具体见表2。
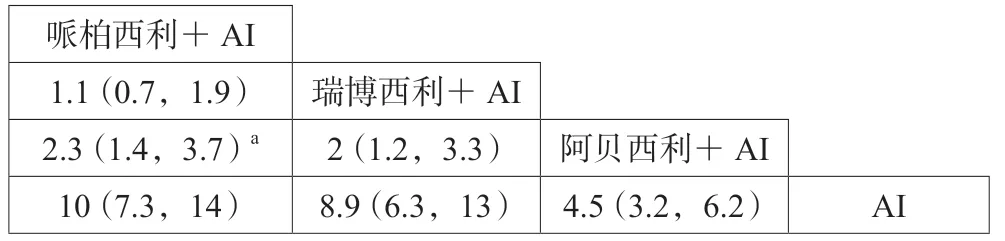
表2 不同方案3级以上不良反应发生率的网状meta分析结果 [HR(95%CI)]Tab 2 Network meta-analysis on incidence of grade 3 and above adverse reactions in different therapeutic regimens [HR(95%CI)]
3级以上不良反应发生风险的SUCRA值排序为哌柏西利联合AI(0.903 329 2)>瑞博西利联合AI(0.762 358 3)>阿贝西利联合AI(0.334 312 5)>单纯AI(0.000 000 0),提示哌柏西利联合AI的3级以上不良反应发生风险最大,而阿贝西利联合AI的3级以上不良反应发生风险较小。各方案常见不良反应对比显示:三种药物不良反应类型基本一致,均引起血液毒性、疲劳、恶心、腹泻等常见不良反应,但各类型发生率有差异,详见表3。其中哌柏西利及瑞博西利最常见不良反应及3级以上不良反应均是中性粒细胞减少,阿贝西利最常见不良反应是腹泻,3级以上最常见不良反应是中性粒细胞减少。

表3 常见不良反应及3级以上不良反应Tab 3 Common adverse reactions and grade 3 and above adverse reactions
2.2.2 有效性 纳入文献的基本情况见表4,其中6项研究报道了PFS数据,4项研究报道了OS数据。对纳入文献进行Cochrane风险评估,结果显示整体文献质量较高。Q统计量检验提示不存在异质性(P>0.05),选择固定效应模型进行分析。一致性检验表明一致性好(DIC差值<5);Brooks-Gelman-Rubin诊断显示收敛程度满意。PFS的网状meta分析结果显示:与单纯AI相比,哌柏西利联合AI(HR=0.59,95%CI:0.51~0.68)、瑞博西利联合AI(HR=0.57,95%CI:0.46~0.70)和阿贝西利联合AI(HR=0.53,95%CI:0.43~0.65)在改善PFS方面的干预效果更好(P<0.05),其余干预措施彼此间差异无统计学意义,见表5。利用P-score比较各治疗方案的优势程度,P-score从小到大排序依次为AI(0.0000)、哌柏西利联合AI(0.5254)、瑞博西利联合AI(0.6361)和阿贝西利联合AI(0.8385),提示阿贝西利联合AI在延长PFS上可能具有一定优势,但差异无统计学意义。OS的网状meta分析结果显示:与单纯AI相比,瑞博西利联合AI(HR=0.76,95%CI:0.63~0.92)和阿贝西利联合AI(HR=0.75,95%CI:0.58~0.97)在改善OS方面的干预效果更好,其余干预措施彼此间差异无统计学意义,见表6。P-score从小到大排序依次为AI(0.0000)、哌柏西利联合AI(0.3312)、瑞博西利联合AI(0.7828)和阿贝西利联合AI(0.7861),提示阿贝西利联合AI在延长OS上可能具有一定优势,但差异无统计学意义。
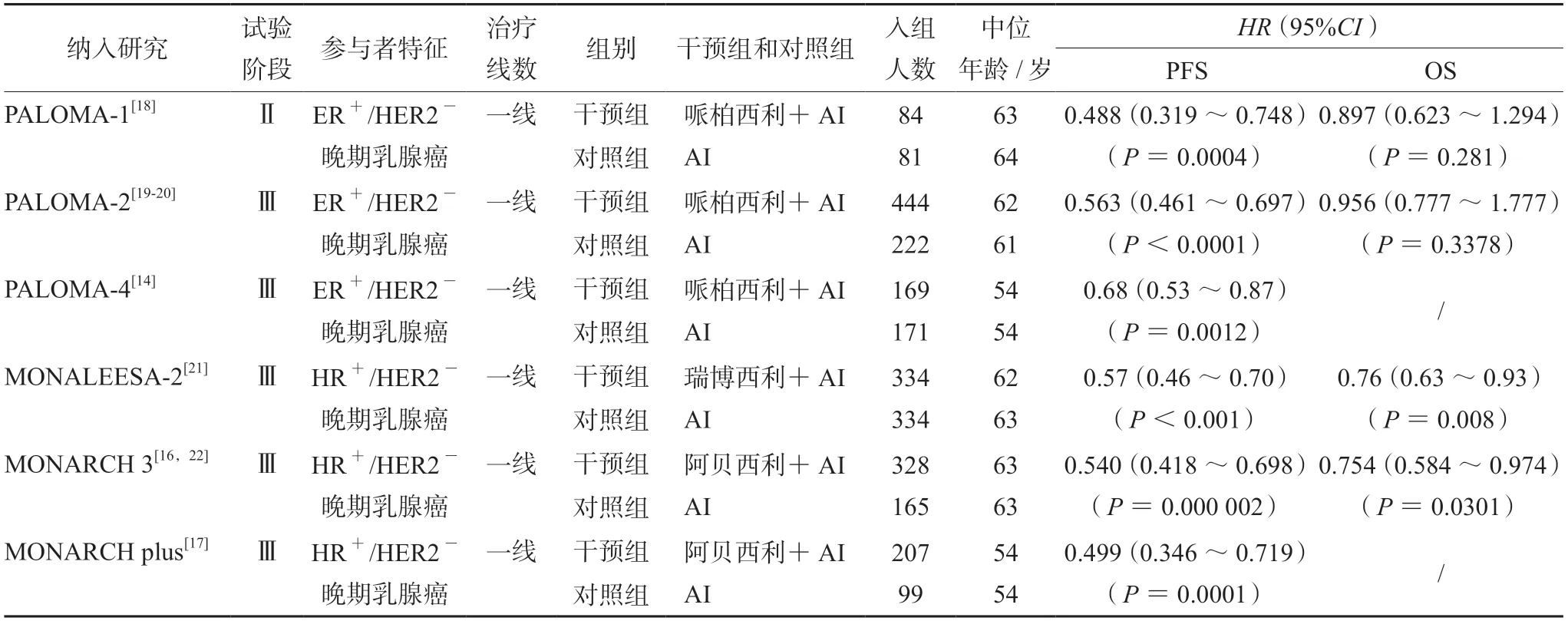
表4 纳入文献有效性基本特征Tab 4 Basic characteristics of included studies on effectiveness evaluation
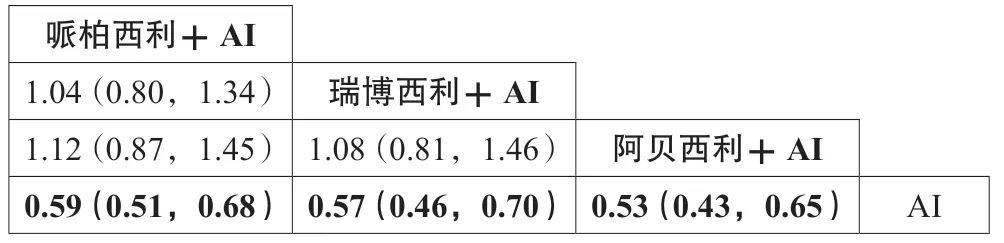
表5 不同方案PFS的网状meta分析结果 [HR(95%CI)]Tab 5 Network meta-analysis of PFS in different therapeutic regimens [HR(95%CI)]
2.2.3 经济性 由于瑞博西利尚未在中国上市,关于瑞博西利在中国的经济性研究困难。我们根据单疗程治疗药品费用比较各干预方案的经济性,参照丁香园Insight数据库提供的价格信息,截至2023年1月20日,检索发现哌柏西利胶囊(爱博新)125 mg价格为13 668元/瓶(每瓶21粒),阿贝西利片(唯择)150 mg医保价格为1190元/盒(每盒14片),来曲唑片(芙瑞)2.5 mg价格为21.14元/盒(每盒10片)。根据说明书用法用量,哌柏西利125 mg每日一次,连服21日之后停药7日;阿贝西利150 mg每日两次;来曲唑2.5 mg每日一次。按照临床研究中28日为一个疗程计算,哌柏西利、阿贝西利联合来曲唑单疗程药品费用分别为13 727元和4819元。而哌柏西利胶囊(爱博新)于2023年3月1日进入医保目录,价格更新为4275.6元每盒(125 mg/粒),单疗程费用降为4334.6元。进一步结合文献报道的单疗程周期间不良反应发生情况与治疗成本费用分析,哌柏西利方案和阿贝西利方案发生率≥5%的3/4级不良事件和3/4级腹泻(发生率<5%),发现单人单疗程周期间阿贝西利方案的3/4级不良事件的治疗费用显著低于哌柏西利方案(201.2元vs319.8元)[23]。另由上市前安全性分析可知,哌柏西利1~4级血液毒性发生率均显著高于阿贝西利,而阿贝西利1~4级腹泻发生率更高。中性粒细胞减少(如聚乙二醇化重组人粒细胞刺激因子注射液3 mg×1支为1670元)的治疗费用相对较高,腹泻的治疗费用相对较低(如盐酸洛哌丁胺 2 mg×6粒/盒约10元)。因此,哌柏西利方案不良反应诊治成本高于阿贝西利。综上,阿贝西利方案单疗程周期间不良反应治疗成本略低于哌柏西利方案。
2.2.4 创新性
① 用药方式:CDK4/6抑制剂联合AI类药物可作为HR+/HER2-晚期乳腺癌一线方案。除此之外,基于MONARCH 1试验结果[24],FDA批准了阿贝西利单药末线治疗既往接受过内分泌治疗与化疗后转移阶段HR+/HER2-乳腺癌患者。因此,阿贝西利是唯一取得单药治疗和联合治疗HR+/HER2-晚期乳腺癌的CDK4/6抑制剂。
② 作用靶点:根据说明书和文献总结发现,阿贝西利的作用靶点较哌柏西利、瑞博西利更广。三种药物都可抑制CDK4、CDK6激酶,但George等[25]研究发现阿贝西利对CDK1、CDK2、CDK5、CDK9、CDK14、CDKs16-18激酶也具有抑制作用。哌柏西利对CDK4、CDK6选择性相近,CDK4参与肿瘤细胞增殖,CDK6能加速造血干细胞增殖,因此哌柏西利的骨髓抑制明显;瑞博西利对CDK4选择性大于CDK6,因此瑞博西利骨髓抑制较为常见,但弱于哌柏西利;阿贝西利对CDK4选择性远大于CDK6,虽然阿贝西利骨髓抑制也较为常见,但弱于哌柏西利,此外,阿贝西利对CDK9等激酶也有一定亲和力,而CDK9参与肠道细胞转录,因此阿贝西利的腹泻发生率远大于哌柏西利和瑞博西利。
③ 专利价值:检索FDA的Orange Book和文献发现,瑞博西利和阿贝西利专利价值高于哌柏西利。哌柏西利化合物核心专利已于2023年1月16日到期,而瑞博西利和阿贝西利化合物核心分别将于2031年11月9日和2029年12月15日专利到期。
④ 技术国产化:检索药融云数据库发现,哌柏西利可促进技术国产化。截至2023年1月20日,国内已有3家药企获得了哌柏西利胶囊仿制药的生产批文,另有10余家药企的仿制药上市申请在审评审批中。除此之外,哌柏西利片也于2022年8月在中国获批上市,国内有两家药企递交了仿制药上市申请。瑞博西利和阿贝西利目前暂无国产仿制药上市申请。
2.2.5 适宜性 在药品适应证和医保方面,结合说明书和国家医保目录发现,阿贝西利国内获批适应证最广;阿贝西利是最先进入医保目录的CDK4/6抑制剂,医保支付范围限HR+/HER2-的局部晚期或转移性乳腺癌,而哌柏西利胶囊也于2023年3月进入医保目录。在药品使用与储存方面,阿贝西利可连续服用,哌柏西利和瑞博西利需间歇给药;除此之外,哌柏西利需随餐服用,但瑞博西利和阿贝西利非必需。三种药品储存条件相似。在药品剂型方面,哌柏西利的剂型更多样,便于患者服用,提高了患者依从性。总体而言,阿贝西利在适宜性方面优于瑞博西利,略优于哌柏西利,详见表7。

表7 适宜性评价指标Tab 7 Evaluation content of suitability indicators
2.2.6 可及性
① 可获得性:咨询药学专业人士和国家医保服务平台发现,阿贝西利的可获得性优于哌柏西利、瑞博西利。哌柏西利和阿贝西利分别于2018年7月和2020年12月在中国获批上市,而瑞博西利目前尚未在国内上市,可获得性较差。以上海为例,截至2023年1月20日,哌柏西利的配备机构包括定点医疗机构7家,无定点零售药店;而阿贝西利的配备机构包括医疗机构30家,定点零售药店8家。
② 可负担性:以年人均用药费用占城镇/农村居民人均可支配收入比作为指标,计算结果显示阿贝西利的可负担性优于哌柏西利。以2022年为例,2022年城镇和农村居民人均可支配收入分别是49 283元和20 133元。哌柏西利联合来曲唑年治疗费用约为178 928元,分别占城镇和农村居民人均可支配收入的363%和889%。阿贝西利联合来曲唑年治疗费用62 819元,分别占城镇和农村居民人均可支配收入的127%和312%。
3 讨论与总结
本研究从多维度开展了哌柏西利、瑞博西利和阿贝西利联合AI方案用于HR+/HER2-晚期乳腺癌一线治疗的临床综合评价,科学建立临床综合评价体系并规范运用网状meta分析等方法,研究结果较为可靠,可为临床用药实践提供参考。
在安全性方面,上市前三种药物的总体不良反应发生率相似,近100%。网状meta分析显示阿贝西利联合AI的3级以上不良反应发生风险最低。三种药物不良反应发生类型基本一致,但各类型的发生率有所差异,哌柏西利和瑞博西利以中性粒细胞减少最为常见,而阿贝西利是腹泻。总体来看,阿贝西利安全性和耐受性良好,优于哌柏西利和瑞博西利。就有效性而言,相对于单纯AI,阿贝西利联合AI和瑞博西利联合AI均可延长PFS和OS,而哌柏西利联合AI仅改善PFS,OS呈数值上延长,但差异无统计学意义。同时,三种治疗方案彼此间差异无统计学意义。在经济性方面,结合安全性分析提示阿贝西利联合来曲唑的药品成本和不良反应诊治费用总额低于哌柏西利联合来曲唑。在创新性方面,阿贝西利的用药方式和作用靶点更多样,哌柏西利目前专利已到期,因此在促进技术国产化方面存在一定优势,瑞博西利的创新性较差。在适宜性方面,阿贝西利药品说明书适应证更广且给药方便,但哌柏西利的药品剂型更多样,瑞博西利适宜性相对较差。在可及性方面,瑞博西利未在中国上市,可及性最差。阿贝西利的药品配备机构数量较多,可负担性优于哌柏西利。综上所述,阿贝西利在各维度均表现良好。
本研究也存在一定局限性:① 缺乏直接比较的大样本真实世界安全性和有效性数据,且信息收集过程有待优化;② 未能构建药物经济性模型,系统分析比较三种方案的成本-效果;③ 未能实时反映哌柏西利和阿贝西利的药品配备率,随着哌柏西利于2023年3月1日正式进入医保目录,届时CDK4/6抑制剂市场格局将会进一步发生改变。

