金星散水提液诱导ECA-109细胞凋亡和氧化应激的作用及机制研究
李博,雷琨,刘家邑,刘军锋*,张珍(.陕西省中医医院,西安 7000;2.陕西中医药大学陕西省中药资源产业化协同创新中心,陕西 咸阳 72046;.北京中医药大学临床医学院,北京 00029)
食管癌(esophageal cancer,EC)是消化系统中常见的恶性肿瘤,主要类型为食管鳞状细胞癌和食管腺癌。据统计,2020年全世界有超过54万人死于食管癌。食管癌发病隐匿,大多数患者发现时已处于中晚期,然而治疗效果相对有限,5年生存率仅20%[1-2]。因此,亟需寻找有效治疗食管癌的药物。
金星散方源于著名中医肿瘤专家贾堃的效验方,由郁金20 g、白矾20 g、火硝20 g、重楼20 g、蟾酥3 g、红硇砂6 g、鸡子壳30 g、料姜石30 g、天南星30 g组成,可攻坚破积、利气止痛、养血健胃、强心滋补、扶正祛邪,增强机体抗病能力,使肿瘤细胞退变、体积缩小以至消失[3-5]。但其是否具有抗食管癌的作用,并不清楚。本研究应用人食管癌ECA-109细胞,探究金星散水提液抗人食管癌的作用及其机制。
1 材料
1.1 细胞
人食管癌ECA-109细胞(广州吉妮欧生物科技有限公司)。
1.2 试药
CCK-8检测试剂盒(货号:BS350A,兰杰柯科技有限公司);Hoechst 33342染料(货号:C1028)、流式细胞术凋亡检测试剂盒(货号:C1062M)(碧云天生物公司);流式细胞术周期试剂盒(货号:WLA010a,万类生物科技有限公司);ROS/Superoxide检测试剂盒(货号:ENZ-51010,美国Enzo Life Sciences 公司);Caspase-3(货号:9662,美国Cell Signaling Technology公司);Nrf2(货号:ab137550,Abcam公司);山羊抗兔二抗、山羊抗鼠二抗(HRP标记,武汉三鹰生物技术有限公司);金星散全部药材由陕西省中医医院药房提供。
1.3 仪器
SW CJ-2FD型超净工作台(江苏苏净集团有限公司);IX73 倒置荧光显微镜(日本奥林巴斯);311型细胞培养箱、Thermo Multiskan GO多功能酶标仪(美国Thermo公司);流式细胞仪(美国BD公司);Western blot曝光仪器Chemi Doc XRS+(美国Bio-Rad公司)。
2 方法
2.1 细胞培养
ECA-109细胞置于含10%血清的1640培养基中(含双抗),37℃、5% CO2饱和湿度培养箱内常规培养。
2.2 金星散水提液(简称JXS水提液)的制备
金星散根据贾堃原方配比由陕西省中医医院药房提供,经张红研究员鉴定符合要求。煎药前先预泡10 min,加水煎煮2次,每次武火烧开,文火微沸40 min,合并煎液、滤过、浓缩、冷冻干燥,获得干药粉末50.92 g(1 g粉末相当于4.1 g药材)。称取10 g干药粉末到41 mL纯化水中,热溶解后离心取上清液,0.45 µm水性膜过滤,即得1 g·mL-1JXS水提液。
2.3 CCK-8测定ECA-109细胞活性
取对数生长期ECA-109细胞,2×104/孔(含1%血清的1640培养基)接种于96孔板内,24 h后换液加药,以不同剂量(0.49~1000 µg·mL-1)或在不同时间(6~48 h)刺激结束时,加10 µL/孔CCK-8检测液,显色后应用多功能酶标仪在450 nm处测定OD,并进行统计分析[6]。
2.4 Hoechst染色
种细胞条件同“2.3”项下,换液加药,以不同剂量(31.25~250 µg·mL-1)或在不同时间(6~48 h)刺激结束后,每孔加入Hoechst 33342染色液(×1000)10 µL,避光37℃ 10 min,荧光显微镜下观察并拍照[7]。
2.5 流式细胞术对ECA-109细胞凋亡和周期的检测
取对数生长期ECA-109细胞,2×106/孔(含1%血清的1640培养基)接种于6孔板内,24 h后换液加药,不同浓度JXS水提液刺激48 h后,每两孔施以相同刺激(保证细胞数量),收集细胞上清液到离心管中,消化贴壁细胞后同样收集细胞混悬液,合并细胞上清液并离心,弃上清液,按照凋亡检测试剂盒说明书规定,加入FITC和PI染料并混匀,室温避光,反应20 min,流式细胞仪检测细胞凋亡情况[8]。
种细胞条件同上,不同浓度JXS 水提液刺激24 h后,收集悬浮和贴壁细胞,按照周期检测试剂盒说明书规定,预冷PBS洗1次,70%乙醇固定,4℃过夜,染色前预冷PBS洗去固定液,加入100 µL RNase A,37℃ 30 min,再加入500 µL PI染色液并充分混匀,4℃避光放置30 min,流式细胞仪检测细胞周期变化[9]。
2.6 ROS/Superoxide染色
种细胞条件同“2.3”项下,加药刺激结束后,按照试剂盒说明书操作,加入ROS和Superoxide检测试剂孵育30 min,Hank’s液200 µL每孔洗2次,最终每孔加100 µL Hank’s液,在荧光显微镜下观察并拍照(绿色染色代表ROS,橙色或红色染色代表Superoxide)。采用荧光酶标仪检测ROS(490 /525 nm)和Superoxide(550 /620 nm)水平,统计并分析[10]。
2.7 Western blot分析
取对数生长期ECA-109细胞,2×105/孔(含1%血清的1640培养基)接种于12孔板内,换液加药,细胞刺激结束后采用强RIPA(含蛋白酶和磷酸酶抑制)提取蛋白,高速离心10 min,取上清液,蛋白定量并调平。经10% SDS-PAGE电泳、转膜、封闭,一抗4℃ 过夜,二抗室温孵育1 h,ECL发光试剂显影,凝胶成像系统拍照。采用Image J软件对条带进行定量分析[11-13]。
3 结果
3.1 JXS水提液抑制ECA-109细胞活性
CCK-8检测结果显示,不同浓度JXS水提液刺激ECA-109细胞48 h后,从3.9 µg·mL-1开始均表现出抑制ECA-109细胞的活性,31.25~1000µg·mL-1抑制率分别为43.52%、56.14%、75.05%、75.46%、74.86%和74.71%(见图1A)(P<0.01),125 µg·mL-1抑制率为75.05%,是最有效的浓度,因此,选择125 µg·mL-1分析其时间依赖性;JXS 水提液125 µg·mL-1刺激ECA-109细胞不同时间,结果显示从12 h开始表现出抑制细胞的活性(P<0.05),24 h和48 h 抑制率分别为30.61%、70.21%(见图1B)(P<0.01),表明JXS水提液显著抑制ECA-109细胞活性且呈剂量和时间依赖性。

图1 JXS水提液对ECA-109细胞活性的影响(±s,n=4)Fig 1 Effect of JXS aqueous extract on the ECA-109 cell viability(±s,n=4)
3.2 JXS水提液诱导ECA-109细胞凋亡
显微镜下观察250 µg·mL-1JXS水提液刺激ECA-109细胞不同时间后的形态学变化,与对照组相比较,JXS水提液刺激后的细胞体积缩小并变圆,细胞间连接消失,与周围的细胞脱离,随着时间的延长该特征细胞逐渐增加,到48 h基本全部发生变化(见图2A)。Hoechst染色结果显示,JXS水提液250 µg·mL-1刺激ECA-109细胞不同时间(6、12、24、48 h),细胞核发生固缩、变形和碎裂,核的形状出现月牙状或碎裂成若干块,与对照组细胞核的均匀蓝色相比发白发亮,随着时间的延长,细胞核的这种变化不断加剧,初步证明JXS水提液诱导ECA-109细胞凋亡呈时间依赖性(见图2B)。给予JXS水提液不同浓度24 h刺激ECA-109细胞后,发现从31.25µg·mL-1开始少量细胞核出现凋亡形态,62.5µg·mL-1大量增加,125和250 µg·mL-1细胞核基本出现凋亡特征,且数量急剧减少(见图2C),推测细胞进入凋亡后期细胞核碎裂,并发生自溶,因此细胞核大量减少,表明JXS水提液诱导ECA-109细胞凋亡呈剂量依赖性。

图2 JXS水提液对ECA-109细胞形态(A)和细胞核Hoechst染色(B和C)的影响(±s,×400)Fig 2 Effect of JXS aqueous extract on the ECA-109 cell morphology(A)and nucleus Hoechst staining(B and C)(±s,×400)
流式细胞术Annexin V/PI 双染法检测结果显示JXS水提液刺激ECA-109细胞24 h后,不同浓度JXS水提液引起细胞膜内磷酯酰丝氨酸蛋白外翻染色阳性而细胞核碘化丙啶染色阴性的细胞数分别为27.8%、30.9%、40.7%、47.5%(见图3A),说明JXS水提液随着浓度的增加,诱导ECA-109细胞凋亡的数量也随之增多,进一步证明JXS水提液诱导ECA-109细胞凋亡。Western blot分析凋亡通路的关键蛋白,发现JXS水提液刺激ECA-109细胞24 h,随着JXS水提液浓度的增加,Caspase-3的表达降低(P<0.01),Cleaved-Caspase-3蛋白水平升高(见图3B~3D)(P<0.05,P<0.01),说明JXS水提液启动Caspase-3介导的凋亡信号通路诱导ECA-109细胞凋亡。

图3 JXS水提液对ECA-109细胞凋亡(A)及相关蛋白表达(B)的影响(±s,n=3)Fig 3 Effect of JXS aqueous extract on the ECA-109 cell apoptosis(A)and related protein expression(B)(±s,n=3)
3.3 JXS水提液阻滞ECA-109细胞周期在G2/M期
流式细胞术检测结果发现,低浓度JXS水提液31.25 µg·mL-1刺激ECA-109细胞24 h后,G0/G1期细胞数量大幅度减少(P<0.01),S期细胞基本不变,G2/M期细胞显著增加(见图4A~4C)(P<0.01),证明JXS水提液将ECA-109细胞周期阻滞在G2/M期。
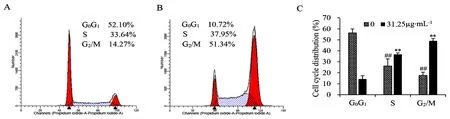
图4 JXS水提液对ECA-109细胞周期的影响(±s,n=3)Fig 4 Effect of JXS aqueous extract on the ECA-109 cell cycle(±s,n=3)
3.4 JXS水提液诱导ECA-109细胞ROS/Superoxide水平升高
ROS/Superoxide染色结果见图5,由图5可知,JXS水提液刺激ECA-109细胞3 h时ROS水平在125和250 µg·mL-1少量升高(P<0.01),6 h时在62.5、125和250 µg·mL-1均显著升高(P<0.01),绿色ROS阳性染色也得出一致的结果;Superoxide检测发现,JXS水提液刺激ECA-109细胞3 h时,Superoxide水平基本无差异,6 h时在62.5、125和250 µg·mL-1均显著升高(P<0.01)。提示ROS水平从3 h时触发,到6 h时大量升高,Superoxide水平在6 h显著升高。综上表明,JXS水提液刺激ECA-109细胞6 h后诱发氧化应激。
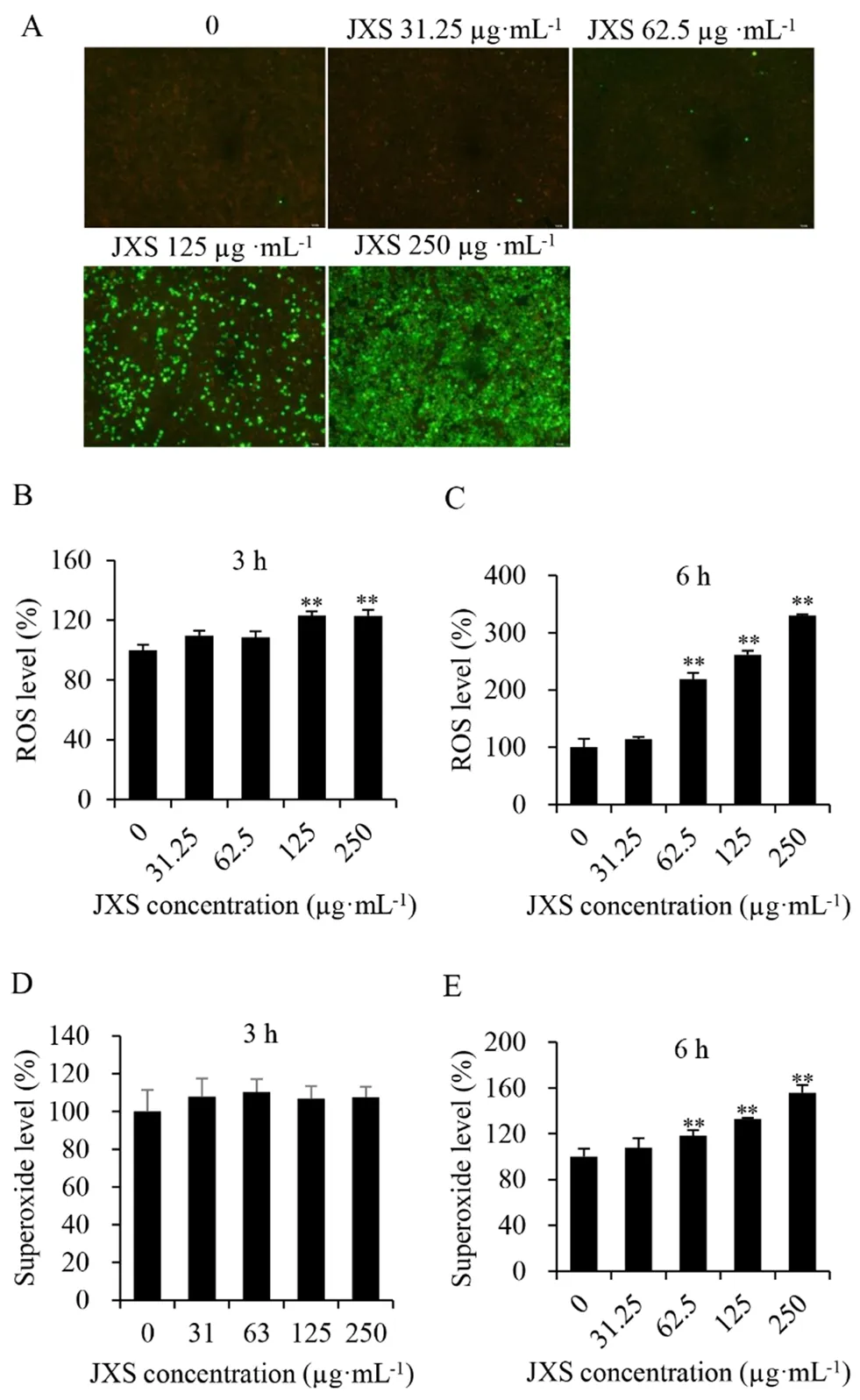
图5 JXS水提液对ECA-109细胞ROS/Superoxide水平的影响(±s,n=4,×100)Fig 5 Effect of JXS aqueous extract on the ROS/Superoxide level in ECA-109 cell(±s,n=4,×100)
3.5 JXS 水提液降低Nrf2蛋白的表达
Western blot蛋白分析结果显示,不同浓度JXS水提液刺激ECA-109 6 h后Nrf2的表达逐渐降低(见图6,P<0.05,P<0.01),而Nrf2是细胞抗氧化系统的关键蛋白,降低Nrf2水平会削弱细胞的抗氧化能力,提示JXS水提液可能是通过降低Nrf2蛋白的表达诱导氧化应激。

图6 JXS水提液对ECA-109细胞Nrf2蛋白表达的影响(±s,n=4)Fig 6 Effect of JXS aqueous extract on the Nrf2 protein expression in ECA-109 cell(±s,n=4)
4 讨论
本研究初步揭示了金星散抗食管癌的作用及机制,发现JXS水提液可诱导ECA-109细胞凋亡,且呈时间和剂量依赖性,并将细胞周期阻滞在G2/M期;JXS水提液诱导ECA-109细胞氧化应激继而下调Nrf2蛋白的表达。其抗食管癌ECA-109细胞的作用,与下调Nrf2诱导氧化应激有关。
细胞凋亡通常不会引发宿主炎症或免疫反应,因此,选择性诱导肿瘤细胞凋亡是潜在的治疗方法[10,14-16]。Caspase家族蛋白在凋亡信号通路中起到关键的作用,起始Caspases蛋白(Caspase-8、Caspase-9及Caspase-10)触发凋亡程序,效应Caspases(Caspase-3、Caspase-6及Caspase-7)引起凋亡发生[17-18]。Caspase-3活化是细胞凋亡的重要标志之一,Caspase-3被切割活化后成为Cleaved-Caspase-3,两者此消彼长[19-20]。本研究发现JXS水提液引起Caspase-3水平下降,Cleaved-Caspase-3水平升高;Hoechst染色表明JXS水提液刺激后细胞核发生皱缩和碎裂,体现出凋亡的细胞核典型特征,流式细胞术进一步验证了JXS水提液抗人食管癌ECA-109细胞的作用。然而,金星散在体内是否仍具有抗食管癌或其他肿瘤的作用,需要进一步的研究来揭示。
细胞周期是指细胞从第一次分裂结束产生新细胞到第二次分裂结束所经历的全过程[21]。肿瘤发生时,肿瘤细胞周期失调并无限增殖,阻滞细胞周期是抗肿瘤治疗的有效手段之一[22]。本研究发现,只有低质量浓度31.25 µg·mL-1JXS水提液将ECA-109细胞阻滞在G2/M期,62.5µg·mL-1G2/M期阻滞作用较低,而125和250µg·mL-1与对照细胞的周期状态基本一致(数据未显示)。可见,JXS水提液在低浓度时可一定程度地阻滞ECA-109细胞的周期,当浓度增大时JXS水提液较大程度地抑制或者直接阻遏了细胞的增殖。
Nrf2作为调控抗氧化应激的一种关键转录因子,在诱导机体的抗氧化应答中起着重要作用[23]。正常情况下,氧化应激发生时,Keap1发生构象变化而失活,解离的Nrf2聚集在细胞核中,激活下游的抗氧化酶,发挥抗氧化作用[24-27]。在肿瘤细胞中,Nrf2通过促进细胞代谢的重新编程加速肿瘤细胞增殖,有助于肿瘤的恶性表现,减少Nrf2激活将有助于肿瘤的治疗[28]。研究发现JXS水提液在加药刺激6 h后引起ECA-109细胞ROS/Superoxide水平显著升高,Nrf2的表达水平显著降低,提示JXS水提液通过下调Nrf2,降低ECA-109细胞的抗氧化能力,这可能是其触发氧化应激诱导ECA-109细胞凋亡的原因。
综上,金星散具有抗人食管癌细胞的作用,推测其机制与下调Nrf2诱导氧化应激有关。

