嗜热毁丝菌裂解性多糖单加氧酶TtLPMO9I 的酶学性质及其功能研究
郑菲 杨俊钊 牛羽丰 李蕊麟 赵国柱
(北京林业大学生物科学与技术学院,北京 100083)
纤维素能够转化为可发酵的糖类,生产出具有重要应用价值的工业产品,这对于解决当今世界面临的环境污染、粮食短缺、饲料资源紧张和能源危机等问题都具有重要的现实意义[1]。传统的纤维素降解酶系能够有效的将木质纤维素资源转化为小分子糖类,因此得到了广泛应用。近年来,研究人员不断挖掘出一些新型的木质纤维素降解辅助酶(auxiliary activities,AA),包括漆酶、过氧化物酶、纤维二糖脱氢酶等[2]。其中,裂解性多糖单加氧酶(lytic polysaccharide monooxygenase,LPMO)是一种氧化裂解酶,可通过氧化裂解的方式破坏纤维素的结构,在纤维素的高效酶解中发挥重要作用[3]。
LPMO 属于铜离子依赖型单加氧酶,通过破坏纤维素、几丁质等多糖的结晶表面,辅助糖苷水解酶对底物的催化,在工业生物质转化过程中具有较高的应用潜力[4]。随着对LPMO 酶资源的挖掘和对催化机制的深入研究,目前LPMO 被归类于CAZy 数据库中的辅助活性蛋白家族AA9-AA11以 及AA13-AA17[5-9]。其 中,真菌源 的LPMO 主要分布在AA9 家族,即LPMO9,具有高活性和广泛的底物谱[8]。例如,来源于梭孢壳属(Thielavia australiensis)的TausLPMO9B 和H2O2共同降解磷酸膨胀纤维素时,促进了底物的裂解[10];来源于黏褶菌属(Gloeophyllum trabeum)的GtLPMO9S 对纤维素、羧甲基纤维素、木葡聚糖等具有较高活性[11]。此外,LPMO 作为辅助活性蛋白,大多都与糖苷水解酶表现出一定的协同作用效果。例如,Agrawal等[12]用来源于曲霉属(Aspergillus terreus 9DR)的LPMO(PMO_08942、PMO_07920)对甘蔗渣/稻草进行预处理可显著提高纤维素酶的糖化率;Müller等[13]将商业纤维素酶与15%的LPMO(TaLPMO9A)混合后,葡萄糖产量提高了31%。
研究发现,LPMO 的催化机制相对比较复杂,在还原剂,如抗坏血酸、还原性谷胱甘肽等和铜离子存在的情况下,从底物糖环上的1 位碳或4 位碳上夺取一个氢原子,同时反向掺入一个氧原子,在水分子的参与下可将底物转变为糖醛酸或二元醇[14-15]。因此,根据生成底物类型可以初步将LPMO 分 为C1 催化酶、C4 催化酶或是C1 和C4共催化酶3 种类型。此外,近期研究还发现部分LPMO 可以氧 化C6 位,但并不 裂解糖苷键[16]。LPMO9 的结构具有高度的保守性,其催化结构由β三明治结构组成,一般包含8-10 个由loop 结构相连的β 折叠[17]。活性位点呈平面结构,活性中心的铜离子由平面中两个保守的组氨酸残基共同稳定,形成组氨酸支架[4]。此外,结合平面附近的芳香族残基对底物的裂解方式具有选择性。例如,Danneels等[18]将来源于红褐肉座菌(Hypocrea jecorina)的LPMO9A 与底物结合平面的芳香族氨基酸残基Y211突变成丙氨酸后,C4 氧化能力增强,C1 氧化能力减弱。
嗜热毁丝菌(Thermothelomyces thermophilus)具有强效降解纤维素的能力,其基因组中除编码多个糖苷水解酶外,还存在大量的LPMO9,目前,仅有少数几个功能被鉴定[19-25],需进一步加深对LPMO9性质及协同效率的研究。本文以嗜热毁丝菌为出发菌株,系统地分析其基因组编码的LPMO9 序列的多样性,筛选出功能未鉴定的LPMO9 序列并进行异源表达,对重组蛋白的功能进行探究,获得新型、高效的LPMO9。此外,本研究还探究了LPMO9 与商品化纤维素酶之间的协同作用效果,为高效降解纤维素提供新的策略,对提高生物质转化效率具有重要意义。
1 材料与方法
1.1 材料
1.1.1 基因和菌株 Ttlpmo9i 基因编码序列由北京睿博兴科生物技术有限公司合成;用于目的基因克隆的大肠杆菌感受态细胞Trans1-T1 购自北京全式金生物技术有限公司;用于构建表达载体的质粒和外源基因表达的pPIC9 和毕赤酵母GS115 购自美国Invitrogen 生命技术有限公司。
1.1.2 主要试剂与仪器 无缝克隆与重组试剂盒、快速凝胶提取试剂盒、PCR 聚合酶2×TransStart®FastPfu Fly PCR SuperMix(-dye),限制性 内切酶FlyCut®Bgl II,FlyCut®EcoR I,和FlyCut®Not I 均购自北京全式金生物技术有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;胰蛋白胨、酵母浸粉购自赛默飞世尔科技公司;羧甲基纤维素钠(CMC-Na)和微晶纤维素购自Sigma-Aldrich;琼脂糖购自Biowest 公司、YNB 购自北京兰博利德生物技术有限公司。不同量程的移液器购自艾本德公司;PCR 仪、核酸电泳仪、蛋白电泳仪、凝胶成像仪均购自伯乐生命医学产品有限公司;培养箱购自上海一恒科学仪器有限公司;分子过滤膜包购自赛多利斯科学仪器(北京)有限公司;M200 PRO 多功能酶标仪购自帝肯Tecan 上海贸易有限公司;ÄKTA Pure蛋白纯化仪购自思拓凡Cytiva。
1.2 方法
1.2.1 生物信息学分析 在CAZy(http://www.cazy.org/)和NCBI(https://www.ncbi.nlm.nih.gov/)数据库中获取LPMO 的序列信息;使用在线网站ExPASy-ProtParam tool(https://web.expasy.org/protparam/)对蛋白的理论分子量、等电点进行分析;使用在线网 站SignalP 6.0(https://services.healthtech.dtu.dk/services/SignalP-6.0/)对蛋白的信号肽进行预测;使用在线网站NetOGlyc 4.0(https://services.healthtech.dtu.dk/service.php?NetOGlyc-4.0)预测蛋白O-糖基化位点;利用BLASTp(Basic Local Alignment Search Tool protein)对蛋白序列进行同源性分析;利用MEGA11 将LPMO9 已解析出晶体结构的C1 催化酶:TtGH61E(Thermothielavioides terrestris,PDB ID:3EII)、PcLPMO9D(Phanerochaete chrysosporium,PDB ID:4B5Q);C4 催化酶:NcLPMO9C(Neurospora crassa,PDB ID:4D7U)、NcLPMO9D(N.crassa,PDB ID:4EIR);C1/4 催化酶:TaLPMO9A(Thermoascus aurantiacus,PDB ID:2YET)、NcLPMO9M(N.crassa,PDB ID:4EIS)蛋白氨基酸序列与嗜热毁丝菌LPMO9 蛋白进行多序列比对并构建系统发育树;利用Smart 在线网站(http://smart.embl-heidelberg.de/)对蛋白质的结构域进行预测;利用SWISSMODEL(https://swissmodel.expasy.org/),以来源于大丽轮枝菌(Verticillium dahlia)的A0A2J8EXP9 为模板对蛋白质进行同源建模,将TtLPMO9I 序列相似度为67.11%的NcLPMO9C 中的铜叠加到TtLPMO9I蛋白模型上。LPMO 的命名参考Berka 等[26]的报道。Pymol(https://pymol.org/2/)用于模型结构的可视化和制图。
1.2.2 基因的克隆 将去除信号肽后的TtLpmo9i 编码基因重组至pPIC9 表达质粒的EcoR I/Not I 克隆位点处,然后转化到大肠杆菌Trans1-T1 细胞中。利用3'AOX 和5'AOX 通用引物进行菌落PCR,验证阳性克隆子并测序。将测序正确的阳性克隆子转接到LB培养基(体积质量分数为0.5%酵母浸粉,1%胰蛋白胨,1%氯化钠)中,37℃过夜培养后提取重组质粒pPIC9-Ttlpmo9i。
1.2.3 蛋白的表达与纯化 用限制性内切酶Bgl Ⅱ线性化处理重组质粒pPIC9-Ttlpmo9i,通过电击转化至毕赤酵母感受态细胞,涂布在固体MD 培养基(体积质量分数为1.5%琼脂糖,2%葡萄糖,灭菌后加入体积质量分数为1.34% YNB,4×10-5%生物素)上。30℃倒置培养48 h 后,在MD 培养基中挑选24个单克隆,培养在3 mL BMGY(体积质量分数为0.5%酵母粉,1%胰蛋白胨,体积分数为0.5%甘油,经121℃高温灭菌20 min 后加入体积质量分数为1.34%YNB,4×10-5%生物素)培养基中。在30℃,200 r/min 条件下培养48 h 后,收集细胞并重新悬浮于1 mL 的BMMY(体积质量分数为0.5%酵母粉,1%胰蛋白胨,经121℃高温灭菌20 min 后加入体积质量分数为1.34% YNB,4×10-5%生物素,体积分数0.5% 甲醇)诱导培养基中。在30℃,200 r/min 条件下诱导表达72 h 后,以12 000 r/min 离心10 min收集上清液,并通过基质辅助激光解吸飞行时间质谱仪(MALDI-TOF)和SDS-PAGE 筛选出重组蛋白。将筛选出阳性克隆子接种至30 mL YPD 液体培养基(体积质量分数为1%酵母浸粉,2%胰蛋白胨,2%葡萄糖)中,30℃,200 r/min 培养48 h 后,以体积分数 0.5%的接种量接种至400 mL BMGY 液体培养基中。30℃,200 r/min 培养48 h 后,收集菌体转移至200 mL BMMY 诱导培养基中,继续诱导培养48 h,每隔24 h 补加一次甲醇(体积分数0.5%)。48 h 后收集上清液,利用10 kD 膜包浓缩至15 mL 体积后进行脱盐处理。然后加入到平衡后的HiTrap QXL 阴离子交换层析柱中,在10 mmol/L 的pH 8.0 的Tris-Hcl 缓冲液中,使用0-1 mol/L NaCl 进行线性梯度洗脱,收集相应的峰所对应的蛋白并进行酶活性的测定和SDS-PAGE 分析。
1.2.4 酶活力的测定 将含有体积质量分数1%CMC-Na、3 μmol/L 酶液、1 mmol/L 抗坏血酸和0.1 mmol/L CuSO4的反应体系在特定条件下培养6 h,后采用DNS 法检测反应过程中还原糖的释放量来测定LPMO 的活性。以葡萄糖为标准建立校正曲线。酶活定义为:在酶的最适条件下,每分钟产生1 μmol还原糖所需的酶量为1 个单位(U)。
1.2.5 酶学性质分析
1.2.5.1 不同浓度抗坏血酸对酶活性的影响 以10 mg/mL CMC-Na 为底物,取3 μmol/L TtLPMO9I,0.1 mmol/L CuSO4,以不同浓度抗坏血酸(0、0.1、1、10 mmol/L)在50℃,pH 5.0 的条件下处理12 h。在各浓度抗坏血酸反应体系中,以沸水浴10 min 灭活后的TtLPMO9I 作为实验对照,每组3 次重复,计算不同浓度抗坏血酸条件下还原糖的产生量并绘制柱形图。
1.2.5.2 最适温度和温度稳定性的测定 在不同温度(40-80℃)和酶的最佳pH 值下确定酶的最适温度。将最大酶活值设定为100%,计算相对酶活。取3 μmol/L 酶分别在60℃、70℃和80℃下处理4 h、8 h 和12 h,在最佳条件下测定剩余酶活力。未处理酶液的初始酶活定义为100%,计算各时间点和温度点下的相对酶活值并绘制温度稳定性趋势图。
1.2.5.3 最适pH 及pH 稳定性的测定 在不同pH值(pH 3.0-7.0:100 mmol/L 柠檬酸-磷酸氢二钠缓冲液;pH 8.0-9.0:100 mmol/L Tris-HCl 缓冲液;pH 10.0:甘氨酸-NaOH)和酶的最佳温度下测定酶的最适pH 值。将最大酶活值设定为100%,计算相对酶活,绘制最适pH 趋势图。将酶在pH 6.0-8.0、37℃条件下孵育4、8、12 h 后,在最佳条件下测定剩余酶活性。以初始酶活定义为100%,计算各时间点和pH 条件下的相对酶活值并绘制pH 稳定性趋势图。
1.2.6 TtLPMO9I 与商业酶的协同作用 分别以20 mg/mL 预处理玉米秸秆、10 mg/mL 微晶纤维素为底物,将50、100、200 μg TtLPMO9I 在50℃、pH 5.0的条件下与适当稀释的商业酶(Novozymes 188)分别对预处理玉米秸秆、微晶纤维素进行协同酶解,反应时间为12 和24 h。以单独添加各浓度TtLPMO9I 和单独添加纤维素酶的反应作为对照。将反应后的体系进行离心,取上清液,采用DNS 法测定还原糖含量,并计算TtLPMO9I 与商业酶作用的还原糖增长率与协同度。

预处理玉米秸秆的制备:取10 g 玉米秸秆,用100 mL 1%(W/V)NaOH 溶液在121℃下处理1 h;用蒸馏水洗涤至中性,并通过120 目滤网过滤收集;在烘箱中干燥24 h 备用。
2 结果
2.1 生物信息学分析
从CAZy 数据库中获得嗜热毁丝菌基因组序列,分析编码LPMO9 的22 个蛋白氨基酸序列(表1)。结果显示,这些氨基酸数目和相对分子质量分别在151-444 aa 和16.2-46.6 kD 之间。对蛋白结构域进行分析显示,仅有4 个LPMO(LPMO9B、AEO54509.1、MtLPMO9、LPMO9I)在催化结构域的C 端存在一个碳水化合物结合结构域(CBM)。图1为该菌株LPMO9 家族成员与同家族已解析出晶体结构的LPMO 系统发育树结果图,由图可知,按照底物切割方式可分为3 类,大部分集中在C1/C4 催化酶的分类中。

图1 嗜热毁丝菌AA9 家族LPMO 蛋白系统发育树分析Fig.1 Phylogenetic tree of LPMO proteins in the AA9 family of T.thermophilus

表1 嗜热毁丝菌AA9 家族LPMO 蛋白性质预测Table 1 Protein property prediction of the LPMO AA9 family from T.thermophilus
本研究的核心材料TtLPMO9I(GenBank Accession No.: AEO56416.1)核苷酸序列全长为921 bp,编码了306 个氨基酸,前15 个氨基酸为信号肽序列,去除信号肽后的成熟蛋白理论分子量为29.9 kD,等电点为5.81。多序列比对结果显示(图2-A),TtLPMO9I 包含了大多数LPMO9 的保守氨基酸残基,如H1、H84、H156、G163、Q165、Y167、Y205。其中,H1 和H84,Y167 是主要的铜离子结合位点,构成TtLPMO9I 的活性中心。
图2-B 为SWISS-MODEL 同源建模得到的TtLPMO9I 模拟结构。预测结果表明,TtLPMO9I 为双结构域蛋白,包含一个由226 个残基组成的催化结构域(H1-I226),在蛋白C 端存在一个由34 个氨基酸残基组成的CBM1(P258-P291)。TtLPMO9I 的催化结构域具有8 个β 折叠片,形成β 三明治结构。前组由β1、β3、β6 组成,另一组由β4、β7、β8 组成。β2 参与两组β 折叠的形成,每个β 折叠片相互叠加、包裹形成蛋白质的核心。CBM1 结构域则由β9和β10 与连接两个折叠片的loop 区构成。TtLPMO9I的活性位点呈平面结构,铜离子与H1(3.0 Å)和H84(2.2 Å)的侧链和H1 的氨基末端的氮原子(3.5 Å)相连形成一个“T 型”结构的组氨酸支架,并且两个组氨酸与Y167 的侧链酚基(2.8 Å)与铜离子之间的相互作用,共同稳固了铜离子,对底物的催化具有重要作用。在催化结构域中,有3 个loop 区(L2 loop:L17-I50;LS loop:G115-G131;LC loop:G177-I226)共同参与形成TtLPMO9I 的催化平面,其中,LS loop 中的G119 与LC loop 中的G214-G215之间可形成疏水作用,维持蛋白的稳定。
2.2 TtLPMO9I的表达和纯化
SDS-PAGE 结果(图3-A)显示,TtLPMO9I 的表观分子量大于其理论分子量(TtLPMO9I:31.4 kD)。经网站预测,其包含3 个O 糖基化位点(S227、S229、S231),均位于两个结构域之间的连接区。这可能是造成表观分子量大于理论分子量的原因之一。为进一步确认表达的蛋白是否为目的蛋白,将表达纯化的TtLPMO9I 通过MALDI-TOF 进行质谱分析(图3-B)。如图所示,共有8 段肽段序列与目标蛋白的理论序列匹配,蛋白序列的覆盖度为24.4%,因此能够确定纯化后的蛋白即为目的蛋白,可将该蛋白进行后续的研究。
图3 重组蛋白TtLPMO9I 的验证Fig.3 Validation of the recombinant protein TtLPMO9I
2.3 TtLPMO9I酶学性质分析
2.3.1 不同浓度抗坏血酸对TtLPMO9I 活性影响 由于LPMO 通过氧化裂解的方式作用于纤维素底物,在加入抗坏血酸、还原性谷胱甘肽等还原剂的条件下可显著提高反应效率。由图4 可知,当抗坏血酸终浓度为1 mmol/L 时,TtLPMO9I 的还原糖产生量达到最高值(579 ± 9)mg/L,较不加抗坏血酸时增加84%,显著提高了TtLPMO9I 的催化活性。
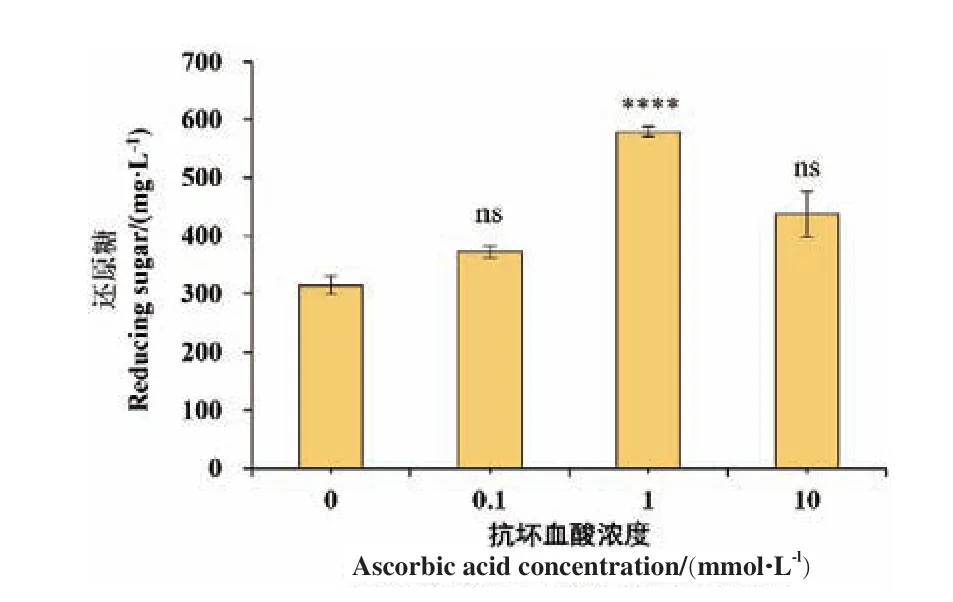
图4 抗坏血酸对TtLPMO9I 酶活性的影响Fig.4 Effect of ascorbic acid concentration on the enzyme activity of TtLPMO9I
2.3.2 最适温度及温度稳定性分析 在pH 5.0 条件下测定TtLPMO9I 在不同温度(40-80℃)下的酶活力,由图5-A 可知,TtLPMO9I 的最适温度为60℃,在50-70℃之间的酶活力均在80%以上,对温度的耐受性较好。将TtLPMO9I 分别在60-80℃下分别孵育4、8、12 h,检测其剩余酶活力(图5-B)。结果表明,TtLPMO9I 在60℃条件下孵育4、8、12 h 后,其剩余酶活随孵育时间延长逐渐降低,处理12 h 后剩余酶活为54%。TtLPMO9I 在70℃孵育8 h、80℃孵育4 h 条件下,其剩余酶活降为0。
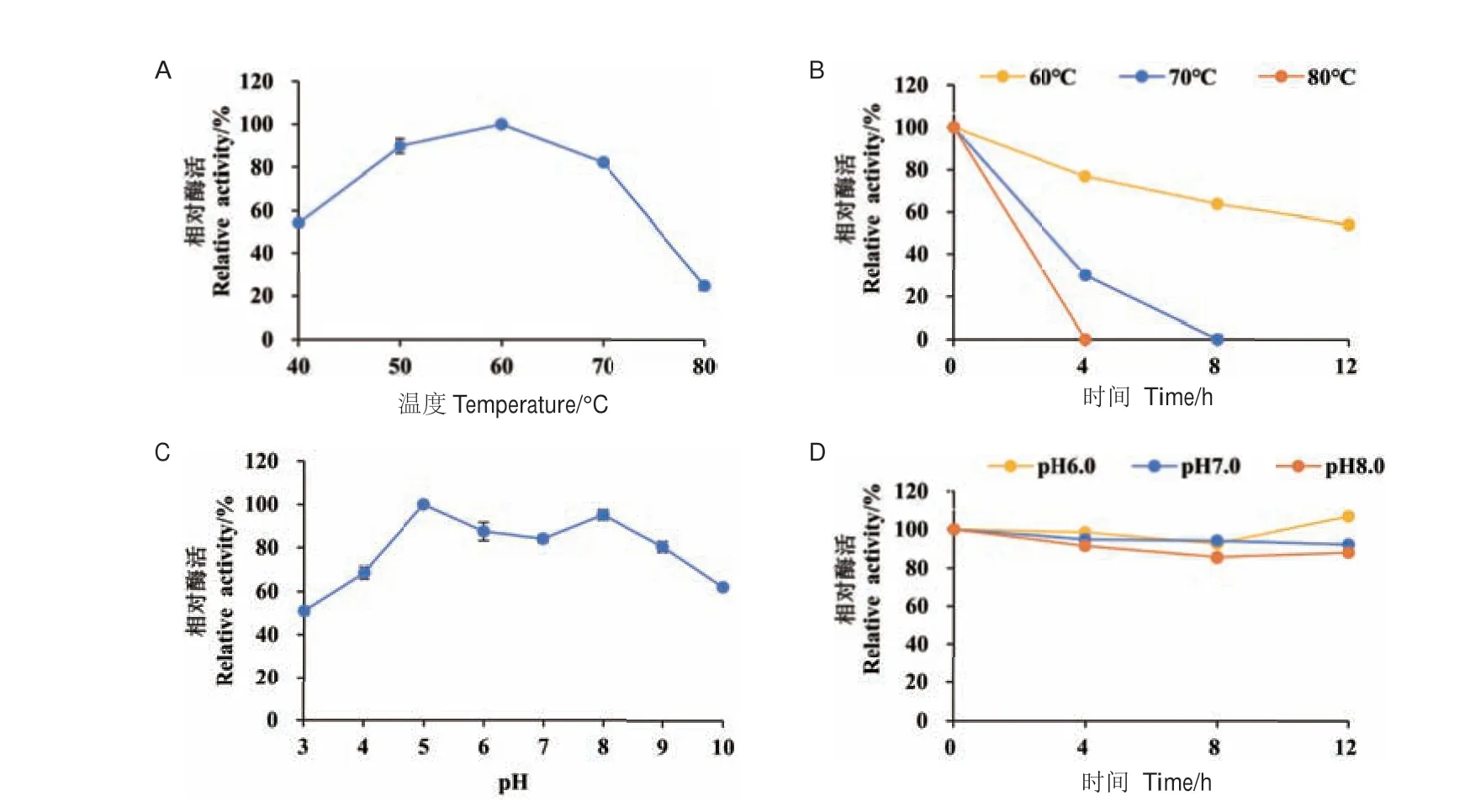
图5 TtLPMO9I 的酶学性质Fig.5 Enzymatic properties of TtLPMO9I
2.3.3 最适pH 及pH 稳定性分析 在pH 3.0-10.0范围内 测定最 适pH 值(图5-C)。TtLPMO9I 在pH 5.0 达到酶活最高值,在pH 5.0-9.0 相对酶活均保持在80%以上,说明其对pH 耐受性的范围较广。此外,TtLPMO9I 在pH 6.0-8.0 条件下孵育12 h 后,其相对酶活均在80%以上,表明TtLPMO9I 具有良好的pH 稳定性(图5-D)。
2.4 TtLPMO9I与纤维素酶在反应中的协同效应
由图6-A-B 的结果图显示,添加不同量的TtLPMO9I 后,与纤维素酶协同降解玉米秸秆所产生的还原糖增加了34%-142%,根据1.2.6 协同度计算公式得到协同度在1.14-2.10 之间。当以玉米秸秆为底物时,在反应体系中分别添加50、100、200 μg的TtLPMO9I 和100 μL 稀释后的纤维素酶,反应12 h 后体系中的还原糖含量与未添加TtLPMO9I 相比分别增加了34%、70%、99%,协同度为1.14、1.36、1.51。反应24 h 后协同产糖量较未添加TtLPMO9I 增加了45%、102%、142%,协同度分别为1.20、1.73、2.10。由以上数据可知,在降解玉米秸秆过程中,还原糖产量和协同度随反应时间及TtLPMO9I 浓度的增加而增加。在纤维素酶中添加200 μg TtLPMO9I 反应24 h,还原糖增加量和协同度达到最大值。

图6 TtLPMO9I 与纤维素酶(Novozymes 188)降解玉米秸秆、微晶纤维素的协同反应Fig.6 Synergistic reaction between TtLPMO9I and cellulase(Novozymes 188)for the degradation of pretreated corn straw and Avicel
此外,在降解微晶纤维素的过程中,TtLPMO9I与纤维素酶也表现出协同作用效果,但还原糖的增加量与协同度均低于玉米秸秆,分别为6%-46%和0.92-1.24(图6-C-D)。在反应体系中分别添加50、100、200 μg 的TtLPMO9I 和100 μL 稀释后的纤维素酶,反应12 h 后还原糖含量较未添加TtLPMO9I 增加了11%、38%、46%,协同度为0.92、1.20、1.24。反应24 h 后,较未添加TtLPMO9I 的还原糖增加量分别为6%、15%、18%,协同度为0.96、1.04、1.05。
3 讨论
LPMO9 分布广泛,大多数来源于真菌,如在构巢曲霉(Aspergillus nidulans)基因组中编码9 个LPMO9 基因[27];柄孢霉(Podospora anserina)基因组中编码33 个LPMO9 基因[28];粗糙脉孢霉(Neurospora crassa)基因组中编码14 个LPMO9 基因[29],这些真菌均具有良好的木质纤维素降解能力,因此,推测LPMO 在降解木质纤维素过程中扮演着重要角色。嗜热毁丝菌基因组中也编码了大量的木质纤维素降解酶基因,是潜在的高效中高温酶库[26]。测序结果显示,嗜热毁丝菌基因组中共编码22 个LPMO9 蛋白的基因[26],目前,仅有7 个被报道[19-25]。本研究基于已报道的嗜热毁丝菌基因组序列,挖掘其中未鉴定的TtLPMO9I,探究其功能,丰富LPMO9 酶资源库。此外,选择工业应用中常见的商业纤维素酶与TtLPMO9I 进行协同作用,探究协同作用效果,优化酶资源的复配方案,从而提高生物质的转化效率。
生物信息学分析表明,TtLPMO9I 是一类双结构域的LPMO,在催化结构域的C 端包含了一个CBM1结构域。研究发现,大约30%的LPMO 含有非催化性的CBM[30],CBM 在结合纤维素底物并增强催化效率方面具有重要作用[31]。通常,双模块LPMO9的催化结构域在N 端,因为N 末端的组氨酸可与铜结合,对活性至关重要,C 端含有第一家族非催化性CBM,可与纤维素中的结晶区结合[32]。Agrawal等[12]通过比较单结构域LPMO 和含有CBM1 的双结构域LPMO 的酶学性质发现,双结构域的LPMO有更加广泛的底物谱,其对纤维素和木聚糖均表现出明显的活性。综上所述,CBM 的存在可以加强LPMO 和底物的结合能力,有利于增加可溶性产物的释放。
酶学性质结果显示,纯化的TtLPMO9I 蛋白在60℃,pH 5.0 时具有最高活性,在pH 5.0-9.0 范围内活性在80%以上,这与大多数LPMO9 性质相似,均在50-60℃和pH 4.0-6.0 的范围内表现出较高的酶活性[12,33-34]。此外,TtLPMO9I 具有良好的热稳定性,在60℃条件下处理12 h,剩余酶活为54%。然而,在相同温度条件下,来源于灰霉菌的flLPMO处理20 min,酶活完全丧失[35];来源于黄孢原毛平革菌的PMO_08942 和PMO_07920 最适温度均为50℃,温度升高催化活性急剧下降[12]。综上,TtLPMO9I可以长时间抵抗高温环境,具有商业应用的潜力。
LPMO 是一类新型的木质纤维素降解辅助酶,通过氧化作用裂解糖苷键,使木质纤维素的结构更加松散,有利于糖苷水解酶降解底物,达到协同效果。例如Dimarogona 等[36]证明LPMO StCel61a 和纤维素酶Celluclast 的比例为1∶2 时,对云杉的降解效率提高了42%;Bulakhov 等[37]将3 种LPMO9 分别与纤维素酶进行协同降解微晶纤维素底物,与纤维素酶单独降解相比,协同作用后的还原糖产量提高了17%-31%;Li 等[34]将PdLPMO9A 与纤维素酶共同作用在玉米秸秆上,还原糖产量比PdLPMO9A与纤维素酶单独降解产生还原糖量高29.9%。本研究中,TtLPMO9I 促进纤维素降解效果较为显著。当200 μg TtLPMO9I 添加到商业酶中处理玉米秸秆,产糖效率和协同度随反应时间的增加而增加,反应24 h 后,产糖量较未添加时增加142%,其协同作用效果较其他材料具有突出的优势。此外,Harris 等[38]发现,GH61 蛋白(现已归类于LPMO)对纤维素酶活性的促进作用仅发生在木质纤维素底物上,而不是纯纤维素底物。有研究报道,LPMO 发挥功能需要电子供体,除可以外加抗坏血酸等还原剂外,底物中的木质素也可以提供电子,并且激活LPMO 的能力与木质素预处理的水平有关[39]。本研究以玉米秸秆为底物时,TtLPMO9I 与纤维素酶的最大协同度达到2.10,而以纯纤维素类底物—微晶纤维素为底物时,最大协同度仅为1.24。由此推测,TtLPMO9I与纤维素酶的协同效果可能与底物的组成有关。
4 结论
本研究从嗜热毁丝菌基因组中获得了一个新型的氧化裂解酶TtLPMO9I 的编码基因并成功进行了异源表达。酶学性质检测发现TtLPMO9I 的pH 稳定性和温度稳定性较好,并且与纤维素酶表现出良好的协同作用效果,显著提高还原糖的产生量。本研究丰富了AA9 家族LPMO 的酶资源库,可以为木质纤维素的高效降解提供新的材料。

