蛋白质翻译后修饰之间的互作关系及其协同调控机理
陈艳梅
(中国农业大学生物学院 植物抗逆高效全国重点实验室,北京 100193)
蛋白质是由核糖体合成并发挥重要功能的生物大分子。蛋白质在整个生命周期中会经历多种翻译后修饰(post-translational modification,PTM),这些修饰影响蛋白质的构象、活性、稳定性、定位和相互作用等[1-2]。据统计,细胞中有约450 种不同的翻译后修饰,而模式植物拟南芥(Arabidopsis thaliana)基因组编码的蛋白质中,约1 000 个蛋白质会同时被至少两类不同的翻译后修饰调控[3-4]。植物细胞中常见的翻译后修饰,例如,磷酸化(phosphorylation)、泛素化(ubiquitination)、类泛素化(sumoylation)、乙酰化(acetylation)、糖基化(glycosylation)、肉豆蔻酰化(myristoylation)等[1,5]。翻译后修饰可发生在蛋白质氨基酸的侧链、C 端或N 末端上,它们通过修饰现有的官能团或引入新的官能团来扩展其分子功能。翻译后修饰和去修饰是个可逆的过程,通常由一系列特定的酶催化完成,统一命名为“书写器”(writer)和“擦除器”(eraser)[6]。例如,蛋白激酶(kinase)、泛素连接酶(ubiquitin ligase)和类泛素连接酶(SUMO ligase)具有“书写器”的功能;而磷酸酶(phosphatase)、泛素酶(ubiquitin protease)和类泛素酶(SUMO protease)具有“擦除器”功能。这类酶有底物特异性,可分别针对底物蛋白的特定氨基酸残基添加和移除修饰。近年来,植物生物学研究领域探讨得较多的翻译后修饰有蛋白质磷酸化、泛素化和类泛素化。磷酸化是由蛋白激酶催化磷酸基团到底物的特定氨基酸位点,如苏氨酸(Ser)、丝氨酸(Thr)或酪氨酸(Tyr)残基上来实现。泛素化是泛素在三类酶(包括E1 泛素激活酶、E2 泛素偶联酶和E3 泛素连接酶)的依次催化下形成复合体,最终把泛素共价结合到靶蛋白上的过程[7]。类泛素化与泛素化相似,是类似于泛素的蛋白(small ubiquitin-like modifier,SUMO)在一系列酶的催化下共价结合到底物蛋白上的过程。
在细胞中,任意两个或多个不同翻译后修饰会发生串扰作用(PTM crosstalk)。翻译后修饰之间的串扰作用有两类分子模式:(1)不同修饰通过调控同一个底物蛋白而发生互作关系,这种模式下,有些氨基酸被修饰后会影响同一个氨基酸位点或者相邻氨基酸的其他修饰,并协同调控所修饰的蛋白质分子功能(图1-A);(2)多个具有“书写器”或者“擦除器”功能的酶依次以对方作为底物,通过添加修饰或去除修饰而改变酶活性,并形成正调控或反馈调节环而发挥功能(图1-B)[7-9]。
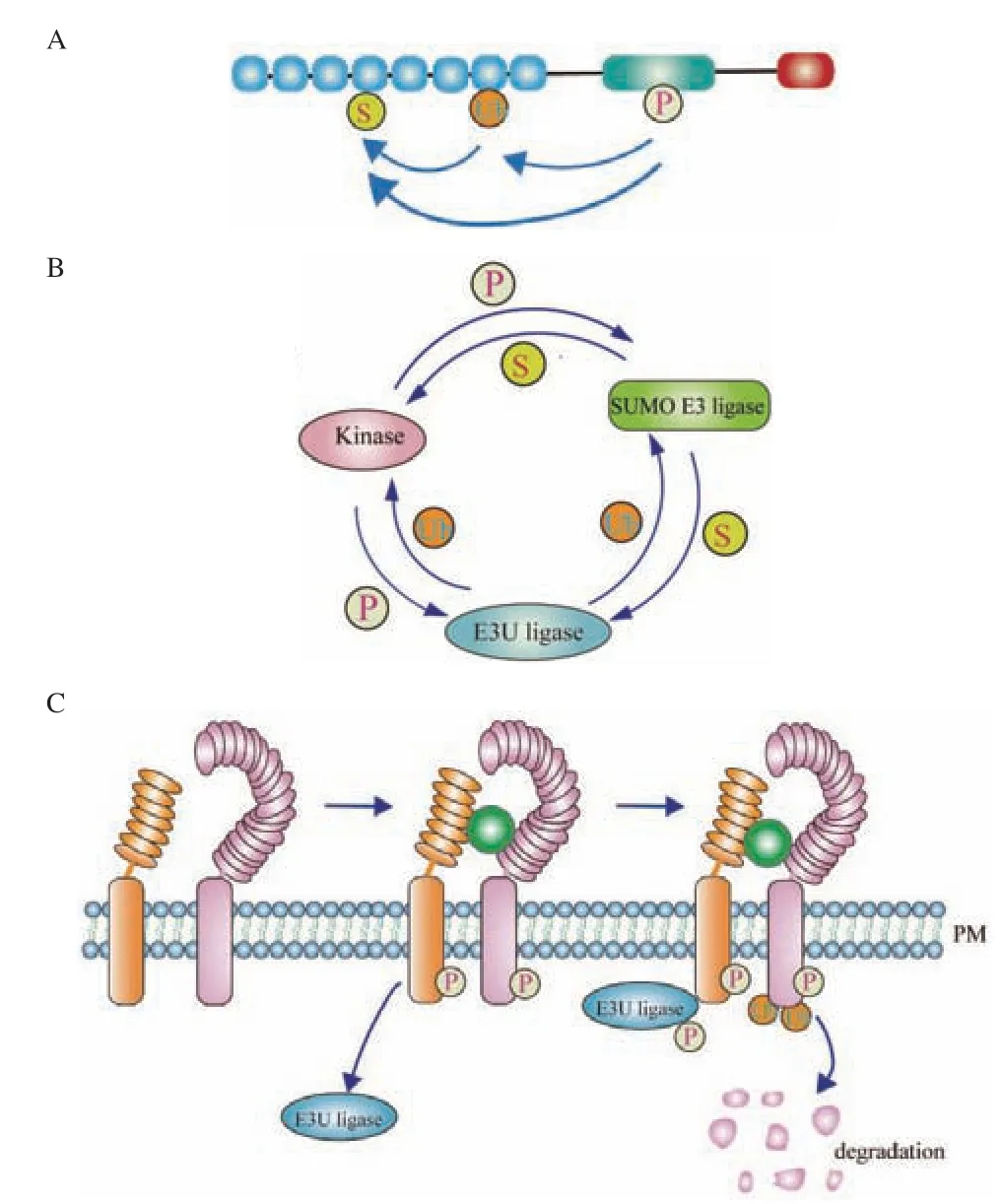
图1 “磷酸化-泛素化-类泛素化”之间的串扰调控机制Fig.1 Crosstalk and interaction among “Phosphorylationubiquitination-sumoylation”
蛋白质翻译后修饰之间的这种串扰作用在植物生长发育和应对外界环境胁迫时具有重要的调控功能[7,10-11],但由于翻译后修饰具有高度复杂性和动态性等特征,导致解析其分子机制难度较大[12]。目前,植物细胞中关于不同翻译后修饰之间串扰调控模式的分子机理研究还处于起步阶段,本文概述磷酸化、泛素化和类泛素化三类重要的翻译后修饰之间的协同调控机制以及它们的特征和分子功能。
1 “磷酸化与泛素化修饰”调控模块
植物细胞中有大量基因编码蛋白激酶[13],磷酸酶[14]和泛素连接酶[15],说明磷酸化和泛素化修饰在植物生长发育中的重要生物学功能,本节分4 部分讨论这两种修饰在细胞中如何发挥协同调控作用。
1.1 磷酸化介导的降解途径
有些蛋白质被磷酸化修饰后会进一步诱导泛素化作用,并通过顺式调控的方式引起底物蛋白降解,这个过程称之为“磷酸化降解”(phosphodegron)[16]。这个过程通常是由底物蛋白上一个特定磷酸化基序(phospho-motif)作为泛素连接酶的锚定位点,当基序被磷酸化后会诱导泛素连接酶与之结合,并启动泛素化过程介导的降解作用。例如,拟南芥铁离子转运蛋白IRT1(iron-regulated transporter 1)会被磷酸化降解机制调控[17]。研究发现,IRT1 除了转运铁离子外,当细胞内其他金属离子浓度过高时也会转运外排以避免细胞损害。这种外排机制通常是由IRT1 转运体蛋白的胞质区一段富含组氨酸的结构结合重金属离子,从而招募CBL(calcineurin B-like protein)互作激酶CIPK23(CBL-interacting protein kinase 23)来磷酸化附近的几个丝氨酸和苏氨酸残基[17]。IRT1 磷酸化后提供一个E3 泛素连接酶IDF1(IRT1-degradation factor 1)的结合区域,IDF1 泛素化IRT1 的两个赖氨酸位点,从而诱导IRT1 的胞吞作用并使其降解。后续研究表明,cipk23 突变后植株会大量表达IRT1 并呈现重金属离子敏感表型,说明CIPK23 介导的磷酸化途径在“磷酸化-泛素化”信号通路中具有核心调控作用[17]。
E3 连接酶对底物的招募依赖于“磷酸化-去磷酸化”过程。例如,黑暗中生长的植物见光过程中会诱导转录因子PIF3(phytochrome-interacting factor3)的多个位点磷酸化,并促进PIF3-EBF1/2与SCF 核心组分结合以形成SCFEBF1/2复合体,再进一步诱导PIF3 的泛素化和降解,从而调控光形态建成[18]。
磷酸化也会抑制E3 泛素连接酶和底物蛋白之间的相互作用,这个过程可称为“磷酸化抑制的降解途径”。该过程可被磷酸酶反转,在磷酸酶的作用下,底物蛋白被去除磷酸化修饰后即会发生泛素化过程。ABA 和赤霉素信号通路中便涉及到这种调控机理。
1.2 磷酸化修饰在E3泛素连接酶及其与底物蛋白互作中的调控作用
E3 泛素连接酶磷酸化后可激活其与底物之间的相互作用。例如,拟南芥14-3-3 蛋白结合E3 连接酶ATL31 后会诱导ATL31 的C 端4 个氨基酸位点依次磷酸化[19]。而且,这两个蛋白之间的互作对于ATL31 的泛素化及其诱导的14-3-3 蛋白质降解具有决定作用[20]。在高碳低氮条件下,拟南芥ATL31至少有一个氨基酸残基(如Thr209)会被CIPK 激酶磷酸化[21]。研究还发现,CIPK 介导的这种磷酸化机制会被钙离子进一步增强,表明钙信号和碳/氮营养之间存在一定的调控机制[21]。
E3 泛素连接酶的磷酸化也可以弱化其与底物之间的互作。赤霉素信号通路中3 个关键调控蛋白涉及到这种调控机制,包括TAGK2 激酶、E3 泛素连接酶GARU(GA receptor ring E3 ubiquitin ligase)和赤霉素受体GID1(GA insensitive dwarf1)[22]。研究发现,酪氨酸激酶抑制剂genistein 能影响TAGK2 激酶介导的GARU 蛋白的酪氨酸磷酸化,并抑制其与底物GID1 的互作[22]。此外,genistein 抑制TAGK2的活性后能显著提高GID1 的泛素化水平,降低蛋白稳定性,进而降低GID1 诱导的DELLA 蛋白降解机制[22-23]。
1.3 E3泛素连接酶磷酸化后影响其自身的蛋白稳定性
E3 泛素连接酶被磷酸化修饰后会影响自身的稳定性和活性[23-24]。除了泛素化底物蛋白外,E3 泛素连接酶还有自泛素化调控机制。在拟南芥中,植物U-box(PUB)E3 泛素连接酶的磷酸化可阻止其自泛素化过程[23]。MPK3 激酶可被植物病原相关分子模式PAMPs 激活,并磷酸化负调控因子PUB22 的 U-box结构域并降低PUB22 的二聚化过程(dimerization)。由于PUB22 可以通过形成二聚体的形式而降解,磷酸化修饰能提高PUB22 的稳定性。在此基础上,可通过构建模拟PUB22 磷酸化突变体以提高PUB22 的表达水平和植物的抗病毒性能[23]。因此,E3 泛素连接酶的这种负调控机制在MPK3 介导的免疫应答中具有重要作用。并且,这种串扰调控机制不受底物蛋白的影响,因为U-box 泛素连接酶的底物结合位点不包括U-box 结构域[25]。
ABA 信号通路的调控因子KEG(keep on going)蛋白质既有E3 连接酶结构域又有激酶结构域[26]。有趣的是,磷酸化的KEG 被ABA 刺激后会启动自泛素化过程并降解[27-28]。把KEG 的激酶结构域突变后不会改变KEG 对底物蛋白的泛素化调控功能,但是ABA 处理后KEG 的降解程度会大幅度下降,暗示激酶结构域的自磷酸化影响了KEG 的自泛素化活性。但需要强调的是,不排除其他激酶在这个过程中也发挥作用[28]。
1.4 蛋白激酶通过泛素化作用途径调控植物对环境胁迫的应答机理
多数胞外信号是通过膜定位的受体激酶向胞内传递,通常情况下,受体激酶一旦被配体激活后会引起其磷酸化和泛素化修饰,进而诱导受体激酶向胞内转移、翻转(turn over)或降解并传递信号(图1-C)。研究发现,鞭毛菌受体FLS2(flagellinsensitive2)[29]和油菜素内酯受体BRI1(brassinosteroid insensitive 1)[30]两个信号通路均被“磷酸化-泛素化修饰”的串扰模式调控。这两个受体激酶一旦感应到其相应的配体时(flagellin 和BR),FLS2和BRI1 会分别与BAK1 激酶形成复合物并向胞内内吞共同激活下游通路[29-30]。重要的是,FLAGELLIN和油菜素内酯(brassinosteroid,BR)信号都会磷酸化E3 泛素连接酶PUB12/13 的保守氨基酸残基,进而分别激活PUB12/13 与其相关的受体FLS2 和 BRI1互作,最终导致FLS2 和BRI1 降解。虽然FLS2 和BRI1 对泛素连接酶的招募机理不相同,但是,FLS2和BRI1 的磷酸化调控对于PUB12/13 介导的降解途径起决定作用[29-30]。
因此,受体激酶磷酸化后会进一步诱导泛素化并通过胞吞途径向胞内内吞,再进一步激活下游通路,这种调控模式下,受体激酶的磷酸化成为启动后续降解的标志。除了膜定位受体激酶之外,类似的调控机制也存在于胞质定位的受体激酶和非受体样激酶中。例如,ABA 信号通路中,当蛋白激酶SnRK2.3 被激活并磷酸化底物蛋白PP2-B11 后,会诱导PP2-B11 通过依赖于泛素化途径的蛋白质酶体降解,进而调控ABA 信号通路和非生物胁迫应答[31]。
2 “磷酸化和类泛素化修饰”调控模块
与磷酸化相比,植物细胞中类泛素化修饰没有那么广泛和普遍。目前为止,细胞核蛋白的类泛素化分子机理研究得相对透彻[32]。最先报道具有“磷酸化-类泛素化”串扰调控模式的蛋白是油菜素内酯信号通路中的核心转录因子CESTA[33]。研究发现,BR 处理植株后会导致CESTA 的第72 位赖氨酸(K72)被SUMO1 和SUMO1 类泛素化修饰,进而诱导CESTA 核移位并激活其转录活性。但是,CPK 激酶能通过磷酸化CESTA 来减弱这种类泛素化过程和核移位效应[33]。
“磷酸化-类泛素化”模块也调控植物免疫应答过程中水杨酸受体蛋白NPR1(nonex-presser of pr genes 1)的活性。研究证明,没有病原菌入侵时,NPR1 第55 和59 位丝氨酸残基的磷酸化会抑制NPR1 的类泛素化作用,并使其保持稳态[34]。当植物感染病原菌后,水杨酸会激活蛋白激酶SnRK2.8并磷酸化NPR1 的两个氨基酸残基(Ser589 和Thr373),导致NPR1 从细胞质转移到细胞核[35]。在细胞核里,NPR1 被SUMO3 类泛素化修饰后抑制NPR1 与转录抑制因子的结合,游离的NPR1 能结合转录启动因子并激活胁迫相关基因的表达,一旦激活免疫反应后,依赖于磷酸化修饰的类泛素化会诱导NPR1 蛋白降解[34]。此外,NPR1 另外两个丝氨酸残基(Ser15 和 Ser11)的磷酸化过程依赖于NPR1的类泛素化修饰;反之,它们磷酸化后会进一步增强NPR1 的类泛素化程度[34]。近期的研究报道表明,芜菁花叶病毒(TuMV)能阻止NPR1 与SUMO3 的相互作用及类泛素化修饰,并导致后续在Ser11/15 位点的磷酸化过程不能进行,从而抑制水杨酸介导的植物抗病毒信号通路[11]。
除了NPR1 以外,“磷酸化-类泛素化”模块也调控植物免疫反应中的其他信号分子。研究报道,在免疫应答过程中,有多个MAPK 激酶的底物蛋白会被类泛素化修饰,包括转录因子WRKY、EIN3、EIL1 和组蛋白去甲基化酶HDA19 等[36]。虽然目前不明确这些蛋白是否受“磷酸化-类泛素化修饰”串扰模式所直接调控,但这些发现说明植物免疫应答通路中存在这两种修饰的复杂调控机制。
这些研究说明,同一类翻译后修饰在不同氨基酸位点具有不同的分子调控功能(site-specific regulation)。而且,蛋白质的多种翻译后修饰之间的串扰调控模式会激发胞内信号的级联反应,包括蛋白质的激活、翻转等一系列过程,虽然动态但能保持严谨又精确的调控。
3 “泛素化-类泛素化修饰”调控模块
“泛素化和类泛素化修饰”之间可以相互拮抗或协同调控[37]。虽然这两种修饰都涉及到E1-E2-E3信号传递途径,但其分子调控模式却不一样,而且,泛素化和类泛素化修饰会竞争同一个赖氨酸位点。早期的研究发现,在盐胁迫时,DELLA 蛋白RGA(repressor of GA)的第65 位赖氨酸残基(K65)类泛素化后会促进该蛋白质的表达[38]。该位点突变成精氨酸后RGA 的表达水平保持不变,进一步的研究表明,RGA 的赖氨酸位点K65 由“类泛素化和泛素化”两种修饰共同调控,并且,类泛素化修饰后能保护RGA 免受赤霉素介导的泛素化途径降解。Guo等[39]发现类泛素化和泛素化修饰会竞争蛋白激酶RACK1B 的4 个赖氨酸(Lys50,Lys276,Lys281 和Lys291),而且这4 个赖氨酸的类泛素化作用会增强RACK1B 对ABA 介导的泛素化降解作用。
尽管泛素化和类泛素化作用机制不一样,在有些情况下,类泛素化修饰会诱导蛋白质通过泛素化途径降解。E3 类泛素连接酶STUbL 含有类泛素化结合基序(SUMO-interacting motif),能识别并与被类泛素化修饰的蛋白结合,从而诱导未发生修饰的赖氨酸残基通过泛素化途径降解[40]。蛋白质组实验也证实类泛素化状态可被泛素化改变[41]。而且,被多个类泛素化修饰的蛋白质氨基酸侧链也会同时被泛素化修饰[42],这种修饰的蛋白能直接介导底物通过蛋白质酶体降解[40]。使用SUMO1、SUMO2和SUMO3 作为诱饵通过酵母双杂交实验研究互作也发现,有6 个STUbL 的同源蛋白与诱饵互作;其中,STUbL4 通过与CONSTANS 基因的转录抑制因子CDF2 互作来调控开花过程[43]。进一步的研究证明,CDF2 被SUMO1 类泛素化修饰,并且,过表达STUbL4 会降低CDF2 的表达量[43-44]。这些研究表明,植物细胞中也存在SUMO 介导的降解途径。
“泛素化和类泛素化修饰”之间会相互影响对方的生物学活性。研究发现,植物在黑暗环境生长时,E3 类泛素连接酶SIZ1 能通过类泛素化过程修饰植物光形态建成抑制因子COP1(constitutive photomorphogenic1,COP1)并增强COP1 的活性,使其进一步泛素化靶基因(如HY5)从而负调控光形态建成[45]。COP1 也会反向诱导SIZ1 的泛素化并使其通过蛋白质酶体途径降解。然后,COP1-SIZ1通过“泛素化和类泛素化”的正调控与负反馈调控模式相结合发挥功能,以保障植物的光形态建成。
4 “磷酸化-泛素化-类泛素化”调控模块
磷酸化、泛素化和类泛素化这3 种修饰可协同调控信号通路。这种调控模式最早报道于动物细胞中,三类修饰协同调控基因毒性胁迫应答机理并诱导NEMO 蛋白的激酶亚基的核定位等过程[46]。植物中也有类似的调控机理,正如我们前面描述过,磷酸化、类泛素化和泛素化修饰影响NPR1 的功能和稳定性[34]。此外,这3 种修饰也调控光信号中PHYB-PIF 通路,研究发现,PHYB 蛋白的C-末端类泛素化修饰后能抑制其后续的磷酸化信号通路以及对PIF5 的泛素化修饰,从而减弱PHYB 和PIF 之间的互作[47]。然而,红光和白光会增加PHYB 的类泛素化程度,点突变研究揭示 PHYB 的SUMO 化靶点K996 突变后会导致植物呈现红光敏感表型,说明该位点的类泛素化修饰在光信号通路中具有调控作用[47]。
这3 种修饰的共调控模式也存在于能量代谢的感受器——SnRK1 激酶的信号通路中。SnRK1 的激活依赖于T-loop 区的苏氨酸磷酸化,该位点的磷酸化会诱导E3 类泛素连接酶SIZ1 通过类泛素化过程作用于SnRK1 的多个亚基,导致SnRK1 降解并抑制其下游信号的传递[48]。该研究说明SnRK1 通过磷酸化过程诱导的类泛素化修饰和后续的降解途径而发挥功能,并以负反馈调控的模式来减弱不良信号向下游的继续传递;同时也揭示了“磷酸化、类泛素化和泛素化”这3 种修饰环环相扣的调控模式在植物应对环境胁迫过程中的关键调控作用。
此外,SnRK1 通过磷酸化途径调控硝酸还原酶的活性[49],被磷酸化修饰后的硝酸还原酶会进一步与14-3-3 蛋白结合而失去酶活性[50]。研究报道,SIZ1 可通过类泛素化过程增强硝酸还原酶的活性。也有证据表明硝酸还原酶是通过依赖于泛素化的蛋白质酶体途径降解[49]。这些研究进一步说明了“磷酸化-泛素化-类泛素化”在细胞内瞬时而又动态的分子作用模式。
5 结论与展望
蛋白质信息由遗传密码编码,而翻译后修饰能使蛋白质的分子功能更加多样化。近年来,植物中关于翻译后修饰的调控机理研究越来越深入,但目前的报道很少关注到不同修饰之间的联系和相互作用。事实上,很多植物生理或代谢过程都涉及到多类修饰的共调控,不同翻译后修饰能快速而精确地把胞外信号激活、感知、整合并传递到下游通路上。本文综述了磷酸化、泛素化和类泛素化三类重要修饰的特征、协同调控机理和互作关系。这三类修饰可发生在同一个蛋白上,并且它们之间会相互影响和调控对方的功能与活性。然而,目前关于这个领域的研究还不够深入,还有很多未知的分子机制有待探讨,包括:(1)很多激酶或者类/泛素连接酶的底物还不明确;(2)类泛素连接酶(如E3 SUMO ligase)也有磷酸化修饰[51-52],但关于这些磷酸化的分子功能和调控机制尚不清楚;(3)在“泛素化-类泛素化修饰”模块中,蛋白质酶体如何在复杂而又相似的信号模式中识别并降解底物?(4)现有的报道大多数集中于“书写器”的分子功能研究领域,而关于“擦除器”的基因调控功能探讨较少。
质谱技术能对多种翻译后修饰进行精确的定量和定性分析,并且已取得了很大成就[53-54]。但翻译后修饰在细胞内的化学计量较低(也即被修饰的蛋白质所占比例相对较低);其次,翻译后修饰在不同环境下均处于快速动态变化的状态(如磷酸化状态数秒之内就能发生改变),导致大规模研究分析不同修饰之间的串扰调控机理依然有很大的技术难度。未来的研究应结合生化、遗传、结构生物学和单细胞生物学等多种技术手段进行更系统的探索。

