卵巢癌组织中LncRNA SNHG11、miR-184 表达与患者临床病理特征和预后的关系
杨洋,胡娟,黄润强
1 十堰市太和医院妇科,湖北 十堰 442000;2 三峡大学附属仁和医院妇科
卵巢癌是临床常见的女性生殖系统恶性肿瘤之一,2022 年我国卵巢癌新发病例57 090 例,死亡39 306 例,严重威胁女性生命健康[1]。及时评估卵巢癌患者预后对促进其预后改善很有必要。长链非编码核糖核酸(LncRNA)、微小核糖核酸(miRNA)等非编码核糖核酸(ncRNA)是基因组的新兴元素,虽不编码蛋白质,但参与肿瘤细胞增殖、分化、侵袭、转移、耐药、凋亡等的调控[2]。LncRNA小核仁核糖核酸宿主基因11(SNHG11)是新发现的LncRNA 成员,其在卵巢癌中异常表达[3]。LncRNA SNHG11 与食管鳞癌、肝细胞癌患者预后有关[4-5]。miR-184 是进化高度保守的一种miRNA,在卵巢癌中异常表达[6]。miR-184 与舌鳞状细胞癌、肾透明细胞癌患者预后有关[7-8]。本研究拟探讨卵巢癌组织中LncRNA SNHG11、miR-184 表达与临床病理特征和预后的关系,旨在为改善患者预后提供理论依据。
1 资料与方法
1.1 临床资料 收集2019 年1 月—2020 年5 月在十堰市太和医院手术切除的104 例份卵巢癌组织及其癌旁组织(距离癌组织边缘≥2 cm 且经病理检查为正常组织)标本,取样后立即液氮速冻后保存于-80 ℃冰箱中。患者年龄31~74(60.54 ± 5.68)岁;病理类型:浆液性癌83例、黏液性癌21例;肿瘤最大径≥3 cm 41例、<3 cm 63例;分化程度:低分化39例、中高分化65 例;国际妇产科联盟(FIGO)分期[9]:Ⅰ~Ⅱ期41例、Ⅲ期63例;淋巴结转移45例。纳入标准:患者或家属知情同意;经病理检查确诊为卵巢癌;初次确诊,且入院前未接受化疗、放疗、免疫治疗、靶向治疗等。排除标准:年龄<18 岁;临床资料不完整;继发性卵巢癌;合并其他部位恶性肿瘤;合并自身免疫性疾病;合并精神疾病。本研究经医院伦理委员会批准。
1.2 卵巢癌组织中LncRNA SNHG11、miR-184 检测 采用实时荧光定量PCR 法。将冻存组织剪碎后,用RNA 提取试剂盒[天根生化科技(北京)有限公司]提取组织总RNA,分光度计测定吸光度。用逆转录试剂盒(北京百迈客生物科技有限公司)将RNA 转录为互补RNA 后,用荧光定量PCR 试剂盒(北京百迈客生物科技有限公司),以互补RNA 为模板进行反应。反应体系:互补RNA 5 μL、2×SYBR Green PCRmix 12.5 μL、上游引物1.0 μL、下游引物1.0 μL,ddH2O 加至总体积25 μL。反应条件:95 ℃加热10 min,95 ℃变性10 s、64 ℃退火10 s、延伸72 ℃ 30 s 循环35 次。LncRNA SNHG11 上游引物5'-TGGGAGTTGTCATGTTGGGA-3',下游引物5'-ACTCGTCACTCTTGGTCTGT-3';内参GAPDH 上游引物5'-ATGTTCGTCATGGGTGTGAA-3',下游引物5'-CAGTGATGGCATGGACTGT-3'。 miR-184 上游引物5'-TGGACGGAGAACTGAUAAGGGT-3',下游引物5'-GTGCAGGGTCCGAGGT-3';内参U6 上游引物5'-CTCGCTTCGGCAGCACA-3',下游引物5'-AACGCTTCACGAATTTGCGT-3'。用2-ΔΔCT法计算组织中LncRNA SNHG11、miR-184相对表达量。
1.3 预后随访 通过电话或门诊对卵巢癌患者随访3 年,第1 年每3 个月随访1 次,之后2 年每6个月随访1 次。随访至患者死亡或2023 年5 月,统计患者生存率。
1.4 统计学方法 采用SPSS28.0 统计软件。计量资料以-x±s表示,比较采用配对或独立t检验;采用Pearson 相关法分析卵巢癌组织中LncRNA SNHG11与miR-184表达的相关性;用Kaplan-Meier法绘制生存曲线,用Log-rank 检验比较生存率;用多因素Cox回归分析卵巢癌患者预后的影响因素。P<0.05 为差异有统计学意义。
2 结果
2.1 卵巢癌组织与癌旁组织中LncRNA SNHG11、miR-184表达比较 卵巢癌组织中LncRNA SNHG11表达高于癌旁组织,miR-184 表达低于癌旁组织(P均<0.05)。见表1。

表1 卵巢癌组织与癌旁组织中LncRNA SNHG11、miR-184相对表达量比较(-x ± s)
2.2 卵巢癌组织中LncRNA SNHG11 与miR-184 表达的相关性 用StarBase 软件预测发现,LncRNA SNHG11 与miR-184 存在结合位点。Pearson 相关分析显示,卵巢癌组织中LncRNA SNHG11 表达与miR-184表达呈负相关(r=-0.711,P<0.05)。
2.3 LncRNA SNHG11、miR-184表达与卵巢癌患者临床病理特征的关系 不同分化程度、FIGO 分期、淋巴结转移的卵巢癌组织中LncRNA SNHG11、miR-184 表达比较差异有统计学意义(P均<0.05),不同年龄、病理类型、肿瘤最大径的卵巢癌组织中LncRNA SNHG11、miR-184 表达比较差异无统计学意义(P均>0.05)。见表2。

表2 LncRNA SNHG11、miR-184表达与卵巢癌患者临床病理特征的关系(-x ± s)
2.4 LncRNA SNHG11、miR-184表达与卵巢癌患者预后的关系 104 例卵巢癌患者随访3 年,死亡45例,总生存率为56.73%(59/104)。根据卵巢癌组织中LncRNA SNHG11、miR-184 表达均值分为高/低表达组。LncRNA SNHG11 高表达组(≥2.27,53 例)总生存率45.28%(24/53)低于LncRNA SNHG11 低表达组(<2.27,51 例)的68.63%(35/51);miR-184高表达组(≥1.02,54 例)总生存率68.52%(37/54)高于miR-184 低表达组(<1.02,50 例)的44.44%(22/50);比较差异有统计学意义(P均<0.05)。
2.5 卵巢癌患者预后的单因素和多因素Cox 回归分析 以随访时间为时间变量,临床病理特征和LncRNA SNHG11、miR-184 为自变量,生存状态(死亡/存活=1/0)为因变量。多因素Cox 回归分析显示,FIGO 分期Ⅲ期、淋巴结转移、LncRNA SNHG11≥2.27 为卵巢癌患者死亡的独立危险因素,miR-184≥1.02为独立保护因素(P<0.05)。见表3。
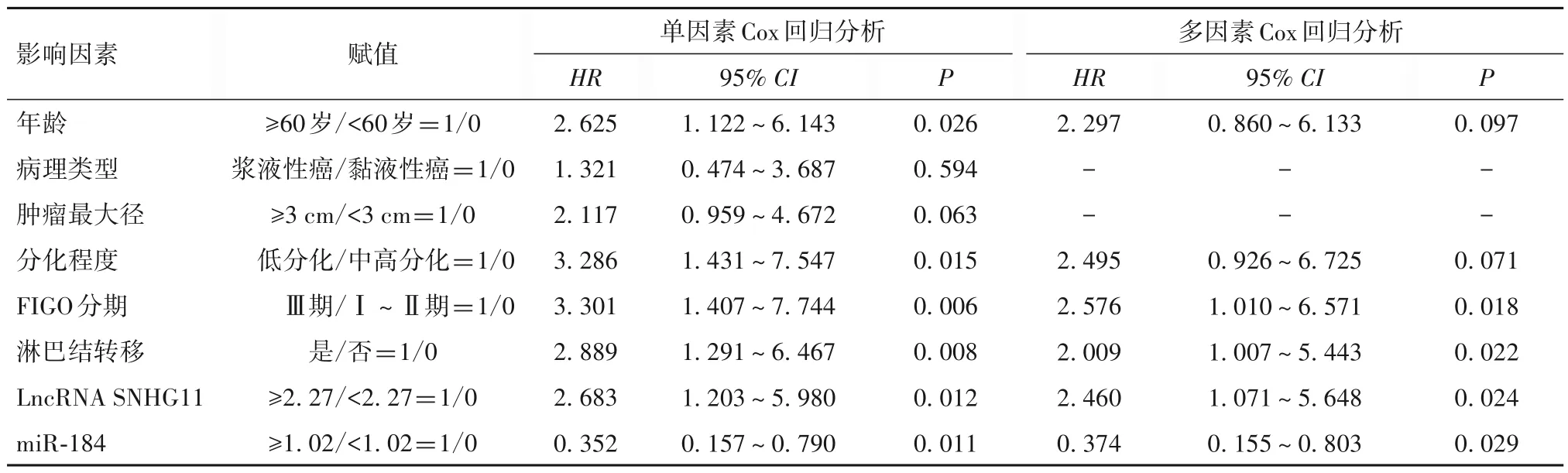
表3 影响卵巢癌患者预后的单因素和多因素Cox回归分析结果
3 讨论
卵巢癌是起源于输卵管或卵巢上皮细胞的恶性肿瘤,根治性切除是早期卵巢癌最有效的治疗方法,但由于卵巢深处盆腔且卵巢癌早期无特异性症状,导致70%左右的患者在初诊时即为晚期,失去最佳切除时机[10]。尽管近年来肿瘤细胞减灭术和化疗、放疗、免疫、靶向等治疗技术或药物取得较大进展,但仍难以获得满意的疗效,且随着治疗时间的延长,耐药和复发转移愈发常见,导致卵巢癌患者总体预后仍然较差[11-13]。分析卵巢癌患者预后相关因素,对指导临床干预和改善患者预后意义重大。
卵巢癌是多种因素和机制导致的一种实体肿瘤,细胞内外的ncRNA 能通过转录或转录后调控等方式调控细胞多种病理生理功能,进而参与卵巢癌发生、发展[14]。LncRNA 是长度>200 个核苷酸的ncRNA,该类ncRNA虽然缺乏典型的开放阅读框,但能通过海绵miRNA竞争性结合信使核糖核酸或直接调控信使核糖核酸,参与蛋白质调节、转录调节、表观遗传调控等过程,进而参与肿瘤进程[15]。LncRNA SNHG11 是定位于人染色体20q11.23 上的一种LncRNA,参与多种恶性肿瘤过程。如LncRNA SNHG11 能靶向miR-324-3p 上调血管内皮生长因子A,促进胰腺癌细胞增殖、迁移和血管生成[16];LncRNA SNHG11能靶向下调miR-193a-5p表达促进非小细胞肺癌细胞增殖、侵袭和迁移[17]。上述研究提示,LncRNA SNHG11 是一种促癌基因。研究显示,LncRNA SNHG11 表达升高与结直肠癌、前列腺癌患者预后不良有关[18-19]。有研究报道,LncRNA SNHG11 在卵巢癌中呈高表达[3]。然而关于LncRNA SNHG11 与卵巢癌患者的关系尚不清楚。本研究结果显示,卵巢癌组织中LncRNA SNHG11高表达,与分化程度、FIGO 分期和淋巴结转移有关,提示LncRNA SNHG11 高表达参与卵巢癌发生发展。分析原因可能是LncRNA SNHG11 表达升高能结合β-连环蛋白激活Wnt/β-连环蛋白途径,促进卵巢癌细胞增殖、迁移、侵袭和血管生成,导致卵巢癌恶性进展[20]。
miRNA是长度约22个核苷酸的单链ncRNA,能通过与靶标基因完全或不完全互补结合,抑制蛋白质翻译而负向调控信使核糖核酸表达,参与肿瘤进程[21]。miR-184是定位于人染色体7q32.2上的一种以miR-183/96/182 基因簇形式存在的miRNA。近年多项研究证实miR-184 可参与肿瘤进程,如miR-184能靶向下调锌指蛋白3表达,调控上皮间质转化,促进口腔鳞状细胞癌细胞增殖、迁移及侵袭[22];miR-184能靶向下调补体1和肿瘤坏死因子受体6 表达,抑制肺腺癌细胞恶性进展[23]。上述研究提示,miR-184 在肿瘤发生、发展过程中发挥促癌或抑癌作用。实验报道,miR-184 在卵巢癌中呈低表达[6]。且相关研究显示,miR-184 异常表达与胃癌、肝细胞癌患者预后不良有关[24-25]。本研究结果显示,卵巢癌组织中miR-184 低表达,与卵巢癌分化程度、FIGO 分期和淋巴结转移有关,提示miR-184 低表达参与卵巢癌发生、发展。分析原因可能是miR-184 表达降低会导致类Sm 蛋白4 表达上调,导致细胞周期紊乱,使卵巢癌细胞不受控制的增殖、分化、迁移和侵袭,促进卵巢癌恶性进展[6]。
本研究通过StarBase 软件预测发现,LncRNA SNHG11与miR-184存在结合位点,相关性分析也发现二者在卵巢癌组织中表达呈负相关,提示LncRNA SNHG11 和miR-184 可能共同参与卵巢癌进程。李少儒等[3]通过双荧光素酶报告基因实验也证实LncRNA SNHG11 与miR-184 存在靶向关系,下调LncRNA SNHG11 表达能靶向上调miR-184 表达,降低卵巢癌细胞增殖、迁移与侵袭能力。本研究结果还显示,LncRNA SNHG11高表达患者总生存率较低表达患者低,是卵巢癌患者死亡的独立危险因素;miR-184 高表达患者总生存率较低表达患者高,是卵巢癌患者死亡的独立保护因素。这说明卵巢癌组织中LncRNA SNHG11、miR-184 表达与患者预后有关,可能成为卵巢癌预后评估新的标志物。
综上所述,卵巢癌组织中LncRNA SNHG11 高表达,miR-184 低表达,二者表达变化与分化程度、FIGO 分期、淋巴结转移和预后有关。但本研究结果还需多中心研究进行验证。

