视觉发育关键期单眼形觉剥夺弱视大鼠视皮层的差异表达基因及其功能分析
李佳芹,毕爱玲,2,毕宏生,2
1 山东中医药大学眼科与视光医学院,济南 250014;2 山东中医药大学附属眼科医院实验中心山东省眼病防治研究院实验中心 山东省中西医结合眼病防治重点实验室
弱视是与视皮层发育相关的临床常见眼科疾病,综合患病率高达2%~5%,多见于儿童和青少年[1]。在视觉发育期内,由于单眼斜视、屈光参差、高度屈光不正及形觉剥夺等异常视觉经验引起单眼或双眼的最佳矫正视力低于相应年龄的正常人,且眼内无任何器质性病变,排除遗传相关眼病,则可诊断为弱视[2]。弱视的发病机制复杂,与视觉传输通路密切相关,其发病最核心的位置是大脑视皮层[3]。研究发现,视觉发育关键期对啮齿动物进行单眼形觉剥夺(MD),导致初级视皮层神经元的输入偏好向非剥夺眼发生显著变化,引起视觉发育相关基因表达异常,影响视皮层结构和功能,导致视觉受损[4]。基因芯片技术是一种运用大量特定序列的基因探针与标记样品分子进行杂交,通过检测探针杂交信号强度,获得相应基因序列信息的基因检测技术,具有高精确度、高灵敏度、高通量等优势。基因芯片技术已应用于各研究领域,而有关弱视模型动物视觉皮层基因表达变化的报道较少。2022年7月—2023年2 月,本研究以形觉剥夺弱视大鼠为模型,运用基因芯片技术检测各样本视皮层基因表达情况,筛选差异表达基因,运用基因本体论(GO)和京都基因与基因组百科全书(KEGG)对差异表达基因进行富集分析,确定弱视相关发病基因及其生物学信息,为分子水平靶向治疗弱视提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SD大鼠10只,雌雄各5只,合笼,购自北京维通利华实验动物技术有限公司,动物许可证编号:SCXK(京)2016-0006,孕24 d 左右娩出幼鼠,均排除眼部器质性疾病。选取出生13 d 尚未睁眼SD 大鼠24 只,雌雄不限,体质量12~15 g。大鼠与幼鼠均饲养于山东中医药大学眼病防治研究院,室温25 ℃、湿度50%、12 h/12 h 昼夜光照节律,饲养期间食物水源充足,自由进食饮水。动物实验过程严格遵守ARVO 原则,实验动物饲养和使用经山东中医药大学实验室动物管理和使用委员会批准。
1.1.2 实验试剂 红霉素眼膏(北京双吉制药有限公司),氧氟沙星滴眼液(辰欣伟都药业有限公司),RNeasy mini kit(德国QIAGEN 公司),Gene Expression Hybridization Kit、Low Input Quick Amp Labeling Kit、One-Color(美国Agilent 公司),RNeasy mini kit(德国QIAGEN 公司),Gene Expression Wash Buffer Kit(美国Agilent公司)。
1.1.3 实验仪器 手术器械、脑切片模具(深圳市瑞沃德生命科技有限公司),NanoDrop ND-2000 分光光度计(美国Thermo Fisher 公司),Hybridization Oven、Agilent Bioanalyzer 2100、Agilent Microarray Scanner(美国Agilent 公司),Staining Dishes(美国Thermo Shandon公司)。
1.2 动物分组及单眼形觉剥夺弱视模型制备 将24 只出生13 d 尚未睁眼SD 大鼠按随机数字表法均分为空白对照组、模型组。模型组参照文献[5]的方法构建模型,操作方法:经腹腔注射1%戊巴比妥钠溶液进行麻醉、固定,用复合碘消毒右眼周围皮肤,切除右眼上下眼睑0.8~1.0 mm边缘组织,用眼科缝合针2~4 针间断缝合上下眼睑。术后7 d 在创缘处使用氧氟沙星滴眼液和红霉素眼膏,防止感染。正常光照下饲养大鼠,每天早晚观察缝合部位,剔除脱线、漏光及眼内感染大鼠。连续饲养45 d 后切开右眼眼睑边缘。
1.3 视皮层脑组织获取 出生60 d,腹腔注射1%戊巴比妥钠溶液麻醉后快速断头处死大鼠,取大脑放于脑切片模具中,参考大鼠脑立体定位图谱[6]切取双侧视皮层脑组织,放于EP管中,-80 ℃保存备用。
1.4 差异表达基因筛选 采用基因芯片实验。RNA 的抽提、纯化及芯片杂交实验:用RNeasy mini kit抽提样品总RNA,并用NanoDrop ND-2000分光光度计及Agilent Bioanalyzer 2100 进行电泳质检;质检合格的总RNA 用Agilent 表达谱芯片配套试剂盒进行放大和标记,并用RNeasy mini kit 纯化标记后的cRNA;按照Agilent 表达谱芯片配套提供的杂交标准流程进行杂交,在65 ℃、10 r/min滚动杂交炉中滚动杂交17 h,杂交cRNA 上样量1.65 μg;杂交后,使用Gene Expression Wash Buffer Kit 在洗缸中洗片;使用Agilent Microarray Scanner 对杂交芯片进行扫描,软件设置Dye channel: Green, Scan resolution=3 μm,PMT 100%,20 bit。用Feature Extraction software读取基因芯片扫描原始数据,用R软件中limma包Quantile 算法对原始数据进行归一化处理。绘制箱线图,观察样本数据分布的总体特征。用表达差异倍数及t检验对差异表达基因进行筛选,筛选标准为表达差异倍数≥2 且P<0.05。采用火山图分析两组间差异基因总体分布情况,聚类热图分析组内各样本间差异基因的分布。
1.5 差异表达基因GO 和KEGG 富集分析 用GO和KEGG 工具对差异表达基因进行富集分析。挑选标准:term/GO 或term/pathway 上至少存在2 个差异表达基因(P<0.05)。筛选出基因富集显著的功能和信号通路,按照Enrich factor 值从大到小降序排列,取前30个结果制作可视化气泡图。
2 结果
2.1 差异表达基因筛选结果 将原始数据经过均一化和对数转换处理,绘制得到箱线图,见图1,数据中位数基本为一条直线,各样本间具有可比性。模型组与空白对照组视皮层差异基因总体表达情况见图2。其中,左侧视皮层差异表达基因共163 个,表达上调基因28个、表达下调基因135个;右侧视皮层差异表达基因数共38 个,表达上调基因25 个、表达下调基因13个。共获得16个共有差异表达基因,表达上调基因9个、表达下调基因7个。

图1 箱线图
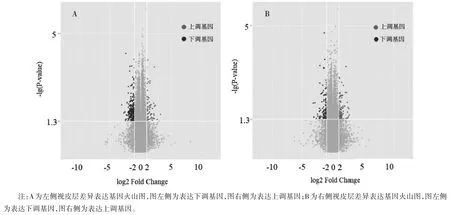
图2 大鼠左侧、右侧视皮层差异表达基因火山图
2.2 差异表达基因GO 富集分析结果 空白对照组与模型组左侧视皮层差异表达基因进行GO 富集分析,选取富集最显著的30 个功能,其中富集程度大于2 的GO 条目共有22 个,参与分子功能的条目有5 个,包含核糖体的结构成分、结构分子活性、氧化还原酶活性、转运蛋白活性、气味结合;参与细胞组成的条目有8个,包含细胞质核糖体大亚基、核糖体大亚基、细胞质核糖体、核糖体亚基、核糖体、细胞体、核糖核蛋白复合物、细胞质;参与生物过程的条目有9 个,包含蛋白质翻译、感觉器官发育、氧化还原过程、器官形态形成、离子跨膜运输、细胞增殖正调节、羧酸代谢过程、有机环化合物反应、有机酸代谢过程。
空白对照组与模型组右侧视皮层差异表达基因进行GO 富集分析,选取富集最显著的30个功能,其中富集程度大于2 的条目共有19 个,参与分子功能的条目有4个,包含蛋白质二聚化活性、相同蛋白结合、受体结合、水解酶活性;参与细胞组成的条目有1 个,构成神经元细胞突起;参与生物过程的条目有14 个,包含多细胞生物繁殖过程、化学稳态、稳态过程、繁殖、移动、基因表达正向调控、组织发育、细胞代谢过程负调控等。
2.3 差异表达基因KEGG 富集分析结果 对空白对照组与模型组左侧视皮层差异表达基因进行KEGG 富集分析,筛选出富集程度最显著的30 个信号通路,包括胚胎背腹轴线形成、光信号传导通路、血管内皮生长因子(VEGF)信号通路、氧化磷酸化信号通路、醛固酮调节的钠重吸收信号通路、碳水化合物的消化吸收信号通路、B 细胞受体信号通路等,见图3。空白对照组与模型组右侧视皮层差异表达基因KEGG 信号通路主要富集于维生素消化和吸收、脂肪消化和吸收、长期抑制、血管平滑肌收缩、肌动蛋白骨架的调节通路、神经活性配体-受体相互作用信号通路、癌症信号通路、嗅觉传导信号通路。
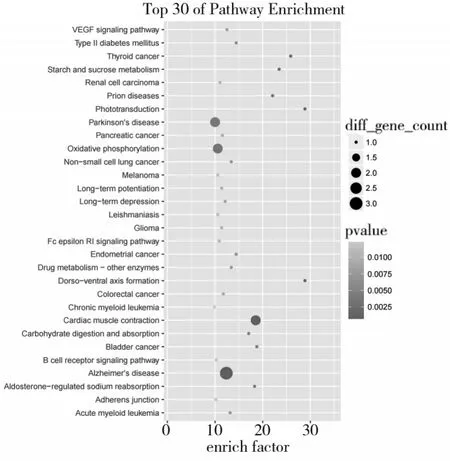
图3 左侧视皮层差异表达基因KEGG富集分析气泡图
左、右两侧视皮层差异基因的KEGG 富集代谢通路不尽相同,其中与视觉相关的主要代谢通路包括背腹轴形成、光信号传导通路、丝裂原活化蛋白激酶(MAPK)信号通路、核苷酸结合寡聚化结构域(NOD)样受体信号通路、神经营养蛋白信号通路、神经活性配体—受体相互作用信号通路等。其中与视功能异常改变有关的大部分通路集中在MAPK1、鸟氨酸结合蛋白Gα2(GNAT2)基因。
3 讨论
MAPK 是一种常见的细胞内信号通路,在癌发生、促进癌细胞增殖和迁移、抑制凋亡和刺激血管生成中起着至关重要的作用[7-8]。MAPK1 是MAPK 信号传导通路的重要蛋白质编码基因,又称ERK1/2或p44/42。在正常情况下,其位于细胞质中,在高糖、各种生长因子、过氧化氢、离子射线等刺激下磷酸化激活,促进基因转录和表达,参与细胞增殖和分化[9]。在哺乳动物细胞中,与MAPK1 相关的细胞内信号转导途径被认为是经典的MAPK 信号转导途径[10-11]。γ-氨基丁酸(GABA)是大脑中主要抑制性神经递质,介导视皮层兴奋性神经元形态和功能改变[12-13]。脑源性神经营养因子(BDNF)是由视网膜中的神经元产生的神经营养因子,广泛存在于中枢神经系统,参与调节视皮层可塑性、调控视觉系统神经发育、调节突触发生和神经保护[14-15]。研究表明,在视觉早期发育过程中,兴奋性GABA 和BDNF 之间依赖MAPK信号传导通路形成正反馈回路,其中,GABA 刺激BDNF 表达,BDNF 促进GABA 的突触释放[16]。异常的视觉刺激引起GABA 表达变化,使神经元产生异常视觉冲动,并且通过MAPK信号通路,刺激BDNF 异常表达,引起突触结构改变和视觉神经元异常发育,导致弱视发生。另外,MAPK1 通路激活,进一步介导一氧化氮合酶(NOS)表达和一氧化氮(NO)产生[17-18]。NO通过加强谷氨酸的释放,参与视觉冲动的产生、整合与传递,对视觉的发育有重要影响[19]。在弱视猫模型、形觉剥夺弱视大鼠模型的研究中,分别检测出视网膜与大脑视皮层NOS、GABA 的表达明显减少[20-21]。可以推测,NOS的降低导致NO 合成减少,影响视觉发育,进而导致弱视。另外,BDNF 与谷氨酸突触表达调控长时程增强(LTP)过程也密切相关,代谢型谷氨酸受体激活引起神经兴奋性信号传递,并介导细胞内级联反应,诱导LTP,改变神经可塑性,参与视皮层发育[22-23]。
GNAT2 基因包含8 个外显子,共编码354 个氨基酸,主要功能为光信号传导通路[24]。研究证实,GNAT2 参与的光信号传导通路与视功能作用发挥密切相关。光信号传导通路中,GNAT2 主要参与编码视锥转导G 蛋白的α 亚基及视锥体光感受器中GTP 酶的活化过程[25]。在视锥光感受器中,光刺激激活光色素与转导蛋白(G 蛋白)的相互作用,刺激结合的GDP 交换为GTP。与GTP 结合的视锥细胞特异性α 转导素亚基从其β 和γ 亚基释放,并通过从cGMP-磷酸二酯酶的活性位点去除抑制性γ 亚基来激活该酶。cGMP 磷酸二酯酶降低了光感受器中cGMP 的浓度,引起cGMP 门控通道关闭和光感受器的超极化。RONNING 等[26]对敲除小鼠GNAT2 基因,发现GNAT2表达缺失情况下不存在视锥驱动的视网膜信号传导。另外,研究结果显示单眼形觉剥夺GNAT2-/-小鼠的屈光偏移幅度较GNAT2+/+小鼠大两倍[27]。以上研究表明,GNAT2 基因是光信号传导通路的关键基因,敲除GNAT2基因会引起视网膜光信号传导异常,导致小鼠屈光发育异常,进而引起视觉发育的不完善,导致弱视形成。多巴胺(DA)是弱视发病分子机制中的中枢神经系统关键调控递质,参与视觉发育关键期视觉神经元的发育成熟、突触结构的可塑性等过程[18,28]。PARK等[29]发现,具有非功能性视杆细胞的GNAT1-/-小鼠由于DA 的代谢异常,导致其在产后1~4周DA 代谢产物3,4-二羟基苯乙酸水平下降,引起屈光发育异常。另外,由于ON通道缺陷导致DA 紧张性水平降低[30]或光感受器变性[31]也增加了对形觉剥夺性视觉异常发育的易感性。这些结果表明,DA对屈光发育和形觉剥夺异常视觉表现具有复杂作用,在视觉发育过程中,DA 可能出现中枢神经系统视觉分子信号异常表达,从而增加视觉发育异常的易感性。
本实验采用健康大鼠,在其视觉发育关键期进行右眼单眼缝合,以异常视觉经验诱导建造形觉剥夺弱视大鼠模型。运用基因芯片技术检测左、右眼对应大脑视皮层基因表达情况,发现大量基因表达显著下调,少量表达上调。对差异基因进行筛选,发现弱视模型大脑视皮层中MAPK1 基因表达下调,GNAT2 基因表达上调。MAPK1 基因表达下调表明弱视状态下,与视觉信号传导相关的细胞信号途径发生了变化,影响了视觉冲动的产生、整合与传递,进一步影响了视觉神经元异常发育和连接。G 蛋白在视网膜的视觉传导途径中参与感光色素激活、二次信号传导等过程。GNAT2 基因表达上调反映了对视觉信号传导的一种代偿性反应,即在弱视条件下,生物体试图通过增加GNAT2的表达来增强对有限视觉输入的感知。
综上所述,形觉剥夺弱视模型大鼠视皮层MAPK1 基因表达下调,由MAPK1 介导的NOS、NO表达降低,以及GABA、BDNF 参与的视觉信号通路及生物学活性表达限制,可能是形觉剥夺弱视相关的分子学生物途径。另外,形觉剥夺弱视模型大鼠GNAT2 基因表达上调,可能导致视锥驱动的视网膜信号传导异常,进一步导致视觉光信号转导异常,并且伴随DA 对形觉剥夺视觉发育的影响,可能是弱视形成的另一分子机制。本实验从基因层面分析了影响弱视形成的大脑视皮层神经系统发育、神经元突触结构变化和功能可塑性的过程,为弱视治疗、视觉信号转导及大脑视觉发育的可塑性研究提供了新的方向。当然,未来仍需结合目标基因对具体的分子机制进行探索。

