高脂饮食诱导肥胖小鼠不同脂肪组织炎症反应相关基因表达及其机制
陈思远,郭子豪,万梦瑶,梁小弟,2
1 新疆医科大学基础医学院生物化学与分子生物学教研室,乌鲁木齐 830017;2 新疆地方病分子生物学重点实验室
肥胖是一种由遗传、环境、心理和社会因素引起的慢性代谢性疾病[1]。其最明显的特征是体内脂肪堆积过多,当身体的能量摄入大于消耗时,机体会将多余的能量以TG的形式储存在脂肪组织,经过长期累积会促进脂肪组织的扩张,最终导致肥胖[2]。肥胖不仅会影响形体,还会增加糖尿病、高血压、肿瘤以及免疫失调等一系列疾病发生的风险[3]。HOTAMISLIGIL等[4]首次提出肥胖是由不同炎症因子诱导产生的一种全身性的慢性低度炎症状态,脂肪组织的慢性炎症是联系肥胖和代谢类疾病的关键所在[5]。哺乳动物体内的脂肪组织根据形态和功能分为白色脂肪组织(WAT)和棕色脂肪组织(BAT)。WAT 会将多余的能量储存起来,并分泌脂肪因子以微调代谢和炎症反应;而BAT 则以非颤栗性产热的方式消耗能量来维持体温。在肥胖状态下,WAT 会过度扩张导致脂肪细胞肥大,其中会伴随多种炎症因子的产生和分泌增加[6];BAT 在炎症的刺激下线粒体的完整性遭到破坏,并进一步导致产热功能受损[7]。肥胖诱发的炎症反应会对两种脂肪组织造成不同的影响,但目前对肥胖不同组织间炎症反应的研究较少,因此有必要探究不同脂肪间的炎症反应机制。炎症反应机制涉及多个基因变化以及信号通路的激活。用转录组学对脂肪组织进行测序分析,可更好地观察不同脂肪组织中炎症相关基因的表达差异。2022 年3 月—11 月,本研究构建了高脂饮食诱导的肥胖小鼠模型,并探究不同脂肪组织间的炎症反应机制,以探讨肥胖与炎症的关系,为临床诊治提供新思路。
1 材料与方法
1.1 材料 C57BL/6J 雄性小鼠10 只,6 周龄,体质量(19 ± 1)g,购自新疆医科大学动物实验中心,许可证号为SCXK(新)2018-0002,均在新疆医科大学SPF 动物实验中心喂养,温度(22 ± 3)°C,湿度(50 ±5)%,每天明暗时间各12 h。本实验通过伦理审查委员会批准(IACUC-20220310-06)。高脂饲料,含脂量60% kCal,购于美国Research Diet公司。
1.2 动物分组及模型制备方法 将10 只小鼠随机分为正常饮食对照组(ND 组)、高脂饮食模型组(HFD 组)各5 只,分别喂以常规饲料、高脂饲料,饲喂10 周,以HFD 组大于ND 组平均体质量的20%作为肥胖模型建立成功标准。每周记录小鼠体质量。
1.3 脂肪组织获取 干预10 周,将小鼠颈部脱臼处死,取肩胛间棕色脂肪组织(BAT)、腹股沟白色脂肪组织(iWAT)、附睾白色脂肪组织(eWAT)置于液氮中保存。
1.4 脂肪组织转录组测序(seq) 将HFD 组中的iWAT 样本1(iWAT1)、iWAT 样本2(iWAT2)、eWAT样本1(eWAT1)、eWAT 样本2(eWAT2)、BAT 样本1(BAT1)、BAT样本2(BAT2);ND组中的iWAT样本1(iWAT1)、iWAT 样本2(iWAT2)、eWAT 样本1(eWAT1)、eWAT 样本2(eWAT2)、BAT 样本1(BAT1,由于ND 组小鼠BAT 少,在测序时将两个样品的BAT 合并为1 份)交于美吉生物医药科技有限公司(上海)进行RNA-seq。数据准确可靠标准:错误率<0.1%;碱基质量值(Q),Q20(测序质量在99%以上的碱基占总碱基的百分比)>85%;Q30(测序质量在99.9%以上的碱基占总碱基的百分比)>80%;Total mapped(能定位到基因组上优化后的数据百分比)>80%为获得的数据准确可靠。主成分分析(PCA)方法:将原来变量(HFD 组和ND 组中所有样本经测序所获得的原始数据)重新组合成一组新的互相无关的几个综合变量(即主成分PC1 和PC2),所有因素按重要性排序,忽略掉靠后的微小因素,简化数据。通过PCA 找出离群样品、判别相似性高的样品簇,挖掘样品间的关系和变异。
1.5 差异表达基因筛选及功能分析 用DESeq2软件进行基因差异分析,筛选标准:P<0.05、差异倍数(FC)值1.5~2。基因本体论(GO)功能富集分析:采用Goatools 软件对基因集中的基因/转录本进行富集分析,用Fisher 精确检验。京都基因与基因组百科全书(KEGG)通路富集分析:采用R 语言脚本对基因集中的基因/转录本进行富集分析,用Fisher 精确检验。为避免假阳性,用多种多重检验方式校正P值,P<0.05为此功能存在显著富集。
1.6 统计学方法 采用GraphPad Prism9.0 统计软件。计量资料比较采用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组体质量变化 见图1。
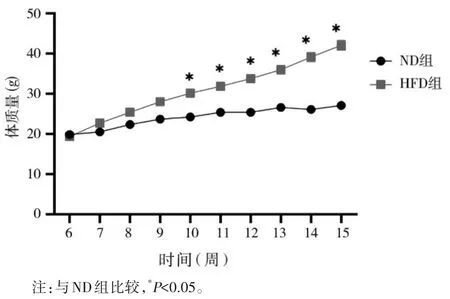
图1 两组小鼠体质量变化比较
2.2 两组脂肪组织seq 质量评估结果 错误率均<0.1%,Q20>85%,Q30>80%,说明本次测序获得的数据准确可靠。见表2。

表2 测序数据质控统计结果(%)
2.3 PCA分析结果 各个组可较为明显的区分,每组组内样本均聚成各自较为独立的区域,组内的差异性明显小于组间的差异性。见图2。
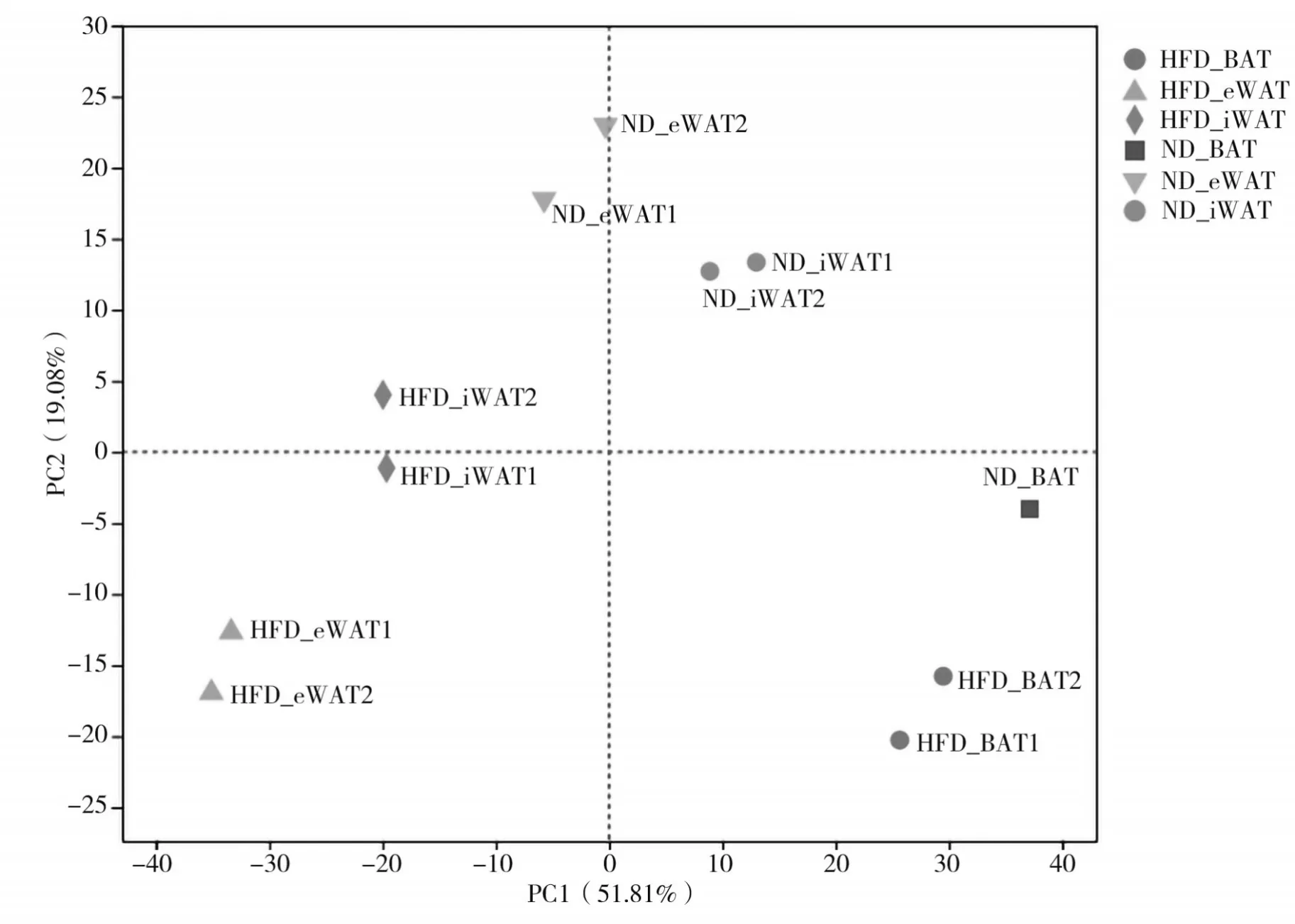
图2 PCA分析结果
2.4 差异表达基因筛选结果 在iWAT 中表达上调基因2 548个,表达下调基因2 082个;在eWAT 中表达上调基因3 384 个,表达下调基因2 780 个;在BAT 中表达上调基因1 630 个,表达下调基因1 128个。三种脂肪组织共同差异表达的基因958 个,占10.55%;在iWAT 与eWAT 间共同差异表达的基因1 654 个,占18.22%;在iWAT 与BAT 间共同差异表达的基因331 个,占3.65%;在eWAT 与BAT 间共同差异表达的基因571个,占6.29%。
2.5 差异表达基因GO 功能富集分析结果 HFD组三种脂肪组织的差异表达基因在BP中均有富集。在三种脂肪组织表达全部上调基因中,主要富集在炎症反应和免疫反应等过程;在三种脂肪组织表达全部下调基因中,主要富集在脂质代谢和小分子代谢等过程。见图3。
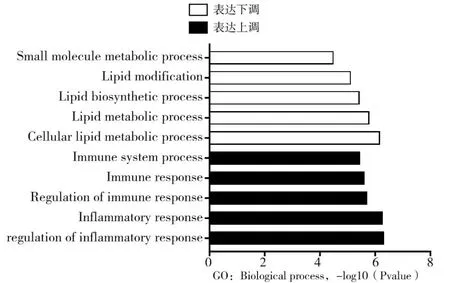
图3 HFD组三种脂肪组织中差异表达基因的GO功能富集分析
2.6 差异表达基因KEGG通路富集分析结果 HFD组三种脂肪组织差异表达基因富集的信号通路包括PI3k-Akt、NF-kappa B、Toll-like receptor、T cell receptor、Insulin信号通路。见图4。
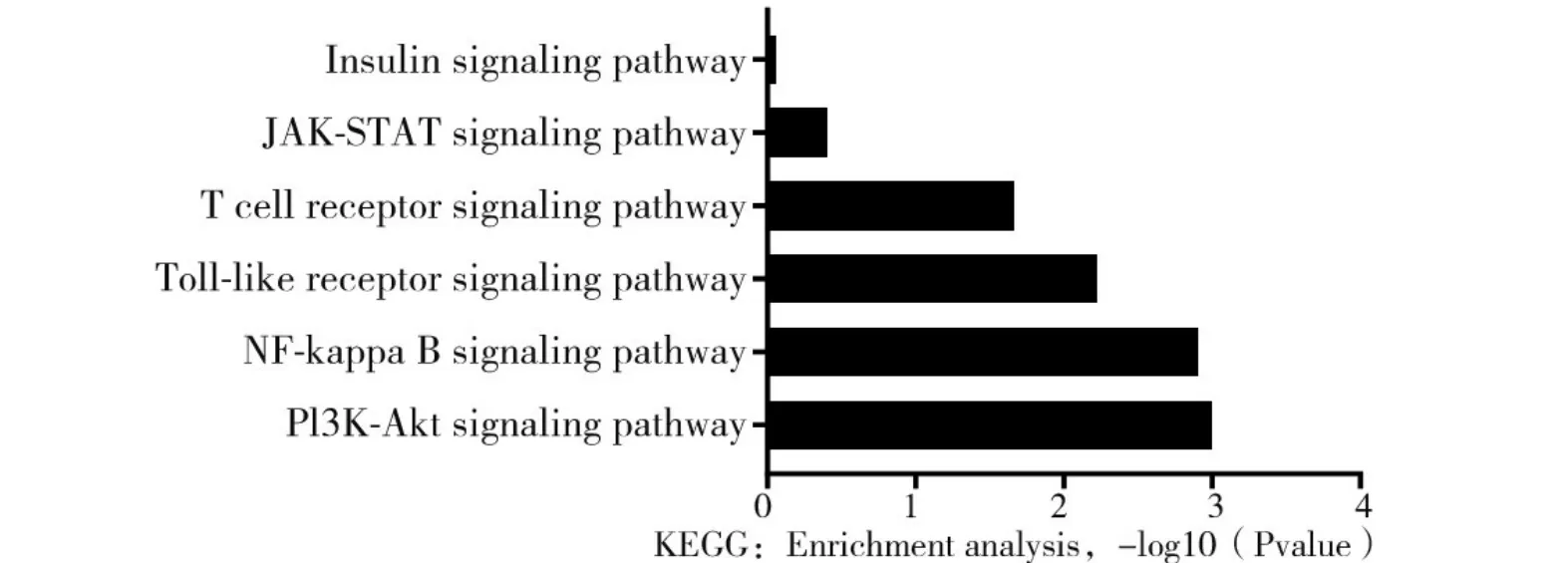
图4 HFD组三种脂肪组织中差异表达基因的KEGG通路富集分析
2.7 不同脂肪组织前20 个与炎症相关表达上调基因 三种脂肪组织中前20 个与炎症相关表达上调基因见表3,其中ITGAD 基因在三种组织中均表达上调。
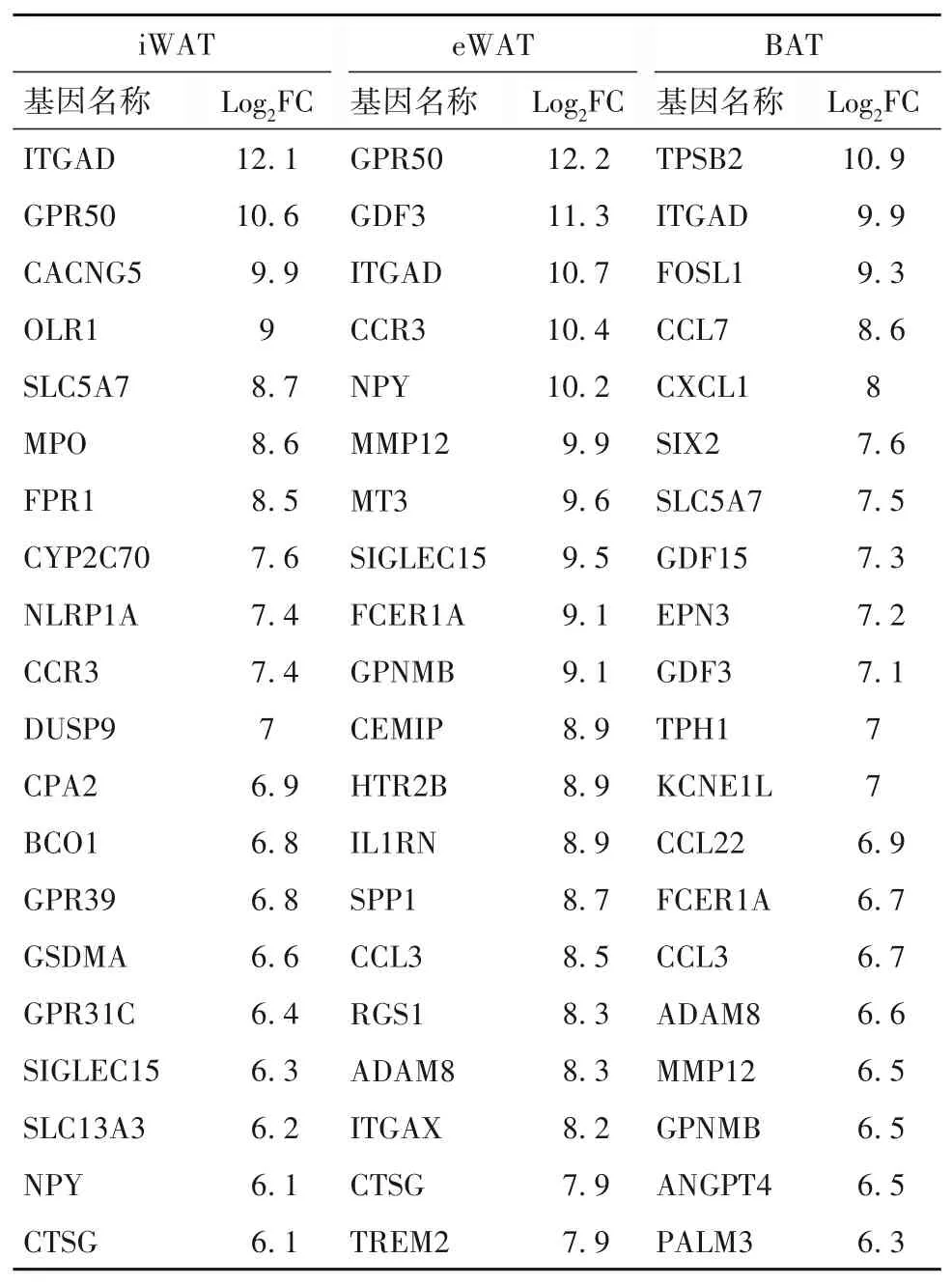
表3 不同脂肪组织前20个与炎症相关表达上调基因
3 讨论
在人类和啮齿动物研究中,由于高脂饮食引起的肥胖,经常观察到脂肪组织和肝脏中有代谢炎症[8]。脂肪组织不仅是被动的能量储存库,还具有调节全身代谢稳态的能力。在肥胖状态下,脂肪细胞会分泌一系列炎症因子,除引起全身性的慢性炎症外,还会使肥胖患者体内代谢紊乱,如胰岛素抵抗、2 型糖尿病、非酒精性脂肪肝等[5]。肥胖和炎症的关系密不可分,相互转化,互为因果。因此可通过减缓或逆转脂肪炎症来抑制肥胖相关疾病的发生。
脂肪组织按其形态和功能可分为WAT 和BAT,而WAT 又可根据解剖位置的不同分为皮下WAT(SAT)和内脏WAT(VAT)。有证据指出,无论是肥胖小鼠[9]还是肥胖人类[10],VAT 中的巨噬细胞要比SAT 中多,而且在肥胖和胰岛素抵抗的情况下,VAT中脂肪细胞的肥大程度也远超于SAT[11]。因此认为VAT 中的炎症反应会比SAT 更加复杂和强烈。与WAT 相比,在生理学和病理学中对BAT 的炎症状态知之甚少。由于BAT 可以将能量以热量的形式耗散来保护动物免受体温过低的影响,故还具有抗肥胖和抗糖尿病的作用。越来越多的证据表明,炎症会通过损害BAT 的能量消耗和葡萄糖摄取能力,直接改变其产热活性[12]。因此,要想真正了解炎症的发生、发展机制,就要从不同脂肪组织在炎症状态下所有差异表达的基因入手。
转录组学是研究生物体内所有基因的表达情况的一项技术,对于研究基因调控、疾病发生和发展、药物研发等具有重要意义。在本研究通过转录组学对高脂饮食诱导的肥胖小鼠模型中的不同组织进行测序。在数据分析过程中需对测序结果进行质量评估,以确保本次测序获得的数据准确可靠。Q 在生物物理学中是碱基识别出错概率的整数映射,用于分析每个碱基被识别错误的概率,其值越高表明碱基识别越可靠。质控标准中的Q20表示该碱基错误的概率为0.01,Q30表示错误率为0.001。一般Q20在85%以上、Q30 在80%以上视为测序质量较好。本研究结果中Q20>85%、Q30>80%,说明本次测序获得的数据准确可靠,可以进行后续分析。
为了挖掘样品间的关系和变异,通过PCA 找出离群样品、判别相似性高的样品簇。研究结果显示最主要的两个主成分方差贡献率分别为51.81%、19.08%,并将平面划分为四部分。从样本的聚类距离来看,HFD 组的iWAT1 和iWAT2、eWAT1 和eWAT2、BAT1 和BAT2 样本间相似性较高,而iWAT、eWAT、BAT 之间则有很大的离群性,同样在ND 组也如此。本研究样品在不同组别(HFD 组和ND 组)和组织(WAT 和BAT)间都呈现了一定的差异性,有利于开展后续的差异表达分析。
由于不同组织间的差异表达基因可能在炎症的发生、发展中起重要作用,因此本研究筛选了不同脂肪组织间的差异表达基因。在三种脂肪组织间表达上调的基因和表达下调的基因各不相同,其中eWAT 表达上调和下调的基因最为显著,而iWAT 次之,BAT 最少。这有可能是脂肪组织的发育起源和功能造成的差异。白色脂肪细胞主要来源于成肌因子5阴性细胞,而棕色脂肪细胞起源于成肌因子5阳性细胞[13]。除起源不同外,它们的生物学功能也完全不同。白色脂肪细胞主要负责能量的储存和动员。此外,白色脂肪细胞还参与激素分泌、免疫应答等过程。另一方面,棕色脂肪细胞则可以通过非颤栗性产热的方式消耗能量以维持核心体温。为一进步探讨炎症和脂肪组织的关系,本研究又对三种脂脂肪组织的差异表达基因做了GO 功能富集分析和KEGG 通路富集分析。GO 功能富集分析显示在三种脂肪组织表达全部上调基因中,主要富集在炎症反应和免疫反应等过程;而在三种脂肪组织表达全部下调基因中,主要富集在脂质代谢和小分子代谢等过程。这是因为越来越多的脂质及其代谢产物被认为是复杂信号通路的关键参与者,这些信号通路以多种方式调节巨噬细胞,如调节巨噬细胞对病原体的反应和吞噬作用[14]。在KEGG 通路富集分析中又得到了充分的验证,一些经典的炎症信号通路包括PI3k-Akt、NF-kappa B、Toll-like receptor、T cell receptor均显著上调。以上结果说明在炎症的发生、发展中三种脂肪组织均发生了强烈的脂质分解和代谢活动,相关基因的参与和调控作用或许可以解释由肥胖引发的炎症向代谢紊乱转变的过程。
虽然在炎症状态下不同脂肪组织间的差异表达基因存在明显差距,但究竟哪些基因在炎症过程发挥主导作用尚不清楚。为了能找出调控炎症的准确靶点,本研究对BAT、iWAT、eWAT 三种脂肪组织中表达上调最明显的前20 个基因进行分析,发现ITGAD 基因在三者中表达上调都比较明显。研究表明,ITGAD 基因参与调控脂肪的新陈代谢和血糖平衡,对动物生长发育和脂肪沉积有重要作用[15]。GPR50 基因在HFD 小鼠的iWAT 和eWAT 中表达上调,但却在BAT 中表达上调不明显。在2 型糖尿病小鼠的脂肪组织中也可以观察到GPR50 的表达显著增加,而GPR50的缺乏增强了3T3-L1细胞的炎症反应,并诱导蛋白激酶B(Akt)和胰岛素受体底物1(IRS1)的磷酸化。此外,敲除3T3-L1 细胞系中GPR50 会抑制过氧化物酶体增殖物激活受体γ(PPARγ)的表达。表明GPR50 可以减轻脂肪细胞中的炎症反应并调节胰岛素信号传导,而这种作用是通过IRS1/AKT 信号通路和PPARγ 表达来介导的[16]。CCR3 基因主要在过敏性鼻炎中发挥作用,它通过抑制过敏性鼻炎小鼠PI3K/Akt通路,降低嗜酸性粒细胞炎症和Th2 免疫反应[17]。GDF3 基因尽管在脂肪细胞和脂肪组织巨噬细胞(ATM)中各有表达,但ATM 被认为是GDF3 的主要来源,其在ATM 中的表达可以通过胰岛素或NOD 样受体热蛋白结构域相关蛋白3 炎症小体来调节[18]。低水平的胰岛素会刺激GDF3的表达,而GDF3会抑制脂肪组织中的脂肪甘油三酯脂肪酶(ATGL)表达和脂肪分解。此外,ATM 中炎症小体介导GDF3激活,并抑制儿茶酚胺诱导的ATGL 活化和衰老小鼠脂肪细胞中的脂肪分解[18]。GDF3 作为激活素受体样激酶7 的配体,降低脂肪细胞中PPARγ 或CCAAT/增强子结合蛋白α 的活性[19]。PPARγ 与GDF3 的增强子结合,并激活其在巨噬细胞中的转录,以控制骨骼肌再生过程中的组织修复[20]。然而,GDF3 在ATM 中的表达如何被调节仍未确定。其余表达上调基因均参与了炎症反应。
综上所述,高脂饮食诱导的肥胖会引发一系列的炎症反应,而不同脂肪组织中的炎症表现也各有差异。在临床中,可将减轻肥胖患者中的脂肪组织炎症反应作为治疗肥胖及其相关代谢疾病的潜在策略。

