L-甲硫氨酸和L-半胱氨酸混合液对抗二氯喹啉酸孔雀稗生长、生理和乙烯信号途径相关基因表达的影响
汪 鹏, 周 浪, 赵 义, 林熠斌, 姚 明, 王向磊, 宋圆圆*,,3
(1.福建农林大学 农学院 作物遗传育种与综合利用教育部重点实验室,福州 350002;2.福建农林大学 作物生物技术福建省高校重点实验室,福州 350002;3.福建农林大学 闽台作物生物育种农业农村部重点实验室,福州 350002;4.山东京卫制药有限公司,山东 泰安 271000)
稻田杂草种类多样,禾本科稗属 (Echinochloaspp.) 植物是危害最为严重的稻田杂草之一,其中孔雀稗Echinochloa crus-pavonis喜深水田,是一些湿地中的恶性杂草[1]。二氯喹啉酸 (quinclorac)是目前水稻田中应用最为广泛的除草剂品种之一[2],属于典型的生长激素类型除草剂,作用机理主要是通过诱导乙烯的生物合成而抑制稗草生长,杂草中毒后症状与生长素过量时相似,高浓度下表现为对植物细胞分裂、节间延长乃至叶、茎生长的显著抑制作用,并最终使植株枯黄、坏死[3-5]。二氯喹啉酸能被稗属杂草吸收进入植株体内并迅速传导,进一步诱导根部细胞产生乙烯合成的前体物质——1-氨基环丙基-1-羧酸(1-aminocyclopropane-1-carboxylic acid,ACC),再经ACC 氧化酶 (ACC oxidase, ACO) 氧化生成乙烯,在此过程中产生的衍生物氢氰酸 (hydrogen cyanide,HCN)累积在稗草组织中能够抑制稗草的生长[4-7]。因此,二氯喹啉酸诱导乙烯生物合成而引起的氢氰酸积累被认为是该除草剂的主要作用机制[8-9]。
由于频繁、长期使用二氯喹啉酸,田间已出现对二氯喹啉酸具有高水平抗性的稗草生物型群体[10-12]。有研究认为,稗属杂草对二氯喹啉酸抗性的产生是因为ACC 合成酶 (ACC synthase,ACS)的活性受到抑制,导致乙烯生物合成的直接前体ACC 含量不足,致使乙烯的生物合成途径被抑制而造成的[13-14]。β-氰丙氨酸合成酶 (β-cyanoalanine synthase,β-CAS) 活性的提高也可以提升稗属杂草对二氯喹啉酸的抗性[15]。水稻叶片中的β-CAS可以降解乙烯生物合成途径中产生的有毒副产物氢氰酸[16-17],这也是目前植物中所发现的氢氰酸降解的唯一途径。此外,植物体中的一些保护酶如超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT) 和过氧化物酶 (POD) 等也参与了植物对逆境胁迫的适应,这些酶活性的强弱在一定程度上反映了植物抵抗逆境的能力[18-20]。谷胱甘肽S-转移酶 (GSTs) 能够调节氧化还原状态,解毒代谢产物,维持免疫稳态,在植物抵御非生物胁迫时也起着重要作用[21-22]。
现今,有关稗属杂草对二氯喹啉酸抗性的研究大多集中在抗性相关基因方面[23],从代谢角度进行的研究还鲜有报道。氨基酸广泛参与植物的蛋白质合成及多种代谢过程,进而影响植物的生长发育与对逆境胁迫的适应性,而外源施加氨基酸也可作为氮素营养与信号分子影响植物的生长与抗逆[24-27]。现有研究发现,在拟南芥中,外源施加L-谷氨酰胺 (L-Gln)、L-天冬酰胺 (L-Asn) 及L-天冬氨酸 (L-Asp) 等氨基酸可促进植物生长[23,26]。Saeed 等[24]对大豆的研究也发现,添加氨基酸处理显著提高了大豆地上部分生长参数、鲜重和荚果产量。可见,外源施加氨基酸在平衡植物的产量和品质,特别是调节次级代谢产物的水平方面发挥着重要作用。
本研究探索了外源混施L-甲硫氨酸和L-半胱氨酸对二氯喹啉酸抗性孔雀稗抗药性的影响,进一步测定了抗性孔雀稗的生物表型及植株体内保护酶系 (SOD、CAT 及POD) 和解毒酶GSTs 的活性变化,并对乙烯合成通路中ACS、ACO 1和与氰化物解毒相关的β-CAS基因进行了荧光定量PCR 检测,以期探索外源添加L-甲硫氨酸和L-半胱氨酸混合液对抗二氯喹啉酸孔雀稗生长、生理和乙烯信号途径相关基因表达的影响。
1 材料与方法
1.1 供试材料
对二氯喹啉酸具有中高水平抗性的孔雀稗Echinochloa crus-pavonis(编号:3008A-20) 种子由江苏省农业科学院植物保护研究所李永丰研究员提供[28-29],整株水平法测得其GR50值为有效成分1519.23 g/hm2,对二氯喹啉酸的抗性指数为 8.87[28]。试验土壤取自福建农林大学校园农场,过10 mm筛,高压蒸汽湿热灭菌2 次 (每次30 min,103 kPa,121 ℃)。
万分之一电子天平,上海奥豪斯有限公司。RNA 提取试剂盒,上海普洛麦格生物产品有限公司;反转录和荧光定量PCR 试剂盒,北京兰博利德生物技术有限公司。
1.2 试验方法
1.2.1 药剂配制 50% 二氯喹啉酸可湿性粉剂(quinclorac 50% WP) 购自中国江苏省激素研究所股份有限公司,用无菌水配制成10 mmol/L 的母液备用;99%L-甲硫氨酸粉末和99%L-半胱氨酸粉末均购自中国上海麦克林生化科技有限公司,用无菌水配制成10 mmol/L 的1:1 等摩尔浓度混合母液备用。
1.2.2 试验设计 当抗性孔雀稗幼苗生长至12 d(三叶一心左右) 时分别进行以下5 个处理:对照CK,仅添加木村B 营养液 (950 mL) (配方见表1);药剂处理1~4:分别添加1.2.1 节中配制得到的10 mmol/LL-甲硫氨酸与L-半胱氨酸1 : 1 等摩尔浓度氨基酸混合母液20、40、60 和80 mL 至木村B 营养液中 (终体积为950 mL)。将抗性孔雀稗幼苗置于上述5 种不同处理营养液中培养15 d (生长至4 叶一心左右) 后进行各项生理指标的测定;之后再向各处理培养液中分别加入10 mmol/L 的二氯喹啉酸溶液50 mL (终体积为1000 mL,除草剂终浓度为 500 μmol/L),继续培养3 d 后再进行各项生理指标的测定。
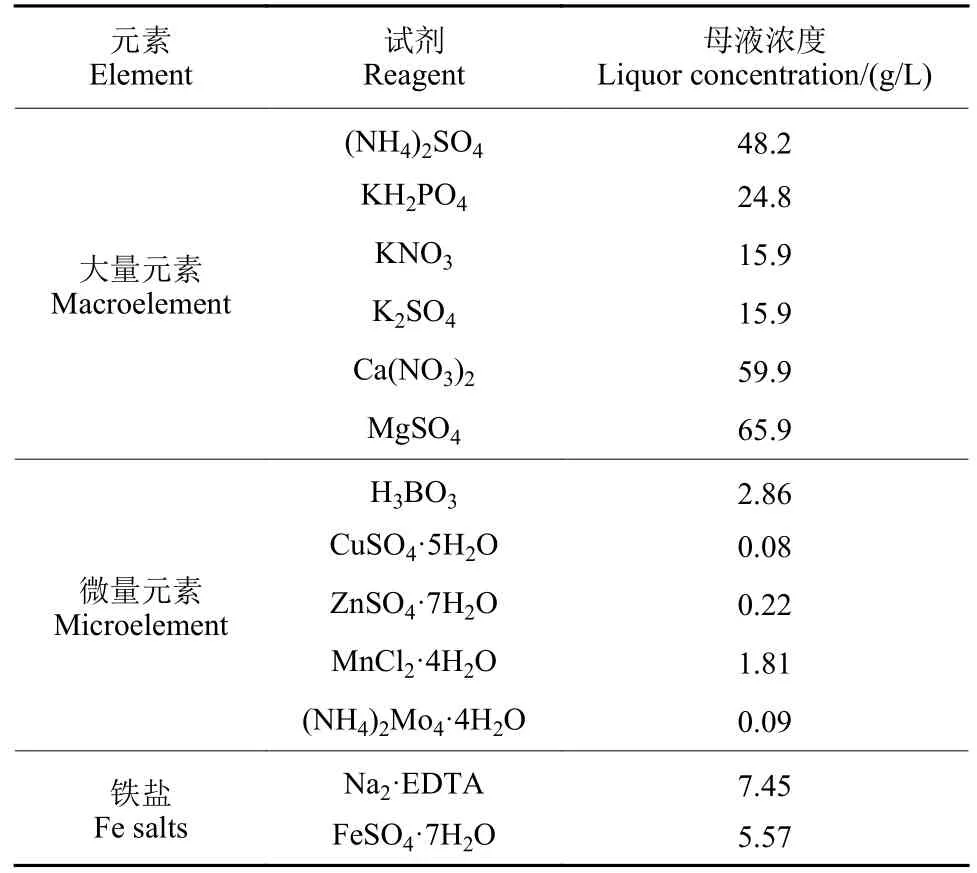
表1 木村B 营养液配方Table 1 Kimura B nutrient salts formula
1.2.3 试验方法 抗性孔雀稗种子用2% 的NaClO 溶液消毒 10 min,无菌水冲洗干净后催芽2 d。将露白的种子移栽至装有灭菌土壤的花盆中培养10 d 后,选取长势一致的幼苗移栽到12.5 cm ×8.5 cm × 11.0 cm 的六孔水培盒中进行水培。每个试验处理设3 个重复 (3 盒),每盒3 株,共9 株抗性孔雀稗。将各处理水培盒随机摆放在玻璃温室中进行培养,光周期14 h/10 h (L/D),维持相对湿度在75%左右,温度20~35 ℃。培养期间每天补充木村B 营养液使各处理塑料盒内培养液总体积维持在1000 mL。
1.3 测定方法
1.3.1 幼苗生长指标测定 分别测量并记录各处理生长18 d 后抗性孔雀稗的根长 (cm) 和株高 (cm),其中根长测量范围为每株植物的最长主根;擦干根系和叶片表面水分,称量整株鲜重 (g) 和根鲜重 (g)。每个处理测定9 株植物。
1.3.2 保护酶和解毒酶活性测定 采集不同处理的抗性孔雀稗叶片各100 mg,加入液氮研磨至粉末状。分别采用紫外吸收法测定CAT 活性[29],氮蓝四唑 (NBT) 还原法测定SOD 活性[29],愈创木酚法测定POD 活性[29],咖啡酸法测定PPO 活性[30],二硝基氯苯法测定GSTs 活性[23]。
1.3.3 总RNA 提取和cDNA 合成 分别称取不同处理的抗性孔雀稗叶片各50 mg,加入液氮研磨至粉末状,参照Eastep® Super 总 RNA 提取试剂盒说明方法提取叶片总RNA,经DNaseI 处理后,吸取 200 ng/μL RNA,采用兰博利德反转录试剂盒逆转录得到cDNA,于 - 80 ℃冰箱冻存备用。
1.3.4 实时荧光定量PCR 分析 依据实验室前期获得的抗性型孔雀稗基因转录组数据[27],根据其基因功能注释结果,基于浙江大学樊龙江教授团队公布的E.crus-galli的CDS sequence[31-33],从抗性孔雀稗基因中挑选与ACS 相关的EC_v6.g023859,与ACO 相关的EC_v6.g050359、EC_v6.g065826和EC_v6.g024163基因,与β-CAS 相关的EC_CAS基因,分别进行实时荧光定量PCR 分析。采用
NCBI Primer-BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 设计用于RT-qPCR 扩增的引物,引物序列见表2 (EC_Actin为内参基因)。根据兰博利德PCR 试剂盒的 Ultra SYBR 三步法荧光定量程序进行荧光定量 PCR 反应,反应条件为:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s,40 个循环。采用 2-ΔΔCT法进行相对定量分析。引物合成由福州尚亚生物工程技术服务有限公司完成。

表2 荧光定量 PCR 分析所用特异性引物Table 2 Specific primers for real-time quantification PCR
1.4 数据处理
使用Microsoft Excel 2016 软件处理数据,通过GraphPad Prism 9 绘制结果图,采用SPSS 20软件分析结果的差异显著性。所有试验均按照完全随机试验设计进行。在统计分析之前,采用Shapiro-Wilk 正态性检验和Levene 方差同质性检验检查数据的正态性 (p> 0.05)。当数据满足方差正态性和同质性假设时,采用方差分析 (ANOVA)(Tukey's post hoc test,p< 0.05) 比较处理组之间的差异显著性。
2 结果与分析
2.1 外源氨基酸混合液对抗性孔雀稗生长的影响
结果如图1 所示,在不添加二氯喹啉酸处理的情况下,不同浓度的L-甲硫氨酸和L-半胱氨酸混合液处理对抗性孔雀稗幼苗生长无明显影响,其根长、株高和鲜重在不同处理组之间及各处理与空白对照之间均无显著性差异。
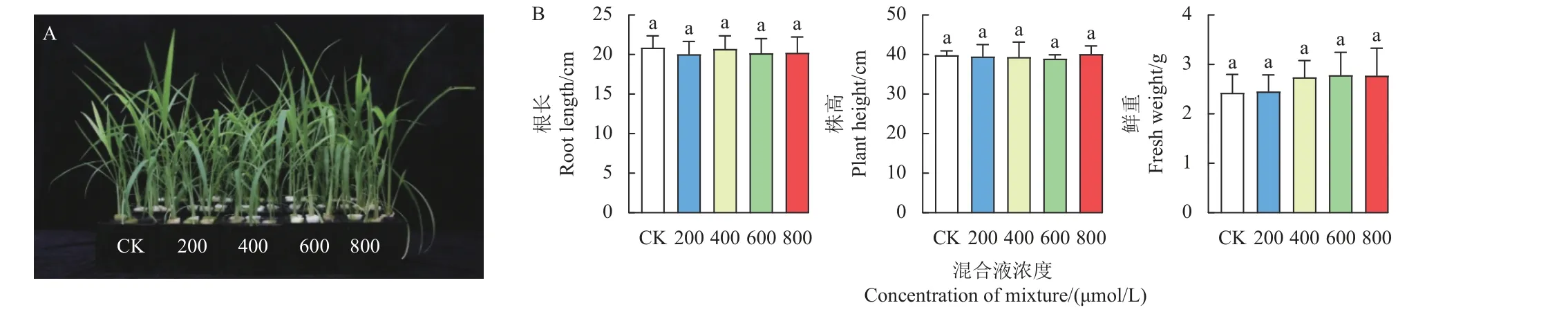
图1 不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液对抗性孔雀稗根长、株高和鲜重的影响Fig.1 Root length, plant height and fresh weight of quinclorac-resistant Echinochloa crus-pavonis plants treated with the equimolar mixture of L-methionine and L-cysteine at different concentrations
2.2 外源氨基酸混合液对抗性孔雀稗相关酶活性的影响
结果见图2。与CK 相比,不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液处理对抗性孔雀稗叶片中SOD 和CAT 酶活性均无显著影响;低浓度 (200 和400 μmol/L) 氨基酸混合液处理组抗性孔雀稗叶片中PPO 酶活性与CK 相比也无显著性差异,而高浓度 (600 和800 μmol/L) 氨基酸混合液处理组PPO 酶活性显著下降,分别比CK 降低了35%和47%;200、600 和800 μmol/L 氨基酸混合液处理组POD 酶活性均被诱导升高,其中800 μmol/L 处理组比CK 提高了64%;200、600和800 μmol/L 氨基酸混合液处理组GSTs 酶活性与CK 相比无显著性差异,但400 μmol/L 氨基酸混合液处理组GSTs 酶活性比CK 提高了14%,差异显著 (p< 0.05)。说明不同浓度L-甲硫氨酸和L-半胱氨酸混合液处理对抗性孔雀稗PPO、POD、GSTs 酶活性存在不同程度影响,但对SOD 和CAT酶活性则几乎无影响。
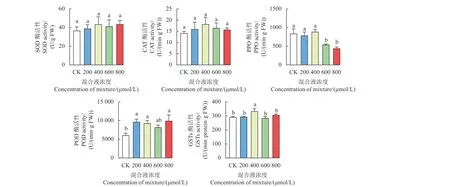
图2 不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液对抗性孔雀稗相关酶活性的影响Fig.2 Enzyme activities of quinclorac-resistant Echinochloa crus-pavonis plants treated with the mixture of L-methionine and L-cysteine at different concentrations
2.3 外源氨基酸混合液对二氯喹啉酸胁迫下抗性孔雀稗耐药性的影响
结果如图3 所示。500 μmol/L 的二氯喹啉酸胁迫对CK 及不同浓度L-甲硫氨酸和L-半胱氨酸混合液预处理组抗性孔雀稗地上部分和地下部分生长均有一定影响。在二氯喹啉酸胁迫下,与CK 相比,800 μmol/L 氨基酸混合液预处理对抗性孔雀稗生长的抑制作用最强 (图3A)。二氯喹啉酸胁迫下,CK 组抗性孔雀稗根系生长受到明显抑制,而200 μmol/L 氨基酸混合液预处理组根系生长受抑制情况相对较轻,但随着氨基酸混合液预处理浓度升高,抗性孔雀稗根系生长受抑制作用变强,即氨基酸混合液对抗性孔雀稗根系生长存在低浓度促进高浓度抑制现象 (图3B)。二氯喹啉酸胁迫下,600 和800 μmol/LL-甲硫氨酸和L-半胱氨酸混合液处理组抗性孔雀稗根系生长状态明显差于 200 和400 μmol/L 氨基酸混合液处理组,表明高浓度氨基酸混合液处理后可能出现了一定程度的根系中毒状况 (图3B)。如图3C 所示,二氯喹啉酸胁迫下,L-甲硫氨酸和L-半胱氨酸混合液处理浓度为 200 μmol/L 时,抗性孔雀稗整株鲜重、株高和根鲜重分别比CK 提高30%、24%和99%,差异显著;600 μmol/L 氨基酸混合液处理组根长与 800 μmol/L 氨基酸混合液处理组之间具有显著差异,但与CK 相比均无显著差异。总体来看,在500 μmol/L 二氯喹啉酸胁迫下,添加L-甲硫氨酸和L-半胱氨酸混合液预处理,对抗性孔雀稗生长存在一定的低浓度促进高浓度抑制现象,说明适当提高L-甲硫氨酸和L-半胱氨酸混合液的施用浓度,可增强二氯喹啉酸对抗性孔雀稗的作用。
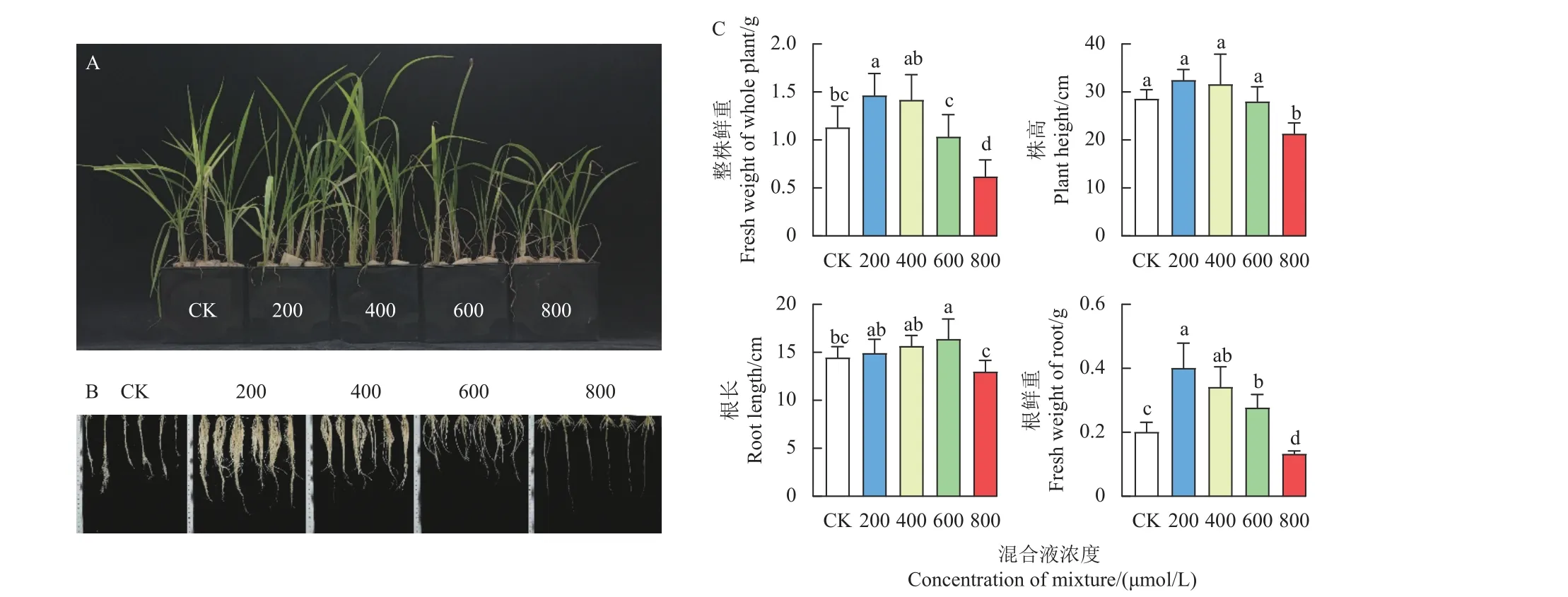
图3 不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液对二氯喹啉酸胁迫下抗性型孔雀稗幼苗生长的影响Fig.3 Effect of pre-treatment with a mixture of L-methionine and L-cysteine at different concentrations on seedling growth of quinclorac-resistant Echinochloa crus-pavonis
2.4 外源氨基酸混合液对二氯喹啉酸胁迫下抗性孔雀稗相关酶活性的影响
结果见图4。在 500 μmol/L 二氯喹啉酸胁迫下,200 μmol/LL-甲硫氨酸和L-半胱氨酸混合液处理组抗性型孔雀稗叶片中SOD 和GSTs 酶活性达到最高,分别比CK 高出22%和22%;800 μmol/L氨基酸混合液处理下则SOD 和GSTs 酶活性最低,分别比CK 低38%和35%,存在显著性差异。二氯喹啉酸胁迫下,不同浓度氨基酸混合液处理组抗性型孔雀稗叶片中CAT 酶活性均显著高于CK;同时,400 μmol/L 氨基酸混合液处理组PPO 酶活性比CK 显著提高了143%;POD 酶活性随着氨基酸混合液处理浓度的升高而升高,到最高浓度800 μmol/L 时则与CK 相比差异不显著。总之,在500 μmol/L 二氯喹啉酸胁迫下,添加不同浓度L-甲硫氨酸和L-半胱氨酸混合液处理,对抗性型孔雀稗叶片中的保护酶和解毒酶如SOD、CAT、PPO、POD 以及GSTs 活性都有不同程度影响,说明施加L-甲硫氨酸和L-半胱氨酸混合液可增强二氯喹啉酸对抗性孔雀稗的作用。
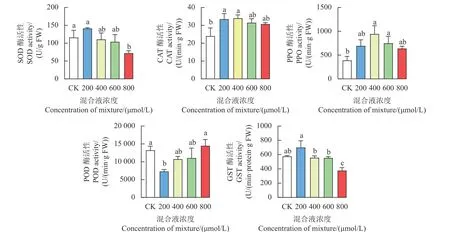
图4 不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液对二氯喹啉酸胁迫下抗性型孔雀稗幼苗抗性相关酶活性的影响Fig.4 Effect of pre-treatment with a mixture of L-methionine and L-cysteine at different concentrations on activities of resistance associated enzymes in seedlings of quinclorac-resistant Echinochloa crus-pavonis
2.5 外源氨基酸混合液对二氯喹啉酸胁迫下抗性孔雀稗基因表达的影响
实时荧光定量PCR 研究发现,在 500 μmol/L二氯喹啉酸胁迫下,与ACC 合成酶 (ACS) 相关的EC_v6.g023859基因表达量随着L-甲硫氨酸和L-半胱氨酸混合液处理浓度的升高而上调,其中800 μmol/L 氨基酸混合液处理组比CK 显著上调了5.44 倍,同时与其他浓度氨基酸混合液处理组之间也均存在显著性差异 (图5A);与ACC 氧化酶 (ACO) 相关的EC_v6.g050359、EC_v6.g065826和EC_v6.g024163基因的表达量随着氨基酸混合液处理浓度的升高而上调,其中800 μmol/L 氨基酸混合液处理组EC_v6.g050359、EC_v6.g065826和EC_v6.g024163基因表达量分别比CK 上调了6.82、77.00 和18.91 倍,其余浓度氨基酸混合液处理组EC_v6.g050359、EC_v6.g065826和EC_v6.g024163的相对表达量与CK 相比也均出现了显著性上调 (图5B、5C、5D);与CK 相比,600 和800 μmol/L 氨基酸混合液处理组EC_CAS基因的表达量也出现了显著上调,上调倍数分别为4.68 和4.35 倍 (图5E)。
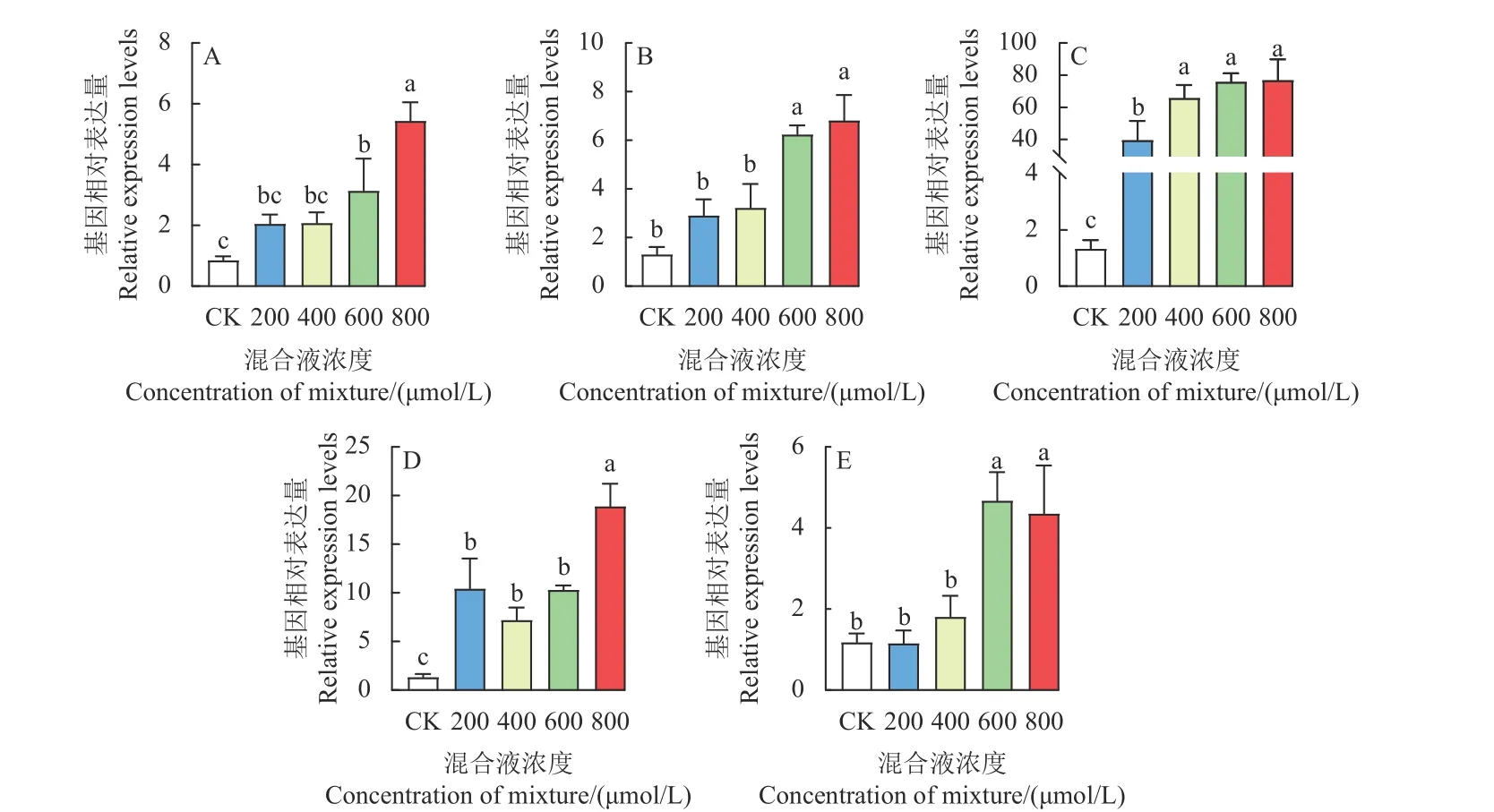
图5 不同浓度L-甲硫氨酸和L-半胱氨酸等比例混合液对二氯喹啉酸胁迫下抗性型孔雀稗ACC 合成酶和ACC 氧化酶及氰化物解毒酶相关基因表达的影响Fig.5 Effect of pre-treatment with a mixture of L-methionine and L-cysteine at different concentrations on expression of ACC synthesis gene, ACC oxidation genes and cyanide detoxification enzyme gene in seedlings of quinclorac-resistant Echinochloa crus- pavonis
3 结论与讨论
氨基酸是蛋白质的结构单元,同时也是很多代谢产物的合成前体,在植物代谢途径中发挥着多种功能。已有研究表明,氨基酸类物质在植物抗逆和生长中、特别是影响次级代谢产物的水平方面具有重要作用[23-24]。氨基酸广泛参与植物的生长发育、抗逆等生理活动,外源氨基酸也可通过参与其他代谢过程和作为信号分子促进植物生长[25-28]。本研究明确了外源添加L-甲硫氨酸和L-半胱氨酸等比例混合液对抗性型孔雀稗抗除草剂二氯喹啉酸的效果:低浓度下,L-甲硫氨酸和L-半胱氨酸混合液处理降低了稗草对除草剂的敏感性,高浓度下则增强了稗草对除草剂的敏感性,即外源添加L-甲硫氨酸和L-半胱氨酸混合液对稗草对二氯喹啉酸耐药性的影响存在低浓度促进高浓度抑制现象。
植物体内相关酶活性升高是增强植物防御能力和解毒能力的前提。已有研究表明,植物体内的保护酶系 (SOD、CAT、PPO、POD) 能够消除逆境胁迫下活性氧的积累,以保证植物的正常生长[20-21],而GSTs 酶能直接轭合除草剂并参与解毒反应,从而使杂草的耐药性增强[18,22]。本研究发现,在500 μmol/L 二氯喹啉酸胁迫下,随着L-甲硫氨酸和L-半胱氨酸混合液处理浓度升高,抗性孔雀稗叶片中SOD、CAT、PPO 和GSTs 酶活性整体均表现为逐渐下降趋势,而POD 酶活性则随着氨基酸混合液处理浓度的升高而逐渐升高。在低浓度 (200 μmol/L) 氨基酸混合液处理下,二氯喹啉酸对抗性孔雀稗的毒害作用被减弱,植物中防御酶SOD、CAT、PPO 以及解毒酶GSTs 活性与CK 相比均有所升高,抗性孔雀稗对除草剂的防御能力和解毒能力得以加强,从而增强了对二氯喹啉酸的抗性;而800 μmol/L 高浓度的氨基酸混合液处理则增强了二氯喹啉酸对抗性孔雀稗的作用,导致叶片出现萎蔫及死亡,根部短小停止生长。总之,在500 μmol/L 二氯喹啉酸胁迫下,抗性型孔雀稗可显著提高保护酶活性以抵御活性氧的积累,保护自身免受除草剂影响,而经过不同浓度的L-甲硫氨酸和L-半胱氨酸混合液处理后,抗性孔雀稗的保护酶和解毒酶活性会发生相应变化,最终导致抗性孔雀稗对除草剂二氯喹啉酸的敏感性发生变化。
有研究表明,二氯喹啉酸对敏感型杂草的主要作用机制是诱导其乙烯生物合成途径中有毒氰化物的积累[8-9]。同时亦有研究发现,乙烯合成的前体物质ACC 含量如果不足,将会导致乙烯的生物合成途径启动失败,致使稗草对二氯喹啉酸抗性增强[14],而β-CAS 酶可以降解在乙烯生物合成途径中产生的有毒氰化物,同样也可提高稗草对二氯喹啉酸的抗性[15-17]。本研究发现,随着L-甲硫氨酸和L-半胱氨酸混合液处理浓度升高,与乙烯生物合成相关基因的表达水平呈上调趋势,导致稗草ACC 的合成及氧化加快,从而产生更多的乙烯,并随之产生更多的HCN,最终导致稗草死亡。另一方面,稗草为了避免自身死亡,调动与氰化物解毒相关β-CAS 基因大量上调表达,加速降解在乙烯生物合成途径中产生的有毒氰化物,从而提高稗草对二氯喹啉酸的抗性。推测在高浓度的L-甲硫氨酸和L-半胱氨酸混合液处理下,植物降解HCN 的速度可能远远低于生成HCN 的速度,导致植物出现萎蔫,甚至最终死亡。
本研究通过不同浓度L-甲硫氨酸和L-半胱氨酸混合液处理抗性孔雀稗后再采用二氯喹啉酸处理,测定了供试稗草的生物表型、酶活性变化以及与乙烯生物合成及氰化物解毒相关基因表达水平的变化,从上述3 个方面研究了氨基酸类代谢物L-甲硫氨酸和L-半胱氨酸混合液对抗性稗草对二氯喹啉酸敏感性的影响。总体而言,外源添加L-甲硫氨酸和L-半胱氨酸混合液对稗草的抗药性具有低浓度下促进高浓度下抑制的作用;外源氨基酸可影响植物保护酶和解毒酶的活性,随着L-甲硫氨酸和L-半胱氨酸混合液浓度升高,稗草抗氧化酶SOD、CAT、PPO 以及解毒酶GSTs 活性整体均表现为逐渐下降趋势,而POD 酶活性则随氨基酸混合液浓度升高而逐渐升高;同时稗草乙烯信号途径ACC 合成酶基因和ACC 氧化酶基因,以及与氰化物解毒相关的β-氰丙氨酸合成酶基因也均随着氨基酸混合液浓度升高而上调表达,可能进一步促进了乙烯代谢产物氢氰酸的形成,进而导致稗草对除草剂的敏感性升高,抗性降低。本研究结果可为降低稻田中除草剂的施用量,以及减轻田间稗属杂草对二氯喹啉酸的抗性提供参考。后续还将通过转录组学和代谢组学进一步对稗草抗药性变化的分子机制进行探究。

