miR-146b-5p调控CD82介导食管鳞状细胞癌恶性表型
谭依依, 黄丛改,2, 郑振渊, 彭天元, 王 薇, 卢晓梅
(1新疆医科大学第一附属医院, 乌鲁木齐 830054; 2西南医科大学附属医院病理科, 四川 泸州 646000;3汕头大学医学院, 广东 汕头 515000)
食管癌(Esophageal cancer,EC)位居全球常见肿瘤第6位[1]。我国是食管癌的高发区,约占全球新发病例的50%[2]。食管癌在组织病理学上可分为食管腺癌(Esophageal adenocarcinoma,EAC)和食管鳞状细胞癌(Esophageal squamous cell carcinoma,ESCC)。我国EC新发病例以ESCC为主,约占 90%[3],但ESCC转移的分子机制尚不清楚。微小核糖核酸(miRNA)是一类非编码短链RNA,通过与靶向mRNA的3′非翻译区(3′UTR)互补序列结合[4],促进mRNA降解或抑制翻译,参与多种生物学功能的调节。近年来,有关miRNA在肿瘤转移中的具体作用越发得到重视。在ESCC中,miRNA在调节肿瘤转移和恶性程度方面形成了复杂的调控网络[5]。本课题组前期基于miRNA表达谱分析发现,miR-146b-5p在ESCC组织中的表达显著上调[6],相似的研究结果在其他肿瘤中也得到了验证[7-9],但miR-146b-5p在ESCC中的具体调控机制尚需阐明。CD82/KAI1是四次跨膜蛋白超家族成员之一,1995年在前列腺癌中被鉴定为肿瘤转移抑制因子[10],该蛋白在正常组织中呈高表达,而在肿瘤组织中表达显著性下调。本课题组前期研究结果显示,CD82在ESCC组织中呈现低表达[11]。其他研究也证实CD82在多种实体瘤中可抑制肿瘤的进展和转移[12-16]。本课题组结合生物信息学miRNA调控靶标预测结果,推测miR-146b-5p可能通过靶向调控CD82介导ESCC的恶性表型。本研究旨在通过生物信息学分析、免疫印迹法、报告基因实验等明确CD82是否是miR-146b-5p的下游靶基因,探究miR-146b-5p对CD82的调控作用,为ESCC转移的治疗寻找新的分子靶点。
1 材料与方法
1.1 研究对象在前期研究选取的6对ESCC患者miRNA表达谱分析的基础上,本研究扩大样本量,选取2020年10月-2021年12月在四川省西南医科大学附属医院行食管癌根治术治疗的38名ESCC患者的癌组织和癌旁正常组织(NAT)样本。NAT距肿瘤边缘5 cm以上,病理证实未见肿瘤细胞浸润。纳入标准:(1)组织病理学诊断为ESCC;(2)术前未接受任何放疗或化疗;(3)临床病理资料完整。排除标准:(1)其他恶性肿瘤患者;(2)有输血和免疫治疗史者。本研究已通过西南医科大学附属医院医学伦理委员会审批(审批号:KY2022274),所有患者均已签署知情同意书。
1.2 实验方法
1.2.1 主要试剂 人ESCC细胞系KYSE30、KYSE150、KYSE510和人胚肾细胞293T细胞由汕头大学医学院肿瘤研究中心赠送。CD82抗体(武汉三鹰,货号:66803-1-Ig),GAPDH抗体(美国ImmunoWay生物技术,货号:YM3029),jetPRIME转染试剂(法国polyplus公司,货号:1010000),miR-146b-5p原位杂交试剂盒(博士德生物,货号:MK11220),DAB染色试剂盒(中山金桥生物,货号:ZLI-9018),psiCHECK(TM)-2-hCD82_3′UTR野生型(wt)和psiCHECK(TM)-2-hCD82_3′UTR突变型(mut)质粒均购自云舟生物科技(广州)股份有限公司;双荧光素酶报告基因试剂盒(诺唯赞生物,货号:DL101),EdU-594细胞增殖检测试剂盒(碧云天公司,货号:C0078),miR-146b-5p抑制剂(miR-146b-5p inhibitor)、miR-146b-5p模拟物(miR-146b-5p mimic)均购自上海吉玛制药技术有限公司,LV-hsa-miR-146b-5p sponge和LV-hsa-miR-146b购自汉恒生物科技(上海)有限公司。
1.2.2 原位杂交 miR-146b-5p原位杂交试剂盒和配套试剂均严格按照说明书操作。所有载玻片在42℃培养箱中孵育过夜,DAB染色后在显微镜下观察。has-miR-146b-5p靶基因序列:5′-UGAGAACU-GAAUUCCAUAGGCUG-3′。has-miR-146b-5p探针序列:5′-CAGCCTATGGAATTCAGTTCTCA-3′。
1.2.3 细胞转染 取对数生长期细胞接种于12孔板中培养过夜,细胞融合度为50%时进行转染。分别取100 μL jetPRIME buffer,加入终浓度10 nmol/L的阴性对照(Negativecontrol,NC)、inhibitor或mimic,再加入3 μL jetPRIME reagent,孵育10 min后滴加于细胞培养液中,24 h后更换新鲜培养液。转染48 h进行后续检测。按此方法分为NC组(阴性对照)、inhibitor组(miR-146b-5p抑制剂处理)、mimic组(miR-146b-5p模拟物处理)。慢病毒稳转细胞系构建:细胞融合度10%左右时,弃去原有培养基,加入1/2体积新鲜培养基,滴加病毒液进行感染,4 h后补足至完全培养体积。24 h后更换新鲜培养基,48 h后荧光显微镜观察细胞状态,加入嘌呤霉素进行细胞筛选,筛选终浓度为2 μg/mL,持续7 d,维持终浓度为1 μg/mL。按此方法分为NC组(阴性对照)、KD组(敲低组,即感染LV-hsa-miR-146b-5p sponge)、OE组(过表达组,即感染LV-hsa-miR-146b)。
1.2.4 双荧光素酶报告基因实验 ENCORI数据库预测miR-146b-5p与CD82结合位点(https://rnasysu.com/encori/)[17],由云舟生物构建携带双荧光素酶报告基因启动子的野生型CD82′(wt)质粒psiCHECK(TM)-2-hCD82_3′UTR(wt)和该结合位点突变型CD82(mut)质粒psiCHECK(TM)-2-hCD82_3′UTR (mut),在293T细胞、KYSE150、KYSE510细胞中与miR-146b-5p mimic共转染。48 h后使用报告基因检测试剂盒检测细胞荧光强度。
1.2.5 免疫印迹法(Western-blot) 用10%SDS-PAGE凝胶电泳转膜,5%脱脂牛奶室温封闭1~2 h,加入一抗(1∶5 000稀释),4℃孵育过夜。加入二抗(1∶10 000稀释),室温孵育2 h。1×TBST洗膜3次,每次10 min,化学发光显影。
1.2.6 条件培养基(Conditional medium, CM)制备 提前一天弃去培养皿中原有培养基,加入无血清1640培养基,培养细胞24 h后吸出培养基,室温,1 000 r/min,离心10 min,使用0.45 μM滤膜的无菌过滤器过滤上清,获得条件培养基,-80℃保存。使用时,冰上解冻,以1∶1的比例混合条件培养基和无血清1640培养基,培养ESCC细胞24 h后进行划痕实验。用NC-CM表示使用NC来源CM处理,KD-CM表示使用KD组来源CM处理,OE-CM表示使用OE组来源CM处理。
1.2.7 细胞增殖与划痕实验 提前一天将细胞按每组6个复孔,每孔以1×104个接种于96孔板。用细胞培养基配制2×EdU工作液,与培养基等体积加入孔板,使EdU终浓度为10 μmol/L,37℃培养箱孵育2 h。标记完成后,4%多聚甲醛室温固定15 min,含0.3% Triton X-100的PBS室温孵育10~15 min。加入Click反应液,室温避光孵育30 min。按1∶1 000比例用PBS稀释Hoechst 33342 (×1 000),室温避光孵育30 min,活细胞工作站检测EdU阳性细胞比例并拍照。在12孔板中接种细胞,细胞融合度80%左右时更换无血清培养基,饥饿处理24 h,每组3个复孔,每个复孔平行划3条划痕,更换2%FBS的1640培养基继续培养。0 h、12 h和24 h拍照记录。划痕愈合比例=(0 h划痕面积-24 h划痕面积)/0 h划痕面积×100%。
1.2.8 短发夹RNA(shRNA)设计构建与包装 使用默克(Merck)公司预设计shRNA工具(https://www.sigmaaldrich.cn)检索CD82的shRNA序列,序列均位于CD82 3′UTR区,序列及引物见表1。载体使用pLKO.1质粒,所构建质粒经测序比对无误。转染后细胞分组为pLKO.1组(即空载组)、shCD82-1组(使用shCD82-1敲低CD82)、shCD82-2组(使用shCD82-2敲低CD82)。在此基础上,用miR-146b-5p抑制剂或模拟物处理细胞,分为pLKO.1+inhibitor组、pLKO.1+mimic组、shCD82-2+inhibitor组、shCD82-2+mimic组。

表1 shRNA-CD82引物
2 结果
2.1 miR-146b-5p在ESCC组织和NAT中表达水平比较原位杂交实验结果显示,miR-146b-5p在ESCC组织中的阳性表达率为86.8%(33/38),在NAT中的阳性表达率为28.9%(11/38)。与NAT组织病理评分(1.32±1.99)比较,miR-146b-5p在ESCC组织中的病理评分(3.16±1.81)较高,差异有统计学意义(P<0.05),见图1。
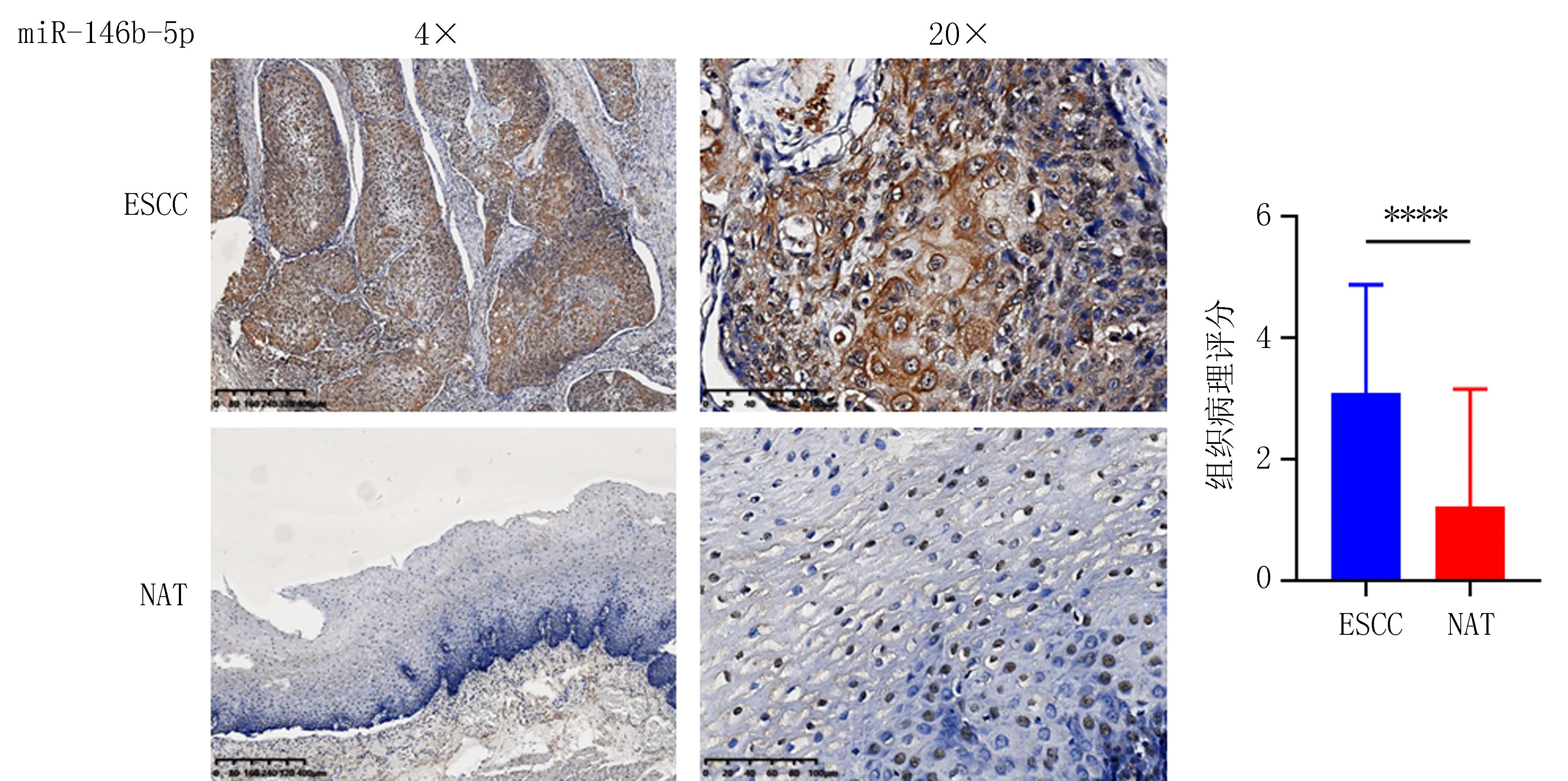
注:与NAT比较, ****P<0.000 1。
2.2 细胞功能实验结果比较EdU细胞增殖实验结果显示,与NC组EdU阳性细胞比例(55.00±4.04)比较,inhibitor组EdU阳性细胞比例(33.53±2.84)显著下降,mimic组EdU阳性细胞比例(63.80±1.82)显著上升(P均<0.05)。经慢病毒处理后,与NC组EdU阳性细胞比例(70.75±4.07)比较,KD组EdU阳性细胞比例(54.75±10.10)显著降低(P<0.05),其余组比较差异无统计学意义(P>0.05)。细胞划痕实验结果显示,在经慢病毒处理后的KYSE30细胞,与NC组划痕愈合比例(54.86±9.64)比较,KD组划痕愈合比例(36.91±7.40)显著下降,OE组划痕愈合比例(92.53±6.18)显著上升(P<0.05);将KYSE150细胞慢病毒处理后,与NC组划痕愈合比例(49.65±7.89)比较,KD组划痕愈合比例(38.88±6.82)显著下降(P<0.05),OE组划痕愈合比例(50.71±7.64)无统计学差异(P>0.05),见图2A~2D。

注: A-B, EdU细胞增殖实验结果图; C-D, 划痕实验结果图。 与NC组比较, *P<0.05, **P<0.01, ***P<0.001。
2.3 miR-146b-5p与CD82之间的靶向调控作用比较通过ENCORI数据库预测分析寻找miR-146b-5p下游靶基因。在预测的分子中发现肿瘤转移抑制因子CD82。双荧光素酶报告基因实验结果显示,与mut+mimic组比较,wt+mimic组相对荧光强度显著下调(P<0.05),见图3A。Western-blot实验结果显示,与NC组比较,KD组CD82在蛋白水平显著性上调(P<0.05),见图3B。构建的shRNA可抑制ESCC细胞中CD82的表达水平,见图4A。在此基础上,利用inhibitor上调miR-146b-5p的表达水平或mimic下调miR-146b-5p的表达水平。EdU实验结果显示,shCD82-2+inhibitor组和shCD82-2+mimic组EdU阳性细胞比例比较,差异无统计学意义(P>0.05),见图4B。

注: A, shRNA敲低CD82 Western-blot结果图; B, 抑制CD82时调节miR-146b-5p, EdU实验结果图。 与pLKO.1+inhibitor组比较, **P<0.01。
2.4 条件培养基对ESCC细胞恶性表型的影响加入KD组条件培养基后,与NC-CM组细胞划痕愈合比例(51.04±11.18)比较,KD-CM组细胞划痕愈合比例(40.57±5.26)显著下降(P<0.05),其他组无统计学差异(P>0.05),见图5。

注: 与NC-CM组比较, *P<0.05。
3 讨论
基于我国17个肿瘤登记地区的数据显示,近年来ESCC患者的5年生存率有所上升,已达30.3%[18],但ESCC仍对我国国民健康造成沉重负担,预后仍有较大的改善空间。目前,手术治疗是ESCC的主要治疗方式,经手术治疗后的患者短期生存率有所上升,但术后3年复发或转移率高达40%~60%[19],导致长期预后仍然较差。因此,探明ESCC进展转移的分子机制,对我国食管癌的诊治尤为重要。
本研究通过核酸原位杂交法检测了miR-146b-5p在ESCC组织中为高表达,通过细胞功能实验证明miR-146b-5p在ESCC细胞中发挥促进增殖与迁移的作用。口腔鳞状细胞癌中研究显示,miR-146b-5p在肿瘤成纤维细胞来源外泌体中呈高表达,口腔鳞状细胞癌细胞可通过内化摄取外泌体中的miR-146b-5p,从而增强增殖、迁移和侵袭能力[20],这与本研究结论一致。为明确miR-146b-5p作用的分子机制,通过ENCORI数据库预测CD82可能是miR-146b-5p下游靶基因之一,通过双荧光素酶报告基因实验、western-blot实验结果证明CD82确实是miR-146b-5p的一个直接作用的下游靶基因。CD82作为公认的肿瘤抑制因子,在正常组织中高表达,而在癌组织中的表达则是下调[21]。早期研究认为,CD82的抑癌作用表现在抑制肿瘤转移[22-23]。而近年来部分研究发现,CD82对肿瘤细胞的增殖也有一定的抑制作用[24]。为观察CD82在ESCC细胞增殖中的作用,本研究构建了能够抑制CD82表达的shRNA质粒。通过转染,本研究发现抑制CD82并未能够显著性抑制ESCC细胞的增殖。说明CD82在ESCC细胞增殖中的作用是极其有限的。同时,本研究结果也提示miR-146b-5p主要通过靶向调控CD82在ESCC细胞迁移中发挥重要作用。近期研究发现,CD82可参与外泌体的分泌[25-27],且外泌的CD82可重塑肿瘤微环境,从而影响远处肿瘤细胞的侵袭转移能力。根据前期研究报道[25-27],可推测ESCC组织中CD82表达下调是由于CD82被肿瘤细胞外泌了,从而导致ESCC组织中CD82为低表达[11]。由此,为了模拟外泌的miR-146b-5p,本研究制备了条件培养基进行细胞培养并进行细胞划痕实验。结果显示,与NC-CM组细胞划痕愈合比例比较,KD-CM组细胞划痕愈合比例显著下降。提示miR-146b-5p可通过影响分泌,影响ESCC细胞的迁移。
综上所述,miR-146b-5p主要通过靶向调控CD82介导ESCC细胞的迁移。miR-146b-5p或可作为ESCC转移的潜在生物标志物。miR-146b-5p与CD82之间的靶向调控有望为ESCC治疗提供新靶点。本研究的不足之处在于缺少动物实验,有待后续研究。

