不同剂量腺嘌呤建立脾肾阳虚型慢性肾衰竭大鼠模型的实验研究
刘 晓, 李 悦, 李静茹, 陆 蕾, 谢 娜, 朱慧敏, 舒占钧
(新疆医科大学1第四临床医学院, 2附属中医医院中医药临床研究基地, 乌鲁木齐 830099)
慢性肾脏病(Chronic kidney disease,CKD)是由各种原因引起的,在原发或继发肾脏疾病基础上造成的慢性肾实质损害,我国CKD的患病率约5%~10%,30%~40%的CKD患者在诊断后20年内会发展为慢性肾衰竭(Cronic renal failure,CRF),最终需要接受肾脏替代治疗以维持生命质量[1-3]。有研究表明准确、及时、尽早地对CRF患者进行中医辨证论治,可以有效地改善患者的临床症状及相关指标,延缓CRF进展[4-5]。在众多实验模型中,啮齿类动物被广泛用于研究肾脏疾病诱发的进展机理以及确定潜在的治疗靶点。本研究通过对模型大鼠肾大部分切除法(5/6肾切除法)、单侧输尿管梗阻模型法、阿霉素注射模型法以及腺嘌呤灌胃等多种造模方式进行预实验并进行比较后,确定腺嘌呤灌胃作为本研究的造模方法。本研究通过腺嘌呤灌胃建立脾肾阳虚型慢性肾衰竭动物模型,验证腺嘌呤不同剂量灌胃大鼠模型的稳定性和可靠性,通过监测和分析大鼠肌酐(Serum creatinine,Scr)、尿素氮(Blood urea nitrogen,BUN)、24 h尿蛋白定量(24-hour urinary protein quantification,24 h-UTP)水平的变化,并结合肾脏病理学检查,旨在确定腺嘌呤灌胃制备脾肾阳虚型慢性肾衰竭(Chronic kidney disease,CRF)大鼠模型的最佳造模剂量。
1 材料与方法
1.1 动物雄性SD大鼠24只,体重(220±20)g,由新疆医科大学实验动物中心供给。实验动物饲养及观察在新疆医科大学动物实验中心进行。12 h昼夜循环照明,环境温度保持在22~26℃,湿度50%~60%,动物自由进食和饮水。动物实验伦理审批号IACUC-20230217-71。
1.2 造模药物、试剂腺嘌呤(乌鲁木齐经科兴业生物科技有限公司,A8626-25 g,纯度≥99%);Scr、BUN、24 h-UTP试剂盒(南京建成生物工程研究所,C011-2-1、C013-2-1、C035-2-1);苏木素染液(福州迈新生物技术开发有限公司,CTS-1097);伊红染液及中性树胶(北京中杉金桥生物技术有限公司,ZLI-9613、ZLI-9555);马松(Masson)染液(南京建成科技有限公司,D026-1)。
1.3 仪器恒温箱及恒温鼓风干燥箱(上海精宏实验设备有限公司,DNP-9272、DHG);显微镜(Nikon生物显微镜,E200);包埋机(普瑞斯星医疗器械有限公司,PBM-B);烤片机(金华市益迪医疗设备有限公司,YD-AB3);切片机、染色机、组织脱水机(Leica公司,RM2235、AUTOSTAINER XL、ASP300S)。
1.4 分组与造模方法24只SD大鼠适应性喂养1周未见不良反应后,按随机数字表法分为:正常组(n=6)、模型1组(M1组,n=6),模型2组(M2组,n=6)及模型3组(M3组,n=6)。正常组以等量生理盐水灌胃,将腺嘌呤溶于0.9%Nacl中制备成混悬溶液,根据预实验剂量,M1组以腺嘌呤150 mg·kg-1·d-1灌胃;M2组以腺嘌呤200 mg·kg-1·d-1灌胃;M3组以腺嘌呤300 mg·kg-1·d-1灌胃,实验周期3周。
1.5 标本采集方法各组大鼠每周称重记录,于实验开始后第7天、第14天、第21天放入代谢笼中留取尿液,留尿期间禁食不禁水。记录24 h尿量,取10 mL,3 000 r/min离心沉淀,取上清液检测24 h-UTP。实验开始后第7天、第14天以2%戊巴比妥(25 mg/kg) 腹腔注射麻醉,眼眶取血约1.5 mL,以3 000 r/min离心10 min,分离血清检测Scr、BUN。3周结束对大鼠进行称重取材,取材前禁食12 h,禁水4 h。麻醉成功后,腹主动脉取血2 mL,离心后保存待检测。迅速分切肾脏组织,一半置于4%多聚甲醛进行固定,一半置于冻存管中冻存备用。石蜡包埋后切片、染色,行光镜病理组织学检查并摄片。以肉眼和显微镜观察肾脏组织的大体及病理变化。取材结束后断颈处死大鼠。
1.6 观察指标及检测方法
1.6.1 大鼠一般情况 大鼠饮食状况、精神状态、反应活动度、毛发光泽、垫料潮湿、二便等情况。每周大鼠称重,记录24 h尿量。
1.6.2 BUN、Scr及 24 h-UTP水平 BUN 采用脲酶法,SCr采用苦味酸法,24 h-UTP采用尿蛋白定量试剂盒法。
1.6.3 肾脏组织病理 肾脏组织脱水、透明、包埋、封固、切片后,用苏木-伊红(HE)染色,光镜下观察肾脏组织形态改变。
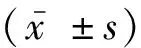
2 结果
2.1 大鼠一般状态正常组精神状态佳,毛色柔顺有光泽,拱背、激惹反应明显,饮食进水及二便皆正常。各模型组大鼠出现不同程度的精神萎靡不振,活动度降低,弓背蜷缩,毛发稀疏无光泽,耳缘及脚趾苍白发凉,小便频数,大便稀溏等现象。见图1。

注: A, 正常组; B, M1组; C, M2组; D, M3组。
2.2 大鼠体重、24 h尿量、Scr、BUN及24 h-UTP水平变化与正常组大鼠比较,各模型组大鼠体重均有不同程度的减轻(P<0.05),造模第2周,与M1组大鼠体重比较,M2组、M3组大鼠差异均有统计学意义(P<0.05)。与正常组大鼠比较,各模型组大鼠24 h尿量明显增多(P<0.05),Scr、BUN及24 h-UTP水平均升高(P<0.05),且M3组大鼠各指标升高最明显。各模型组大鼠Scr、BUN及24 h-UTP比较差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠造模前、造模后各项指标变化比较
2.3 大鼠死亡情况造模第3周,M3组死亡1只,其余组未出现死亡情况,见表2。

表2 各组大鼠存活率的比较
2.4 大鼠肾脏外观的比较正常组大鼠双侧肾脏大小适中呈枣红褐色,无明显肿大,表面圆润有光泽,质地柔软,包膜结合紧密,不易剥离。模型组大鼠较正常组明显肿大,颜色苍白,表面凹凸不平,包膜易脱落,肾脏表面有明显的灰白色颗粒状,尤其M3组,出现“大白肾”,触之易碎。见图2。

注: A, 正常组; B, M1组; C, M2组; D: M3组。
2.5 大鼠肾脏病理损伤情况光镜观察下,正常组肾小球结构及数目基本正常,肾小球囊腔、球囊无明显异常,系膜细胞及内皮细胞无增生,未见肾小管坏死或蛋白管型,肾间质未见纤维组织增生。经腺嘌呤灌胃后,各模型组大鼠的肾脏组织出现不同程度的改变,镜下见肾小球形态基本完整,肾小球数目稍减少,其中M2组及M3组肾小球数目减少明显且结构破坏严重;部分近肾小管空泡变性严重,上皮萎缩,刷状缘消失,部分肾小管管腔扩张;肾小球内可见大量黄绿色结晶沉淀物,存在肾间质炎性细胞浸润和纤维组织增生,其中M2组黄绿色结晶沉淀物明显,M1组及M3组见少量结晶沉淀。见图3、4。

注:A,正常组;B,M1组;C,M2组;D:M3组。

注:A,正常组;B,M1组;C,M2组;D:M3组。
3 讨论
CRF是在各种慢性肾脏疾病的基础上,引发肾实质受损破坏,出现肾功能减退直至衰竭的疾病[6]。中医对CRF的认识源于《黄帝内经》,其当属于“水肿”“癃闭”“肾痿”等病的范畴[7]。CRF 的基本病机为本虚标实[8]。本虚多责之于脾肾两虚,因外感六淫、情志内伤、饮食失调、久病劳倦等多种病因累及脾肾,如《素问·至真要大论》云:“湿气大来,土之胜也,寒水受邪,肾病生焉”“诸湿肿满,皆属于脾”。标实常归咎于浊瘀内阻,如《素问·调经论》言:“瘀血不去,其水乃成”。水积之处必是气滞之所,气结之地必是瘀血浊毒之乡。
本实验中随着造模剂量增加及时间延长,大鼠畏寒肢冷、蜷缩抱团取暖、小便频数,大便稀溏及耳缘足部发凉现象越明显,这些现象皆符合中医脾肾阳虚证型。正如《素问·上古天真论》:“肾者主水,受五脏六腑之精而藏之,故五脏盛乃能泻”。若肾阳不足,气化失常,则水液不能气化,而见小便清长,夜尿频多;同时因肾阳不足,命火虚衰,则不能温煦脾土,运化失职,致大便溏泻;而肾阳虚衰,温煦失职,故见畏寒肢冷,蜷卧少动之证。有学者研究证实腺嘌呤所致mTO下游信号的肾脏激活、内质网应激、肾小管损伤、纤维化,其肾脏线粒体功能受损[9]。线粒体为细胞内的负责产生细胞所需能量的重要细胞器,当线粒体功能受损时,细胞无法有效地产生足够的能量,导致身体各部位的血液循环减弱,从而出现畏寒肢冷等症状。
肾间质纤维化是各种原因引起的CKD发展到CRF的共同途径,以肾小管萎缩、肾小球硬化为主要特征[10-11]。 5/6肾切除法制备CRF模型稳定性强,但模型制备时间较长,需二期手术,容易出血、感染甚至死亡[12];单侧输尿管梗阻模型法制备CRF动物模型可用于研究肾小球硬化,适用于CRF早期研究,但其造模时间较长,常用于急性肾衰竭的模型制备,不符合临床慢性肾衰竭慢性渐进病程的发病特点,难以模拟人类CKD到CRF的过程[13];阿霉素注射制备CRF模型对多系统具有较强的毒性,模型死亡率高,需要控制阿霉素造模剂量[14]。腺嘌呤灌胃作为一种常见的CRF制备模型,能够在一定程度上模拟人类慢性肾脏疾病的复杂进展过程。因此本研究确定腺嘌呤灌胃作为造模方法。有研究显示,大鼠经灌胃腺嘌呤不同剂量后,体内尿酸合成加速,在血中呈过饱和状态而形成结晶,沉积于肾间质及髓质,刺激局部,引起肾小管间质纤维化,并波及肾小球的广泛化学炎症反应连续性破坏病变,最终导致肾功能损害[15]。另有研究报道腺嘌呤通过黄嘌呤氧化酶的作用形成极难溶于水的2,8-二羟基腺嘌呤,后者经肾小球滤过,沉积在肾小管,堵塞肾小管腔从而影响氮质化合物的排泄,导致氮质血症,最终形成肾衰;还可以直接损伤肾小管,引起炎症和纤维化反应[16]。本实验结果显示,腺嘌呤破坏肾脏病理学改变是首先通过结晶沉淀破坏肾小管,而后波及肾小球,肾间质被破坏,最终致肾脏功能受损。本实验结果显示,模型大鼠肾脏体积增大,呈现“大白肾”,此肾脏体积变化与实际临床中CRF肾脏体积萎缩有出入,分析原因可能是2,8-二羟基嘌呤堵塞于肾小管,为肾后梗阻性模型,而临床上同属于这一类的梗阻性肾病,其肾脏表现为体积增大和水肿。
CRF动物模型建模成功依据通常有以下几方面[17]:表观指标,包括大鼠一般行为状态、活动情况及24 h尿量等;生化指标,如Scr、BUN、24 h-UTP等;肾脏病理组织指标,如肾小球数量减少、结构破坏,肾小管空泡样变性,管腔扩张可见蛋白管型,中性粒细胞浸润等。依据中医慢性肾衰竭诊疗指南[18],脾肾阳虚型慢性肾衰竭的中医辨证主症:畏寒肢冷;倦怠乏力;气短懒言;食少纳呆;腰酸膝软。次症:腰部冷痛;脘腹胀满;大便不实;夜尿清长。舌淡有齿痕,脉沉弱。本实验中腺嘌呤灌胃制备脾肾阳虚CRF动物模型,大鼠一般行为状态符合中医主症和次症,脾肾阳虚型中医证型吻合度高,实验中不同剂量的腺嘌呤灌胃大鼠3周后,3组模型组的Scr、BUN及24 h-UTP水平均显著高于正常组。考虑M3组死亡率较高且M1组肾脏病理组织改变不明显,综合评价各模型组生化指标及肾脏病理结果,认为M2组更接近临床脾肾阳虚型慢性肾衰竭发展进程,且死亡率较低,符合脾肾阳虚型CRF生理病理学特点。
本实验建立了制备脾肾阳虚型CRF动物模型的较为稳定的造模方法,但仍有局限之处:如估算肾小球滤过率是反映肾脏病变严重程度的一个重要指标,不仅可以反映肾小球的滤过功能,同时也提示肾小管的浓缩功能[19],但是本实验缺乏估算大鼠肾小球滤过率的方法,因此无法通过肾小球滤过率评估CKD的分期;同时本研究发现,随着造模时间延长,大鼠麻醉后苏醒时间随之延长,推测可能与大鼠肾脏功能受损,致使麻醉药物在大鼠体内代谢及排泄减缓有关。提示在后期实验中,需要根据大鼠灌胃浓度及周期适量减少麻醉药物的配比浓度,或减少麻醉药物的剂量。
综上所述,腺嘌呤灌胃建立脾肾阳虚动物模型方法可行,在后续研究药物干预脾肾阳虚型CRF中具有一定的应用价值。

