尿PSA与其他危险因素交互作用对老年前列腺增生的预警作用研究
卢晓霞, 庄茂军, 李 健
(吉林省白山市中心医院1检验科, 2心内科, 3泌尿科, 吉林 白山 134300)
前列腺增生是临床常见的一种老年男性泌尿系统疾病,随着我国人口老龄化速度加快,该病发病趋势也在逐步递增[1]。前列腺增生在组织学和解剖学上主要表现为前列腺体的增生和体积的增大,在功能上主要表现为排尿困难、尿频、尿急、夜尿增多等排尿相关的异常,对于控制不佳的患者,严重情况下还会出现急性尿潴留、上尿路积水或肾功能损害,严重影响了患者的生活质量[2-3]。前列腺增生发病机制复杂,部位隐蔽,潜伏时间长且症状不明显,早期诊断较为困难[4]。尿PSA是检测老年前列腺增生的重要指标,对老年前列腺增生的预警起着重要的作用[5]。本研究中分析了尿PSA与其他危险因素交互作用对老年前列腺增生的预警作用,现报道如下。
1 对象与方法
1.1 研究对象选取2021年5月至2023年5月本院收治的97例老年前列腺增生患者为研究组,年龄66~84岁,平均年龄(75.41±8.45)岁,另选取84例同期来自体检中心健康老年人为对照组,年龄66~83岁,平均年龄(74.47±8.37)岁,所有患者均在我院进行治疗,患者对本次研究内容均已知情并签署知情同意书。
1.2 纳入与排除标准纳入标准:所有患者符合文献[6]中对于老年前列腺增生患者的诊断标准;年龄>60周岁;均经影像学检查确诊;精神、意志正常;口齿清晰,言语通常。排除标准:非增生性前列腺肥大;膀胱结石或严重泌尿系感染;合并其他恶性肿瘤、自身免疫疾病、血液系统疾病;存在脑静脉窦血栓;存在急性出血倾向;心、肝、肾功能障碍者;临床资料不完整者。
1.3 方法
1.3.1 尿PSA、血清PSA水平检测 于治疗前,所有患者于清晨进行留尿准备,随后进行导尿,留取清洁中段尿4 mL,充分混合后,使用罗氏601釆用化学发光法进行检测,记录尿中PSA含量。采集患者清晨8∶00空腹静脉血6 mL,离心处理10 min,3 000 r/min,取上层清液,-80℃保存,待检。使用化学发光法检测血清PSA水平。
1.3.2 氧化应激标志物水平检测 于治疗前,采集患者清晨8∶00空腹静脉血6 mL,以转速3 000 r/min离心处理10 min,取上层清液,-80℃保存,待检。将其中1/2血清使用ELISA法检测丙二醛(MDA)水平,使用碳酸盐缓冲液,将待测液稀释,后倒入孔中,4℃下过夜处理,后弃去,洗净,孔中加入1%牛血清白蛋白(BSA),37℃孵育60 min,后弃去,洗净,稀释抗血清,每孔加入0.1 mL,37℃下进行轻微摇晃40 min,后弃去,冲洗干净,使用3,3′,5′,5′-四甲基联苯胺(TMB)进行显色处理,后在450 nm波长下检测OD值。将剩余血清在分离后2 h使用全自动生化分析仪,分别采用比色法、邻苯三酚底物法对超氧化物歧化酶(SOD)、总抗氧化物(TAS)进行检测。
1.3.3 临床资料收集 收集患者的资料进行统计记录,包括年龄(<70岁,≥70岁)、肥胖(体质指数≥28 kg/m2)、逼尿肌功能异常(是,否)、高血压(有,无)、雄激素水平升高(是,否)、糖尿病(有,无)、高脂血症(有,无)、膀胱颈纤维化(是,否)、高盐饮食(是,否)、肉眼血尿病史(有,无)、泌尿系感染(有,无)、前列腺炎症(有,无)等情况。
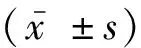
2 结果
2.1 两组患者尿PSA、血清PSA水平对比与对照组相比,研究组患者尿PSA、血清PSA表达水平升高,差异具有统计学意义(P<0.05)。见表1。

表1 两组患者尿PSA水平对比
2.2 两组患者氧化应激标志物水平对比与对照组相比,研究组患者超氧化物岐化酶(SOD)、总抗氧化物(TAS)表达水平降低,丙二醛(MDA)表达水平升高,差异具有统计学意义(P<0.05)。见表2。

表2 两组患者氧化应激标志物水平对比
2.3 老年前列腺增生的单因素分析单因素分析显示,老年前列腺增生的发生与年龄、高脂血症、肉眼血尿病史、泌尿系感染无关(P>0.05);与肥胖、逼尿肌功能异常、高血压、雄激素水平升高、糖尿病、膀胱颈纤维化、高盐饮食、前列腺炎症有关(P<0.05);肥胖(体质指数≥ 28 kg/m2)、逼尿肌功能异常、高血压、雄激素水平升高、糖尿病、膀胱颈纤维化、高盐饮食、前列腺炎症的老年患者前列腺增生发生率较高,差异具有统计学意义(P<0.05)。见表3。

表3 老年前列腺增生的单因素分析
2.4 老年前列腺增生的多因素Logistics回归分析以老年前列腺增生为因变量(未发生=0;发生=1),选择单因素分析中P<0.05的变量进行多因素Logistics回归分析,结果显示,肥胖、逼尿肌功能异常、高血压、雄激素水平升高、糖尿病、膀胱颈纤维化、高盐饮食、前列腺炎症、尿PSA、血清PSA为影响老年前列腺增生的危险因素(P<0.05)。见表4、5。

表4 自变量赋值

表5 老年前列腺增生的多因素Logistics回归分析
2.5 尿PSA与其他危险因素交互作用对老年前列腺增生的影响分析尿PSA与其他危险因素交互作用对老年患者前列腺增生的影响,结果显示,尿PSA与老年患者前列腺增生存在乘积交互作用(P<0.05)。见表6。

表6 尿PSA与其他危险因素交互作用对老年前列腺增生的影响
3 讨论
老年前列腺增生分为内外两层,内层为尿道周围的粘膜和粘膜下结节大而软的纤维肌腺;外层为腺体小而硬的纤维肌型增生向外压迫的前列腺体,同时也只是前列腺的主体,两层之间被纤维膜隔开[8]。前列腺增生主要发生在内层腺体间质中,而腺体间质中的增生组织以结缔组织和平滑肌为主,其增大的腺囊、增生腺管上皮呈乳头状向囊腔内突出,形成间质腺样组织的混合性结节[9]。老年前列腺增生影响因素复杂,了解老年前列腺增生的危险因素,早期对疾病进行诊断,提供新的治疗目标,在预警老年前列腺增生中具有重要意义[10]。
尿PSA是由前列腺上皮细胞分泌产生,具有丝氨酸蛋白酶活性,在正常前列腺组织中以低浓度形式存在,主要起到液化精液的作用,具有较高的组织特异性[11]。尿PSA是早期诊断老年前列腺增生的标志物,与年龄、肥胖、高血压等危险因素的交互作用对老年前列腺增生有着预警的作用[12]。SOD是生物体内存在的一种抗氧化金属酶,可以催化超氧自由基歧化生成氧和过氧化氢,是生物体内最重要的且最佳的自由基清除剂,在一定程度上反映了前列腺增生发展情况[13]。TAS可反映机体抗氧化能力,有助于抵抗氧化应激反应和炎症反应,是前列腺增生患者体内抗氧化标志物[14]。本研究显示,老年前列腺增生患者中尿PSA、MDA表达水平升高,SOD、TAS表达水平降低,提示前列腺增生患者体内氧化应激紊乱。
薄化君等[15]研究显示,老年人群机体免疫力下降,基础病较多,前列腺体积也会随着年龄的增加而增大,从而导致前列腺增生的发生率增加。肥胖会导致体内激素水平发生改变,由雄激素转化为雌激素,从而对前列腺组织产生影响。此外,肥胖会导致体内炎症反应增加,从而加重前列腺组织损伤,引起前列腺增生[16]。高血压也是老年患者常见疾病,其前列腺增生和高血压间存在密切关系,高血压尤其是舒张压的升高,能够促进前列腺增生发生、发展,同时还可以促进前列腺组织血管新生,从而导致前列腺增生肥大[17]。雄激素是调控前列腺生长发育的重要激素,是前列腺增生的另外一个决定性因素[18]。当尿道受到严重压迫时,会产生下腹部坠胀酸痛、睾丸牵拉样疼痛,甚至导致前列腺增生[19]。本研究显示,BMI≥28 kg/m2、高血压、雄激素水平对老年前列腺增生具有预警作用。
钱月亭等[20]有关研究显示,糖尿病患者胰岛素抵抗引起血糖调节紊乱,加速动脉粥样硬化,干扰机体系统功能,激活细胞因子,降低前列腺腺体周围性激素结合蛋白含量,使腺体内尿PSA表达上调,引起上皮细胞进行有丝分裂,从而促进前列腺增生的发生、发展。膀胱颈纤维化容易导致前列腺血液循环异常,代谢产物堆积,使得前列腺管阻塞,腺液排泄不畅,造成前列腺慢性充血,进而诱发前列腺增生[21]。高盐饮食是引起前列腺增生的原因之一,含盐量较高的饮食会导致体内水分潴留,加重患者尿频、尿急等症状。肉类或奶制品组成的饮食会影响二氢雄激素水平升高和其他激素表达水平,同时会增加前列腺增生的风险[22],因此,饮食调整是缓解前列腺增生症状的重要策略之一。炎症通过释放的炎性因子与前列腺基质和上皮细胞相互作用,促进产生前列腺因子,从而导致前列腺增生的发生[23]。本研究显示,膀胱颈纤维化、糖尿病、高盐饮食、前列腺炎症为老年患者前列腺增生的危险因素,尿PSA与危险因素的交互作用可预警老年患者前列腺增生。
综上所述,老年前列腺增生与肥胖、逼尿肌功能异常、高血压、雄激素水平升高、糖尿病、膀胱颈纤维化、高盐饮食、前列腺炎症、尿PSA、血清PSA水平有关,可根据其尿PSA与危险因素交互作用对老年前列腺增生的预警作用,对其危险因素进行控制,从而降低老年前列腺增生的发病率。

