不同黄曲霉菌株强化发酵对浏阳豆豉鲜味形成的影响
周 晓,李 跑,吴梓仟,唐 辉,2,徐巨才,蒋立文,覃业优,刘 洋,
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.广东省粤北食药资源利用与保护重点实验室,广东 韶关 512005;3.五邑大学药学与食品工程学院,广东 江门 529020;4.湖南坛坛香食品科技有限公司,湖南 长沙 410128)
豆豉是我国一种传统发酵豆制品,其中曲霉型豆豉是目前起源最早且分布最广的豆豉之一,占据广泛的消费市场。浏阳豆豉作为湖南省曲霉型豆豉的典型代表,在《中国实业志》上有记载,浏阳豆豉自唐朝时期就因其独特的鲜香滋味而闻名相传[1]。浏阳豆豉采用传统古法工艺,用煮熟的黑豆进行两阶段发酵(制曲和渥堆发酵)[2]。原料豆在微生物所产蛋白酶和自身生长代谢的作用下,将蛋白质、碳水化合物等大分子物质水解成小分子多肽和氨基酸,产生大量的风味物质。而微生物多样性的差异是造成豆豉风味差异的重要原因。然而,现阶段浏阳豆豉的工业化生产工艺尚未完善,多采用自然发酵(natural fermentation,NF)的方式进行生产,群落结构易受到环境、气候等多方面的影响,导致其产品品质稳定性较差[3]。
近年来,多方研究表明,引入特定的微生物强化发酵进行控制和干预,可以在实现模拟NF过程中多菌株共同发酵的同时有效抑制杂菌污染,从而提升产品的稳定性[4]。吴梓仟等[5]利用从浏阳豆豉中鉴定分离出来的两株黄曲霉进一步发酵浏阳豆豉,发现强化发酵能促进浏阳豆豉的蛋白降解及有机酸的形成,最终改善其风味。Chen Yufei等[6]利用黑豆和黑曲菌进行固态强化发酵,结果表明强化发酵显著提高了黑豆的氨基酸态氮含量。Wang Chuan等[7]利用具有高产蛋白酶活性的贝莱斯芽孢杆菌、肠球菌和布拉氏酵母菌3 株菌进行混菌强化发酵,小肽质量分数从4.48%增加至47.4%,豆粕的品质显著提升。目前国内外对浏阳豆豉系统的研究较少,且较多集中于其生产过程中优势微生物的分离鉴定和挥发性风味物质的研究[8-11],少有关于强化发酵对豆豉鲜味提升的调控作用研究。
本研究以陕西肾型小黑豆为原料,利用实验室前期从浏阳豆豉中鉴定并分离纯化出4 株不产毒的优势黄曲霉菌株[2],采用NF、优势黄曲霉菌株(Aspergillus flavus7214、A.flavus7622、A.flavus6112、A.flavus5322)强化发酵以及混菌强化发酵(M4,A.flavus7214∶A.flavus7622∶A.flavus6112∶A.flavus5322=1∶1∶1∶1)制备浏阳豆豉。通过对比不同优势菌株的产蛋白酶能力及酶系组成特点,结合强化发酵豆豉与NF豆豉的氨基酸态氮质量分数、水溶性蛋白质量分数、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)、感官评价以及肽组成情况,分析强化发酵过程中蛋白质降解规律,进一步评价强化发酵菌株对浏阳豆豉鲜味的影响机制,以期为浏阳豆豉的品质提升和工业化生产菌株的选育和开发提供一定的理论支持。
1 材料与方法
1.1 材料与试剂
A.flavus7214、A.flavus5322由实验室从浏阳豆豉分离纯化所得;A.flavus6112、A.flavus7622 中国工业微生物菌种保藏管理中心;M4为将以上4 种黄曲霉等比例混合(1∶1∶1∶1)。
麸皮 山东祥瑞饲料厂;黑豆(陕西肾型小黑豆)湖南坛坛香食品科技有限公司。
氢氧化钠、硼酸、甲醇、乙酸、考马斯亮蓝R-250、甲醛、丙酮、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、柠檬酸、亮氨酸、氯化钠(均为分析纯)国药集团化学试剂有限公司;浓硫酸、浓盐酸(均为分析纯)成都市科隆化学品有限公司;味精、明矾(均为食品级)河南省利捷化工有限公司;苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)抑制剂、天冬氨酸蛋白酶(pepstatin A)抑制剂、半胱氨酸蛋白酶抑制剂E-64、氨肽酶抑制剂(bestatin)(均为分析纯)上海碧云天生物技术有限公司;甘氨酸、十二烷基硫酸钠、β-巯基乙醇、三羟甲基氨基甲烷、甘油、丙烯酰胺、过硫酸铵、四甲基乙二胺(均为电泳级)上海麦克林生化科技有限公司;Marker 26616(10~170 kDa)广州赛国生物技术有限公司。
1.2 仪器与设备
LDZX-50 KBS型立式高压蒸汽灭菌锅 上海申安医疗器械厂;BD/BC-521DKM(E)转换型冷藏冷冻箱合肥美的电冰箱有限公司;SPX-250B III型恒温培养箱天津泰斯特仪器有限公司;DW-HL218型超低温冷冻储存箱 中科美菱低温科技有限责任公司;SHZ-82B水浴恒温振荡器 常州金南仪器制造有限公司;AUY220电子天平 日本岛津科技有限公司;TS-5000Z电子舌日本Insent公司;Read Max 1900光吸收全波长酶标仪上海闪谱生物科技有限公司;KDN-19Y凯氏定氮仪上海纤检仪器有限公司;SW-CJ-1FD型无菌操作台苏州净化设备有限公司;SHZ-82B水浴恒温振荡器常州金南仪器制造有限公司;HSS T3色谱柱 美国Waters公司;Ultimate3000-Q Exactive Orbitrap液相色谱-超高分辨质谱联用仪 美国赛默飞世尔科技公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;PHS-3C雷磁pH计 上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 浏阳豆豉的制备
参照吴梓仟等[5]的方法。浏阳豆豉生产工艺如图1所示。

图1 浏阳豆豉生产工艺流程Fig.1 Flow chart for the production process of Liuyang Douchi
将不同豆豉同一批次生产过程中各个阶段的样品,采集后装至已消毒的透明聚乙烯塑料袋中于-20 ℃冻库冷藏。样品采集完毕后,将其置于含有冰袋的泡沫采样箱中低温运回实验室。样品信息如表1所示。

表1 豆豉样品信息Table 1 Sampling information of Douchi
1.3.2 蛋白酶活力测定
蛋白酶抑制剂制备参考Budak等[12]的方法并修改。制备蛋白酶抑制剂,确定PMSF、E-64和bestatin的最终浓度为5 mmol/L,pepstatin A和EDTA最终浓度为10 mmol/L。将5 μL蛋白酶抑制剂加入待测样品中,并在室温孵育40 min后进行测定。蛋白酶活力测定参照GB/T 23527—2009《蛋白酶制剂》采用福林法测定,抑制率根据下式计算:
1.3.3 氨基酸态氮含量测定
参照GB 5009.235—2016《食品中氨基酸态氮的测定》,采用酸度计法测定氨基酸态氮含量。
1.3.4 水溶性蛋白质含量测定
参照NY/T 1205—2006《大豆水溶性蛋白含量的测定》。
1.3.5 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)
参照张远红等[13]的方法并修改。采用三氯乙酸-丙酮沉淀法提取豆豉样品中的蛋白质,冻干备用。取上述干燥样品5 mg置于1.5 mL离心管中,加入100 μL 5×上样缓冲液,振荡30 s,静置10 min。沸水浴加热10 min后10000 r/min离心10 min,上清液即为样液。采用SDSPAGE垂直板电泳不连续系统,分离胶和浓缩胶的体积分数分别为15%和5%。上样体积为8 μL,先恒压70 V至样品进入分离胶,后切换电压至100 V。电泳完成后,用质量分数0.1%考马斯亮蓝R-250染色40 min,再用脱色液(5%(体积分数,后同)甲醇、7%冰乙酸和88%去离子水)进行脱色处理(24~48 h),并于凝胶成像系统上拍照记录。
1.3.6 感官评价
1.3.6.1 感官评定
将豆豉粉与去离子水(1∶10,m/m)混合,在40 ℃下振荡1.5 h,超声提取1.5 h后,过滤,取上清液并于室温条件下离心(10000 r/min,10 min),收集上清液即为豆豉水提取物。感官评估在(25±2)℃的感官评估室中进行。使用9分制对样品的豆豉水提物味道特征进行评估。标准溶液的质量浓度-评分关系如表2所示。
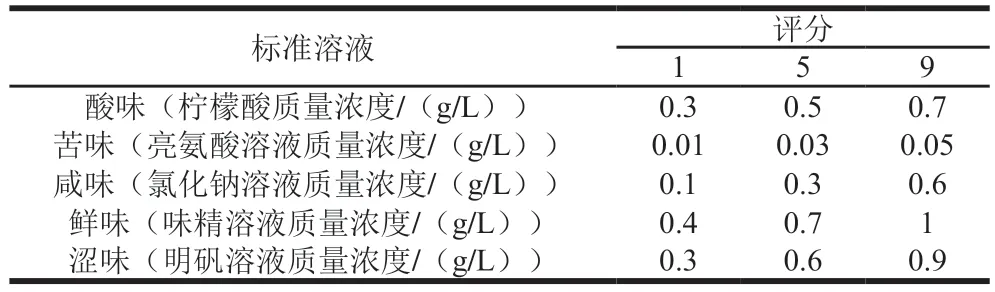
表2 标准溶液评分Table 2 Criteria for sensory evaluation of standard solutions
1.3.6.2 电子舌
样品前处理同1.3.6.1节,测试前,将豆豉水提取物的电导率调节至8.0~8.5 mS/cm。在所有膜的电位在标准味道溶液中稳定后,开始测试。味觉传感器和参比电极共清洗222 s,平衡30 s,每次样品测试持续30 s,回味测试30 s,测试温度控制在20 ℃左右。为确保实验结果的稳定性和准确性,对每个样本进行4 次电子舌测试,取后3 组数据用于后续分析。电子舌传感器对应的基本味道及回味描述见表3。

表3 TS-5000Z电子舌的传感阵列Table 3 Performance descriptions of sensor arrays of electronic tongue TS-5000Z
1.3.7 液相色谱-质谱分析
液相色谱-质谱分析参照苏国万等[14]的方法并加以修改。
样品制备:准确称量0.02~2 mg样品于2~5 mL 离心管中,加入1.5 mL超纯水,过滤膜(0.22 μm)后于超高效液相色谱-电喷雾/四极杆飞行时间串联质谱联用(ultra-high performance liquid chromatographyelectrospray/quadrupole time-of-flight tandem mass spectrometry,UPLC-ESI-Q-TOF-MS/MS)仪上分析检测,进样蛋白质量浓度为2 mg/mL。
液相色谱条件:色谱柱采用HSS T3色谱柱(1.0 mm×100 mm,1.7 μm),进样量1 μL,柱温35 ℃,流速0.05 mL/min。流动相由A液(0.1%的甲酸水溶液)和B液(乙腈)组成,洗脱程序:0~4 min,95% A、5% B;4~6 min,95%~90% A、5%~10% B;6~30 min,90%~60% A、10%~40% B;30~34 min,60%~10% A、40%~90% B;34~40 min,10% A、90% B;40~42 min,10%~95% A、90%~5% B;42~50 min,95% A、5% B。
质谱条件:质谱工作于full MS/DD-MS2模式(正离子采集)下,一级分辨率设置为35000,质荷比范围m/z100~1500,TopN设置为4,轰击能量为梯级能量(20~40~60),二级分辨率设置为35000,动态质荷比采集范围。
1.4 数据处理与分析
所有测试均重复3 次,使用Origin 2021、SPSS Statistics 26和Excel 2016软件进行数据处理,使用OmicStudio工具(https://www.omicstudio.cn/tool)进行相关性热图分析。
2 结果与分析
2.1 不同菌株产蛋白酶特性分析
大豆含有约42%的蛋白质,微生物产生的蛋白酶能催化蛋白质水解生成多肽及小分子氨基酸,其活性也反映了豆豉中蛋白质水解的速率,决定了豆豉发酵成熟的周期。有研究表明,曲霉是发酵食品中重要的蛋白酶来源之一,可促使发酵食品中的蛋白质发生降解[15]。如图2A所示,本实验所有菌株均表现出较强的产蛋白酶活性,其中A.flavus5322菌株活力最强,总蛋白酶活力为(4314.43±26.73)U/g,其次为M4(混菌),A.flavus7622最低,为(2516.62±67.39)U/g,且主要以碱性蛋白酶为主,但由于传统曲霉型豆豉发酵过程为酸性环境[16],碱性蛋白酶活力受到抑制,无法最大程度发挥效果。而从产酸性蛋白酶的分析结果发现,A.flavus5322能力显著高于其余3 种菌及混菌。在曲霉属中鉴定的大多数蛋白酶可分为以下几种:丝氨酸蛋白酶、半胱氨酸蛋白酶、天冬氨酸蛋白酶、氨肽酶和金属蛋白酶,各组主要的抑制剂分别为PMSF、E-64、pepstatin A、bestatin和EDTA[12]。图2B结果表明,各菌株的蛋白酶主要受PMSF抑制剂的影响,且在A.flavus5322中表现最为强烈,抑制率高达33.79%。E-64、pepstatin A和bestatin的抑制率在所有样品中普遍较低。EDTA的整体抑制效果较PMSF弱,但在不同菌株中检测到的抑制活性差异较大,在M4(混菌)中表现出最高的抑制活性。表明4 株黄曲霉菌株中主要以丝氨酸蛋白酶为主,半胱氨酸蛋白酶占比最小。Budak等[12]研究了7 种曲霉的蛋白酶活力,也发现主要蛋白酶为丝氨酸蛋白酶,这与丝氨酸蛋白酶编码基因是曲霉中最大的蛋白酶组分相关。EDTA的抑制效果可能源于其他类别蛋白酶的表达,同时也需要金属离子存在[17-18]。
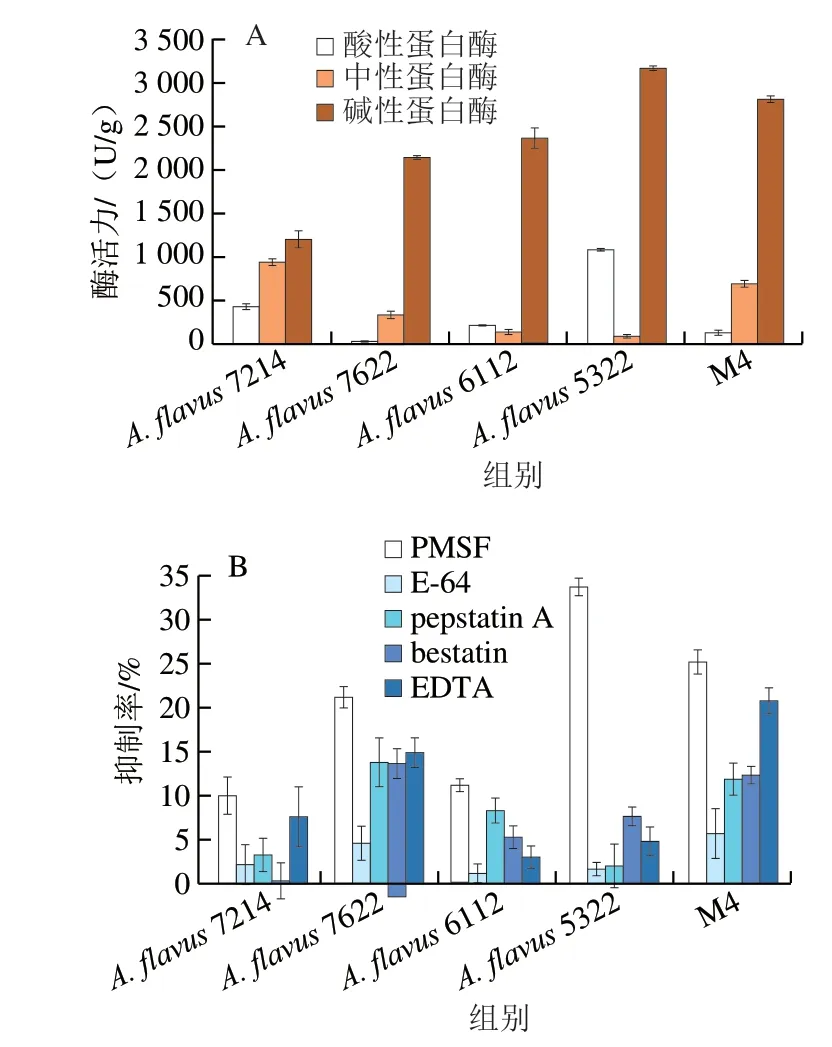
图2 不同菌种关键酶活力分析Fig.2 Activities of key enzymes from different Aspergillus strains
2.2 不同菌种强化发酵豆豉可溶性蛋白质和氨基酸态氮变化规律分析
蛋白质是豆类及其制品的重要成分之一,同时也是食品中重要的营养评定标准之一。如图3A所示,强化发酵豆豉和NF豆豉可溶性蛋白质量分数变化趋势类似,制曲阶段呈缓慢增长,洗霉(S8)工序引起可溶性蛋白质流失,造成其质量分数下降[19]。渥堆阶段出现猛增,且在渥堆24 h(S9)达到最大值。而在渥堆48 h(S10)出现下降,可能随着转桶时食盐的加入,渗透压快速升高,豆豉中的酶系和微生物生长代谢均受到抑制,蛋白质降解能力变弱[20],而微生物生长代谢所需的氮源消耗了之前累积的氨基酸及小肽,导致可溶性蛋白质下降。其中,Q7214豆豉在S6(制曲第6天)降低了0.09%,这可能是不溶性大分子蛋白质的分解速率低于其降解产物被微生物利用的速率,导致其质量分数减少[21]。渥堆结束后,5 种强化发酵豆豉的可溶性蛋白质量分数均高于NF豆豉(1.12%),其中QM4最高,达到1.62%,其次是Q5322(1.38%),说明强化发酵能在一定程度上增强蛋白质的水解。
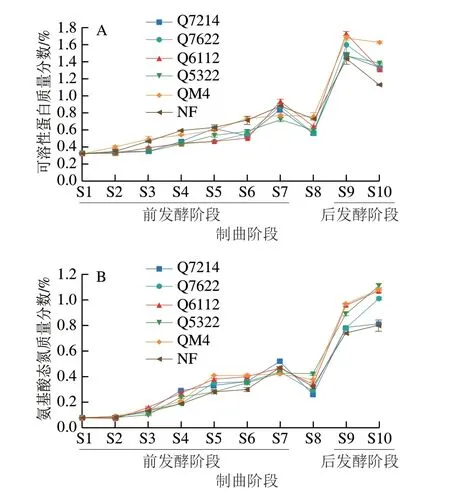
图3 不同菌种强化发酵豆豉可溶性蛋白质(A)和氨基酸态氮(B)变化规律Fig.3 Changes in water-soluble protein (A) and amino acid nitrogen content (B) in Liuyang Douchi fermented by different Aspergillus strains
蛋白质在高温、高湿的发酵环境中,可在微生物和蛋白酶的作用下被分解成肽和氨基酸,因此,氨基酸态氮常作为表征豆豉发酵成熟度的关键因子,反映蛋白质的水解程度[22]。从图3B可以看出,不同豆豉发酵过程中氨基酸态氮的质量分数变化趋势和可溶性蛋白质类似。在制曲阶段(S1~S7)增加缓慢,洗霉阶段的冲洗引起游离氨基酸和肽流失,因此,洗霉后(S8)样品游离氨基酸态氮出现大幅度下降。在渥堆(S8~S10)期间,前24 h蛋白质水解剧烈,导致其迅速上升,而随着食盐的添加,抑制了蛋白酶活性,且部分游离氨基酸参与了美拉德反应,使得氨基酸态氮质量分数增幅减弱,这和陈怡[23]的研究结果类似。通常,传统的发酵豆豉产品含有超过0.2%的游离氨基酸态氮被认为符合质量标准[24]。因此,本研究中5 种强化发酵豆豉氨基酸态氮质量分数(1.11%(Q5322)~0.81%(Q7214))均大于NF豆豉,说明4 株菌株均适宜于豆豉的生产,且能促进蛋白质的水解。
2.3 不同菌种强化发酵豆豉SDS-PAGE变化分析
蛋白质水解作用贯穿了豆豉发酵的全过程,选取豆豉生产过程中不同阶段的样品进行电泳分析。从图4可知,豆豉发酵过程中出现了大豆分离蛋白7S和11S组分的特征亚基条带,即α、α’、β亚基及酸性亚基AS和碱性亚基BS[13],5 种强化发酵豆豉中蛋白质水解趋势大体一致。前发酵阶段(S1~S8)蛋白质水解程度较弱,随着后发酵进行,分子质量在35 kDa以上的条带逐渐模糊,大豆蛋白7S组分和11S酸性亚基AS基本观察不到,发酵结束后(S10)蛋白质水解的最终产物的分子质量主要集中在10~15 kDa之间,说明在后发酵阶段开始,前发酵阶段积累的蛋白酶开始发挥作用,大分子蛋白质被迅速降解,生成小分子蛋白、多肽和氨基酸[25],这与可溶性蛋白质及氨基酸态氮分析结果相符合(图3)。发酵结束后,碱性亚基BS并未消失,说明在大豆发酵过程中,由于两种亚基结构紧密性的差异,亲水性酸性亚基比疏水性碱性亚基更容易降解[26]。同时,从图中可以看出分子质量在10 kDa区域的条带存在明显的阴影区,这可能是因为小分子蛋白质较多,且分子质量相近,导致其难以区分。


图4 不同菌种强化发酵豆豉发酵过程中SDS-PAGE分析Fig.4 SDS-PAGE analysis of Liuyang Douchi fermented by different Aspergillus strains at different fermentation times
2.4 不同菌种强化发酵豆豉滋味评价分析
6 种豆豉样品的感官评价结果如图5A所示。所有样品表现出较强的鲜味和咸味,酸味、苦味和涩味得分较低,但差异也较为明显。强化发酵豆豉中,Q5322鲜味得分最高(7.1),其次是Q6112(7),其余3 种强化发酵豆豉均低于NF(6.9)。豆豉的鲜味主要来源于蛋白质降解生成的鲜味氨基酸和鲜味肽,此结果说明菌株A.flavus5322和A.flavus6112强化发酵能促进鲜味肽的生成。此外,Q5322咸度的增加能提升舌头对鲜味的感知[27],使得Q5322鲜味得分较高。豆豉的酸味来源于发酵过程中碳水化合物的降解[28],QM4酸味得分最低,仅为3.3 分。而苦味可能源于大豆发酵过程蛋白质和肽水解不平衡,导致酶水解产物中产生了苦味[29],虽然苦味会造成豆豉味道欠佳,但适度的苦味可提升豆豉的鲜味[30]。除QM4和Q7214豆豉外,其余3 种强化发酵豆豉苦味相较于NF都出现不同程度的增强,其中Q5322最明显,苦味评分增强了25%。曲霉型豆豉由于制曲过程中的分生孢子而具有一定的涩味[31],5 种强化发酵豆豉的涩味评分均高于NF。

图5 不同菌种强化发酵豆豉滋味评价Fig.5 Radar plots of the taste of Douchi fermented by different Aspergillus strains using sensory evaluation and electronic tongue analysis
电子舌结果表明,6 种豆豉整体风味轮廓相似,酸味得分均低于标样味觉值(-0.17)(图5B)。除Q53222以外,其余豆豉的咸味得分均低于标准溶液味觉值(-0.01)。从苦味来看,Q7622、Q7214、Q6112和QM4相较于NF豆豉都出现一定的增加,其中Q7622提升最为明显,达16.49%。综合来看,Q5322豆豉滋味最浓郁,表现为最强的鲜味、咸味和涩味,与感官评价结果一致;而其苦味得分最低,与感官评价结果相反,可能因为与鲜味-苦味在味觉受体水平上存在拮抗作用[32],电子舌具有单独的味觉传感器,因此苦味评估不受其他风味的影响。
2.5 强化发酵豆豉多肽组成
UPLC-ESI-Q-TOF-MS/MS包括超高压液相色谱技术、电喷雾电离技术以及质谱技术3 个部分,以其高通量和高分辨率为特征,通常被用作肽组学分析的工具。肽组学是一种计算和分析技术,属于蛋白质组学的一个分支和补充,可以对食品中复杂的肽组分进行分类、筛选和鉴定[33]。通常,肽是发酵食品中重要的呈味物质,而鲜味组分的分子质量通常在500 Da以内[15,34]。在本研究中,通过UPLC-QTOF-MS/MS从所有样品中鉴定出131 条短肽(六肽及以下)。进一步通过偏最小二乘判别分析(partial least squares-discrimination analysis,PLS-DA)建立能够区分6 种豆豉的分类模型,以鉴定的肽强度作为X变量,将不同豆豉样品作为Y变量,(1)为0.41,(2)为0.36,共同解释量为0.77,表明该模型稳定可靠,具有较强的预测能力[35]。图6中可聚为3 组,分别为Q5322和NF豆豉、Q7622和Q7214豆豉以及QM4和Q6112豆豉,各组不同豆豉样本之间距离较近,表明两种豆豉在肽组成上相似。生产工艺的相似性可能是导致各组豆豉之间肽组成比较相近的原因。除Q5322强化发酵豆豉外,其余4 种强化发酵豆豉与NF豆豉之间都能实现良好区分,说明其在肽组成和含量上存在较大差异。

图6 不同菌种强化发酵豆豉鲜味肽PLS-DAFig.6 PLS-DA of umami peptides in Douchi fermented by different Aspergillus strains
2.6 强化发酵豆豉潜在鲜味肽分析
为了更直观呈现豆豉中多肽组成对豆豉风味的影响,从已鉴定的6 种豆豉共有多肽中筛选出58 条肽(峰面积百分比>0.1%)与滋味得分情况进行相关性热图分析。如图7A所示,部分多肽与感官鲜味表现出显著相关性。其中WG和LD分别与感官鲜味呈最强的负相关和正相关,而与电子舌相关性分析可以看出,LM和AF表现为较强的负相关,GGL、NL和VN等8 条多肽呈明显正相关。IGS、EK和LS则与感官鲜味和电子舌鲜味中均表现为正相关。EK在Noguchi等[36]的研究中已被证明具有鲜味。目前已鉴定的鲜味肽共有99 条,其中有83 条鲜味肽含有鲜味氨基酸[37]。一般情况下,鲜味氨基酸谷氨酸和天冬氨酸等对短肽的鲜味有重要贡献[37-38]。本实验筛选出36 条含有已知鲜味肽或鲜味氨基酸的短肽及与鲜味呈显著正相关的7 条潜在鲜味肽。

图7 不同菌种强化发酵豆豉鲜味肽分析Fig.7 Analysis of umami peptides in Douchi fermented by different Aspergillus strains
从图7B可知,Q6112和Q5322的潜在鲜味肽总峰面积接近,且明显大于NF豆豉,Q 7214 最低。DL、SV、VS和LD在所有样品中占比最大,且在6 种样品中均大于10%(12.98%~15.75%)。韩富亮等[39]的研究证明,DL具有较强的鲜味,其阈值为2.5 mmol/L。已报道的鲜味肽中,除DL外,VD的相对峰面积在NF中占比达6.17%,在强化发酵豆豉中最高达10.76%(Q7622),最低为6.34%(QM4),EA、VDT、SVE和VG在5 种强化发酵豆豉中的相对峰面积相对于NF豆豉均出现了较大的提升。Azis等[40]通过对豆渣进行强化发酵,也发现米曲霉发酵能提高蛋白质含量、氨基氮含量和蛋白质消化率,促进发酵过程中小分子质量肽和氨基酸的释放。
3 结论
本研究以NF豆豉为对照,不同菌株强化发酵豆豉为实验组,采用理化分析、感官评定结合UPLC-ESIQ-TOF-MS/MS分析不同豆豉发酵过程中的蛋白质降解情况和呈鲜特性差异,并通过相关性分析确定6 种豆豉中与鲜味相关的潜在鲜味肽。蛋白酶活力结果表明,A.flavus5322活力最强,其酸性蛋白酶活性远高于其余3 株菌及混菌,4 株黄曲霉菌株及混菌中的蛋白酶系均以丝氨酸蛋白酶为主。强化发酵豆豉的氨基酸态氮和水溶性蛋白质量分数在渥堆结束后均高于NF,说明强化发酵能在一定程度上促进蛋白质的降解,结合SDS-PAGE结果分析,6 种豆豉的蛋白质降解趋势一致,均在渥堆期迅速降解。感官评价和电子舌结果均表明A.flavus5322强化发酵豆豉具有最强的鲜味。利用UPLC-ESI-Q-TOF-MS/MS从Q7214、Q7622、Q6112、Q5322、QM4和NF豆豉中共鉴定出131 条短肽,通过相关性分析共筛选出43 条鲜味多肽,其中Q6112和Q5322潜在鲜味肽的总峰面积最高,且明显大于NF,已报道的鲜味肽中,DL、VD、EA、VDT、SVE和VG在5 种强化发酵豆豉中的相对峰面积相较于NF豆豉均出现了较大的提升。综上,强化发酵可通过促进蛋白质降解和潜在鲜味肽的释放提升豆豉的鲜味,且A.flavus5322的效果显著。本研究有助于进一步解析强化发酵对浏阳豆豉风味的影响,为浏阳豆豉的品质提升和工业化生产菌株的选育提供理论支持。

