葡萄糖对Starmerella bacillaris香草醛耐受能力的影响
张清燕,赵 君,张 哲,陈 雄,姚 兰,
(1.湖北工业大学生命科学与健康工程学院,湖北 武汉 430068;2.中国轻工武汉设计工程有限责任公司,湖北 武汉 430060)
木质纤维素是一种价格低廉的可再生资源,利用木质纤维素生产乙醇具有巨大的发展空间,但其结构复杂,必须经过一系列预处理才能被微生物利用,在预处理时会产生对微生物具有毒害作用的副产物[1],可分为3大类——呋喃类、弱酸类和酚类[2]。这些副产物存在于水解液中会阻碍酵母的生长,从而降低乙醇发酵效率[1-2]。在这些抑制剂中,酚类抑制剂的毒性最强,会对细胞膜产生损伤,增加细胞膜的通透性和流动性,导致细胞膜的结构被破坏,无法正常发挥功能[3]。目前报道较多的是糠醛、5-羟甲基糠醛、乙酸和乙醇等抑制剂对酵母的影响,对酚类抑制剂的研究较少。由于在预处理过程中产生的酚类化合物种类繁多,缺乏有效的定量及定性分析方法,主要是以外源添加单一酚类抑制剂代替预处理产生的酚类化合物,以此对发酵的作用机理进行研究[4]。
香草醛是水解液中主要的酚类抑制物,在较低质量浓度下就可以对酵母生长产生抑制作用,一般作为酚类的代表抑制物被研究[3],目前改善菌株对香草醛耐受的方法主要有基因工程改造和适应性进化[4]。前期研究表明通过过表达氧化还原酶的编码基因(GCY1、YPR1、PEX5、MBF1、ADH7、ADH6)可以提高菌株的香草醛耐受性[5-8]。由代谢工程改造酿酒酵母获得的一株可耐受多种胁迫因子的菌株XHR11,可将乙醇得率提高21.5%[9]。另外,过表达GSH1、CYS3、GLR1基因,可提高细胞内谷胱甘肽的含量,明显增强菌株对水解液的耐受性[10]。另一方面,通过实验室适应性进化可提高菌株Zymomonas mobilis对香草醛的耐受性和乙醇发酵性能[11]以及酵母Kluyveromyces marxianus对多种抑制剂的耐受能力[12-14]。Almario等[15]得到驯化菌株的生长速率比原始菌株提高了24%。通过基因工程和适应性进化得到高耐受性菌株都需要较长的实验周期,且基因工程可能使酵母失去原有的优良特性,而向培养基中添加保护剂的方法可以缩短实验周期,不会损害酵母原有特性,更利于生物乙醇生产[16]。已有研究表明,在同时含有呋喃类、弱酸和酚类抑制剂的培养基中添加1500 mg/L脯氨酸可将延滞期缩短10 h[17]。葡萄糖在酵母生长过程中为酵母提供生长所需的碳源,为酵母供能[18]。在秸秆预处理中产生的可溶性糖可在酿酒酵母发酵过程中减少酚酸对乙醇脱氢酶的抑制作用,调节细胞内氧化还原状态,从而提高乙醇的产量[19]。10%葡萄糖也可保护热胁迫下的毕赤酵母[20]。目前关于增加培养基中葡萄糖质量分数以提高酵母对香草醛耐受性的研究鲜见报道。
Starmerellabacillaris是一种非酿酒酵母菌,通常应用在葡萄酒酿造中,可以耐受高浓度的乙醇[21],在极端糖浓度下具有更强的适应性[22]。目前关于抑制剂对酵母S.bacillaris的影响研究较少。本实验选取实验室现有的一株S.bacillaris,研究香草醛作为单一抑制剂对其生长的影响,并研究提高培养基中的葡萄糖质量分数后香草醛对该酵母生长的影响作用。同时测定对数生长前期酵母细胞内过氧化氢(H2O2)、活性氧(reactive oxygen species,ROS)、膜渗透率、抗氧化酶的活性,细胞内外甘油的产量,糖代谢过程中与乙醇生成及抗氧化应激相关的酶与辅酶因子水平,旨在奠定S.bacillaris在工业生产乙醇中的应用基础,降低乙醇的生产成本,提高发酵效率。
1 材料与方法
1.1 材料与试剂
菌株S.bacillarisR5由本实验室保藏。
2%酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基:2%葡萄糖、2%蛋白胨、1%酵母粉。6% YEPD:6%葡萄糖、2%蛋白胨、1%酵母粉。
H2O2含量检测试剂盒 中国贝奥蒂姆生物技术研究所;甘油含量测定试剂盒 北京普利莱基因技术有限公司;RNA提取试剂盒 北京天根生物技术有限公司;过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismut,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、己糖激酶(hexokinase,HK)、丙酮酸激酶(pyruvate kinase,PK)、6-磷酸葡萄糖脱氢酶(6-phosphate glucose dehydrogenase,6-PGDH)、还原型辅酶II(nicotinamide adenine dinucleotide phosphate,NADPH)检测试剂盒南京建成生物工程研究所。
1.2 仪器与设备
高压蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;电子分析天平 北京赛多利斯天平有限公司;超净工作台 天津市泰斯特仪器有限公司;HNY-211B全温摇床天津欧诺仪器仪表有限公司;紫外-可见分光光度计 上海精密科学仪器有限公司;高效液相色谱 赛默飞世尔科技(中国)有限公司;Accuri®C6流式细胞仪 美国BD公司;超声波细胞粉碎机 宁波新芝生物科技股份有限公司;ProFlexTMBase聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Applied Biosystems公司;CFX-96荧光定量PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 乙醇发酵与发酵产物测定
从斜面上挑取酵母菌落接种到5 mL 2% YEPD中,30 ℃、200 r/min 培养24 h,取1 m L 转接到50 mL 2% YEPD中培养12 h作为种子液,随后按OD600nm=0.5分别接种到50 mL 2%和6% YEPD发酵培养基中,30 ℃、200 r/min培养,每隔几小时进行取样。
通过测定OD600nm监测菌体的生长状况。用3,5-二硝基水杨酸法[23]测定葡萄糖质量分数,高效液相色谱测定乙醇转化率和香草醛质量浓度。乙醇测定液相色谱条件:高效液相色谱采用Shimadzu LC-10AD系统,色谱柱采用SUGAR SH1011色谱柱,柱温50 ℃,示差折光检测器,流动相为5.4 mmol/L硫酸,流速为1.0 mL/min。香草醛测定液相色谱条件:Inertsil ODS-SP色谱柱(4.6 mm×250 mm,5 μm),柱温30 ℃,检测器温度45 ℃,流动相:甲醇-0.01%乙酸溶液(65∶35,V/V),进样量10 μL,流速为1.0 mL/min,检测波长为270 nm。
1.3.2 酵母细胞中ROS含量及细胞膜损伤测定
取对数生长期前期的酵母细胞,用2’,7’-二氢二氯荧光黄双乙酸钠染液和碘化吡啶进行染色,用BD AccuriTM流式细胞仪测定细胞膜的完整性和细胞内ROS的积累量。
1.3.3 H2O2、甘油、SOD、CAT、HK、PK、6-GPDH、GSH-Px、NADPH水平的测定
将酵母培养至对数生长前期,发酵液12000 r/min离心5 min,弃上清液,按照相关试剂盒的说明书进行各成分水平测定。
1.3.4 实时PCR(real-time PCR)检测
将S.bacillarisR5在2% YEPD培养基中30 ℃、200 r/min培养24 h转接至新鲜的2% YEPD培养基中继续培养,并将其作为种子培养基,取对数生长期的酵母细胞按照OD600nm=0.5分别接入不含抑制剂的2%和6% YEPD培养基中培养,取样监测细胞密度,待OD600nm=1.0时,将此时刻定为0 h,向培养基中加入无菌的香草醛至香草醛的终质量浓度为3 g/L,继续培养2 h。取0 h和2 h的样品,液氮淬灭10 s后放置于-80 ℃保存。使用RNA提取试剂盒提取总RNA,使用NanoDrop 2000测定RNA浓度,按照沈勇[24]描述的程序以及5×HisScript II QRT Super Mix II进行反转录反应,用2×ChamQ Vmversal SYBR qPCR Master MIX进行real-time PCR,用2-ΔΔCt法计算己糖激酶(hexokinase,HK)、6-磷酸果糖激酶(6-phosphate fructose kinase,PFK)、异柠檬酸脱氢酶(isocitrate dehydrogenas,IDH3)、6-磷酸葡萄糖脱氢酶(6-phosphate glucose dehydrogenase,PGD)、乙醇脱氢酶(ethanol dehydrogenase,ADH5)、丙酮酸脱羧酶(pyruvate decarboxylas,PDC)、编码醛酮还原酶基因GCY1基因的相对表达量。
1.4 数据处理与分析
实验数据采用GraphPad Prism 8.0.1和FlowJo-V10软件进行图表绘制,应用Statistica 25.0软件进行差异显著性分析。
2 结果与分析
2.1 葡萄糖水平对S.bacillaris R5生长的影响
为了研究香草醛和葡萄糖含量对酵母生长的影响,在YEPD(分别含有2%和6%葡萄糖)培养基中加入不同质量浓度的香草醛。如图1A所示,在YEPD(含2%葡萄糖)培养基中添加1 g/L香草醛对酵母生长无明显影响,当香草醛质量浓度增加到3 g/L时,滞后期从6 h(1 g/L香草醛)延长到54 h(3 g/L香草醛)。同样地,在YEPD(含6%葡萄糖)培养基中添加1 g/L香草醛对酵母生长无明显影响,当香草醛质量浓度增加到3 g/L时,滞后期分别从6 h(1 g/L香草醛)延长到40 h(3 g/L香草醛),说明提高培养基中的葡萄糖质量分数至6%可以使酵母在高质量浓度香草醛(3 g/L)条件下的延滞期缩短14 h。如表1显示,在两种葡萄糖质量分数下,随着香草醛胁迫的增加,菌株的比生长速率与对照组相比都显著下降。如图1B显示,两种葡萄糖水平下,加入低质量浓度香草醛(1 g/L),前10 h内香草醛的降解速率很快,加入高质量浓度香草醛(3 g/L)后,香草醛的降解速率很慢,酵母在培养基中的香草醛质量浓度降到很低时才开始生长,说明菌株本身对低质量浓度香草醛(1 g/L)具有抗性。
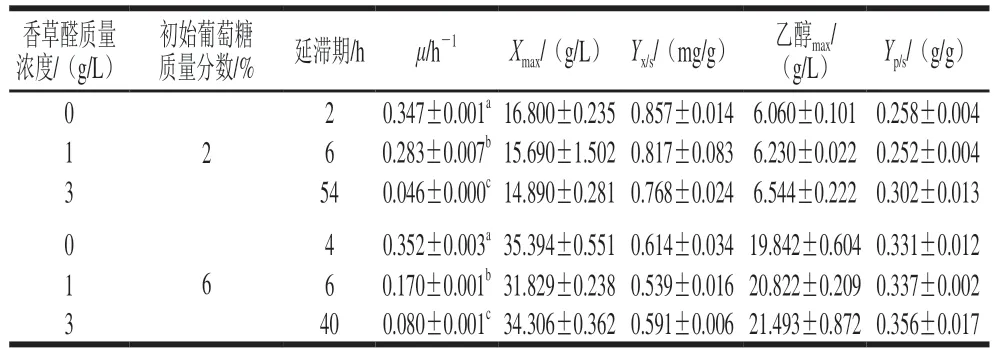
表1 香草醛和葡萄糖添加对酵母S.bacillaris在YEPD培养基中的动力学参数的影响Table 1 Effect of vanillin and glucose supplementation on kinetic parameters for the growth and ethanol production of S.bacillaris in YEPD medium
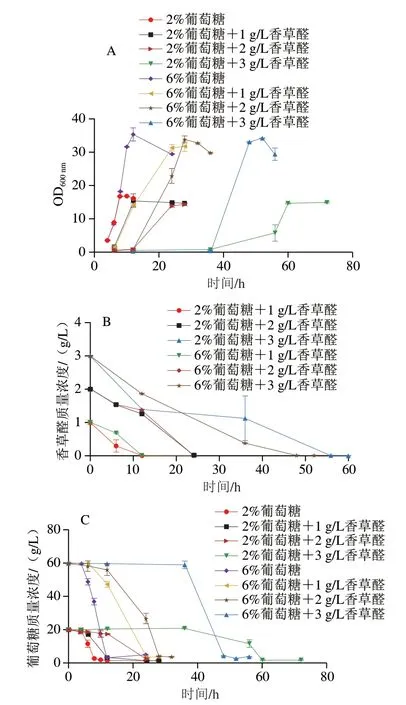
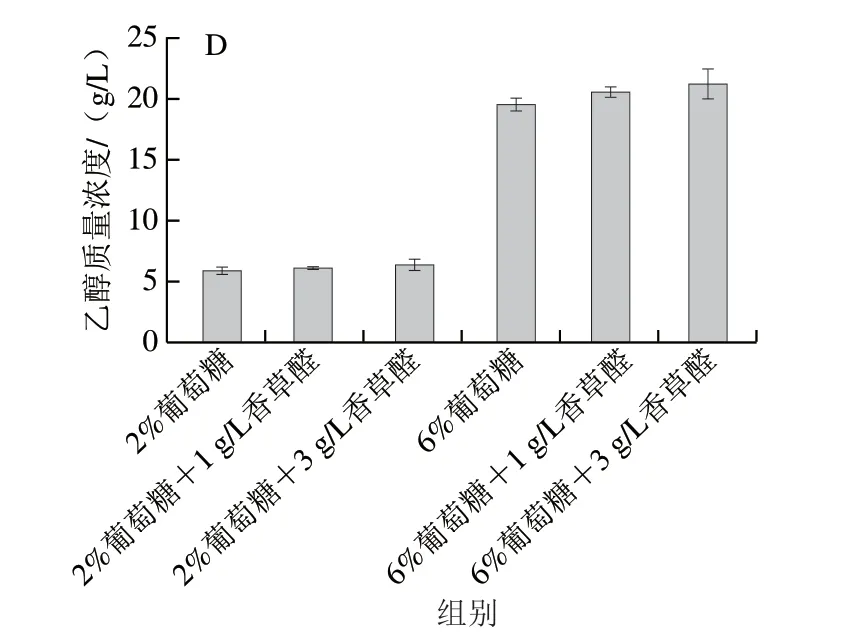
图1 香草醛和葡萄糖添加对酵母S.bacillaris生长的影响Fig.1 Effect of glucose supplementation on the growth of S.bacillaris under vanillin stress
图1C、D显示了发酵过程中的葡萄糖消耗以及乙醇生成情况。当S.bacillarisR5酵母开始生长时,葡萄糖质量浓度急剧下降,乙醇质量浓度开始增加。在两种葡萄糖水平下,低质量浓度香草醛(1 g/L)和高质量浓度香草醛(3 g/L)对酵母的葡萄糖消耗和乙醇生成量无显著影响。2%葡萄糖水平下,最大乙醇质量浓度分别为6.06(对照)、6.23(1 g/L香草醛)、6.54 g/L(3 g/L香草醛),最大乙醇质量浓度对应的时间从8 h(对照)分别延迟到14(1 g/L香草醛)、60 h(3 g/L香草醛);6%葡萄糖水平下,最大乙醇质量浓度分别为19.84(对照)、20.82(1 g/L香草醛)、21.49 g/L(3 g/L香草醛),最大乙醇质量浓度对应的时间从14 h(对照)分别延迟到16 h(1 g/L香草醛)和52 h(3 g/L香草醛)。3 g/L香草醛质量浓度对酵母的延滞期和乙醇转化率有明显影响,2%葡萄糖水平的延滞期为54 h,比生长速率为0.046 h-1,乙醇转化率为(0.302±0.013)g/g,6%葡萄糖水平的延滞期为40 h,比生长速率为0.080 h-1,乙醇转化率为(0.356±0.017)g/g,相较于2%葡萄糖水平延滞期缩短了25.92%,比生长速率提高了82.1%,乙醇转化率提高了17.88%,可见,将培养基中的葡萄糖质量分数提高至6%可缓解3 g/L香草醛对酵母生长及产乙醇的抑制作用。
2.2 葡萄糖水平对S.bacillaris R5在香草醛胁迫下细胞内ROS的影响
酵母细胞中ROS含量过高会影响酵母细胞的活性[25],在高渗、高温、低温等高压条件下,细胞寿命会由于ROS的积累而减少[26]。如图2所示,在同一葡萄糖质量分数下,香草醛质量浓度越高,含有ROS的细胞比例越高,说明香草醛会导致细胞内ROS的积累;在同一香草醛质量浓度下,含有ROS的细胞比例也随着葡萄糖质量分数的增加而升高,说明高糖环境也会增加细胞内的ROS含量。2%葡萄糖水平时,含有ROS的细胞比例分别为1.53%(对照)、2.31%(1 g/L香草醛)、3.42%(3 g/L香草醛);6%葡萄糖水平时,含有ROS的细胞比例分别为2.37%(对照)、2.90%(1 g/L香草醛)、4.51%(3 g/L香草醛)。在2%葡萄糖水平下,添加1 g/L和3 g/L香草醛后含有ROS的细胞比例分别增加了50.9%和123.5%,在6%葡萄糖水平下,添加1 g/L和3 g/L香草醛后含有ROS的细胞比例分别增加了22.3%和90.2%,可见即使6%葡萄糖水平下含有ROS的细胞比例较高,但在加入香草醛后,含有ROS的细胞增加比例均小于2%葡萄糖水平。为了减弱ROS对酵母产生的损伤,需要更高活性的SOD和CAT。
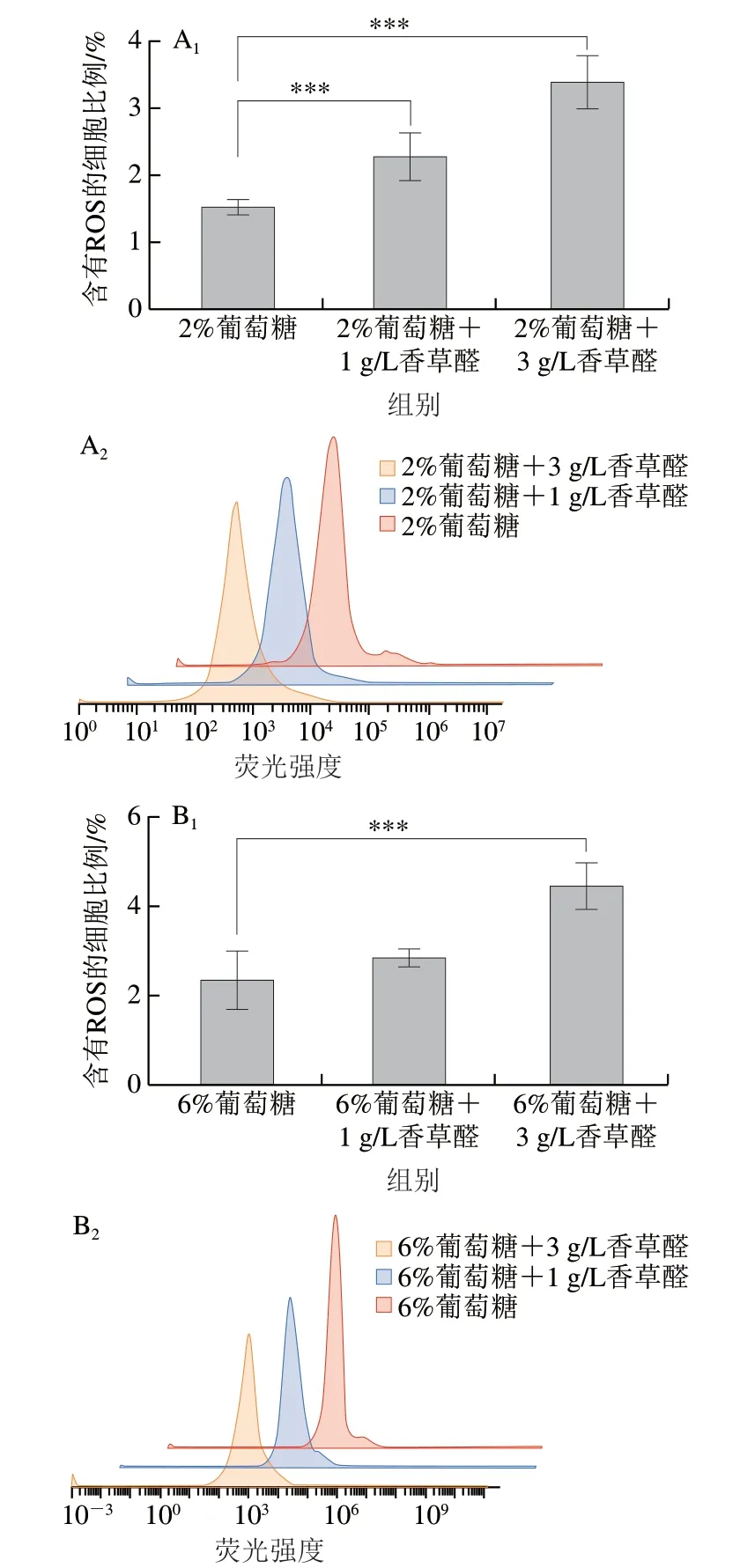
图2 流式细胞仪分析不同葡萄糖质量分数在香草醛胁迫下菌株S.bacillaris产生的ROS含量Fig.2 Flow cytometry analysis of the ROS of content S.bacillaris produced under vanillin stress at different glucose concentrations
2.3 葡萄糖水平对S.bacillaris R5在香草醛胁迫下细胞膜的影响
细胞膜作为酵母与外界环境接触的屏障,具有维持细胞内环境稳态、确保物质正常运输的功能[27],外界环境胁迫会改变细胞膜脂质组成,影响膜ATP酶的活性,使膜通透性、完整性等生理特性发生变化[28]。由图3可知,在2%葡萄糖水平下,1 g/L和3 g/L香草醛组与对照组相比,膜渗透率分别提高了30%和62.8%;而在6%葡萄糖水平下,膜渗透率分别提高了1.7%和52.5%。说明将培养基中的葡萄糖质量分数由2%提高至6%可以降低香草醛胁迫下的膜渗透率,使细胞膜能更好地行使功能。这与通过外源添加麦角固醇的方式使酿酒酵母细胞在4 g/L糠醛胁迫下的膜渗透性降低了29.79%,延滞期缩短了25%的结果相似[29],可见膜渗透性的降低有助于缩短酵母在逆境中的延滞期。
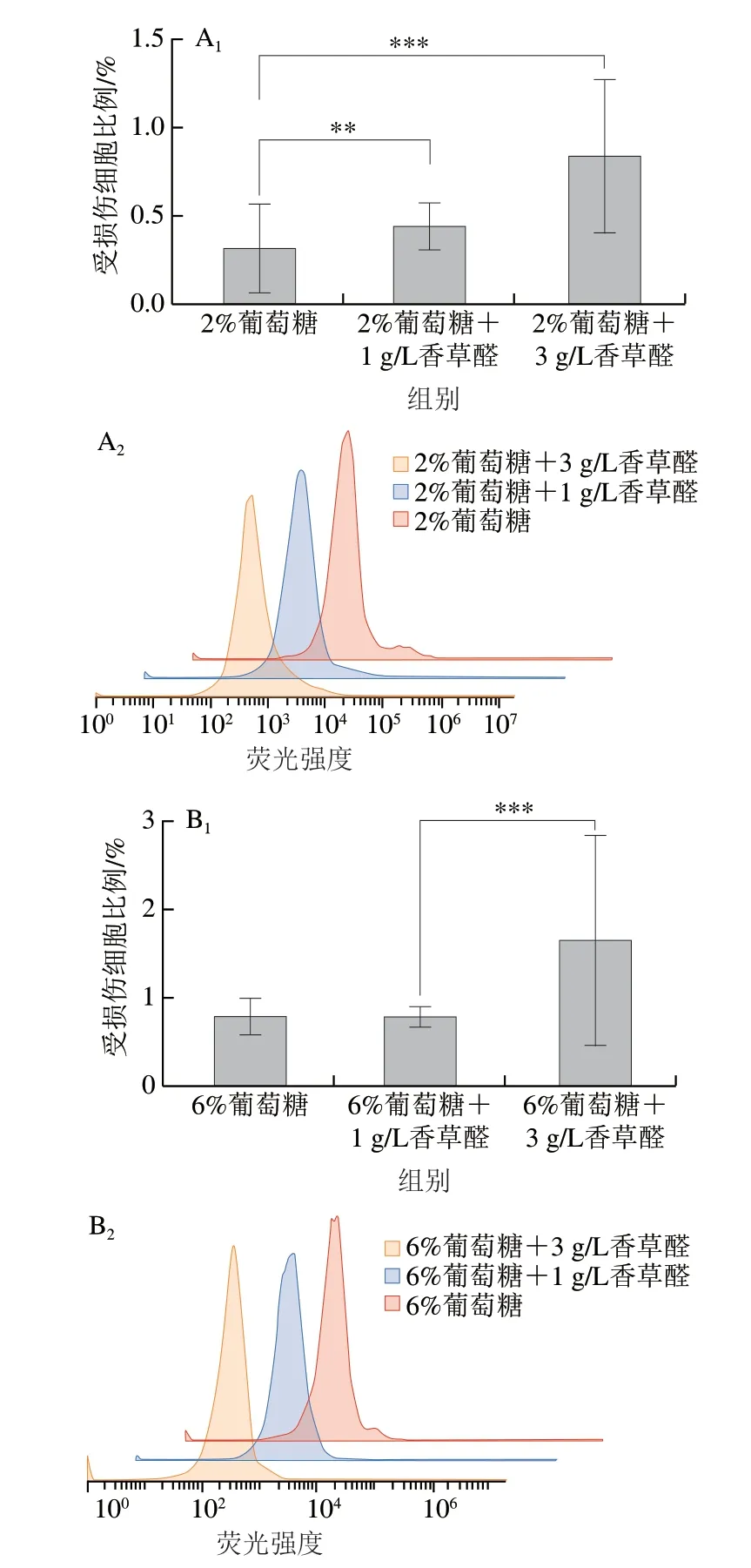
图3 流式细胞仪分析不同葡萄糖浓度在香草醛胁迫下菌株S.bacillaris的细胞膜完整性Fig.3 Flow cytometry analysis of cell membrane integrity of S.bacillaris under vanillin stress at different glucose concentrations
2.4 葡萄糖水平对S.bacillaris R5在香草醛胁迫下细胞内H2O2浓度的影响
H2O2是一种强氧化剂,可以跨膜扩散到细胞中,形成跨膜梯度,一方面,H2O2可以直接或间接地氧化细胞内核酸、蛋白质等生物大分子,并破坏细胞膜,从而加速细胞的衰老和解体;另一方面H2O2也是许多氧化应激反应中的关键调节因子[30]。如图4所示,在2%葡萄糖水平下,H2O2的浓度分别为0.52(对照)、1.3(1 g/L香草醛)、2.7 μmol/L(3 g/L香草醛);6%葡萄糖水平下,H2O2的浓度分别为0.78(对照)、2.0(1 g/L香草醛)、3.1 μmol/L(3 g/L香草醛)。加入香草醛后,2%葡萄糖水平下的H2O2浓度分别提高了150%(1 g/L香草醛)和419%(3 g/L香草醛),6%葡萄糖水平下的H2O2浓度分别提高了156%(1 g/L香草醛)和297%(3 g/L香草醛)。在高质量浓度香草醛(3 g/L)下,6%葡萄糖水平下H2O2浓度的增加量明显低于2%葡萄糖水平。在应激条件下,酵母为了更好地生长会相应提高CAT和GSH-Px的活性分解H2O2[31]。
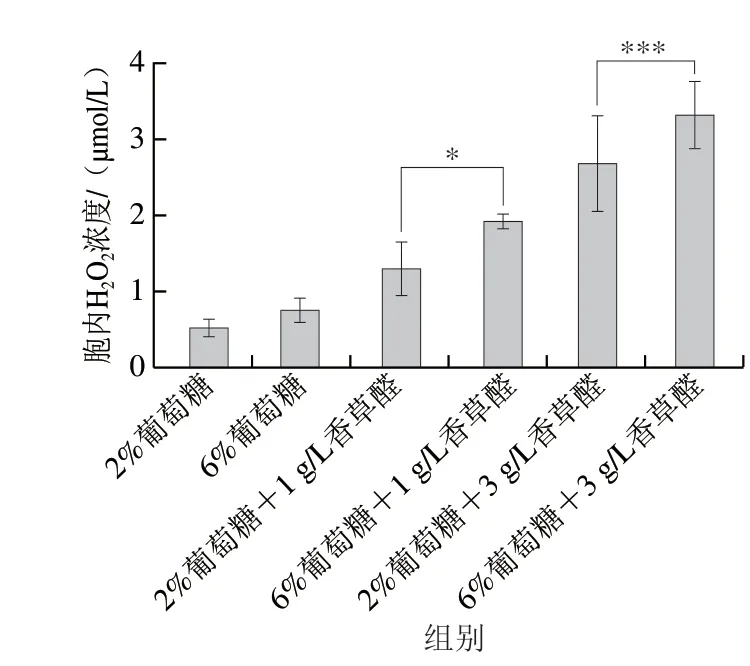
图4 S.bacillaris细胞内H2O2浓度Fig.4 Intracellular H2O2 contents in S.bacillaris
2.5 葡萄糖水平对S.bacillaris R5在香草醛胁迫下细胞内抗氧化酶活性及NADPH含量的影响
如图5A所示,同一葡萄糖水平下,CAT的活性随着香草醛质量浓度的升高而增加,2%葡萄糖水平下分别为1.33(对照)、3.29(1 g/L香草醛)、5.68 U/mg(3 g/L香草醛),6%葡萄糖水平下分别为2.02(对照)、5.26(1 g/L香草醛)、13.6 U/mg(3 g/L香草醛)。在同一香草醛水平下,6%葡萄糖水平比2%葡萄糖水平的CAT活力分别提高了34%、37%、58%,这与细胞内H2O2浓度的分析结果相印证(图4),当酵母受到氧化应激时,通过提高抗氧化酶CAT的活性减轻ROS对细胞的损伤[32]。
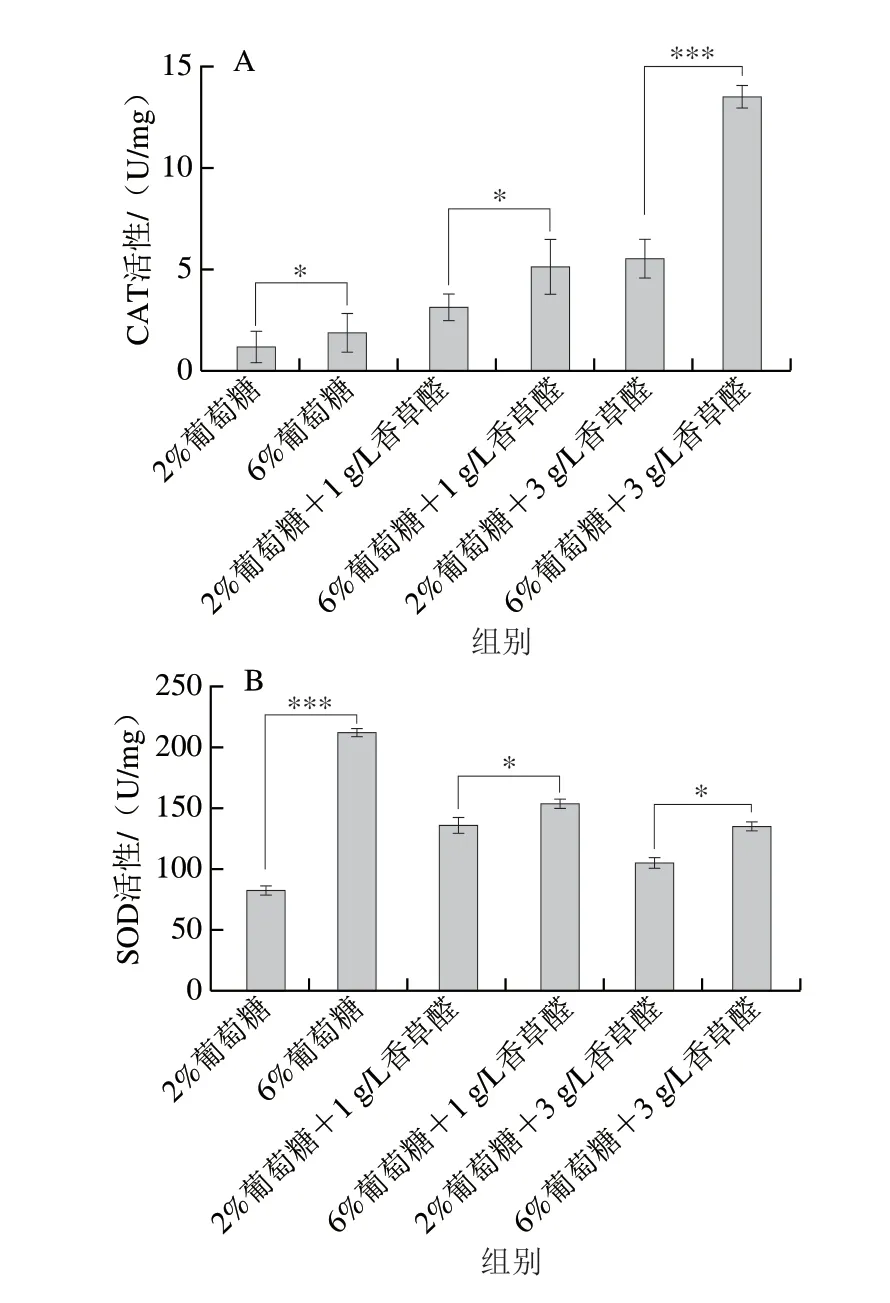
图5 S.bacillaris细胞内抗氧化酶活性及NADPH浓度Fig.5 Antioxidant enzyme activities and NADPH contents in S.bacillaris cells at different glucose levels under vanillin stress
SOD能够保护酵母不受培养环境条件的变化而产生的氧化物伤害[32-33]。两种葡萄糖水平下的SOD活性呈现相同的趋势(图5B),均与香草醛的质量浓度呈线性相关。同一香草醛质量浓度下,高葡萄糖水平的SOD活性均高于低水平葡萄糖,其中在3 g/L香草醛中,2%葡萄糖水平的SOD活性为138 U/mL,6%葡萄糖水平的SOD活性为214 U/mL,提高了35.5%。在两个对照组之间,2%和6%葡萄糖水平的SOD活性分别为83 U/mL和137 U/mL,这与不加抑制剂时高葡萄糖水平的H2O2浓度高于低水平葡萄糖的结果表现一致,可能与酵母在高糖环境下的渗透胁迫有关[18]。
酵母在氧化应激下通过增强酵母中SOD和CAT的活性,可以很好地调节异常的ROS含量,保证酵母细胞的活性和正常的生殖代谢[33],高糖水平增加了与抗氧化机制相关的酶活性。酵母在高糖环境下的氧化损伤比低糖水平下强,但同时酵母细胞中SOD和CAT抗氧化酶活性增加。SOD在酵母中将超氧阴离子自由基(O2-·)转化为H2O2,而CAT则进一步将H2O2转化为水和氧[34]。
GSH-Px是机体内广泛存在的一种重要的催化H2O2分解的酶,能特异性地催化还原型GSH对H2O2的还原反应,可以起到保护细胞膜结构和功能完整的作用[28]。如图5C所示,2%葡萄糖水平中的GSH-PX活力分别为3.36、12.6、20.8 个酶活力单位;6%葡萄糖水平中的GSH-PX活力分别为11.8、20.6、48.3 个酶活力单位。在6%葡萄糖水平下,GSH-Px活力分别是2%葡萄糖水平的3.5(对照)、1.6 倍(1 g/L香草醛)和2.3 倍(3 g/L香草醛),因此,在对数生长期前期,在高质量浓度抑制剂下,S.bacillarisR5会应激出现更高的酶活抵御损伤。
NADPH是酵母中应对氧化应激的重要物质,它作用于GSH,消除酵母细胞内ROS[35]。磷酸戊糖途径和三羧酸循环的代谢过程中会产生和利用NADPH。NADPH的浓度可以反映酵母的抗氧化状态,也可以间接反映不同葡萄糖水平下酵母的应激强度[36]。如图5D所示,两个葡萄糖水平的对照组和加入1 g/L香草醛实验组的NADPH水平并没有明显区别,但在加入3 g/L香草醛后,6%葡萄糖水平的NADPH浓度比2%葡萄糖水平提高了19.4%。根据ROS变化的结果可知,在酵母细胞中,高水平的NADPH用于响应氧化应激。在高糖水平下,磷酸戊糖途径的代谢增强,产生更多的NADPH。
2.6 葡萄糖水平对S.bacillaris R5在香草醛胁迫下细胞内外甘油变化量的影响
甘油是酵母细胞的正常代谢物,是酵母保护剂之一[37]。在应激条件下,酵母一般会通过高渗透压甘油途径增加细胞中甘油的代谢产量,维持酵母细胞渗透压与外界环境的平衡[38]。如表2所示,添加1 g/L和3 g/L香草醛时,6%葡萄糖水平下的酵母胞内甘油质量浓度分别为38.94 mg/L和39.66 mg/L,分别是2%葡萄糖水平下胞内甘油质量浓度的1.51 倍和1.83 倍,这可能是充分的碳源代谢和应激反应的结果,说明高葡萄糖水平能够刺激酵母产生更多的甘油[39]。6%葡萄糖水平下的细胞内含有更高的甘油质量浓度,对酵母的保护作用大于2%葡萄糖水平,从而使酵母能够在3 g/L香草醛的抑制下缩短延滞期。在含有180 g/L NaCl溶液的YEPD培养基中添加5 g/L硫胺素,促进了甘油的有效合成,使酵母细胞更快适应高盐胁迫环境,将延滞期缩短了12 h[40]。酿酒酵母在4 g/L糠醛胁迫下,外源添加50 mg/L麦角固醇可使细胞内的甘油质量浓度提高4.89 倍[29],可见甘油的增加可以维持膜的稳定性,使膜更好的行使功能,与2.3节所得膜损伤率降低的结果对应(图3)。
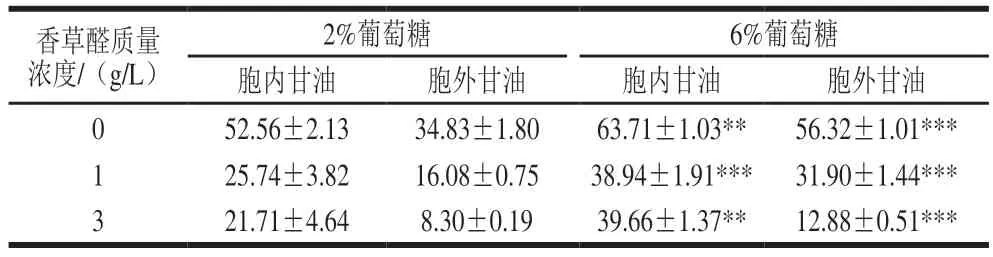
表2 不同葡萄糖水平下S.bacillaris细胞内外甘油变化量Table 2 Intracellular and extracellular glycerol contents in S.bacillaris at different glucose levels under vanillin stress mg/L
2.7 葡萄糖水平对S.bacillaris R5在香草醛胁迫下与碳代谢相关酶的影响
HK是葡萄糖分解过程中的第一个关键酶,它控制了整个酵母的碳通量代谢系统,催化葡萄糖转化为6-磷酸葡萄糖,是酵母代谢的关键酶[41]。如图6A所示,6%葡萄糖水平下细胞初始HK活力为2%葡萄糖水平的1.55 倍;在添加3 g/L香草醛后,6%葡萄糖水平实验组的HK活力显著高于2%葡萄糖水平实验组,是后者的4.16 倍,这与曾令杰等[41]的研究中在经过甲酸处理后增加了酵母细胞内的HK活力、促进了葡萄糖的分解代谢,为酵母抵抗甲酸损伤提供了能量的结论相似。
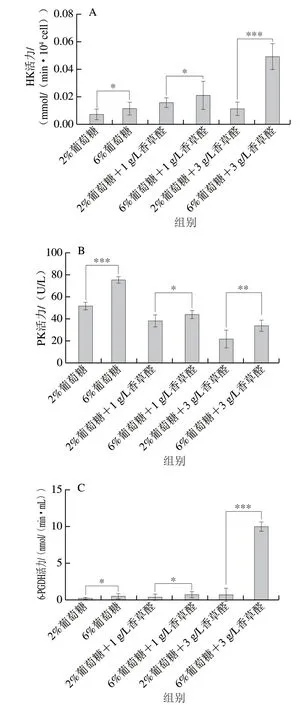
图6 S.bacillaris 细胞内与糖代谢相关酶的活性Fig.6 Activity of S.bacillaris intracellular enzymes related to glucose metabolism
PK是糖酵解过程中不可缺少的酶,其活力水平可以反映糖酵解过程中的通量[42-44]。加入香草醛后,两个葡萄糖水平实验组中的丙酮酸激酶的活力均呈下降趋势(图6B),2%葡萄糖水平的对照组PK活力为52.8 U/L,3 g/L香草醛实验组PK活力为22.7 U/L,PK活力下降了57%;6%葡萄糖水平的对照组的PK活力为76.4 U/L,3 g/L香草醛实验组PK活力为34.7 U/L,PK活力下降了54.5%。在3 g/L香草醛抑制下,6%葡萄糖水平下细胞PK活力的下降速率比2%葡萄糖水平降低了4.3%,说明6%葡萄糖水平产生更多的丙酮酸,由此产生更多的乙醇,低PK活力引起磷酸烯醇式丙酮酸及其底物的积累,磷酸烯醇式丙酮酸会抑制磷酸丙糖异构酶,增强了磷酸戊糖途径(pentose phosphate pathway,PPP),使细胞对氧化剂的抗性增强[44]。
6-PGDH是己糖代谢和戊糖代谢的关键酶[45],该酶可以稳定酵母细胞中NADPH的浓度、抑制氧化应激反应、保护线粒体[46]。在低糖和高糖水平下,实验组6-PGDH的活力均比对照组高(图6C),添加 3 g/L香草醛时,6%葡萄糖中的6-PGDH活力高达10.1 nmol/(min·mL),显著高于2%葡萄糖,说明对于S.bacillarisR5,6%葡萄糖水平下的酵母代谢在对数生长前期细胞中产生了足够的戊糖,使酵母具有更强的抗逆能力[47],且在高糖环境下高表达了PGD基因,生成了更多的NADPH,这与酵母上调磷酸戊糖代谢基因以应对高糖环境的策略一致[48]。在6%和15%葡萄糖水平下,酵母细胞中的6-PGDH的活力显著高于3%葡萄糖水平,使酵母能够更好地应对氧化应激反应[18]。
2.8 与糖代谢及酵母香草醛耐受相关基因的表达水平
前期研究结果表明,提高培养基中的葡萄糖浓度可以使酵母更好地抵御香草醛造成的抑制作用,且提高了乙醇转化率,为揭示其机理,通过real-time PCR测定了与糖代谢相关酶(HK、PFK、IDH3、PGD、ADH5、PDC)以及文献报道酵母中与香草醛耐受相关酶(醛酮还原酶)GCY1基因的表达水平(图7)。糖酵解和三羧酸循环可为细胞提供能量,HK和PFK是糖酵解的两个限速酶,IDH3在三羧酸循环中将NAD+或NADP+还原成还原型烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotide,NADH)或NADPH,NADPH可催化氧化GSH生成还原GSH,还原GSH是常见的抗氧化物质[49]。酵母在无氧环境下,PDC催化丙酮酸生成乙醛和二氧化碳,从而进行乙醇发酵。PGD是PPP的第一个限速酶,其在还原6-磷酸葡萄糖时产生的NADPH是胞质内还原力的重要来源,研究表明细胞在经历氧化应激时的第一反应是上调PPP以促进NADPH的产生[50]。在生物合成乙醇的过程中,乙醛在乙醇脱氢酶的作用下转化成乙醇是一个关键步骤。研究表明,在产乙醇的微生物中过表达醇脱氢酶基因可提高乙醇产量[51],如在Dekkera bruxellensis酵母中过表达ADH3基因可将乙醇产量提高1.2 倍[52]。醛酮还原酶可以催化醛和酮化合物的还原反应,这些催化反应可以利用NADH或NADPH等辅因子作为电子供体,生成相应的醇类物质,如醇、二醇等。编码醛酮还原酶的基因GCY1过表达可以使酿酒酵母在含有6 mmol/L香草醛的培养基中的比生长速率提高49%[53],并过表达GCY1基因可提高菌株香草醛的还原速率,可作为还原酶将香草醛直接还原为毒性较低的香草醇[6]。
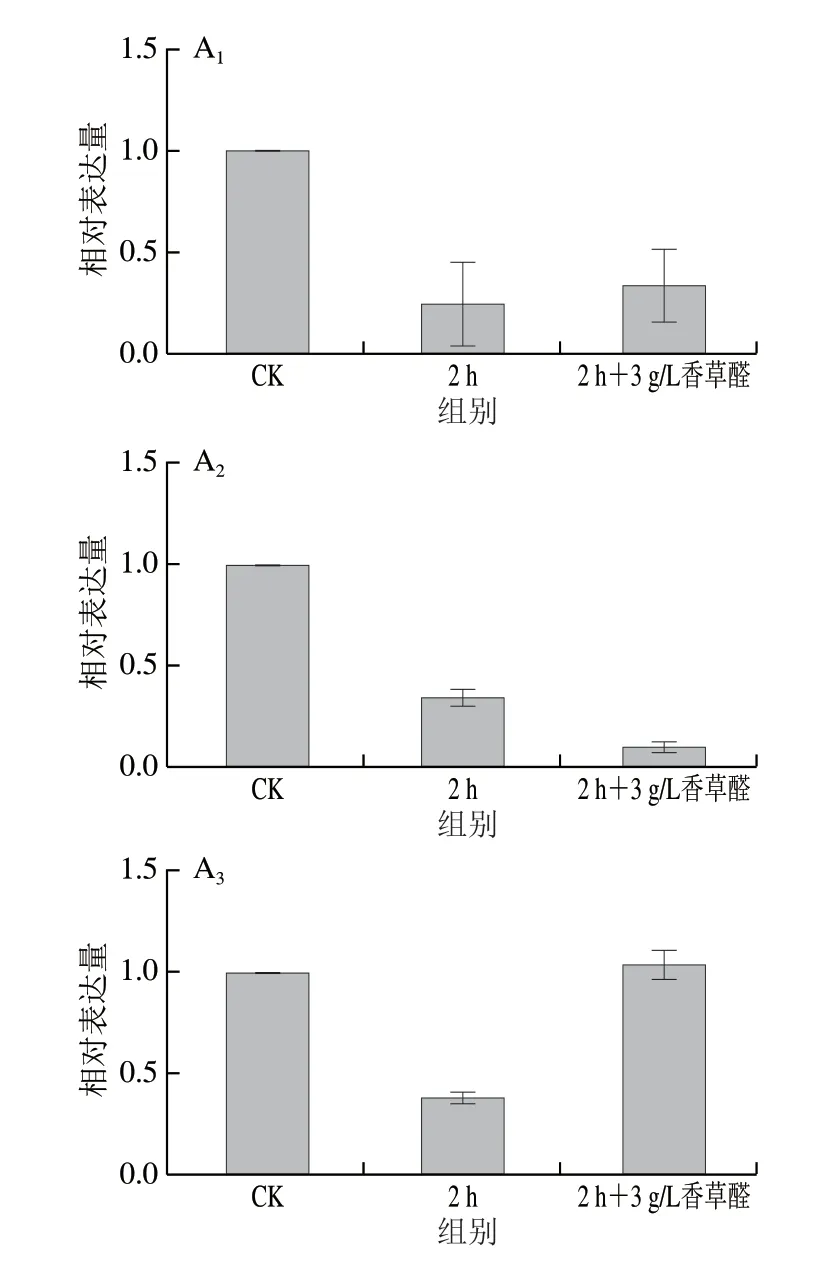

图7 与糖代谢和香草醛耐受相关基因在酵母S.bacillaris中的表达水平Fig.7 Expression levels of genes related to glucose metabolism and vanillin tolerance in S.bacillaris
在3 g/L香草醛胁迫下,2%葡萄糖水平下仅有PDC和GCY1基因表达水平上调,6%葡萄糖水平下HK、PFK、IDH3、PGD、ADH5、gabD、PDC及GCY1基因均呈现上调,分别上调4.6、2.5、13.9、12.2、17.5、34.8 倍和34.9 倍,其中与乙醇生成最相关的基因ADH5在2%葡萄糖水平下并没有上调,在6%葡萄糖水平下表达上调17.5 倍。与香草醛耐受相关基因GCY1在2%葡萄糖水平下仅上调3 倍,在6%葡萄糖水平下上调高达34.9 倍。
将培养基中的葡萄糖质量分数提升至6%促进了碳代谢过程中一些酶相关基因的表达水平,PGD的高表达可得到高活性的6-PGDH,可见在胁迫环境下高葡萄糖质量分数促进碳源流向PPP,生成了更多的NADPH,从而提供更多的还原力,这也与前期所得高浓度的NADPH结果相印证。ADH5的高表达促进了乙醛向乙醇的转化,提高了乙醇的转化率,GCY1的高表达促进了香草醛向香草醇的转化(图8),使得在3 g/L香草醛抑制下的酵母延滞期从54 h缩短至40 h,说明了6%葡萄糖水平可提高S.bacillarisR5酵母菌株对香草醛的耐受程度。

图8 6%葡萄糖水平下与糖代谢相关酶的基因表达变化Fig.8 Changes in gene expression of enzymes related to glucose metabolism at glucose level of 6%
3 讨论
香草醛是木质纤维素原料水解产生的有毒副产物之一,在纤维素乙醇发酵过程中会抑制酵母细胞的生长和代谢[3]。已有研究表明4 mmol/L香草醛会对酵母的生长产生抑制作用[8],在抑制剂存在的条件下酵母的细胞膜会由于氧化应激的影响使得孔隙变大[54-55],甘油产量降低会导致ROS的积累[54]。本研究发现,3 g/L香草醛可明显抑制酵母的生长和乙醇发酵,经香草醛处理的酵母细胞内H2O2、ROS的含量及膜渗透率均提高,说明香草醛破坏了细胞膜,使膜通透性增大,脂质过氧化程度加剧,引起酵母细胞氧化损伤,使细胞的衰老和解体加速。
葡萄糖为酵母提供生长和发酵所需的能量[18,54],在高温环境下葡萄糖可作为一种保护剂减轻酵母由热应激而产生的氧化损伤,降低ROS含量[20]。葡萄糖还可以调节细胞内GSH的水平,在细胞应激反应中发挥作用[54-55]。在秸秆预处理中产生的可溶性糖可以加速细胞外基质的合成,使得在酚酸胁迫下酵母细胞膜的损伤降低[19]。在酵母的对数生长期,大部分碳源主要流向PPP、甘油代谢和乙醇代谢,而ROS含量和膜渗透率增加需要通过调节SOD和CAT等抗氧化酶来应对[18]。本研究发现,将葡萄糖的质量分数从2%提高至6%后,酵母在3 g/L香草醛抑制作用下的延滞期缩短了14 h,比生长速率提高了82.1%,乙醇转化率提高了17.88%。在6%葡萄糖水平下,CAT活性提高58%,SOD活性提高35.5%,GSH-Px活性提高2.3 倍,甘油质量浓度提高1.82 倍,这些变化可以保证细胞在胁迫环境下的活性从而进行正常的生殖代谢;HK和6-PGDH的活力分别提高了4.16、11.8 倍,PK活力下降了54.5%,其中HK是糖代谢的第一个关键酶,低HK活性可增强PPP[40],PK可以平衡糖酵解和呼吸作用[43],6-PGDH可以稳定细胞内NADPH的浓度,抑制氧化应激反应[18,46];NADPH的浓度提高了19.4%,NADPH主要由PPP产生,说明PPP被增强,此途径在胁迫环境下被增强可提高酵母对应激条件的耐受能力[18];与糖代谢相关的酶基因如PGD、HK等的高表达一方面与高酶活性相呼应,另一方面也进一步说明在3 g/L香草醛胁迫下添加6%葡萄糖可以促进PPP。乙醇脱氢酶基因ADH5的表达水平提高了17.5 倍,使乙醛向乙醇的转化加速。可见,提高培养基中的葡萄糖质量分数可以提高抗氧化酶的活性,更好地分解应激产物,并且促进了PPP,从而生成更多的还原酶使酵母更好的应对高胁迫的生长环境。醛酮还原酶基因GCY1的高表达提高了香草醛向无毒的香草醇的转化速率,为酵母的生长和发酵提供更有利的条件。
4 结论
3 g/L香草醛可明显抑制酵母的生长,延长酵母乙醇发酵的周期,香草醛的胁迫可使酵母细胞的膜通透性增加,细胞内容物外泄,氧化还原失衡。为了减弱抑制作用,将培养基中的葡萄糖质量分数由2%提高至6%,缩短了延滞期及乙醇发酵周期,提高了细胞内抗氧化酶的活性,调节了细胞内的氧化还原平衡,减弱了脂质氧化损伤,为酵母提供了更多的ATP以及还原力以应对胁迫环境,从而提高乙醇的转化速率。本研究可为S.bacillarisR5酵母提高酚类抑制物的耐受能力提供一种解决方案。

