基于特征图谱-网络药理学-多指标定量的辣木叶调血脂质量标志物(Q-Marker) 研究
宋亚南,王 云,张 村*,杨洪军,
1.中国中医科学院中药研究所,北京 100700
2.中国中医科学院,北京 100700
高脂血症是一种脂质代谢异常疾病,具体表现为血液循环中总胆固醇、总三酰甘油和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平的升高和/或高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平的降低[1]。辣木叶为辣木科辣木属热带落叶乔木辣木MoringaoleiferaLam.的干燥叶,原产于印度等南亚国家,如今,在我国云南等地已形成一定的种植规模。据报道,辣木叶在降脂方面效果明显,早在《印度阿育吠陀药典》中就有记载,辣木叶可除风止痛、明目清脑、润肤杀虫,主治寄生虫、水肿、脂类病、脾胃病等[2]。现代研究表明,辣木叶提取物能够有效降低3T3-L1 细胞中脂肪的生成[3],甲醇提取物能降低糖尿病大鼠血清LDL-C 的水平并提高HDL-C 水平[4],黄酮类成分可提高HDL-C 对血浆及外周组织胆固醇的清除能力[5-6]。辣木叶中化学成分种类丰富,除维采宁-2、异槲皮素、紫云英苷等黄酮类成分外,还富含新绿原酸、隐绿原酸等有机酸类成分、L-色氨酸等氨基酸类成分等。但目前,有关辣木叶中真正能够发挥调血脂作用的关键性成分尚不清楚。
中药质量标志物(quality markers,Q-Marker)是为规范中药质量评价研究而提出的概念,其以“五原则”为核心,关联质量控制与药效,是与中药功能属性密切相关的化学物质,是存在于中药材或中药产品中固有的或加工过程中产生的成分,同时也是方剂中的君药兼顾臣、佐使药的代表性成分[7]。目前,辣木叶的质量评价研究主要集中在指纹图谱、含量测定等方面,尚未见对其QMarkers 的研究。
特征图谱具有整体性与动态性的特点,能客观反映中药材所含成分,可揭示成分的特征性、溯源性及可测性。网络药理学可从药物-疾病-靶点-通路全方位解析药材的成分-药效的关联,从而体现成分的有效性及配伍的合理性。基于此,本研究以“五原则”为指导,以特征图谱-化学计量学结合网络药理学-分子对接研究模式确定辣木叶用于高脂血症的Q-Markers,进一步对Q-Marker 进行含量测定,旨在为辣木叶质量控制及临床应用提供科学依据。
1 仪器与材料
1.1 仪器
LC-20AT 型高效液相色谱仪,日本岛津公司;1260 Infinity Ⅱ型高效液相色谱仪和6520 Q-TOF 四极杆飞行时间串联质谱仪,美国安捷伦公司;XS105DU 型1/10 万分析天平,梅特勒-托利多公司;BSM-3 200.2 型百分之一电子天平,上海卓精电子科技有限公司;LD-T100A 型高速万能粉碎机,上海顶帅电器有限公司;KQ-300B 型超声波清洗器,昆山市超声仪器有限公司;HH-61 型数显恒温水浴锅,江苏杰瑞尔电器有限公司。
1.2 试剂与试药
维采宁-2 对照品(批号PS000897),购自成都普思生物科技股份有限公司,质量分数≥98%);L-色氨酸(批号 CHB190220),新绿原酸(批号CHB190217),隐绿原酸(批号CHB170828),异槲皮素(批号 CHB160506),紫云英苷(批号CHB181115)均购自成都克洛玛生物有限公司,质量分数均≥98%。印度种改良种(PKM1 型)辣木叶15 批均购自云南天佑科技开发有限公司,经中国中医科学院中药研究所李志勇研究员鉴定为辣木科辣木属辣木M.oleiferaLam.的干燥叶,样品信息见表1。水为娃哈哈纯净水,乙腈,甲醇为色谱纯,其余试剂均为分析纯。

表1 样品信息Table 1 Sample information
1.3 数据库与软件
PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/),SEA 数据库(https://sea.bkslab.org/),UniProt 数据库( https://www.uniprot.org/ ),Genecards 数据库(https://www.genecards.org/),Venny 2.1 平台(https://bioinfogp.cnb.csic.es/tools/venny/index.html),String 数据库(https://cn.stringdb.org/),KOBAS 平台(http://kobas.cbi.pku.edu.cn/in),DAVID 数据库(https://david.ncifcrf.gov/),ImageGP 平台(http://www.ehbio.com/ImageGP/),蛋白结构数据库(PDB,https://www.rcsb.org/),Cytoscape 3.8.2 软件和Discovery studio 2016 软件。
2 基于HPLC 特征图谱-化学计量学的Q-Markers初步筛选
2.1 对照品溶液的制备
精密称定新绿原酸、L-色氨酸、隐绿原酸、维采宁-2、异槲皮素、紫云英苷等6 个对照品适量,分别置于10 mL 量瓶中,加50%甲醇水使溶解并定容至刻度,制成适宜浓度的对照品溶液,吸取适量母液,配制成质量浓度分别为79.20、88.80、38.00、15.47、39.68、86.10 μg/mL 混合对照品溶液。
2.2 供试品溶液的制备
取辣木叶粉末(过4 号筛)0.2 g,精密称定,置25 mL 圆底烧瓶中,精密加入10 mL 50%甲醇溶液,称定质量,加热回流提取60 min,放冷。用50%甲醇水补足减失的质量,摇匀,过0.45 μm 微孔滤膜,得供试品溶液。
2.3 检测条件
2.3.1 色谱条件 色谱柱 Phenomenex Luna C18(2)100A(250 mm×4.6 mm,5 µm),波长254 nm,体积流量0.8 mL/min,柱温35 ℃,进样量5µL;流动相乙腈(A)-0.5%甲酸水溶液(B)梯度洗脱(0~20 min,5%~13% A;20~40 min,13%~18% A;40~50 min,18%~30% A;50~60 min,30%~60% A;60~70 min,60%~100% A;70~72 min,100% A)。
2.3.2 质谱条件 采用电喷雾离子源(ESI),正、负离子检测模式(ESI+、ESI−),氮气作去溶剂化气体。毛细管电压为3.5 kV,碎片电压120 V,碰撞能量为65 eV,干燥气温度350 ℃,干燥气体积流量11.0 L/min,雾化器压力275.79 kPa,;扫描模式为全扫描,质量扫描范围m/z100~1 700。
2.4 特征图谱方法学考察
2.4.1 参照峰的选择 本实验在254 nm 下检出了8 个主要共有峰。采用HPLC-Q-TOF-MS/MS 鉴定出了这8 个共有峰,通过对照品比对及文献[8-12]确认了其中6 个色谱峰。供试品及对照品色谱图见图1,总离子流图见图2,鉴定结果见表2。5 号峰峰面积较高、分离度良好,稳定、无其他峰干扰,且经对照品指认为异槲皮素,故以5 号峰为参照峰。

图1 辣木叶供试品Y10 (A) 及混合对照品 (B) 的HPLC色谱图Fig.1 HPLC chromatogram of sample Y10 (A) and mixed reference standards (B)
2.4.2 精密度试验 称取辣木叶药材(Y10,过4 号筛),按“2.2”项下方法制备得到供试品溶液,按
2.4.3 稳定性试验 称取辣木叶药材(Y10,过4 号筛),按“2.2”项下方法制备得到供试品 溶液,在室温放置0、2、4、8、10、24 h,按“2.3”项下的色谱条件进行测定,以峰5 为参照峰。结果表明,各共有峰的相对保留时间RSD≤1.8%,相对峰面积RSD≤4.6%,表明供试品在24 h 内稳定性良好。
2.4.4 重复性试验 称取同一批辣木叶粉末(Y10,过4 号筛)6 份,按“2.2”项下方法平行制备供试品溶液6 份,按“2.3”项下的色谱条件进行测定,以峰5 为参照峰。结果表明,各共有峰的相对保留时间RSD≤1.5%,相对峰面积RSD≤4.5%。表明该方法重复性良好。
2.5 15 批辣木叶的特征图谱测定
将15 批辣木叶药材HPLC 色谱文件导入“中药色谱指纹图谱相似度评价系统(2012 版)”软件中,以Y1 作为参照图谱,时间窗宽度设置为0.1 min,进行多点校正后自动匹配,得到辣木叶HPLC特征图谱,并生成对照图谱(图3),以峰5 作为参照峰,计算各共有峰的相对保留时间和相对峰面积的RSD 值。

图3 15 批辣木叶HPLC 图谱叠加图Fig.3 HPLC chromatogram of 15 batches of MOLs

图4 15 批辣木叶的HCA 图 (A) 及OPLS-DA 图 (B)Fig.4 HCA diagram (A) and OPLS-DA diagram (B) of 15 batches of MOLs
以生成的对照图谱作为参照图谱(R),对15批样品进行相似度评价,相似度均大于0.967,表明15 批样品间的特征图谱共有峰的差异较小。8个共有峰的相对保留时间RSD≤1.1%,相对峰面积的RSD≤22.4%,说明辣木叶不同批次样品间的特征图谱中的8 个共有峰在保留时间上差异不大,但峰面积存在较大差异。以上结果说明不同产地的辣木叶含量存在较大差异,可初步反映辣木叶的质量属性特征。
2.6 化学计量学分析
2.6.1 聚类分析(hierarchical cluster analysis,HCA)将15 批辣木叶样品的特征图谱各峰峰面积导入SIMCA 14.0 进行聚类分析(hierarchical cluster analysis,HCA),15 批辣木叶样品可根据样品间峰面积不同分为5 组。
2.6.2 正交偏最小二乘法-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)为了更好地观察不同产地样品间的组内差异,在PCA 分析的基础上进一步采用SIMCA 软件进行OPLS-DA 方法进一步分析。在建立的OPLS-DA 模型中R2X(在X轴方向的累积解释率)分别为0.992,R2Y(在Y轴方向的累积解释率)分别为0.924,Q2(模型预测率)为0.83,说明建立的OPLS-DA 模型预测率及稳定性良好。结合变量重要性投影值(variable importance projection,VIP),可知VIP>1的色谱峰为4、5、3、1、2(图5),说明不同产地4、5、3、1、2 号峰分别代表的5 个化学成分(维采宁-2、异槲皮素、隐绿原酸、新绿原酸、L-色氨酸)含量差异较大,是不同产地辣木叶的差异性标志物。

图5 VIP 图Fig.5 VIP diagram
3 辣木叶治疗高脂血症的Q-Markers 预测-网络药理学
3.1 交集靶点的获取
将特征图谱8个成分的典范SMILES(Canonical SMILES)格式文件导入SEA 数据库进行靶点预测,在Library Search 选项中以Custom Query 进行查找。选择所有人类相关靶点,去重,共获得307 个靶点。
以“高脂血症(hyperlipidemia)”为关键词,检索Genecards 数据库(Score≥中位数),并通过UniProt 数据库将靶点蛋白信息转化为UniProt ID,共获得777 个靶点。将所得成分靶点基因与疾病靶点基因分别与Uniprot KB 数据库中经筛选得到的所有人类已验证靶点基因库(更新至20 386 个条目)进行比对,剔除非人类或未经验证的靶点基因(Organism 设置为“Homo sapiens”,Status 设置为“Reviewed”)。获得成分靶点307 个,高脂血症靶点717 个,交集靶点35 个(图6-A)。
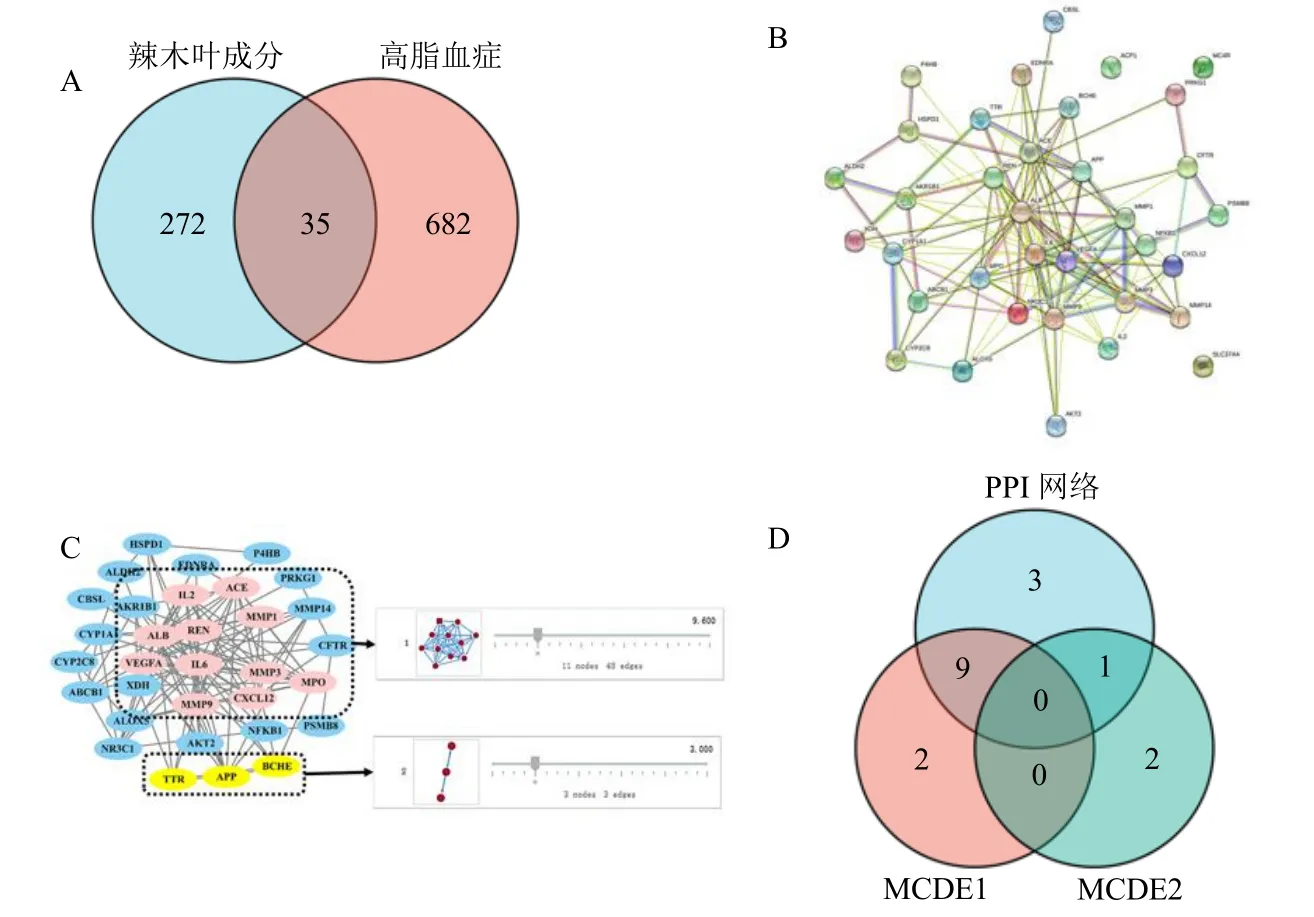
图6 辣木叶治疗高脂血症相关靶点预测Fig.6 Targets of MOLs for hyperlipidemia
3.2 关键靶点的获取
3.2.1 蛋白相互作用(protein-protein interaction,PPI) 将35 个交集靶点通过String 数据库进行PPI网络分析并剔除独立靶点,共获得32 个共同靶点(图6-B);进行拓扑参数筛选(Analyze Network),以中位数为临界值,以同时满足中介中心性>0.007、节点紧密度>0.539、连接度>6.5 的13 个靶点作为关键候选靶点。按照连接度值排序为血清白蛋白(serum albumin,ALB)、白细胞介素-6(interleukin-6,IL-6)、血管内皮生长因子(vascular endothelial growth factor,VEGFA)、基质金属蛋白酶9(matrix metalloprotein 9,MMP9)、血管紧张素Ⅰ转换酶(angiotensin-converting enzyme,ACE)、肾素( renin,REN )、髓过氧化物酶(myeloperoxidase,MPO)、淀粉样前体蛋白(amyloid precursor protein,APP)、趋化因子家族成员( C-X-C motif chemokine ligand 12,CXCL12)、白细胞介素-2(interleukin-2,IL-2)、醛酮还原酶1 成员B1(aldo-keto reductase family 1 member B1,AKR1B1)、皮质激素受体(nuclear receptor subfamily 3 group C member 1,NR3C1)、细胞色素P450 家族成员1A1(cytochrome P450 family 1 subfamily A member 1,CYP1A1)。表明这些靶点可能是治疗高脂血症的关键候选靶点。
3.2.2 基于MCODE 模块的聚类分析 对32 个交集靶点的PPI 网络图进行MCODE 模块分析,设置“Degree Cutoff”为2,“Node Score Cutoff”为0.2,“K-Core”为2,“Max.Depth”为100。共获得2 个功能模块,分别命名为MCODE 1 和MCODE 2,节点个数分别为11 和3,得分分别为9 和3(图6-C)。其中,MCODE 1 模块包括靶点基质金属蛋白酶1(MMP1)、REN、MPO、ACE、IL6、ALB、MMP9、基质金属蛋白酶3(MMP3)、VEGFA、IL2、CXCL12。MCODE2 模块包括靶点丁酰胆碱酯酶(butyrylcholinesterase,BCHE)、转甲状腺素蛋白(transthyretin,TTR)、APP。表明这些靶点模块可能与辣木叶治疗高脂血症有关。
将2 种方法所得的关键靶点取交集(图6-D),得到9 个靶点(ALB、IL6、VEGFA、MMP9、ACE、REN、MPO、CXCL12、IL2)同时与PPI 网络及MCODE1 有关,1 个靶点(APP)同时与PPI 网络及MCODE2 有关。故以此确定10 个靶点为辣木叶治疗高脂血症的关键靶点。
3.3 生物信息学分析
将10 个关键靶点输入DAVID 平台,设置属性为“Homo sapiens”,进行基因本体(gene ontology,GO)分析;将10 个关键靶点输入KOBAS 平台,设置属性为“Homo sapiens”,进行京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。并将P<0.01 的前10 条通过ImageGP 平台、微生信平台进行可视化分析(图7)。

图7 GO 分析 (A) 及KEGG 通路分析 (B) 气泡图Fig.7 Diagrams of GO analysis (A) and KEGG pathway analysis (B)
GO 分析包括生物过程(biological process,BP)、细胞定位(cellular component,CC)和分子功能(molecular function,MF)。以P<0.05 为筛选条件,高脂血症涉及BP、CC、MF 及KEGG 通路分别为28、4、6、22 个;以P<0.01 为筛选条件,高脂血症涉及BP、CC、MF 及KEGG 通路分别为12、3、3、16 个。
GO 分析结果显示,辣木叶治疗高脂血症主要与细胞凋亡负调节、肾脏发育等生物过程有关,与胞外区、细胞外液、细胞外外泌体等细胞定位有关,与生长因子活性、肽酶活性等有关。
KEGG 通路富集结果显示,辣木叶治疗高脂血症主要与产生免疫球蛋白(immunoglobulin A,IgA)的肠道免疫网络、肾素-血管紧张素系统、细胞因子-细胞因子受体相互作用、肾素分泌、磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide 3 kinaseprotein kinase B,PI3K-Akt)信号通路等有关。
3.4 “特征成分-靶点-通路”网络的构建
将筛选的特征成分、关键靶点及关键通路(P<0.01 的前10 条通路)导入Cytoscape 软件中,构建“特征成分-关键靶点-关键通路”网络(图8)。黄色圆形代表特征成分,深绿色方形代表关键靶点,浅绿色三角形代表关键通路。并计算网络拓扑参数,筛选核心成分、靶点与通路,见表3~5。

图8 “特征成分-关键靶点-关键通路”网络Fig.8 “Characteristic component-key target-key pathway” network

表3 关键通路的拓扑参数Table 3 Topology parameters of key pathways

表4 关键靶点的拓扑参数Table 4 Topology parameters of key targets
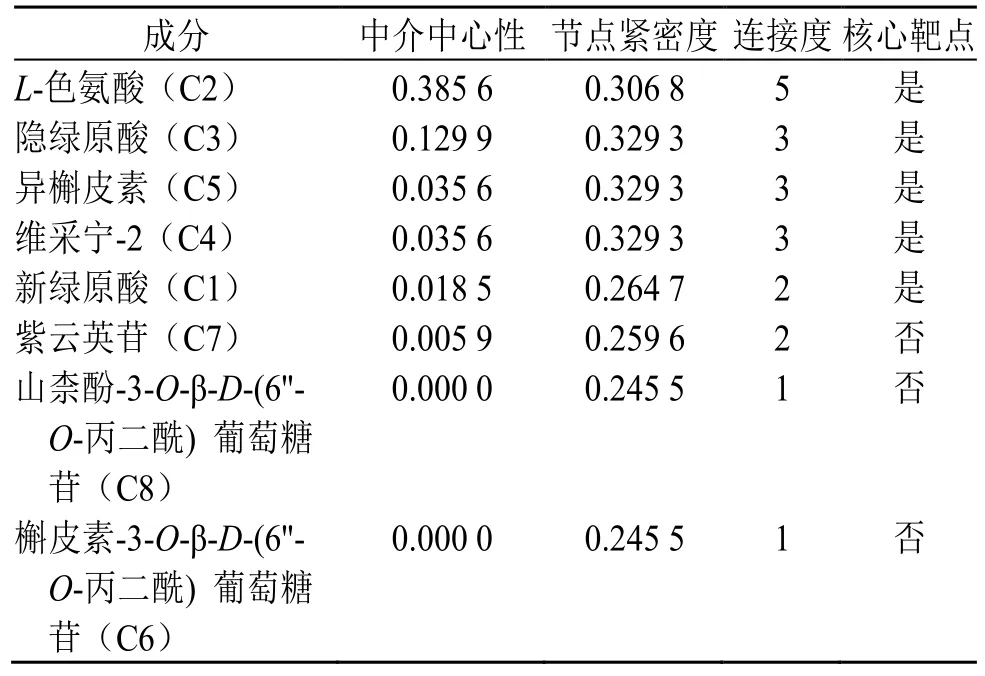
表5 关键成分的拓扑参数Table 5 Topology parameters of key components
根据拓扑参数值分别进行通路、靶点、成分的重要性排序。以拓扑参数大于第一、四分位数且数值大于0.01 限定核心通路、靶点及成分。如表3~5 所示,核心通路、靶点、成分分别为3、5、5 个。结果显示,色氨酸、隐绿原酸、异槲皮素、维采宁-2 等成分可能通过作用于IL6、IL2、MMP9 等靶点,影响细胞因子-细胞因子受体相互作用、产生IgA 的肠道免疫网络、PI3K-Akt 等信号通路来发挥调血脂的作用。
3.5 分子对接
为了验证关键靶点预测结果的可靠性,采用Discovery studio 2016 软件对筛选出的部分核心成分和核心靶点进行“LibDock”分子对接。
3.5.1 分子结构预处理 分别从PubChem 和PDB数据库获取化合物(配体)的SDF 格式文件和核心靶点的3D 靶蛋白复合物结构。采用Discovery Studio 2016 软件对大分子靶蛋白复合物进行常规预处理,去除所有水分子,处理蛋白质结构、加氢后进行力场优化,确定结合位点;获取小分子的多个构象,加氢,施加力场。
3.5.2 分子对接流程的可靠性验证 将蛋白质3D结构中的原配体抽离,再分别对蛋白结构和原配体结构进行预处理,如果Discovery studio 2016 的均方根偏差值(RMSD)<0.2 nm(表6),则代表该方法是可靠的[13]。

表6 靶点蛋白的具体信息Table 6 Specific information on target proteins
3.5.3 分子对接结果的可视化 分子对接得分见图9。L-色氨酸、隐绿原酸、异槲皮素、维采宁-2 与MMP9 对接得分最高,与IL6 对接得分最高的成分是异槲皮素,与IL-2 对接得分最高的成分是维采宁-2,与MMP9 对接得分最高的成分是隐绿原酸。整体来看,对接结果均大于89.880 分,说明辣木叶候选的Q-Markers 与高脂血症的关键靶点能够进行高质量的对接。
将分子对接的得分较高的结果进行可视化,见图10。MMP9 可与L-色氨酸、隐绿原酸、异槲皮素发生相互作用,与L-色氨酸以常规氢键作用于其残基亮氨酸(LEU)418、酪氨酸(TYR)420、甲硫氨酸(MET)422,以π-Alkyl 作用于其残基缬氨酸(VAL)398,以π-π T-shaped 相互作用于其残基TYR4423,以π-π Stacked 及Unfavorable Donor-Donor 作用于其残基组氨酸(HIS)401;与隐绿原酸以常规氢键作用于残基丙氨酸(ALA)417 和189、谷氨酸(GLU)16、LEU 188,以碳氢键作用于脯氨酸(PRO)421、LEU 187,以π-Alkyl 作用于其残基LEU 418;MMP9 与异槲皮素以常规氢键作用于其残基谷氨酰胺(GLN)402、ALA 189、LEU 188、TYR 423,以碳氢键作用于其残基PRO 421、HIS 411,以 π-Alkyl 作用于其残基 VAL 398,以Unfavorable Acceptor-Acceptor 作用于其残基ALA 189。

图10 分子对接结果的可视化Fig.10 Visualization of molecular docking results
IL-6 可与异槲皮素发生相互作用,以常规氢键作用于其残基丝氨酸(SER)368、天冬氨酸(ASP)318、GLN 369、TYR 159,以Metal-Acceptor 作用于金属镁(MG)602,以π-π Stacked 作用于残基TYR 159、以π-π T-shaped 作用于苯丙氨酸(PHE)372、HIS 160,以π-Alkyl 作用于其残基异亮氨酸(ILE)336、PRO 322。
IL-2 可与维采宁-2 发生相互作用,以常规氢键作用于精氨酸(ARG)38、苏氨酸(THR)41,以碳氢键作用于赖氨酸(LYS)35、ALA 73,以π-Alkyl作用于LEU 72。以上结果表明,辣木叶候选的QMarkers 主要依赖于常规氢键、碳氢键、π-Alkyl、ππ Stacked、π-π T-shaped 等与氨基酸残基产生相互作用,进而实现与高脂血症关键靶点的分子对接。
4 Q-Markers 的含量测定
4.1 对照品溶液的制备
同“2.1”项。
4.2 供试品溶液的制备
同“2.2”项。
4.3 方法学考察
4.3.1 线性关系考察 对辣木叶的经对照品指认的6 个成分进行含量测定通过多成分含量测定,对15 批辣木叶进行整体质量控制。
取“2.1”项下新绿原酸、L-色氨酸、维采宁-2、异槲皮素、紫云英苷各0.5、1、1、0.5、0.5 mL 定容到5 mL,得到质量浓度分别为26.4、29.6、23.8、24.8、24.6 μg/mL 的混合对照品溶液,分别精密量取混合对照品溶液0.5、0.8、1、2 mL 定容到2 mL。并分别精密量取各对照品溶液1、2 mL 定容到2 mL。进样5 μL,分析并进行线性关系考察。此外,精密量取质量浓度为380 μg/mL 的隐绿原酸对照品溶液0.1、0.2、1、1.2、1.5、2 mL,分别定容到2 mL。进样5 μL,分析并进行线性关系考察。结果显示,新绿原酸、L-色氨酸、隐绿原酸、维采宁-2、异槲皮素、紫云英苷分别在0.033~1.320,0.037~0.740,0.030~0.595,0.030~0.595,0.031~1.240,0.031~1.230 μg内与峰面积呈现出良好的线性关系,线性回归方程分别为y=1 099 323.26x-13 922.33,y=998 312x-389.13、y=129 927x-16 015、y=1 424 745.62x-10 780.61、y=2 726 799.27x-25 481.72,y=2 373 532.70x-5 592.42,r2均≥0.999 6。
4.3.2 精密度试验 精密称取辣木叶药材粉末(Y10,过4 号筛),按“2.2”项下方法制备供试品溶液,按“2.3”项下色谱条件连续进样6 次,记录峰面积,计算得到上述6 种成分的峰面积的RSD。结果显示,6 种成分的峰面积RSD 均≤3.0%,表明仪器精密度良好。
4.3.3 稳定性试验 精密称取辣木叶药材粉末(Y10,过4 号筛),按“2.2”项下制备供试品溶液,在室温放置0、2、4、8、10、24 h,按“2.3”项下的色谱条件进行测定,记录峰面积,计算得到上述6 种成分的峰面积的RSD。结果显示,6 种成分的峰面积RSD 均≤3.0%,表明供试品溶液在24 h 内稳定性良好。
4.3.4 重复性试验 称取同一批辣木叶粉末(Y10,过4 号筛)6 份,按“2.2”项下方法平行制备供试品溶液6 份,按“2.3”项下的色谱条件进行测定,记录峰面积,计算得到上述6 种成分含量的RSD。结果表明,6 种成分含量的RSD 均≤3.0%,表明该方法重复性良好。
4.3.5 加样回收率试验 精密称取辣木叶药材粉末(Y10,过4 号筛)0.1 g,共6 份,每份样品加入100%的对照品。按“2.2”项下方法平行制备6 份供试品溶液,按“2.3”项下色谱条件连续进样6 次,记录峰面积,计算得到上述6 种成分的回收率的RSD。结果显示,新绿原酸、L-色氨酸、隐绿原酸、维采宁-2、异槲皮素、紫云英苷的平均加样回收率分别在 98.75%、101.70%、101.42%、97.88%、101.48%、100.97%,RSD 分别为2.9%、2.5%、2.6%、2.9%、2.3%、2.8%,均≤3.0%,表明6 种成分的加样回收率结果良好,说明该方法可用于辣木叶中的6 种成分的含量测定。
4.4 15 批药材的多成分含量测定
取辣木叶药材各样品,按“2.2”项下依法制备成供试品溶液并进样测定,计算辣木叶药材中6 种成分的含量(扣除水分)[14],结果见图11。15 批辣木叶中的新绿原酸、L-色氨酸、隐绿原酸、维采宁-2、异槲皮素、紫云英苷的平均质量分数分别为5.81、1.91、2.23、0.94、6.59、2.91 mg/g,RSD 分别为9.2%、19.7%、10.9%、7.6%、9.4%、12.0%。

图11 辣木叶中主要成分的含量测定结果Fig.11 Contents of main components in MOLs
5 讨论
5.1 Q-Markers 的初步筛选—HPLC 特征图谱
在供试样品的制备方面,本实验依次考察了提取方式(加热回流、超声)、提取溶剂(水、甲醇、乙醇及不同比例的甲醇水溶液)、提取时间(30、60、90 min),以色谱峰数量、响应值为主要参考指标,最终确定了辣木叶的最佳提取方法。
在色谱分析方法的建立方面,本实验依次考察了不同型号色谱柱[Phenomenex Luna C18(2)100A色谱柱(250 mm×4.6 mm,5 µm)、Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm)、Kromasil 100-5-C18色谱柱(250 mm×4.6 mm,5 μm)及WelchXtimate C18色谱柱(250 mm×4.6 mm,5 μm)]、不同流动相组成(乙腈-0.5%甲酸水、甲醇-0.5%甲酸水、乙腈-0.1%磷酸水、乙腈-0.5%醋酸水)以及检测波长(254、280、305、330、350 nm),以色谱峰数量、响应值、分离度为主要参考指标,最终确定了辣木叶的液相色谱分离条件。
5.2 以调血脂作用为导向的Q-Markers 筛选—网络药理学研究
根据HPLC 特征图谱筛选出的8 个特征成分均具有一定的降脂作用。有研究表明,色氨酸生物合成或代谢的相关途径可以发挥降脂作用,这可能是因为当L-色氨酸含量增加时,其代谢产物5-羟色胺合成量增加,从而达到抑制摄食需求、减少脂肪摄入的目的[15]。绿原酸、3,5-二咖啡酰奎宁酸和3,4,5-三咖啡酰奎宁酸等咖啡酰奎宁酸类成分可以通过调节脂代谢相关基因的表达发挥降脂作用[16]。新绿原酸可能通过改变参与多种细胞内信号传导途径的过氧化物增殖激活受体 α( peroxisome proliferator-activated receptor α,PPARα)和肝X 受体α(liver X receptor α,LXRα)的表达来改善脂质代谢疾病[17],或是通过减少过氧化物增殖激活受体γ2(peroxisome proliferatoractivated receptor γ2,PPARγ2)的表达和下调核因子κB(nuclear factor-κB,NF-κB)信号通路改善肥胖和肥胖相关的代谢紊乱[18],也可能通过下调微小RNA-34(miR-34),激活烟酰胺腺苷二核苷酸依赖性脱乙酰酶/一磷酸腺苷依赖的蛋白激酶( sirtuin 1/AMP-activated protein kinase,SIRT1/AMPK)途径,从而减轻肝脏脂质积累[19]。而绿原酸、新绿原酸等是隐绿原酸的代谢产物[20],因而对改善高脂血症也具有一定功效。异槲皮素、维采宁-2、槲皮素-3-O-β-D-(6′′-O-丙二酰) 葡萄糖苷、紫云英苷、山柰酚-3-O-β-D-(6′′-O-丙二酰) 葡萄糖苷均属于黄酮类成分。有研究表明,黄酮类成分可通过提高卵磷脂胆固醇脂酰转移酶活性,增加胆固醇的逆向转运,来提高HDL-C 对血浆及外周组织胆固醇的清除能力[5-6];也可通过降低血清中的脂质过氧化,减少大鼠氧化低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)的含量[21]等,来发挥治疗高脂血症的作用。
在此基础上,利用网络药理学共得到交集靶点35 个,经过PPI 蛋白互作及MCODE 模块分析得到10 个关键靶点(ALB、IL6、VEGFA、MMP9、ACE、REN、MPO、CXCL12、IL2、APP)。其中,IL-6、MMP9 等炎症因子的激活可以通过诱导肝脏脂肪酸合成的刺激和脂解作用的增加来升高血脂水平[22-24]。IL2、ACE、MPO[25]、VEGFA 与高脂血症及动脉粥样硬化密切相关[23-24]。ALB 是糖脂代谢的共性生物标志物[26]。血清CXCL12 可作为动脉粥样硬化引起的心脑血管疾病的一种生物学标志物[27]。抑制肾素-血管紧张素转换酶对治疗动脉粥样硬化及调血脂具有一定的协同作用[28]。
为了解释信号通路中关键靶点的作用,进行了KEGG 通路富集分析,筛选出辣木叶治疗高脂血症的3 条核心通路。高脂饮食导致的肥胖往往伴随炎症反应,推测辣木叶可能通过调节细胞因子-细胞因子受体相互作用(促进抗炎因子,抑制促炎因子IL-2、IL-6 等炎症因子发挥抗炎作用[22-29])、产生IgA的肠道免疫网络(药物发挥抗炎作用极有可能与减少IgA 的分泌有关[30])、PI3K-Akt 信号通路[通过影响哺乳动物雷帕霉素靶蛋白(mechanistic target of rapamycin complex 1,mTORC1)和胆固醇调节元件结合蛋白(sterol-regulatory element binding protein,SREBP)[31]、核苷酸代谢[26]等来发挥调血脂的作用。最后,通过构建“特征成分-关键靶点-关键通路”网络及计算网络拓扑参数,在有效性方面,筛选出了5 个Q-Markers(新绿原酸、L-色氨酸、隐绿原酸、异槲皮素、维采宁-2)。
5.3 Q-Markers 的五原则分析
基于特征图谱的OPLS-DA 分析结果显示,维采宁-2、异槲皮素、隐绿原酸、新绿原酸、L-色氨酸含量差异较大,是不同产地辣木叶的差异性标志物,上述几种成分含量较高且稳定,符合Q-Marker 的可测性。
同时,课题组前期研究发现,以上5 个产地差异性标志物成分从药材到水煎液具有较好的传递性(新绿原酸、L-色氨酸、隐绿原酸、维采宁-2、异槲皮素从辣木叶药材到水煎液的转移率分别为34.37%~63.83%、62.43%~115.94%、64.65%~120.06%、56.98%~105.82%、37.46%~69.57%),且以上5 个成分均能在血清或血浆中检出原型或代谢产物[15,32-34],符合Q-Marker 的传递与溯源性。
在此基础上,通过检索TCMSP 网站判断成分的特有性,结果显示,新绿原酸、L-色氨酸、隐绿原酸、异槲皮素、维采宁-2 分别在3、4、3、55、8种中药中存在,除异槲皮素外,另外4 种成分在其他中药中存在较少,符合Q-Marker 的特有性,建议将上述4 种成分纳入辣木叶的质量控制指标。但是考虑到异槲皮素的含量较高,从相对含量和绝对含量来看,异槲皮素在辣木叶中所占的比例高于其他成分,故将该成分也纳入辣木叶的质量控制指标。
辣木叶富含黄酮类成分、有机酸类成分及大量氨基酸,而这些成分又具有显著的药理活性。研究报道,辣木叶总黄酮具有显著的调血脂作用[3-6],又因为异槲皮素和维采宁的含量较高,推测其可能是代表性发挥调血脂作用的黄酮类成分。同时,咖啡酰奎宁酸类的有机酸成分可以通过调节脂代谢相关基因的表达发挥调血脂作用[16]。例如,新绿原酸可能通过改变参与多种细胞内信号传导途径的PPARα 和LXRα 的表达来改善脂质代谢疾病[17],或是通过减少PPARγ2 的表达和NF-κB 信号通路改善肥胖和肥胖相关的代谢紊乱[18],也可能通过下调miR-34,激活SIRT1/AMPK 途径,从而减轻肝脏脂质积累[19]。而绿原酸、新绿原酸等是隐绿原酸的代谢产物或异构化产物[20]。此外,色氨酸生物合成或代谢的相关途径也可以发挥调血脂作用,这可能是因为当L-色氨酸含量增加时,其代谢产物5-羟色胺合成量增加,从而达到抑制摄食需求、减少脂肪摄入的目的[15]。本研究结合文献并通过网络药理学证明以上5 个成分符合Q-Marker 的有效性,同时推测这5 个成分作为辣木叶的主要成分且具有显著的药理作用,可能具有一定的协同作用,即满足QMarker 的配伍合理性。后续,也将针对成分的配伍合理性进行进一步探索。综上,结合以调血脂作用为导向的网络药理学筛选过程,最终将新绿原酸、L-色氨酸、隐绿原酸、异槲皮素、维采宁-2 这5 种成分作为辣木叶的调血脂Q-Markers。
综上,本研究基于特征图谱-化学计量学、网络药理学-分子对接、含量测定的方法,以Q-Marker 的五原则为核心,初步确定新绿原酸、L-色氨酸、隐绿原酸、异槲皮素、维采宁-2 可作为辣木叶用于高脂血症的候选Q-Markers,为建立辣木叶的质量评价标准提供数据参考。同时,本研究探索了辣木叶治疗高脂血症的药效物质及潜在的作用机制,推测辣木叶的主要成分新绿原酸、L-色氨酸、隐绿原酸、异槲皮素、维采宁-2 等可能通过作用于ALB、IL6、VEGFA 等靶点来影响细胞因子-细胞因子受体相互作用、产生IgA 的肠道免疫网络、PI3K/Akt 信号通路以发挥调血脂作用,这也为临床使用提供一定的理论依据。鉴于辣木叶发挥高脂血症为多成分的相互协同作用,本研究预测的候选Q-Markers 尚需要进一步开展其体内吸收、药效等多层面的药效物质研究,并基于多批次、多因素的药材质量分析,为基于高脂血症的辣木叶候选QMarkers 标准的制订提供科学支撑。
利益冲突所有作者均声明不存在利益冲突